To gather current evidence on the use of fiber for constipation treatment in pediatric patients.
Source of dataSystematic review with meta‐analysis of studies identified through Pubmed, Embase, LILACS and Cochrane databases published up to 2016.
Inclusion criteriaRandomized controlled trials; patients aged between 1 and 18 years and diagnosed with functional constipation receiving or not drug treatment for constipation; articles published in Portuguese, English, Spanish, French, and German in journals accessible to the researchers.
Synthesis of dataA total of 2963 articles were retrieved during the search and, after adequate evaluation, nine articles were considered relevant to the study objective. A total of 680 children were included, of whom 45% were boys. No statistical significance was observed for bowel movement frequency, stool consistency, therapeutic success, fecal incontinence, and abdominal pain with fiber intake in patients with childhood constipation. These results should be interpreted with care due to the high clinical heterogeneity between the studies and the methodological limitation of the articles selected for analysis.
ConclusionsThere is a scarcity of qualified studies to evaluate fiber supplementation in the treatment of childhood constipation, generating a low degree of confidence in estimating the real effect of this intervention on this population. Today, according to the current literature, adequate fiber intake should only be recommended for functional constipation, and fiber supplementation should not be prescribed in the diet of constipated children and adolescents.
Reunir evidências atuais sobre o uso de fibras no tratamento da constipação funcional em pacientes pediátricos.
Fontes dos dadosRevisão sistemática com metanálise de estudos identificados por pesquisa nas bases de dados Pubmed, Embase, LILACS e Cochrane publicados até o ano 2016. Critérios de inclusão: estudos controlados randomizados; pacientes com idade entre 1 e 18 anos com diagnóstico de constipação funcional em uso ou não de tratamento medicamentoso para constipação; artigos publicados em língua portuguesa, inglesa, espanhola, francesa e alemã em revistas acessíveis aos pesquisadores.
Síntese dos dadosForam encontrados 2.963 artigos na busca e, após avaliação adequada, nove artigos mostraram‐se relevantes frente aos objetivos do estudo. Um total de 680 crianças foram incluídas, sendo 45% meninos. Não foi demonstrada significância estatística da frequência evacuatória, da consistência evacuatória, do sucesso terapêutico, da incontinência fecal e da dor abdominal com o uso de fibras nos pacientes com constipação infanto‐juvenil. Esses resultados devem ser interpretados com atenção devido à alta heterogeneidade clínica entre os estudos e à limitação metodológica dos artigos analisados.
ConclusõesExiste uma grande falta de estudos qualificados para avaliar a suplementação de fibras no tratamento da constipação infanto‐juvenil, gerando um baixo grau de confiança para se estimar o efeito real dessa intervenção na população em questão. Até esse momento, conforme a literatura atual, deve‐se apenas recomendar a ingestão adequada de fibras na constipação funcional, não se podendo prescrever a suplementação de fibras na dieta das crianças e adolescentes constipados.
A constipação, na pediatria, é definida como atraso ou resistência em evacuar, com história de duas ou menos evacuações por semana, associa‐se à incontinência fecal, à retenção fecal e/ou à dor evacuatória.1,2 É classificada como funcional quando, após avaliação clínica e exame físico no paciente pediátrico, não pode ser atribuída a algum distúrbio intestinal ou extraintestinal, conforme o consenso de ROMA IV.2
A constipação funcional é o resultado da retenção fecal voluntária por parte da criança ou adolescente relacionada ao medo de evacuar. Após tentativas frequentes de evacuação sem sucesso, cria‐se um ciclo vicioso: quanto maior a recusa para evacuar, maior será a retenção de fezes, que irão ressecar e aumentar de volume e causar, assim, mais desconforto.1,3
A constipação é frequente na faixa etária pediátrica, é a queixa principal em 3 a 5% das consultas com pediatra e em 25% das consultas com gastroenterologista pediátrico.4,5 Ao redor do mundo, tem prevalência entre 3 e 29,6%6,7 e no Brasil, especificamente, varia entre 17,5 e 38,4%,4,8 devido aos diferentes critérios diagnósticos usados para a definição de constipação funcional. Seu pico de incidência ocorre durante a fase de treinamento esfincteriano, acomete ambos os sexos e sem diferenças entre classes sociais.1,2 Atinge de forma uniforme todas as idades.7 Quando crônica, a constipação funcional impacta negativamente na qualidade de vida do paciente pediátrico e de sua família.5,6
O baixo consumo de fibras provenientes da dieta tem sido considerado um fator de risco para o desenvolvimento de constipação funcional9 e o aumento do seu consumo, um fator importante na sua prevenção e no seu tratamento.4,10 As fibras alimentares são divididas em insolúveis e solúveis. As fibras insolúveis aumentam o volume fecal porque resistem à ação das enzimas digestivas e da microflora colônica, absorvem água da luz intestinal. As fibras solúveis, fermentadas pela flora intestinal, liberam água adsorvida e produzem ácidos graxos que provocam a coabsorção de eletrólitos e água fecal.11
O tratamento inicial da constipação infanto‐juvenil, na maioria das vezes, consiste na prescrição de fibras por grande parte dos profissionais da área da saúde.12,13 Entretanto, ainda não existem evidências claras que corroborem o uso rotineiro da suplementação de fibras na dieta dessa população como parte do tratamento da constipação funcional.10,14
Uma das recomendações mais recentes da literatura sobre o manejo da constipação funcional infanto‐juvenil, o consenso da European Society for Pediatric Gastroenterology Hepatology and Nutrition – North American Society for Pediatric Gastroenterology Hepatology and Nutrition (ESPGHAN – NASPGHAN) de 2014, pela primeira vez, enfatizou que não havia evidências que justificassem a prescrição de fibras.14 Esse consenso teve como base científica, artigos publicados até 2011. Com o intuito de reunir evidências mais atuais sobre o uso de fibras no tratamento da constipação funcional em pacientes pediátricos, foi proposta uma revisão sistemática com metanálise.
MétodosRevisão sistemática com metanálise de estudos controlados randomizados, com amostra de conveniência com todos os artigos identificados na busca. Os estudos foram reconhecidos por meio de pesquisa nas bases de dados Pubmed, Embase, Lilacs e Cochrane. Para a busca, foram usados vocabulários estruturados Medical Subject Headings (MeSH) para Pubmed, Emtree para Embase e Descritores em Ciências da Saúde (DeCS) para Lilacs. Também foi feita uma busca por referências bibliográficas de pesquisas relevantes na literatura cinza.
Estratégia de busca na base de dados Pubmed: “Child”[Mesh] OR “Child” OR “Children” OR “Child, Preschool”[Mesh] OR “Child, Preschool” OR “Preschool Child” OR “Children, Preschool” OR “Preschool Children” OR “Adolescent”[Mesh] OR “Adolescent” OR “Adolescents” OR “Adolescence” OR “Teens” OR “Teen” OR “Teenagers” OR “Teenager” OR “Youth” OR “Youths” OR “Adolescents, Female” OR “Adolescent, Female” OR “Female Adolescent” OR “Female Adolescents” OR “Adolescents, Male” OR “Adolescent, Male” OR “Male Adolescent” OR “Male Adolescents” AND “Constipation”[Mesh] OR “Constipation” OR Dyschezia OR “Colonic Inertia” AND (randomized controlled trial[pt] OR controlled clinical trial[pt] OR randomized controlled trials[mh] OR random allocation[mh] OR double‐blind method[mh] OR single‐blind method[mh] OR clinical trial[pt] OR clinical trials[mh] OR (“clinical trial”[tw]) OR ((singl*[tw] OR doubl*[tw] OR trebl*[tw] OR tripl*[tw]) AND (mask*[tw] OR blind*[tw])) OR (“latin square”[tw]) OR placebos[mh] OR placebo*[tw] OR random*[tw] OR research design[mh:noexp] OR follow‐up studies[mh] OR prospective studies[mh] OR cross‐over studies[mh] OR control*[tw] OR prospectiv*[tw] OR volunteer*[tw]) NOT (animal[mh] NOT human[mh]).15
Foram considerados elegíveis os estudos controlados randomizados (em língua portuguesa, inglesa, espanhola, francesa e alemã, publicados em revistas acessíveis aos pesquisadores), com pacientes entre um e 18 anos, sem uso de leite materno e com diagnóstico de constipação funcional em uso ou não de tratamento medicamentoso para constipação. Foram excluídos os estudos no qual o uso de fibras não estivesse relacionado ao tratamento da constipação funcional e os estudos com dados incompletos.
Dois revisores avaliaram de forma independente os títulos e os resumos dos estudos identificados na busca eletrônica conforme os critérios de elegibilidade previamente estabelecidos. Na falta de informações adequadas no resumo, os estudos foram avaliados pelo texto na íntegra. A análise pelos revisores não foi mascarada quanto aos autores e aos resultados dos estudos. Um terceiro revisor foi acionado em caso de divergência entre os artigos selecionados pelos primeiros revisores. Após consenso, todos os estudos encontrados foram armazenados no programa EndNoteWeb.
Foi aplicada a ferramenta da Cochrane para avaliação do risco de vieses dos estudos16 e também usada a escala de Jadad,17 que permite pontuar a qualidade dos estudos por meio de cinco perguntas simples, pode‐se atribuir um valor de 0 a 5 pontos para cada estudo; um total de pontos igual ou abaixo de 3 reflete um estudo de qualidade inferior.
Os estudos foram agrupados em metanálise. As variáveis dicotômicas foram expressas como proporções (percentagem) e as variáveis contínuas, como média e desvio‐padrão (DP). A medida de sumário baseada na diferença de médias padronizadas ou Standardized Mean Difference (SMD) foi usada para variáveis contínuas e odds ratio (OR) foi usada para variáveis binárias. A obtenção dessas medidas de sumário e seus respectivos intervalos de confiança de 95% (IC 95%) seguiu modelo de efeito randômico. O teste de inconsistência (I2) foi usado para avaliar a heterogeneidade entre os estudos. Foi feita apenas uma análise por subgrupo, devido ao pequeno número de artigos disponíveis. Valor p < 0,05 foi considerado como estatisticamente significativo.
O estudo de Mozaffarpur et al. categorizou os dados de consistência fecal baseado em uma escala visual que variava de 0 a 100 – 0 definia consistência amolecida e confortável e 100, endurecida.18 Devido ao fato de essa escala usar direção inversa de valores quando comparado à Escala de Bristol (1 a 7, 1 muito endurecidas e 7 líquidas),19 as médias foram subtraídas do valor máximo da escala para refletir os resultados obtidos nas outras escalas, conforme sugerido pelo Cochrane Handbook for Systematic Reviews of Interventions.16
Nimrouzi et al. apresentaram resultados de frequência evacuatória e consistência fecal em mediana e IQ,20 assim como Chmielewska et al. apresentaram para os resultados de frequência evacuatória.21 Foi usado o cálculo de conversão para média descrito pelo Cochrane Handbook for Systematic Reviews of Interventions, por meio da subtração dos valores do IQ e subsequente divisão por 1,35.16 Foi feita análise de sensibilidade com a exclusão de dois artigos de cada desfecho em que foram incluídos.
O artigo de Kokke et al. apresentou os resultados de consistência fecal como média e significância estatística – valor p – para o teste t de Student sem disponibilizar o DP.22 O DP foi calculado a partir dos cálculos disponíveis no Cochrane Handbook for Systematic Reviews of Interventions.16
Weber et al. usaram como desfecho primário a falha terapêutica, foi considerado na análise final como sucesso terapêutico o número total de participantes no estudo menos o percentual de falha.23 Além disso, os dados individuais dos pacientes desse estudo foram obtidos diretamente com os pesquisadores e foram calculados em média e DP.
Análise de sensibilidade foi feita por omissão sequencial de cada estudo, com exclusão um a um para cada desfecho citado. Gráficos de forest plot foram reportados para cada desfecho. Funnel plot de cada desfecho foi analisado para viés de publicação. A análise estatística foi feita com o programa Review Manager 5.3 (Cochrane Collaboration).
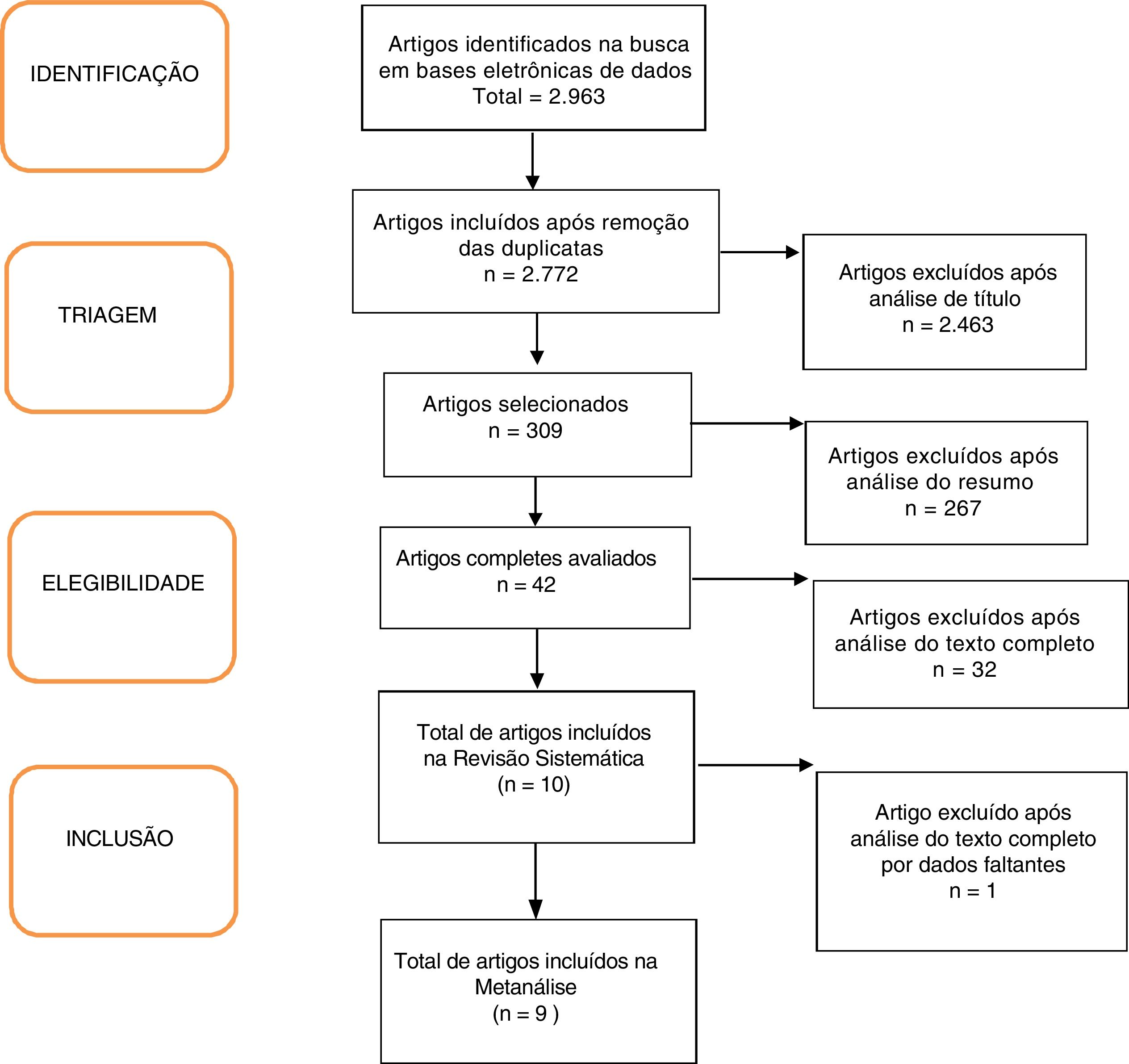
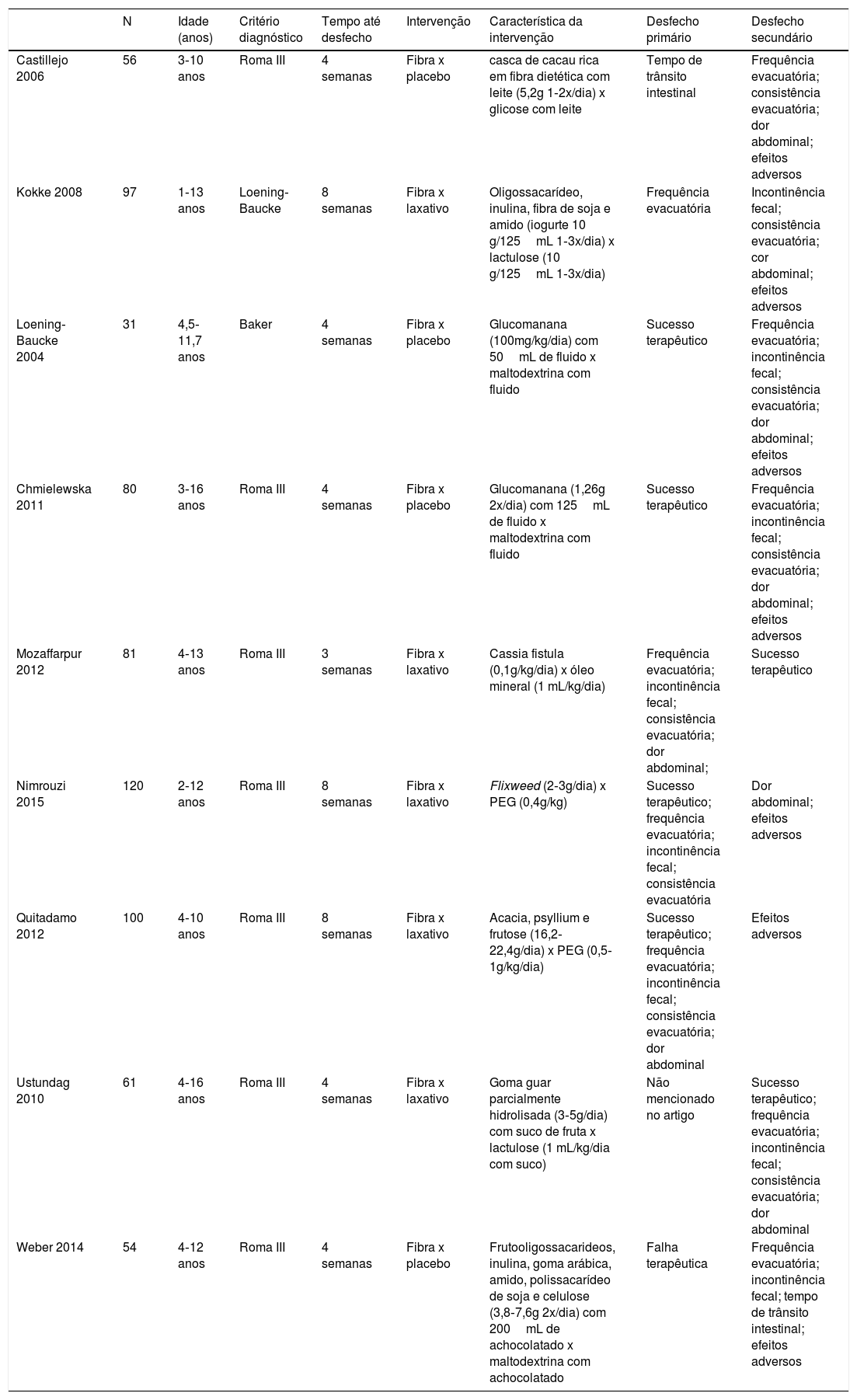
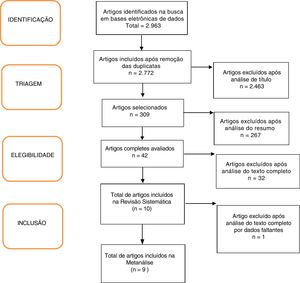
ResultadosForam encontrados 2.963 artigos. Desses, 191 foram removidos por ser duplicados, 2.463 foram excluídos após análise do título e 256 após leitura do resumo. Seguida a avaliação completa dos textos, 32 artigos não preencheram os critérios de inclusão do estudo e um trabalho não apresentou seus dados corretamente. No fim, nove artigos mostraram‐se relevantes.18,20–27 conforme apresentado no Fluxograma (figura 1). Foram incluídas 680 crianças, 45% meninos (apenas o estudo de Ustundag et al. não forneceu essa informação).24 As características dos estudos incluídos estão detalhadas na tabela 1.
A maioria dos estudos optou por usar como desfecho primário frequência evacuatória, consistência evacuatória e/ou o sucesso do tratamento, apesar da diversidade em definir os critérios para o sucesso do tratamento. O estudo de Ustundag et al. não mencionou desfechos primários, apenas secundários.24
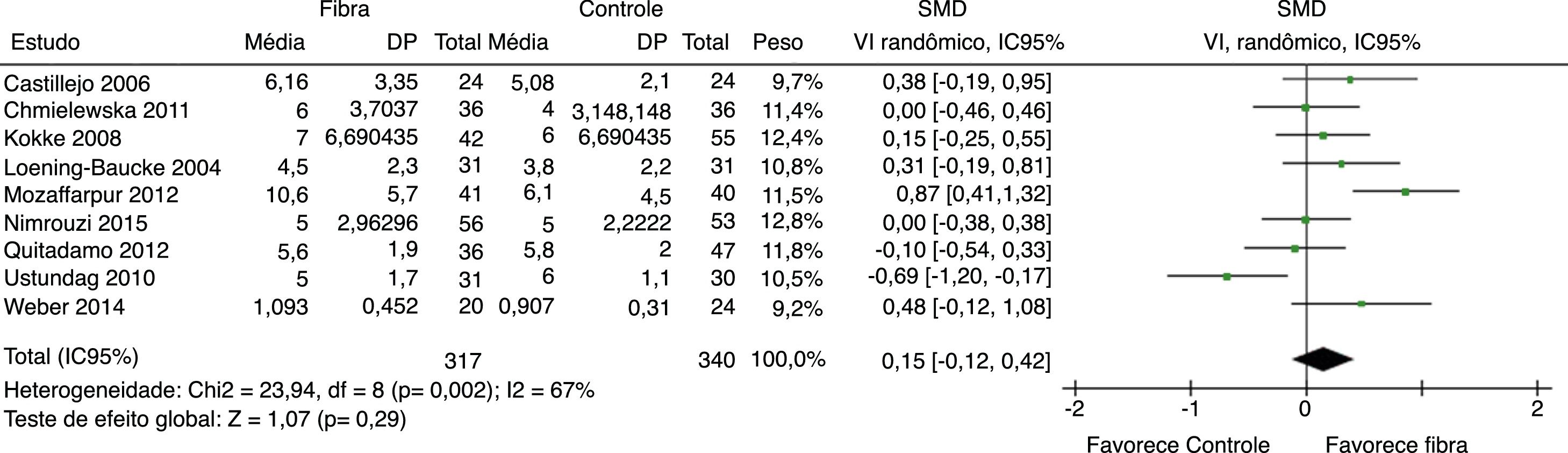
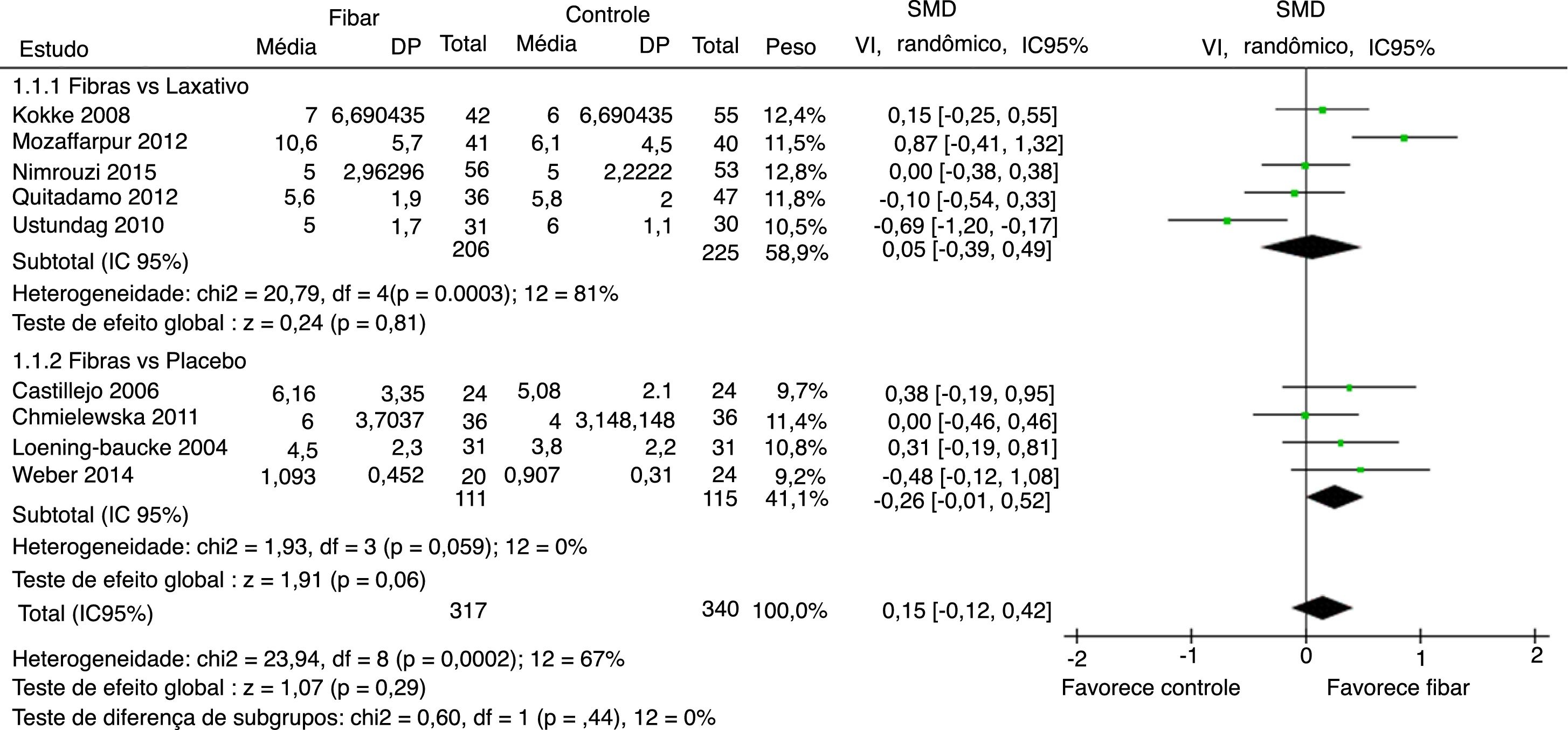
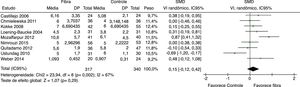
Frequência evacuatória foi reportada por nove estudos. Resultados indicaram que não há aumento significativo do número de evacuações por semana do grupo fibras quando comparado ao grupo controle SMD = 0,15 (IC 95% = ‐0,12–0,42; p = 0,29) (I2 = 67%, p = 0,002) (figura 2).
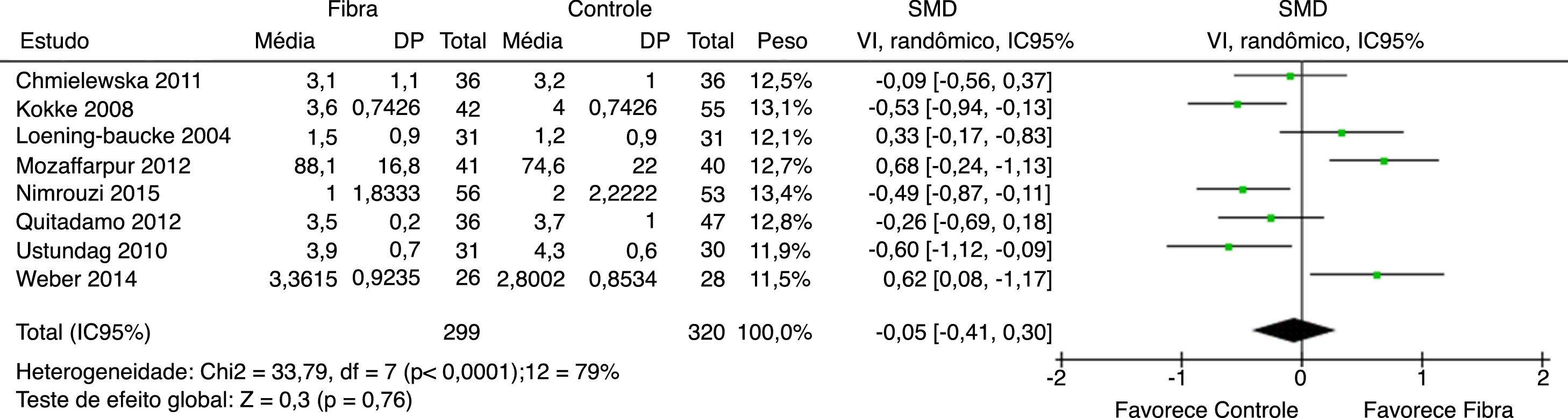
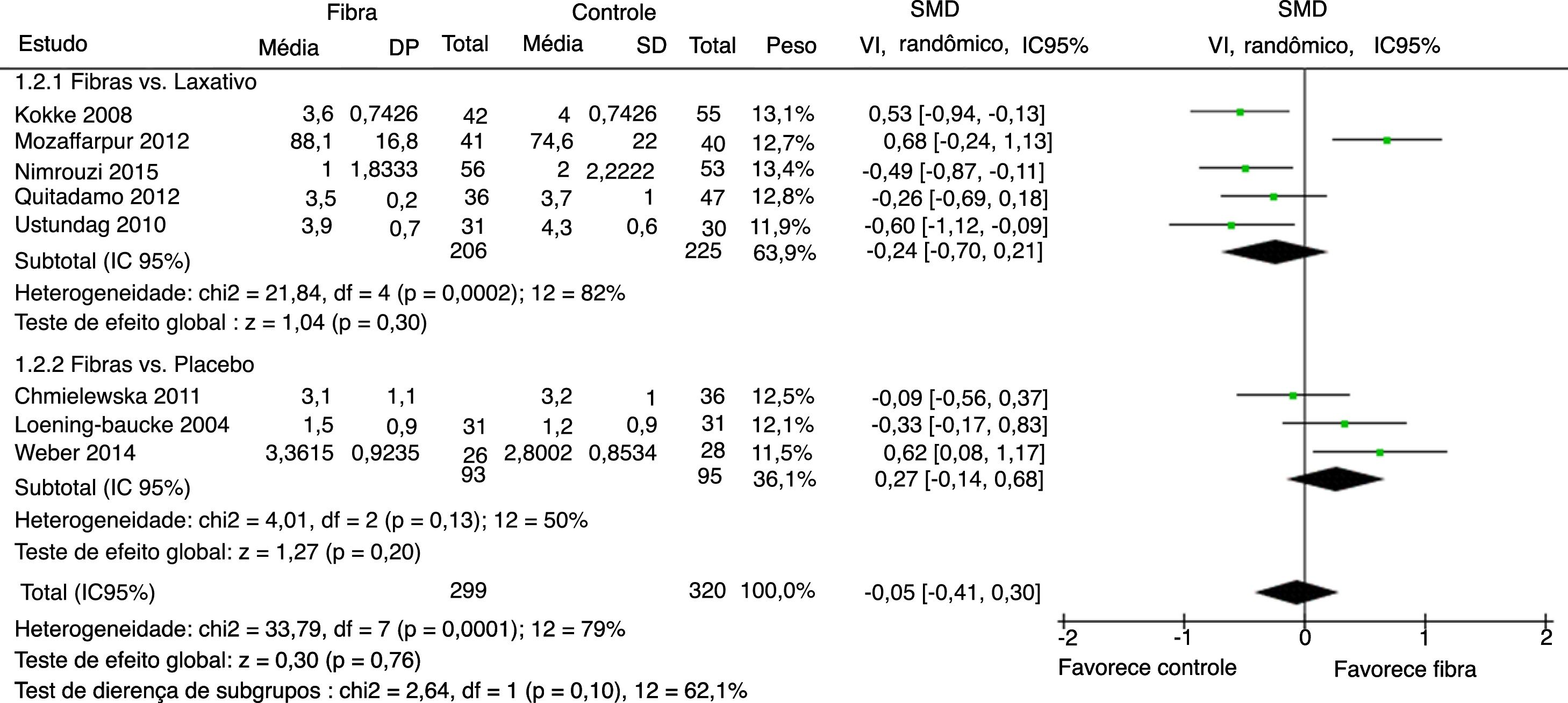
Consistência fecal foi avaliada por oito estudos. Em seis deles foi categorizada como a média das evacuações pela Escala de Bristol. O estudo de Mozzafarpur et al. usou uma escala visual de 0 a 100.18 O estudo de Castillejo et al. forneceu dados dicotômicos, não foi incluído na análise final.25 Os resultados mostraram que não houve diferença estatisticamente significativa entre o grupo fibras e o grupo controle com SMD= ‐0,05 (IC 95% = ‐0,41–0,30; p = 0,76) (I2 = 79%, p < 0,0001) (figura 3).
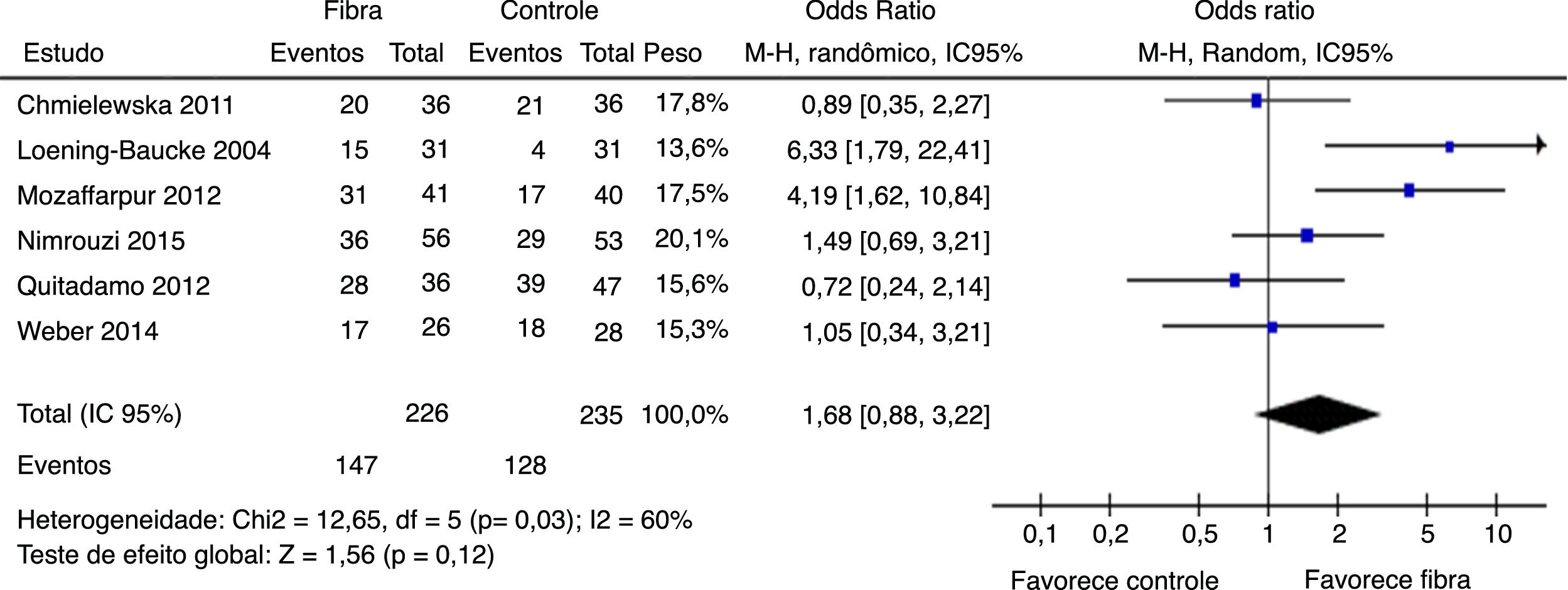
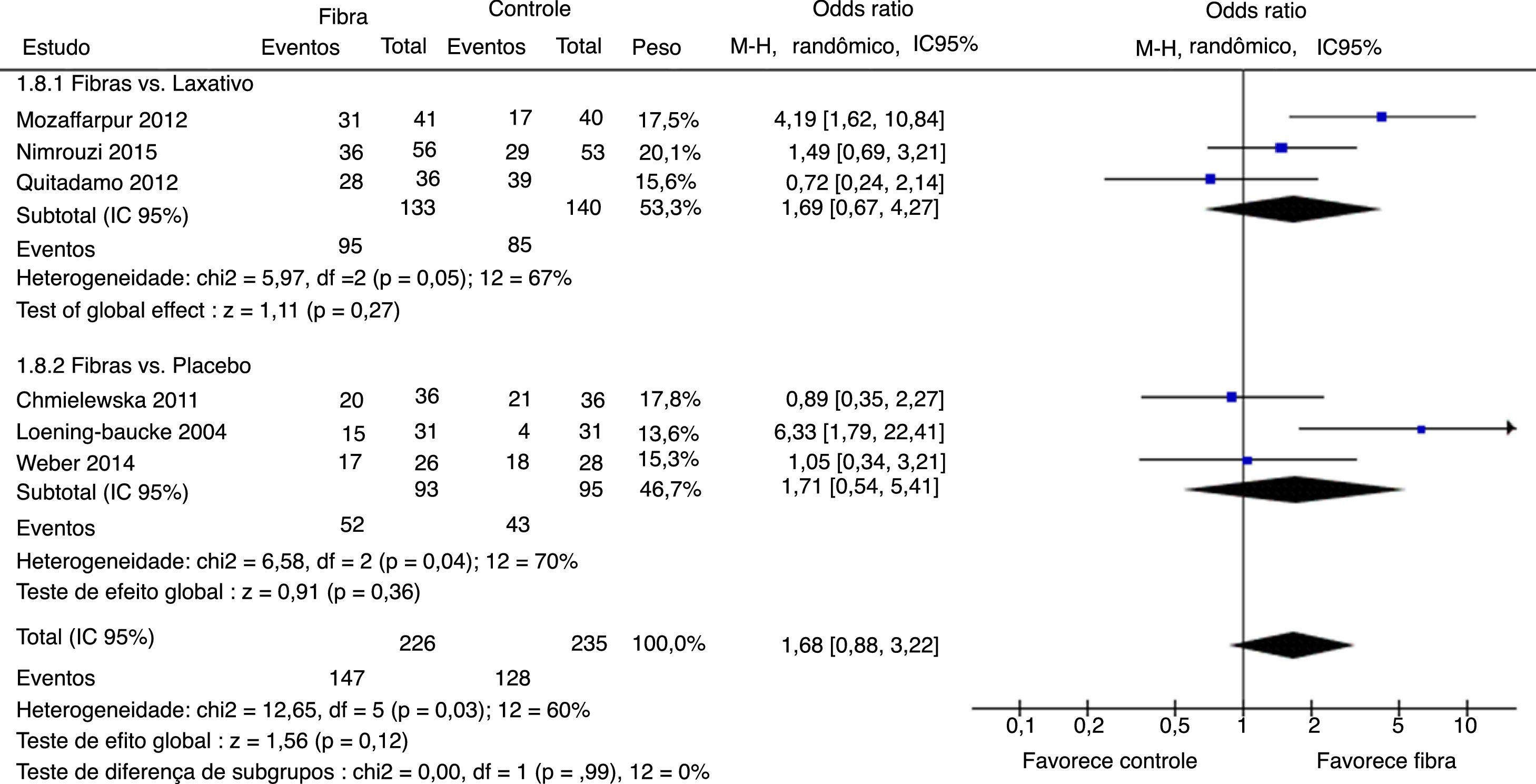
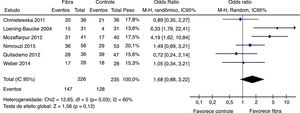
Sucesso terapêutico foi avaliado por seis estudos. Resultados finais mostraram que não houve diferença estatisticamente significativa entre os grupos fibras e controle com OR = 1,68 (IC 95% = 0,88–3,22; p = 0,12) (I2 = 60%, p = 0,03) (figura 4). Houve grande discrepância na definição de sucesso terapêutico usado por cada autor (tabela 1).
Características dos estudos incluídos na análise final
| N | Idade (anos) | Critério diagnóstico | Tempo até desfecho | Intervenção | Característica da intervenção | Desfecho primário | Desfecho secundário | |
|---|---|---|---|---|---|---|---|---|
| Castillejo 2006 | 56 | 3‐10 anos | Roma III | 4 semanas | Fibra x placebo | casca de cacau rica em fibra dietética com leite (5,2g 1‐2x/dia) x glicose com leite | Tempo de trânsito intestinal | Frequência evacuatória; consistência evacuatória; dor abdominal; efeitos adversos |
| Kokke 2008 | 97 | 1‐13 anos | Loening‐Baucke | 8 semanas | Fibra x laxativo | Oligossacarídeo, inulina, fibra de soja e amido (iogurte 10 g/125mL 1‐3x/dia) x lactulose (10 g/125mL 1‐3x/dia) | Frequência evacuatória | Incontinência fecal; consistência evacuatória; cor abdominal; efeitos adversos |
| Loening‐Baucke 2004 | 31 | 4,5‐11,7 anos | Baker | 4 semanas | Fibra x placebo | Glucomanana (100mg/kg/dia) com 50mL de fluido x maltodextrina com fluido | Sucesso terapêutico | Frequência evacuatória; incontinência fecal; consistência evacuatória; dor abdominal; efeitos adversos |
| Chmielewska 2011 | 80 | 3‐16 anos | Roma III | 4 semanas | Fibra x placebo | Glucomanana (1,26g 2x/dia) com 125mL de fluido x maltodextrina com fluido | Sucesso terapêutico | Frequência evacuatória; incontinência fecal; consistência evacuatória; dor abdominal; efeitos adversos |
| Mozaffarpur 2012 | 81 | 4‐13 anos | Roma III | 3 semanas | Fibra x laxativo | Cassia fistula (0,1g/kg/dia) x óleo mineral (1 mL/kg/dia) | Frequência evacuatória; incontinência fecal; consistência evacuatória; dor abdominal; | Sucesso terapêutico |
| Nimrouzi 2015 | 120 | 2‐12 anos | Roma III | 8 semanas | Fibra x laxativo | Flixweed (2‐3g/dia) x PEG (0,4g/kg) | Sucesso terapêutico; frequência evacuatória; incontinência fecal; consistência evacuatória | Dor abdominal; efeitos adversos |
| Quitadamo 2012 | 100 | 4‐10 anos | Roma III | 8 semanas | Fibra x laxativo | Acacia, psyllium e frutose (16,2‐22,4g/dia) x PEG (0,5‐1g/kg/dia) | Sucesso terapêutico; frequência evacuatória; incontinência fecal; consistência evacuatória; dor abdominal | Efeitos adversos |
| Ustundag 2010 | 61 | 4‐16 anos | Roma III | 4 semanas | Fibra x laxativo | Goma guar parcialmente hidrolisada (3‐5g/dia) com suco de fruta x lactulose (1 mL/kg/dia com suco) | Não mencionado no artigo | Sucesso terapêutico; frequência evacuatória; incontinência fecal; consistência evacuatória; dor abdominal |
| Weber 2014 | 54 | 4‐12 anos | Roma III | 4 semanas | Fibra x placebo | Frutooligossacarideos, inulina, goma arábica, amido, polissacarídeo de soja e celulose (3,8‐7,6g 2x/dia) com 200mL de achocolatado x maltodextrina com achocolatado | Falha terapêutica | Frequência evacuatória; incontinência fecal; tempo de trânsito intestinal; efeitos adversos |
PEG, polietilenoglicol.
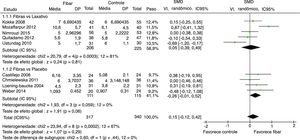
Foi feita análise por subgrupo, avaliaram‐se separadamente os desfechos frequência evacuatória, consistência fecal e sucesso terapêutico entre os artigos que usaram placebo ou medicamentos laxativos como controle versus fibras como intervenção. Nenhum desfecho apresentou alteração significativamente estatística nos resultados dos subgrupos (figuras 5–7). Apesar disso, pode‐se perceber uma tendência em favor das fibras na comparação contra placebo na frequência evacuatória (p = 0,06), que não é observada na análise fibras versus laxativo (p = 0,81).
Metanálise dos estudos selecionados que comparando fibras e controle por subgrupo fibras vs laxativo e fibras vs placebo para frequência evacuatória.
DP, desvio‐padrão; SMD, Standardized Mean Difference; VI, variância inversa; IC95%, intervalo de confiança de 95%; df, graus de liberdade; I2, Teste de Inconsistência.
Metanálise dos estudos selecionados que comparando fibras e controle por subgrupo fibras vs laxativo e fibras vs placebo para consistência fecal.
DP, desvio‐padrão; SMD, Standardized Mean Difference; VI, variância inversa; IC95%, Intervalo de confiança de 95%; df, graus de liberdade; I2, Teste de Inconsistência.
Na análise de sensibilidade por exclusão um a um dos estudos, observou‐se consistência dos resultados principais. Também não houve diferença significativa após a exclusão simultânea dos resultados de Nimrouzi et al. e Chmielewska et al.20,21 A única exceção foi a exclusão do artigo de Ustundag et al. no desfecho frequência evacuatória,24 encontrou‐se aumento significativo de evacuações em favor do grupo fibras com SMD = 0,24 (IC 95% = 0,01–0,46; p = 0,04) (I2 = 47%).
Há evidência de viés de publicação nos funnel plots das análises de desfechos frequência evacuatória, consistência fecal e sucesso terapêutico. A avaliação do risco de viés dos artigos incluídos demonstrou moderado grau de inconsistência devido à grande heterogeneidade dos estudos e ao grande risco de viés de seleção, alocação e cegamento por deficiência metodológica dos desenhos dos artigos (anexo 1). Além disso, foi feita análise de qualidade metodológica dos artigos através da Escala de Jadad,17 que demonstrou que a maioria dos artigos selecionados apresentava qualidade adequada (anexo 2).
DiscussãoApesar de a constipação funcional ser um dos diagnósticos mais prevalentes da faixa etária pediátrica e uma das manifestações gastrointestinais mais presentes na infância, essa área ainda carece de estudos, uma vez que apenas nove artigos foram incluídos nesta revisão sistemática. Na metanálise, não se encontrou significância estatística em qualquer dos desfechos avaliados. E não foi possível estudar outros desfechos, como velocidade do trânsito intestinal, uso de laxativos, presença de dor evacuatória e de efeitos adversos ao uso de fibras, devido à ausência desses dados nos estudos selecionados.
Sobre a frequência evacuatória, um dos principais critérios diagnósticos para a constipação e seu manejo, e importante parâmetro de bem‐estar na faixa etária pediátrica, não houve diferença estatisticamente significativa na análise final. Entretanto, na análise de sensibilidade com a exclusão do artigo de Ustundag et al.,24 que usou laxativos como grupo controle e fibras como grupo intervenção, encontrou‐se um aumento significativo da frequência evacuatória com o uso de fibras. Revisões sistemáticas prévias também demonstraram o aumento da frequência evacuatória com a suplementação de fibras.28,29 Entretanto, a revisão sistemática de Gordon et al.30 não mostrou diferença na frequência evacuatória nessa população.
A consistência fecal é um critério diagnóstico para a constipação, além de ser um fator que gera dor e pioria da qualidade de vida das crianças e dos adolescentes constipados. No presente estudo, entretanto, não se evidenciou diferença estatisticamente significativa na análise final. O mesmo resultado foi encontrado em outra revisão sistemática.28
O desfecho sucesso terapêutico foi o de maior heterogeneidade, devido às diversas definições usadas pelos autores. Na análise final, não houve diferença estatisticamente significativa. Resultado semelhante ao encontrado em revisões sistemáticas prévias.28,29,31 Porém, em outras duas revisões sistemáticas, uma usou glucomanana versus placebo32 e outra psyllium versus placebo,33 demonstraram que essas fibras poderiam ser benéficas para o tratamento de constipação funcional.
Apesar de a análise de subgrupo não mostrar diferenças estatisticamente significativas entre os desfechos analisados, observou‐se uma tendência em favor do uso de fibras em comparação com o placebo no aumento da frequência evacuatória, fato não observado na comparação com laxativo. De um ponto de vista biológico isso faz sentido, pois os tratamentos foram de curta duração e o uso de laxantes nessa situação deveria ter resultados melhores do que o placebo.
Os consensos da ESPGHAN‐NASPGHAN e da National Institute for Health and Care Excellence (NICE) aconselham ingestão normal de fibras para crianças e adolescentes com constipação, não recomendam o uso de suplementos alimentares de fibras isoladamente para o tratamento da constipação funcional na população pediátrica, principalmente devido à falta de evidências científicas que comprovem sua eficácia e efetividade.14,34 O consenso de ROMA IV apenas cita a recomendação de ingestão de fibras adequada para cada idade, salienta que não existem estudos fortes e bem desenhados que apoiem o uso de qualquer suplementação dietética para o tratamento da constipação funcional infanto‐juvenil.1,2 Nosso estudo chegou à mesma conclusão, porém mostrou e criou novas evidências que comprovam essas afirmações.
São necessários novos ensaios clínicos randomizados duplo‐cegos bem desenhados, com critérios diagnósticos e protocolos de tratamento da constipação funcional atualizados e mundialmente recomendados. Assim, possibilitar‐se‐ia a homogeneização das futuras publicações sobre o uso de fibras na constipação infanto‐juvenil e, talvez, se conseguiria reproduzir a eficácia do uso da suplementação de fibras no tratamento da constipação funcional.
LimitaçõesO baixo número de ensaios clínicos randomizados que avaliem o uso de fibras no tratamento da constipação infanto‐juvenil foi uma forte limitação do estudo. Por esse motivo, optou‐se por incluir na análise final artigos com baixa qualidade metodológica e com grupos em paralelo e crossover.
Encontrou‐se alta heterogeneidade em todos os desfechos dos estudos incluídos. A maioria dos estudos usou diferentes definições de constipação funcional, não quantificou o consumo de fibras antes e durante o período da intervenção e optou por intervenções distintas com diversos tipos de fibras e doses individualizadas. Além disso, os trabalhos divergiam na análise estatística e no uso de diferentes grupos controles, compararam o uso de fibras com o uso de placebo ou laxativos. Ainda, houve grande taxa de perda em alguns estudos, que apresentavam pequeno número de participantes.
As análises de sensibilidade auxiliaram na explicação da grande heterogeneidade entre todos os desfechos, mas a análise por subgrupo foi limitada pelo baixo número de estudos na metanálise. Optou‐se pela uso do modelo de efeito aleatório, devido à heterogeneidade importante dos desfechos do estudo.
Usou‐se a diferença de médias estandardizada como medida de efeito para os desfechos contínuos, pois os estudos selecionados não usaram os mesmos escores para classificar os desfechos. Além disso, foi necessário estandardizar os resultados fornecidos para poder combiná‐los na metanálise. Essa medida apresenta validade metodológica, mas os resultados finais têm difícil aplicação na prática clínica diária, pois se perde a interpretação clínica dos escores usados. Foi feita transformação de mediana (IQ) em média (DP), recomendada pela Cochrane,16 que apesar de poder incorrer em erro estatístico é um problema comum em metanálises. Isso foi feito devido ao pequeno número de artigos na literatura, conferiu maior risco de não incluir um estudo, já que o viés de seleção ou viés de não publicação de estudos pode influenciar de maneira mais importante.
Incluímos estudos com qualidade da evidência reduzida por vieses de seleção, alocação e cegamento e a heterogeneidade. Consideramos adequado incluir esses estudos, devido à ausência de outros com melhores critérios metodológicos.
ConclusãoA prescrição de suplementação de fibras na dieta das crianças constipadas como parte do tratamento dessa enfermidade não apresenta evidências científicas que corroborem essa prática, baseada nos resultados desta revisão sistemática com metanálise. Esta metanálise pode ajudar no cenário atual, pois existe uma grande falta de estudos qualificados para avaliar a suplementação de fibras no tratamento da constipação funcional infantil‐juvenil, o que gera um baixo grau de confiança para se estimar o efeito real dessa intervenção na população em questão. Portanto, deve‐se focar na feitura de estudos com alta qualidade metodológica para avaliar os efeitos da suplementação de fibras no tratamento da constipação funcional.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Ao Hospital de Clínicas de Porto Alegre e à Universidade Federal do Rio Grande do Sul.
Como citar este artigo: Picoli de Mello P, Eifer DA, Daniel de Mello E. Use of fibers in childhood constipation treatment: systematic review with meta‐analysis. J Pediatr (Rio J). 2018;94:460–70.
Trabalho vinculado à Universidade Federal do Rio Grande do Sul (UFRGS) e ao Hospital de Clínicas de Porto Alegre (HCPA), Porto Alegre, RS, Brasil.