To summarize the current literature describing high‐flow nasal cannula use in children, the components and mechanisms of action of a high‐flow nasal cannula system, the appropriate clinical applications, and its role in the pediatric emergency department.
SourcesA computer‐based search of PubMed/MEDLINE and Google Scholar for literature on HFNC use in children was performed.
Data summaryHigh‐flow nasal cannula, a non‐invasive respiratory support modality, provides heated and fully humidified gas mixtures to patients via a nasal cannula interface. High‐flow nasal cannula likely supports respiration though reduced inspiratory resistance, washout of the nasopharyngeal dead space, reduced metabolic work related to gas conditioning, improved airway conductance and mucociliary clearance, and provision of low levels of positive airway pressure. Most data describing high‐flow nasal cannula use in children focuses on those with bronchiolitis, although high‐flow nasal cannula has been used in children with other respiratory disease. Introduction of high‐flow nasal cannula into clinical practice, including in the emergency department, has been associated with decreased rates of endotracheal intubation. Limited prospective interventional data suggest that high‐flow nasal cannula may be similarly efficacious as continuous positive airway pressure and more efficacious than standard oxygen therapy for some patients. Patient characteristics, such as improved tachycardia and tachypnea, have been associated with a lack of progression to endotracheal intubation. Reported adverse effects are rare.
ConclusionsHigh‐flow nasal cannula should be considered for pediatric emergency department patients with respiratory distress not requiring immediate endotracheal intubation; prospective, pediatric emergency department‐specific trials are needed to better determine responsive patient populations, ideal high‐flow nasal cannula settings, and comparative efficacy vs. other respiratory support modalities.
Resumir a literatura atual que descreve o uso da cânula nasal de alto fluxo em crianças, os componentes e mecanismos de ação do sistema de cânula nasal de alto fluxo, as aplicações clínicas adequadas e o papel desse sistema no departamento de emergência pediátrico.
FontesFizemos uma pesquisa informatizada na PubMed/Medline e usamos o Google Acadêmico para encontrar literatura sobre o uso da cânula nasal de alto fluxo em crianças.
Resumo dos dadosA cânula nasal de alto fluxo, modalidade de apoio respiratório não invasiva, fornece misturas de gases aquecidas e totalmente umidificadas para pacientes por meio de uma cânula nasal. A cânula nasal de alto fluxo provavelmente auxilia a respiração por meio da redução da resistência inspiratória, eliminação do espaço morto anatômico nasofaríngeo, redução do trabalho metabólico relacionado ao condicionamento de gás, melhoria da condutância das vias aéreas e transporte mucociliar e fornecimento de baixos níveis de pressão positiva nas vias aéreas. A maior parte dos dados que descrevem o uso da cânula nasal de alto fluxo em crianças é focada em crianças com bronquiolite, embora a cânula nasal de alto fluxo tenha sido usada em crianças com outras causas de doenças respiratórias. A introdução da cânula nasal de alto fluxo na prática clínica, inclusive o departamento de emergência, foi associada à redução dos índices de intubação endotraqueal. Dados intervencionistas prospectivos limitados sugerem que a cânula nasal de alto fluxo pode ser tão eficaz quanto a pressão positiva contínua nas vias aéreas e mais eficaz do que a oxigenoterapia‐padrão em alguns pacientes. As características dos pacientes, como melhoria da taquicardia e taquipneia, foram associadas a uma ausência de progressão para intubação endotraqueal. Foram raros os efeitos adversos relatados.
ConclusõesA cânula nasal de alto fluxo deve ser considerada para pacientes do departamento de emergência pediátrico com insuficiência respiratória que não precisam de intubação endotraqueal imediata. Contudo, são necessários ensaios clínicos prospectivos específicos para o departamento de emergência pediátrico para determinar melhor as populações de pacientes que respondem ao tratamento, as configurações ideais da cânula nasal de alto fluxo e a eficácia comparada a outras modalidades de apoio respiratório.
A cânula nasal de alto fluxo (CNAF) é uma modalidade de apoio respiratório não invasiva que fornece misturas de gases condicionadas (aquecidas e totalmente umidificadas) para pacientes por meio de uma cânula nasal. Não há uma definição universalmente aceita sobre a taxa mínima de fluxo que define o “alto” fluxo. Em neonatos, o alto fluxo pode ser definido como taxas de fluxo ≥ 2 L/min, ao passo que, para crianças mais velhas, as taxas de fluxo ≥ 4‐6 L/min normalmente são consideradas de alto fluxo.1–3 Na última década, os sistemas CNAF têm conquistado uma aceitação cada vez maior e, agora, são amplamente usados para auxiliar pacientes gravemente doentes em todas as faixas etárias, desde os neonatos prematuros aos adultos. Eles também têm encontrado uma função em diversos locais dos hospitais, inclusive a unidade de terapia intensiva neonatal (UTIN), a unidade de terapia intensiva pediátrica (UTIP), unidades de terapia intensiva médico‐cirúrgica, unidades de terapia semi‐intensiva e, mais recentemente, o departamento de emergência (DE). Um ensaio clínico controlado e randomizado recente mostrou que a CNAF pode ser superior ao fornecimento de oxigênio de baixo fluxo padrão na prevenção de falhas no tratamento de crianças com bronquiolite,4 ao passo que outros ensaios sustentam que a CNAF é equivalente a modalidades mais tradicionais de apoio de ventilação não invasiva, como a pressão positiva contínua ou bifásica nas vias aéreas (CPAP ou BiPAP).5,6
Neste artigo, analisamos a lógica de uso da CNAF em crianças, a anatomia básica de um sistema CNAF, os mecanismos de ação, a aplicação clínica e a função no DE pediátrico.
Lógica de uso da CNAFA suplementação de oxigênio é uma pedra angular do tratamento de crianças com hipoxemia devido a um processo respiratório agudo, normalmente por meio de uma máscara facial ou de uma simples cânula nasal. A concentração de oxigênio no gás inspirado aumenta conforme a taxa de fluxo de oxigênio aumenta e menos ar atmosférico entra na inspiração. Diferentemente do ar atmosférico, que é rico em vapor de água, os gases medicinais – inclusive o oxigênio – são armazenados como uma substância desidratada. A administração prolongada de oxigênio suplementar causa secura e irritação das mucosas e afeta negativamente o transporte mucociliar, a menos que seja umidificada.7 É comum no ambiente hospitalar usar um umidificador de oxigênio com água esterilizada para esse fim. Esses aparelhos simples e acessíveis fornecem um pouco de hidratação aos gases medicinais secos, porém essa umidificação não é adequada para fluxos de gás superiores a 5 L/m.7,8 Quando são usados fluxos de gás maiores, é imperativo que a mistura de gases esteja completamente saturada com vapor de água e aquecida próximo à temperatura do corpo, pois a mucosa das vias aéreas não consegue transferir de maneira independente calor e umidade suficientes a essas taxas de fluxo suprafisiológicas.
A aplicação da terapia de alto fluxo é fundamentada em quatro características importantes.
- (1)
Um sistema “alto”: o fluxo de gás deve ser levado por uma cânula que não obstrua as narinas. Essa é uma distinção fundamental em comparação com modos de ventilação nasal pressurizados, como a CPAP e a BiPAP. Deve haver espaço o suficiente para que o gás vaze ao redor da cânula, o padrão é que as pontas da cânula ocupem no máximo 50% da área transversal de cada narina.
- (2)
Gás condicionado: as misturas de gases levadas pela CNAF devem ser adequadamente aquecidas e umidificadas para evitar o ressecamento da mucosa respiratória.
- (3)
Alto fluxo: a CNAF deve levar fluxos de misturas de gases maiores do que o pico de fluxo inspiratório do paciente para prevenir a entrada de ar ambiente durante a inspiração.
- (4)
Alta velocidade: o gás levado em alta velocidade penetra profundamente as vias áreas, leva a fonte de gás fresco para mais perto da carina e fornece certo nível de apoio respiratório.
Apesar de a composição de um sistema CNAF variar entre os fabricantes de equipamentos médicos, a configuração básica inclui os mesmos elementos essenciais: 1) uma fonte pressurizada de oxigênio e ar, regulada por um fluxômetro/misturador; 2) um reservatório de água esterilizada conectado a um aquecedor e umidificador eficiente; 3) um circuito isolado e/ou aquecido que mantenha a temperatura e a umidade relativa do gás condicionado enquanto ele se desloca até o paciente; e 4) uma cânula não oclusiva.
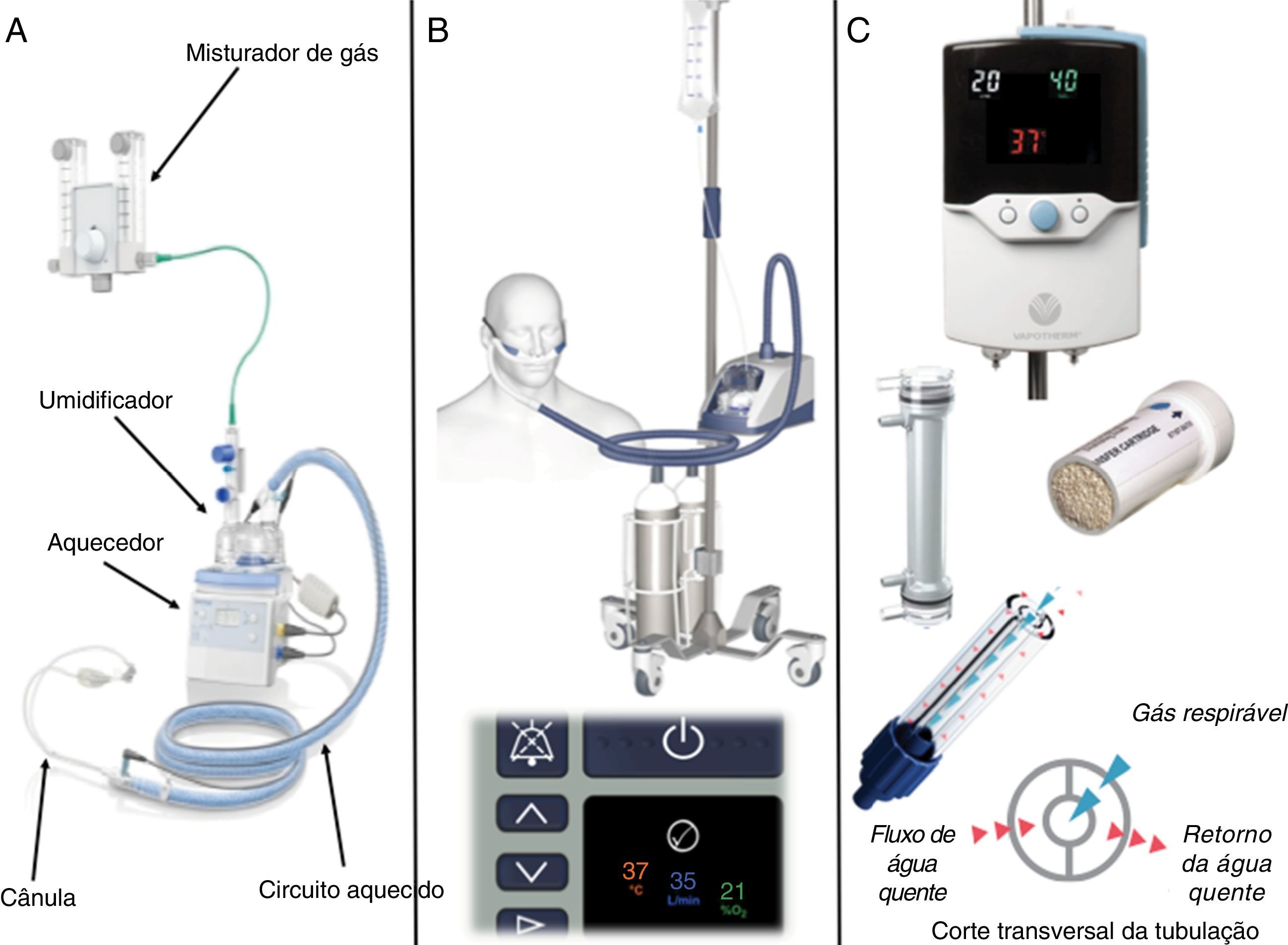
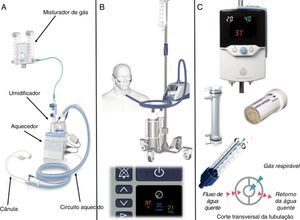
Um sistema CNAF pode ser montado com itens comumente usados em cuidados respiratórios e que estão amplamente disponíveis na maior parte das unidades. Esses sistemas (fig. 1A) são compostos de um reservatório de água aquecida por uma placa aquecedora, como as usadas em ventiladores mecânicos, um misturador de alto fluxo para controlar a composição e o fluxo do gás e um circuito equipado com um cabo aquecido para manter a temperatura do gás e reduzir a condensação. Segundo nossa experiência, o apoio CNAF é mais comumente encontrado como equipamento comercial projetado especialmente para esse fim, como o Airvo 2 (Fisher & Paykel Healthcare Limited, Auckland, Nova Zelândia) (fig. 1B) ou o sistema Precision Flow (Vapotherm Inc, Exeter, Nova Hampshire, EUA) (fig. 1C).
Exemplo de dispositivos comercialmente disponíveis para apoio por cânula nasal de alto fluxo (CNAF). Painel A: sistema CNAF montado com componentes comumente disponíveis, inclusive um misturador, um aquecedor/umidificador, um circuito aquecido e uma cânula. Painel B: O sistema de CNAF Airvo 2 é mostrado aqui como uma unidade móvel com cilindros de ar e oxigênio (em cima), com uma imagem aproximada do painel de controle digital, indica o ajuste da temperatura, do fluxo e da concentração de oxigênio do gás inspirado (embaixo). Painel C: Sistema de CNAF Precision Flow (em cima), filtro de umidificação interno, recorte que mostra a configuração de fibra oca (meio) e recorte que mostra o circuito com um diagrama do sistema de isolamento de água quente (embaixo). As imagens são cortesia da Fisher & Paykel Healthcare Limited (A e B) e da Vapotherm Inc (C).
O Airvo 2 é uma CNAF versátil, que consegue levar grande quantidade de fluxos de gás condicionado. O sistema inclui uma câmara umidificadora que fica em cima de uma placa aquecedora, um painel de controle digital para configurar o fluxo de gás (2 a 60 L/min) e a temperatura (31, 34 ou 37°C), um circuito respiratório com espirais duplas de aquecimento e um sensor de temperatura integrado, cânulas anatômicas maleáveis com pontas macias para proporcionar maior conforto e opções de tamanho que variam de neonatos pequenos a adultos. Pode‐se adicionar oxigênio suplementar ao circuito e regulá‐lo por meio de um fluxômetro externo, ao mesmo tempo em que um sensor ultrassônico de oxigênio embutido analisa a fração de oxigênio inspirado (FiO2) para exibir no painel de controle digital.
O Precision Flow é um dispositivo totalmente integrado que usa um sistema de umidificação de alta eficiência de filtro de fibra oca descartável. O gás circula pelo lúmen das fibras ocas, ao mesmo tempo em que o vapor de água aquecido é forçado pelos poros de pequena partícula (0,005 mícron). Uma interface intuitiva com um único botão controla a temperatura do gás (33 a 43°C, ajustável em acréscimos de 1°C), a FiO2 (0,21 a 1, ajustável em acréscimos de 0,01) e o fluxo de gás (1 a 40 L/min). O filtro projetado para recém‐nascidos e bebês tem um fluxo operacional que vai de 1 a 8 L/min, ao passo que o filtro para crianças e adultos opera entre 5 e 40 L/min, ambos são liberados para uso contínuo por até 30 dias em um mesmo paciente. O gás condicionado se desloca do dispositivo até a cânula por meio do lúmen central de um tubo isolado da água aquecida, que mantém a temperatura do gás e minimiza a condensação. Uma grande variedade de tamanhos de cânulas serve para todas as faixas etárias, inclusive uma cânula com ponta única para evitar a oclusão das passagens nasais em neonatos pequenos que também precisam de sonda nasoentérica.
Mecanismos de açãoUma quantidade cada vez maior de evidências indica que a CNAF exerce efeitos possivelmente benéficos por meio de diversos mecanismos diferentes. Esses mecanismos incluem: 1) resistência inspiratória reduzida, 2) eliminação do espaço morto anatômico nasofaríngeo, 3) trabalho metabólico relacionado ao condicionamento de gás reduzido, 4) melhoria da condutância das vias aéreas e transporte mucociliar e 5) fornecimento de baixos níveis de pressão positiva nas vias aéreas.
- (1)
Resistência respiratória reduzida: as narinas e as passagens nasais são os pontos de maior resistência das vias aéreas humanas.7,9 A aplicação do fluxo que atende ou excede a demanda inspiratória individual por meio de uma cânula nasal adequadamente posicionada ajuda a compensar essa resistência respiratória e fornece, sem esforço, gás fresco mais abaixo nas vias aéreas, desvia assim da área de maior resistência e reduz o trabalho respiratório.
- (2)
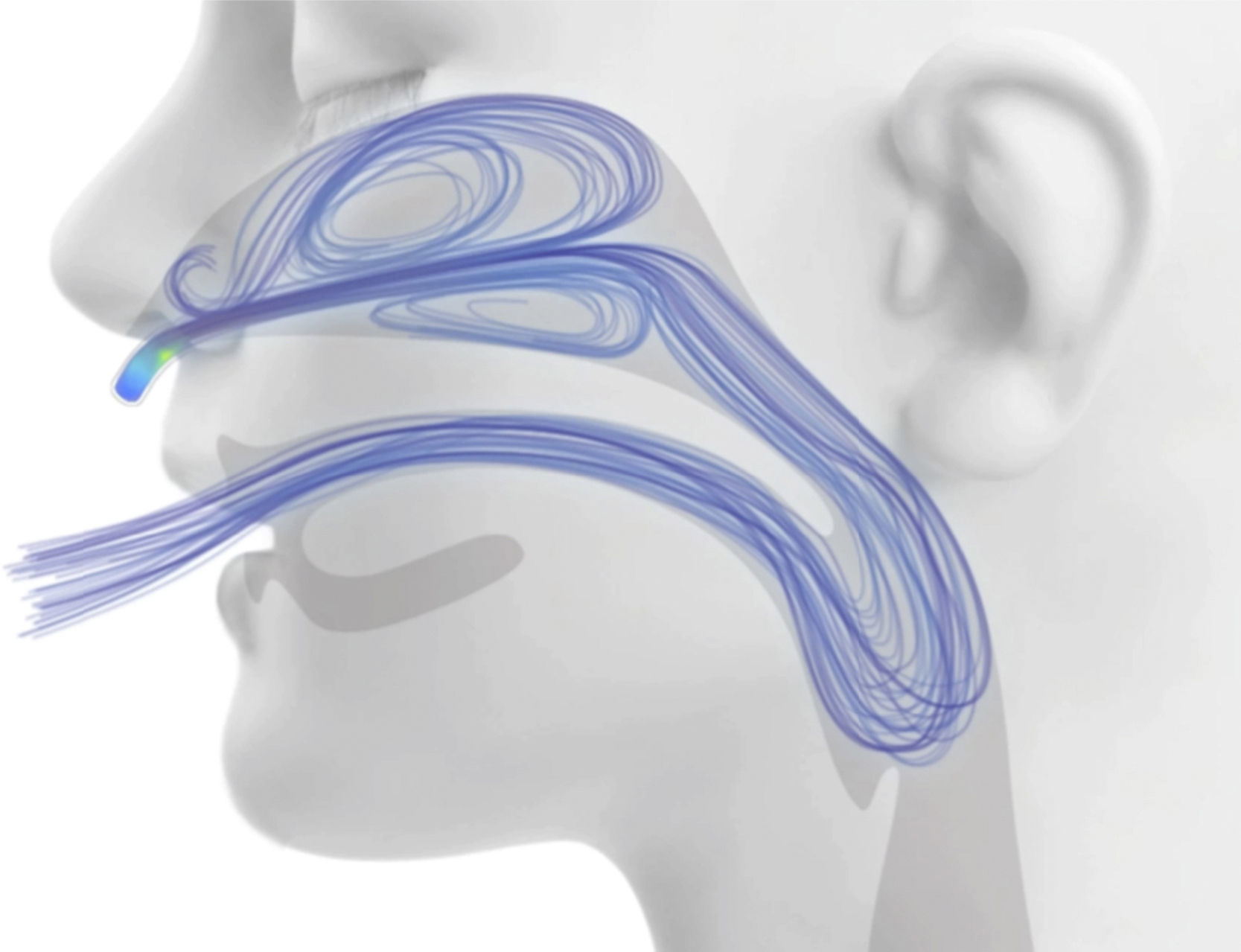
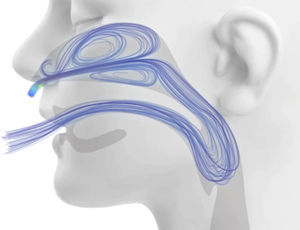
Eliminação do espaço morto anatômico nasofaríngeo: durante a respiração normal, a nasofaringe contém gás rico em dióxido de carbono no fim da expiração. Esse gás é então reinalado durante o próximo ciclo respiratório, o que reduz a eficiência da troca de gases. Quando o sistema CNAF é usado, o gás fresco ocupa rapidamente a cavidade nasal e a faringe, elimina o gás rico em dióxido de carbono do espaço morto da nasofaringe por meio do sistema “aberto” descrito acima10 (fig. 2). Isso equivale a usar o espaço morto anatômico nasofaríngeo como reservatório de gás fresco, reduz, assim, a reinalação e reduz efetivamente a contribuição do espaço morto anatômico para a ineficiência respiratória. Portanto, um paciente assistido pela CNAF pode fazer um esforço respiratório reduzido e diminuir a frequência respiratória para manter o mesmo nível de ventilação alveolar e de PaCO2. Esse mecanismo é particularmente importante em crianças pequenas, considerando que o espaço morto anatômico extratorácico de um recém‐nascido é de 3 mL/kg e não se aproxima do de um adulto (0,8 mL/kg) antes dos seis anos.11
- (3)
Trabalho metabólico relacionado ao condicionamento de gás reduzido: a CNAF fornece gás totalmente condicionado para as vias aéreas, reduz assim as perdas insensíveis de água e o custo de energia para o aquecimento do gás inspirado à temperatura do corpo.10
- (4)
Melhoria da condutância das vias aéreas e transporte mucociliar: a inalação do gás aquecido e umidificado previne o ressecamento das secreções respiratórias,7 diminui a dispneia e a sensação de secura orofaríngea,12 além de ter efeitos potencialmente salutares sobre a função do aparelho mucociliar.13,14
- (5)
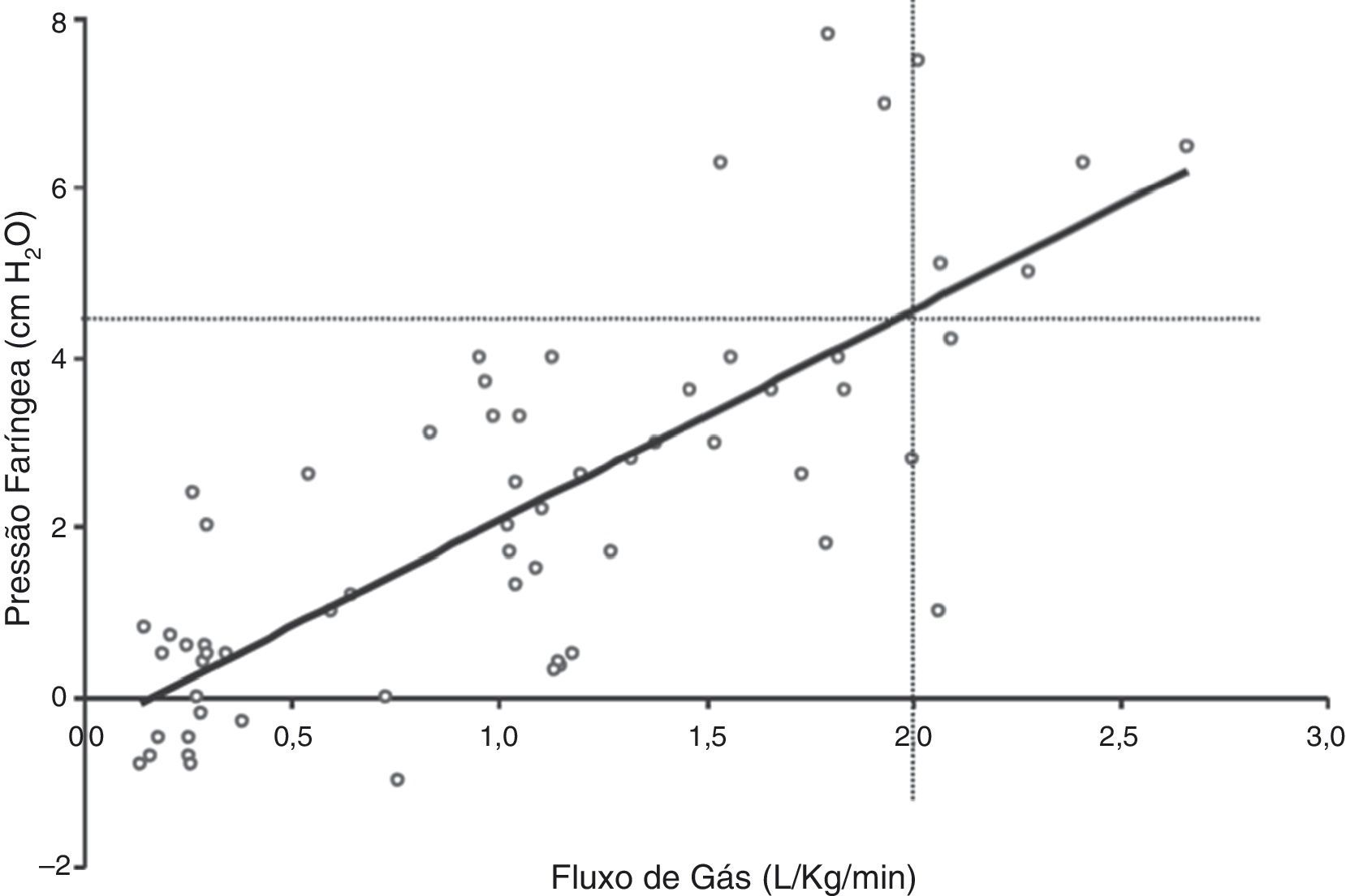
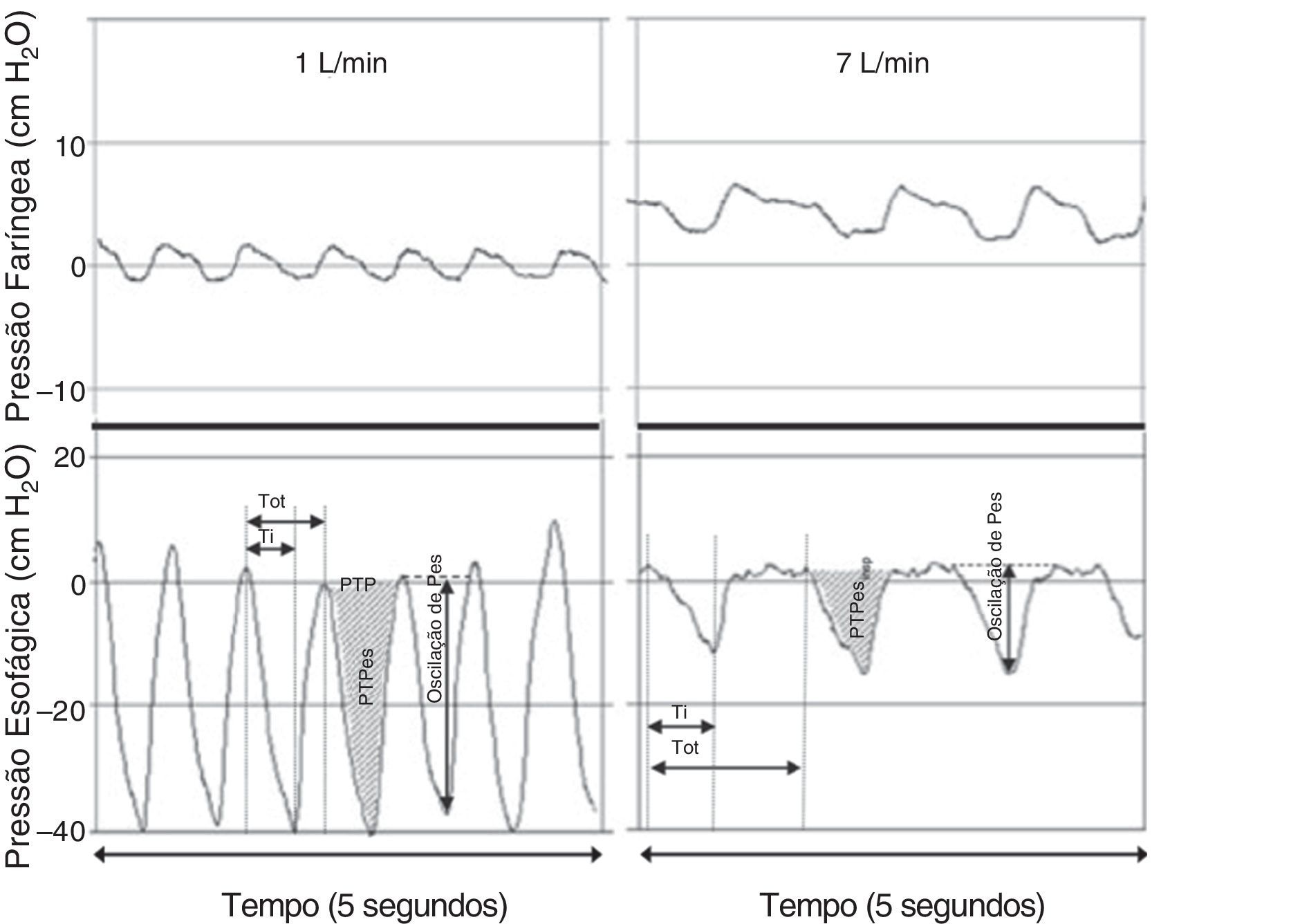
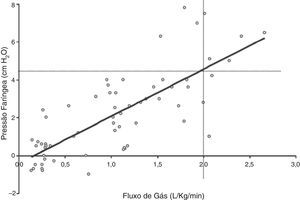
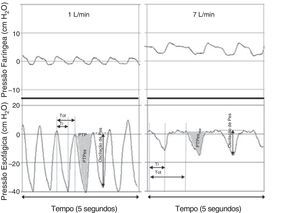
Fornecimento de baixos níveis de pressão nas vias aéreas: a CNAF cria um nível baixo de pressão positiva na faringe que pode ajudar a reduzir a resistência inspiratória dinâmica das vias aéreas e fornecer algum grau de pressão positiva contínua nas vias aéreas.10 O grau de pressão positiva nas vias aéreas observado está diretamente relacionado à taxa de fluxo da CNAF, afetada pela abertura da boca, e depende do local de medição da pressão.10 Três estudos usaram pressões medidas na nasofaringe como substitutas de pressões expiratórias finais positivas mais baixas. Milési et al.15 estudaram 21 bebês de mais de seis meses com bronquiolite e descobriram que aumentar a CNAF para 6‐7 L/min faz com que a pressão faríngea aumente para ∼6 cmH2O e dependa do peso, com fluxos ≥ 2 L/kg/min necessários para atingir a pressão faríngea de ≥ 4 cmH2O (fig. 3). Arora et al.16 relataram pressões faríngeas mais baixas de ∼3 cmH2O em 25 pacientes com bronquiolite em 6‐8 L/min, as pressões eram ainda mais baixas se a boca do indivíduo estivesse aberta. Spentzas et al.17 relataram pressões nasofaríngeas de 4‐5 cmH2O em bebês em 8‐12 L/min e pressões de ∼2 cmH2O em pacientes mais velhos em 20‐30 L/min. Pressões medidas por meio de uma sonda nasofaríngea são possivelmente afetadas pela impressão direta do jato de gás inspirado e provavelmente superestimam a pressão real transmitida às vias aéreas distais intratorácicas, o que leva autores a usar um cateter balão esofágico para medir a pressão esofágica (Pes).18–20 Em um estudo com 11 bebês com bronquiolite, a Pes expiratória final foi ∼7 cmH2O em 8 L/min.20 Em outro estudo com 24 bebês com bronquiolite ou em recuperação de cirurgia cardíaca, a Pes expiratória final foi ∼4 cmH2O em 2 L/kg/min e não significativamente diferente da Pes medida em um fluxo de 2 L/min.19 Da mesma forma, um estudo com 25 crianças gravemente doentes com uma variedade de doenças respiratórias descobriu que a Pes expiratória final era ∼5 cmH2O em 5‐8 L/min, somente ∼1 cm acima das medições obtidas em cânula nasal padrão de 2 L/min.18 Como um todo, as evidências disponíveis confirmam que a CNAF gera aumentos muito modestos na pressão expiratória final positiva relativa à cânula nasal padrão, embora a quantidade real dependa do fluxo da CNAF e do tamanho do paciente. Independentemente do mecanismo, a CNAF tem mostrado reduzir significativamente o trabalho respiratório, na maior parte do tempo atenua a pressão inspiratória intratorácica negativa, como comprovado pelas oscilações baixas da pressão esofágica (fig. 4) e pela atividade elétrica do diafragma.15,19
Figura 3.Relação entre a pressão faríngea e o fluxo de gás durante o apoio CNAF. Adaptado de Milési et al.15
Figura 4.Registros simultâneos das pressões faríngea (em cima) e esofágica (embaixo) de bebês que recebem 1 L/min (esquerda) e 7 L/min (direita) por meio de cânula nasal. Embora ocorra um aumento considerável na pressão faríngea durante condições de fluxo mais alto, praticamente nenhum aumento é observado na pressão expiratória final medida em nível torácico. A aplicação de um fluxo de 7 L/min reduziu de forma significativa as oscilações da pressão intratorácica por meio da atenuação da pressão inspiratória negativa. Adaptado de Milési et al.15
Ao iniciar uma terapia de CNAF, o médico deve controlar três variáveis principais: temperatura do gás, FiO2 e taxa de fluxo. Normalmente, configuramos a temperatura em aproximadamente 1 a 2 graus Celsius abaixo da temperatura do corpo e a ajustamos conforme necessário para o conforto do paciente. Temos presenciado crianças mais velhas e jovens adultos descreverem uma sensação desconfortável e de certa forma claustrofóbica quando a temperatura do gás é igual ou superior à temperatura do corpo, semelhante à experiência de respirar dentro de uma sauna a vapor ou em um dia ensolarado, quente e úmido.
Geralmente começamos a CNAF com uma FiO2 de 0,6 no paciente com hipoxemia, desde que não haja contraindicações fisiológicas ao uso dessas concentrações elevadas de oxigênio suplementar (p. ex., pacientes que se recuperam de uma reconstrução paliativa estágio I de Norwood para síndrome do coração esquerdo hipoplásico). A FiO2 é então rapidamente ajustada para mais ou para menos nos minutos seguintes para atingir a saturação de oxigênio visada (SPO2), normalmente de 92% a 97%. Embora a maioria dos pacientes tratados com a CNAF receba uma mistura de gases enriquecida com oxigênio suplementar, esse não é necessariamente o caso para todos os pacientes. Os pacientes com insuficiência respiratória sem hipoxemia ainda podem ser beneficiados pelos efeitos da CNAF sobre a mecânica respiratória enquanto recebem ar condicionado sem a adição de oxigênio.
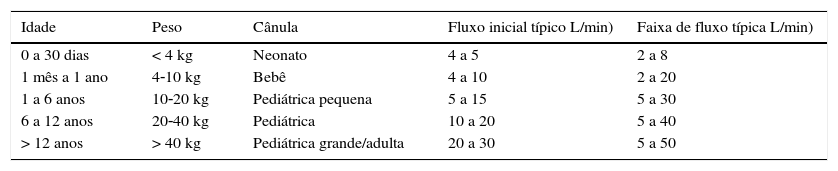
A escolha da taxa de fluxo de gás é estabelecida com base no tamanho do paciente e na magnitude percebida com relação ao apoio respiratório necessário. Em termos gerais, pacientes mais velhos/maiores e pacientes mais dispneicos exigirão fluxos maiores. Não há consenso com relação aos fluxos ideais da CNAF. Alguns autores relatam o uso de protocolos com base na idade, como 2 L/min para pacientes com < 6 meses, 4 L/min para 6‐18 meses e 8 L/min para 18‐24 meses21 ou 8‐12 L/min para bebês e 20‐30 L/min para crianças.17 Outros relatam dosagem com base no peso, como 1 L/kg/min22 ou 2 L/kg/min,23 e dados recentes sustentam que os efeitos da CNAF dependem do peso.15 Um pequeno apoio pode ser fornecido inicialmente com 0,5‐1,0 L/kg/min e um aumento do fluxo até 1,5‐2,0 L/kg/min pode ainda atenuar as oscilações na pressão intratorácica e reduzir o trabalho respiratório.24 Fluxos > 2 L/kg/min podem não ser muito mais eficazes.24 Em nossa prática, um neonato pode ter a CNAF iniciada com fluxos de 4‐5 L/min, ao passo que uma criança começa com um fluxo de 5‐15 L/min (tabela 1). Taxas de fluxo iniciais de 50 L/min foram usadas em estudos prospectivos de adultos gravemente doentes e podem ser razoáveis para pacientes com tamanho de adulto na UTIP.5
Fluxos iniciais típicos para início do uso da CNAF e faixas clínicas de fluxo de acordo com faixa etária e tamanho
| Idade | Peso | Cânula | Fluxo inicial típico L/min) | Faixa de fluxo típica L/min) |
|---|---|---|---|---|
| 0 a 30 dias | < 4 kg | Neonato | 4 a 5 | 2 a 8 |
| 1 mês a 1 ano | 4‐10 kg | Bebê | 4 a 10 | 2 a 20 |
| 1 a 6 anos | 10‐20 kg | Pediátrica pequena | 5 a 15 | 5 a 30 |
| 6 a 12 anos | 20‐40 kg | Pediátrica | 10 a 20 | 5 a 40 |
| > 12 anos | > 40 kg | Pediátrica grande/adulta | 20 a 30 | 5 a 50 |
L, litros; min, minutos.
Considerando o sucesso da CNAF no tratamento de neonatos, crianças e adultos gravemente doentes – principalmente a redução relatada da necessidade de intubação de bebês com bronquiolite tratados na UTIP – o próximo passo natural para os médicos era, naturalmente, considerar iniciar o uso precoce da CNAF em pacientes enquanto ainda fossem tratados no DE. Devido à sua ampla abrangência de populações de pacientes possivelmente adequadas, facilidade de uso, portabilidade e perfil favorável de segurança e conforto para o paciente, a CNAF rapidamente se torna uma modalidade adjunta importante no tratamento de insuficiência respiratória aguda no DE pediátrico.25,26 Embora exista uma carência de dados sólidos específicos do DE pediátrico, recomendamos que se considere o uso da CNAF em bebês e crianças com insuficiência respiratória hipoxêmica aguda e que precisem de apoio além da cânula nasal padrão, mas não de intubação endotraqueal. O uso da CNAF pode ser iniciado após a falha de testes com uma cânula nasal comum ou como modalidade de apoio respiratório principal.
A literatura cada vez maior que descreve o uso da CNAF em crianças foca principalmente em crianças com bronquiolite, apesar de o uso da CNAF também ser relatado em crianças com outras causas de insuficiência respiratória, inclusive pneumonia, asma, crupe e outras formas de obstrução das vias aéreas superiores, doença neuromuscular e convalescença de cirurgia cardíaca.25–29 Diversos estudos avaliaram se a redução da necessidade de ventilação mecânica invasiva estava associada à introdução da CNAF no cuidado clínico. Dois pequenos estudos retrospectivos de pacientes de UTIP com bronquiolite moderada a grave relataram que a diminuição da necessidade de intubação e ventilação mecânica estava, em geral, associada ao uso da CNAF no cuidado clínico.27,30 Um estudo maior de pacientes da UTIP com diversas etiologias de insuficiência respiratória mostrou, da mesma forma, a redução de índices de intubação após a introdução da CNAF.31 Embora esses estudos sejam limitados por seu modelo retrospectivo e uso de controles históricos, resultados semelhantes foram obtidos quando a CNAF foi implantada no DE pediátrico.25 Wing et al. estudaram 848 crianças com insuficiência respiratória aguda que precisaram de internação na UTIP.25 Os índices de intubação em geral caíram de 15,8% para 8,1% (p = 0,006) com a introdução da CNAF e o estabelecimento de uma diretriz de uso, inclusive uma redução de 21% para 10% (p = 0,03) entre crianças com bronquiolite.25 A redução geral foi em grande parte representada pela redução do índice de intubação no DE pediátrico, passou de 10,5% para 2,2% (p < 0,001), ao passo que os índices de intubação após a transferência para a UTIP continuaram estáveis.25
Outros estudos compararam os índices de intubação entre crianças tratadas com a CNAF ou a CPAP. Em um ensaio clínico controlado e randomizado prospectivo de pacientes na UTIP com menos de seis meses com bronquiolite, não houve diferença na necessidade de ventilação mecânica invasiva entre indivíduos tratados com a CNAF a 2 L/kg/min e a CPAP a 7 cmH2O, apesar de a CNAF ter sido associada a pioria mais frequente da dispneia.32 Em um ensaio clínico controlado e randomizado prospectivo de crianças com menos de cinco anos com pneumonia, indivíduos tratados com a CNAF apresentaram índices de deterioração clínica, intubação e óbito similares aos de indivíduos tratados com a CPAP.33 Estudos retrospectivos de pacientes da UTIP com bronquiolite22 e formas variadas de falência respiratória28 relataram indicies de intubação similares entre indivíduos tratados com a CPAP e indivíduos tratados com a CNAF. Entretanto, não há ensaio prospectivo intervencionista publicado com pacientes do DE pediátrico especificamente destinado a testar se a CNAF reduz a necessidade de ventilação mecânica. Logo, esses dados devem ser generalizados com cuidado para pacientes do DE. Ainda assim, devido à segurança relativa, ao conforto e ao fácil uso, recomendamos que se considere o uso da CNAF como uma forma de apoio respiratório para crianças que deem entrada no DE com insuficiência respiratória moderada a grave.
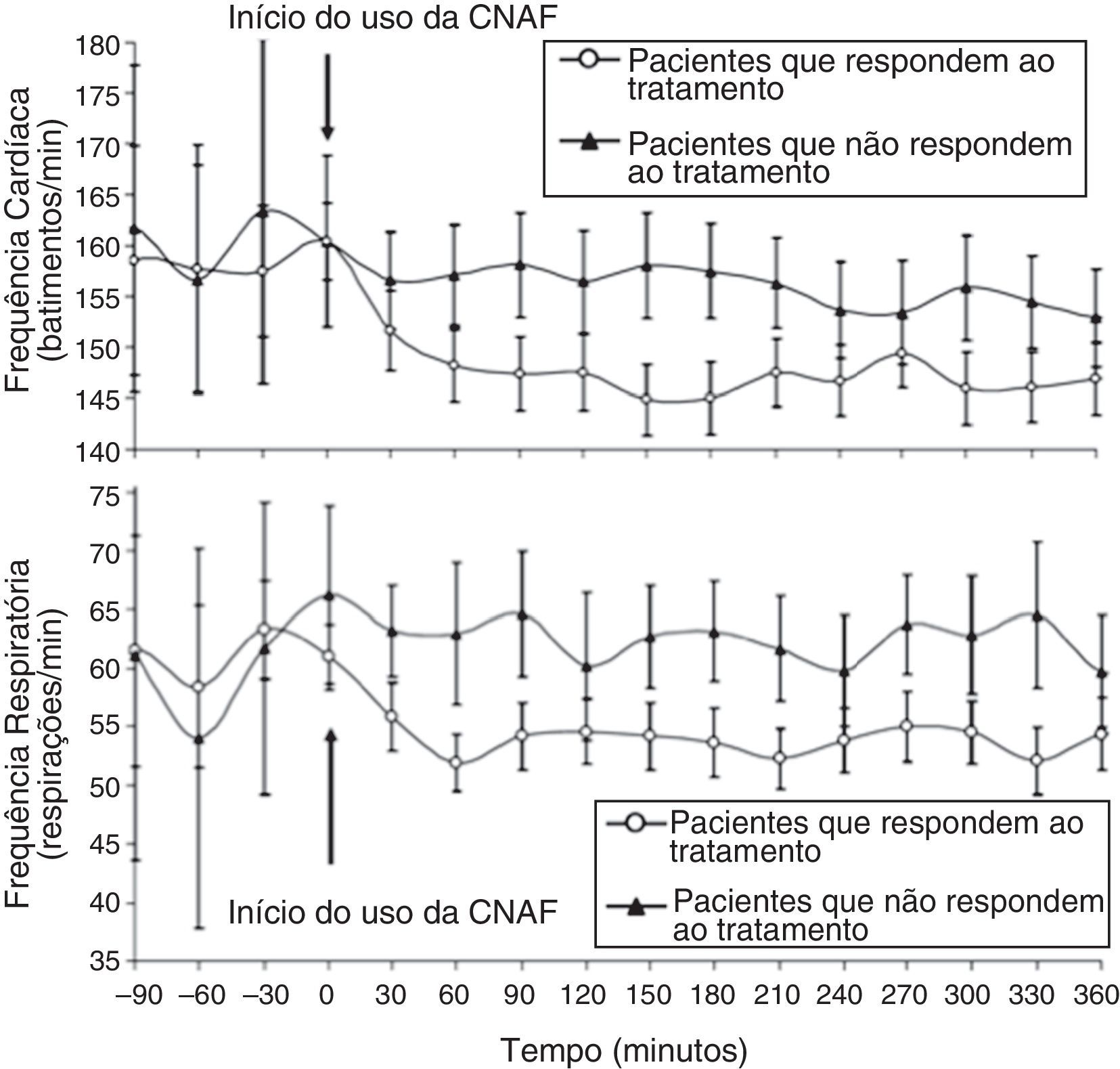
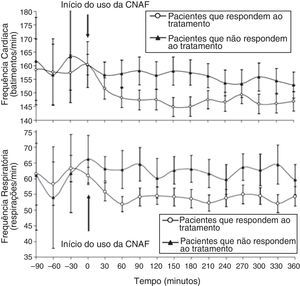
Com essa estratégia, crianças que não responderam à CNAF e que precisam de um nível maior de apoio respiratório devem ser identificadas rapidamente. Diversos estudos retrospectivos menores feitos no DE pediátrico e na UTIP buscaram identificar fatores demográficos e fisiológicos que poderiam representar a diferença entre sucesso e falha da CNAF em crianças com bronquiolite.23,26,27,34 Os preditores do sucesso incluem uma redução significativa na frequência cardíaca de referência dentro de 60 minutos do início da CNAF23,27 e uma melhoria significativa na frequência respiratória (fig. 5).27,34 Bebês e crianças que não tiveram sucesso com a CNAF, variavelmente definido como uma necessidade para a internação em UTIP ou encaminhamento para ventilação não invasiva ou invasiva, eram mais novos,26 menores,34 não tiveram melhoria na frequência cardíaca23,27 nem na frequência respiratória34 e estavam mais doentes na entrada, com pioria da frequência respiratória inicial26 e acidose respiratória,26,34 além do grau de gravidade da doença.27,34
Frequência cardíaca (em cima) e frequência respiratória (embaixo) ao longo do tempo em bebês com bronquiolite viral aguda. Uma redução considerável na frequência cardíaca e na frequência respiratória 60 minutos após o início do uso da CNAF separa os pacientes que respondem ao tratamento dos que não respondem nesta coorte. Adaptado de Schibler et al.27
Em crianças menos doentes, a CNAF foi comparada com a cânula nasal padrão (CN). Em um estudo observacional prospectivo com pacientes do DE pediátrico com bronquiolite, 18 crianças foram tratadas com CNAF e 18 com a CN padrão porque não havia sistema CNAF disponível.35 Embora os grupos apresentassem características básicas semelhantes, a CNAF foi associada a uma melhoria mais rápida na dispneia e a uma duração menor da internação.35 Em outro estudo observacional com 94 pacientes com bronquiolite iniciados na CNAF no DE, a necessidade de transferência para uma UTIP foi quatro vezes menor que a dos 33 controles contemporâneos que receberam a terapia de CN.23 Também houve diversos ensaios clínicos que compararam a CNAF com a CN padrão. Em um estudo, crianças com menos de 18 meses submetidas a extubação após cirurgia cardíaca foram randomizadas para a CNAF a 2 L/kg/min ou CN padrão a 2 L/min.36 A CNAF foi associada ao aumento da proporção PaO2:FiO2 e a uma necessidade menor de ventilação com pressão positiva não invasiva, porém não apresentou diferença em PaCO2 nem na reintubação.36 Um estudo piloto prospectivo menor com 19 crianças com bronquiolite não constatou diferença na duração da oxigenoterapia ou da internação com CNAF em comparação com o oxigênio por câmara pressurizada em torno da cabeça.37 Em um ensaio clínico controlado e randomizado aberto e muito maior que comparou a CNAF e a CN padrão em crianças com bronquiolite moderada internadas na enfermaria geral, Kepreotes et al.4 também não constataram diferença no período de internação, na duração da oxigenoterapia nem nos custos estimados de quarto entre os dois grupos. Entretanto, os autores estimaram que o modelo do ensaio clínico pragmático, que permitiu às crianças do grupo com oxigênio da CN padrão que não tiveram sucesso no tratamento serem encaminhadas para a terapia com CNAF enquanto permaneciam na enfermaria de terapia geral, apresentou boa relação custo‐benefício. Isso é importante se considerarmos que os encargos hospitalares associados à bronquiolite têm subido e são recomendados esforços para limitar os custos.38
Um fator crucial no custo da terapia de CNAF é o local do hospital onde ela é aplicada. Muitos sistemas hospitalares usam a CNAF somente no DE e na UTIP. Outros centros relataram o uso da CNAF nas enfermarias gerais, com perfis de segurança razoáveis.21,23,37,39–41 O uso da CNAF permitido nas enfermarias gerais foi associado à redução do tempo médio de internação no hospital e do total de encargos hospitalares em um estudo retrospectivo com crianças com bronquiolite incialmente tratadas com a CNAF na UTIP.21 A redução dos custos dos hospitais por meio do fornecimento da CNAF nas enfermarias gerais deve ser equilibrada com as preocupações com a segurança do paciente, principalmente considerando o índice de ∼10% de eventuais intubações relatado em diversos estudos com populações de pacientes variadas.17,21,22,26,27,30,33,34,40
Quando se inicia o uso da CNAF no DE, deve‐se também considerar se há disponibilidade de equipamentos CNAF portáteis para evitar a necessidade de interromper o tratamento (e o risco de deterioração clínica associado) ao transportar um paciente do DE para uma unidade hospitalar. Embora alguns desses pacientes possam tolerar o recebimento de gás não aquecido e não umidificado por meio de uma cânula simples ou até a interrupção da CNAF por um breve período de tempo durante o transporte, preferimos implantar dispositivos CNAF portáteis independentes no DE para que, quando necessário, pacientes possam ser transportados para a unidade hospitalar sem interrupção do tratamento.
Avaliação da resposta clínica à CNAFÀ medida que mais hospitais e mais locais dentro de hospitais usarem a CNAF, é essencial que sejam desenvolvidas diretrizes de uso, inclusive como, em quem e quando iniciar o uso da CNAF, protocolos para titulação e desmame, frequência e tipo de avaliação clínica em série e definições claras sobre o que caracteriza falha do tratamento com necessidade de encaminhar o paciente a outras formas de ventilação não invasiva (CPAP ou BiPAP) ou intubação endotraqueal.
O impacto clínico da CNAF sobre o paciente é subjetivamente evidente dentro de minutos após o início de seu uso, como comprovado por relatos de dispneia reduzida e aumento do conforto de pacientes adultos e crianças com capacidade de fala. Os sinais objetivos padrão de resposta clínica, como frequência cardíaca, frequência respiratória, batimento de asa de nariz, uso de músculo acessório e SpO2, usados individualmente ou como parte do índice de insuficiência respiratória normalmente são usados para avaliar a resposta clínica ao tratamento. Diversos estudos mostram que o início do uso da CNAF está associado a melhorias no esforço respiratório, medidas pela melhoria dos sinais vitais, dos índices respiratórios clínicos e da troca de gás.17,19,30,35,39–41 Segundo nossa experiência clínica, é possível distinguir os pacientes que respondem ao tratamento dos que não respondem dentro de 60 minutos após o início do uso da CNAF e, normalmente, até mesmo antes disso. Alguns centros tentaram avaliar o trabalho respiratório de forma mais objetiva que por mera observação clínica direta, mediram as oscilações da pressão intratorácica durante o ciclo respiratório por meio de um sensor de pressão ou balão colocado na região intratorácica meio‐distal do esôfago.15,18,24 Quando consideradas em conjunto com a frequência respiratória do paciente (produto da pressão/frequência), as estimativas da pressão intratorácica medida no esôfago podem ser uma ferramenta valiosa para avaliar a resposta clínica à CNAF e até para ajudar como apoio à titulação.15,18,24 Entretanto, a necessidade de inserção do transdutor esofágico e de equipamentos especiais de transdução de pressão relega essa técnica de monitoramento, na maior parte do tempo, ao uso para pesquisa.
Pacientes que não apresentam melhoria clínica ou continuam a se deteriorar mesmo com o início do uso da CNAF devem ser considerados para encaminhamento opcional ao tratamento (ou seja, BiPAP ou intubação endotraqueal) antes do desenvolvimento de um colapso cardiorrespiratório agudo. Por outro lado, pacientes que apresentam melhoria clínica significativa ainda precisam de observação próxima em um ambiente monitorado, devido à natureza cíclica de muitas doenças respiratórias (ou seja, bronquiolite) e à possibilidade de que a melhoria observada após o início do uso da CNAF seja apenas temporária.
Eventos adversosDe maneira geral, o sistema CNAF é seguro, desde que seja usado dentro dos parâmetros clínicos aceitáveis. Os eventos adversos costumam ser leves, como epistaxe, irritação da pele causada pela cânula ou aerofagia. Eventos adversos graves são extremamente raros, mas houve relato de pneumoencéfalo em um neonato prematuro42 e casos de escape de ar pulmonar (ou seja, pneumotoráx ou pneumomediastino)43 em crianças mais velhas que recebiam o apoio CNAF. Esses eventos adversos enfatizam a importância de se oferecer a CNAF por meio de um “sistema aberto” com uma cânula não oclusiva de tamanho adequado, que permita amplo vazamento de gás entre as pontas e as narinas. Um sistema aberto garante que as pontas da cânula sejam não oclusivas, reduz o risco de aumento repentino da pressão nas vias áreas em decorrência de obstrução negligente. É importante salientar que a incidência de escape de ar pulmonar observada em ensaios clínicos controlados e randomizados em neonatos prematuros vulneráveis não foi diferente entre pacientes tratados com a CNAF ou a CPAP nasal.6 Além disso, a incidência de problemas de pele em pacientes tratados com a CNAF foi significativamente menor do que em pacientes tratados com a CPAP nasal, que precisa de pressão contra a superfície da pele para criar uma vedação oclusiva.6
Alimentação de pacientes em CNAFNão é incomum que pacientes com insuficiência respiratória, especialmente bebês com bronquiolite viral, tenham ingestão oral inadequada nas horas ou dias anteriores à visita ao DE. Além disso, o desconforto causado pela fome normalmente contribui para que o paciente fique agitado, o que pode agravar a insuficiência respiratória. Por essas razões e pela grande importância da nutrição adequada, muitas vezes se pondera se um paciente que recebe a CNAF pode ou não ser alimentado. Embora essa preocupação possa não ser pertinente ao ambiente do DE em instituições nas quais os pacientes em CNAF são rapidamente transferidos para a UTIP, atrasos na transição definitiva de um paciente em CNAF podem levar muitas horas ou até mesmo dias em outros centros.
Embora alguns médicos considerem o uso da CNAF uma contraindicação para a alimentação por via oral, tivemos a experiência pessoal com adultos que ingeriram líquidos e sólidos sem dificuldade quando sujeitos a fluxos que chegam a 40 L/min. Nosso grupo e outros grupos demonstraram que a alimentação de pacientes com CNAF selecionados pode ser feita com segurança e com poucos eventos adversos.44,45 Geralmente, alimentamos pacientes com CNAF que tiveram melhoria clínica significativa contínua em sua insuficiência respiratória, independentemente da taxa de fluxo da CNAF. Nosso esforço tem sido desconsiderar a CNAF como um fator na decisão de iniciar uma nutrição enteral e aplicar os mesmos critérios aplicáveis em qualquer paciente com insuficiência respiratória (com ou sem CNAF): o paciente que apresentar melhoria suficiente de diversos marcadores de insuficiência respiratória receberá nutrição enteral como um teste, independentemente do fluxo da CNAF, ao passo que a nutrição enteral será retirada do paciente que continuar a fazer um grande esforço e que poderá precisar de encaminhamento para o apoio e/ou aspiração. Acreditamos que a combinação do apoio de CNAF com o conforto da nutrição enteral (em pacientes que atendem aos critérios necessários) pode ser um grande passo em direção à redução da insuficiência sofrida por bebês com bronquiolite viral aguda tratados no ambiente hospitalar intensivo.
ConclusãoA CNAF adquiriu um papel bem definido no tratamento de crianças com insuficiência respiratória hipoxêmica aguda, preencheu a lacuna entre o fornecimento de oxigênio suplementar de baixo fluxo e a ventilação não invasiva tradicional (ou seja, CPAP, BiPAP). Considerando a facilidade de uso, o conforto e o conjunto cada vez maior de evidências clínicas que sustentam sua equivalência clínica a outras modalidades de ventilação não invasiva, espera‐se que o uso da CNAF continue a se expandir para além das fronteiras das UTIs neonatais e pediátricas. Dados retrospectivos e relatos informais que mostram uma redução na necessidade de intubação e ventilação mecânica quando a CNAF é iniciada no DE são encorajadores e esperamos ansiosamente por mais dados definitivos de grandes ensaios clínicos randomizados para determinar o papel exato da CNAF em diversos subgrupos de pacientes do DE pediátrico com insuficiência respiratória.46
Conflitos de interesseDr. Rotta recebeu honorários pelo desenvolvimento de material educativo e por palestras patrocinadas pela Vapotherm, Inc. e pela BD/Carefusion. Ele também recebe royalties da Elsevier pelo trabalho editorial em um livro didático de cuidados pediátricos essenciais. Os outros autores declaram não haver conflitos de interesse.
Como citar este artigo: Slain KN, Shein SL, Rotta AT. The use of high‐flow nasal cannula in the pediatric emergency department. J Pediatr (Rio J). 2017;93:36–45.