To review the pathophysiology and evaluation methods of linear growth and bone mineral density in children and adolescents diagnosed with inflammatory bowel disease.
Source of dataNarrative review carried out in the PubMed and Scopus databases through an active search of the terms: inflammatory bowel disease, growth, failure to thrive, bone health, bone mineral density, and children and adolescents, related to the last ten years, searching in the title, abstract, or keyword fields.
Synthesis of findingsInflammatory bowel diseases of childhood onset may present as part of the clinical picture of delayed linear growth in addition to low bone mineral density. The presence of a chronic inflammatory process with elevated serum levels of inflammatory cytokines negatively interferes with the growth rate and bone metabolism regulation, in addition to increasing energy expenditure, compromising nutrient absorption, and favoring intestinal protein losses. Another important factor is the chronic use of glucocorticoids, which decreases the secretion of growth hormone and the gonadotrophin pulses, causing pubertal and growth spurt delay. In addition to these effects, they inhibit the replication of osteoblastic lineage cells and stimulate osteoclastogenesis.
ConclusionInsufficient growth and low bone mineral density in pediatric patients with inflammatory bowel disease are complex problems that result from multiple factors including chronic inflammation, malnutrition, decreased physical activity, late puberty, genetic susceptibility, and immunosuppressive therapies, such as glucocorticoids.
Revisar a fisiopatologia e os métodos de avaliação do crescimento linear e densidade mineral óssea em crianças e adolescentes com diagnóstico de doença inflamatória intestinal.
Fontes dos dadosRevisão narrativa a partir de pesquisa nas bases de dados PubMed e Scopus por meio de busca ativa dos termos inflammatory bowel disease, growth, failure to thrive, bone health, bone mineral density, children e adolescents nos últimos dez anos e com busca nos campos título, resumo ou palavra‐chave.
Resumo dos achadosAs doenças inflamatórias intestinais com início na infância podem apresentar como parte do quadro clínico atraso do crescimento linear, além de baixa densidade mineral óssea. A presença de processo inflamatório crônico com elevados níveis séricos das citocinas inflamatórias interfere negativamente na velocidade do crescimento e na regulação do metabolismo ósseo, além de aumentar o gasto energético, comprometer a absorção de nutrientes e favorecer perdas proteicas intestinais. Outro fator importante é o uso crônico de glicocorticoides, que diminuem a secreção de hormônio do crescimento e dos pulsos das gonadotrofinas e ocasionam atraso puberal e no estirão do crescimento. Além desses efeitos, inibem a reprodução das células da linhagem osteoblástica e estimulam a osteoclastogênese.
ConclusãoA insuficiência do crescimento e a baixa densidade mineral óssea em pacientes pediátricos com doença inflamatória intestinal são problemas complexos e que decorrem de múltiplos fatores, inclusive inflamação crônica, desnutrição, diminuição da atividade física, puberdade tardia, suscetibilidade genética a terapias imunossupressoras, como os glicocorticoides.
As doenças inflamatórias intestinais (DII) são doenças crônicas, de etiologia multifatorial decorrente da interação de fatores genéticos, ambientais, imunológicos e da microbiota intestinal.1 Caracterizam‐se por reação inflamatória crônica no trato gastrointestinal (TGI) e são representadas por três entidades: doença de Crohn (DC), retocolite ulcerativa (RCU) e colite indeterminada (CI).2
A presença de processo inflamatório acarreta elevado gasto energético para o organismo infantil, além de comprometer a absorção de nutrientes.3,4 A assistência dessas crianças envolve o manejo terapêutico da DII com controle da inflamação e o cuidado para assegurar o crescimento e desenvolvimento característicos dessa faixa etária.5 Embora a instituição do tratamento para controle da DII esteja associado a uma melhoria do padrão de crescimento linear, uma proporção substancial de crianças permanece com baixa estatura.6,7
A redução da densidade mineral óssea também é observada nos pacientes com DII. O ganho insuficiente da massa óssea na puberdade pode ter consequências ao longo da vida e predispor à osteoporose na idade adulta.8
Insuficiência do crescimento linear e baixa massa óssea são fenômenos complexos e multifatoriais que resultam da interação entre ingestão dietética inadequada, perdas gastrointestinais excessivas (enteropatia perdedora de proteínas), má absorção, aumento das necessidades nutricionais (gasto energético elevado pelo processo inflamatório crônico) e resposta do organismo aos mediadores inflamatórios4 (tabela 1).
Compreender os mecanismos associados à insuficiência do crescimento linear e redução da densidade mineral óssea nesse grupo de pacientes, com o intuito de prevenir ou minimizar danos, é de fundamental importância. Assim, esta revisão da literatura tem como objetivos abordar aspectos da fisiopatologia da insuficiência do crescimento linear na DII na infância, enfatizar a interferência da inflamação no metabolismo ósseo e as formas de avaliação do crescimento linear e da saúde óssea na população pediátrica.
Imunopatogênese da DIIA patogênese da DII ainda não está completamente esclarecida, embora já se saiba que a disfunção do sistema imunológico da mucosa do TGI desempenha papel importante.6 Uma resposta imune desregulada diante de antígenos bacterianos intestinais em indivíduo com predisposição genética é uma das explicações para o desenvolvimento da inflamação crônica. Atribui‐se a fatores ambientais associados ao estilo de vida do homem moderno o aumento na incidência da DII.9
Estudos de associação genômica já identificaram mais de 200 loci relacionados à suscetibilidade genética para DII. Esses genes codificam proteínas envolvidas na resposta imunológica inata e adaptativa, autofagia e integridade da mucosa intestinal. Dentre esses, polimorfismos no gene NOD2 são os que apresentam maior associação com predisposição genética para DII.10
Em relação aos fatores genéticos associados a DII, a maioria dos genes relacionados à suscetibilidade para DC não foi associada ao retardo do crescimento. Wine et al., em estudo que avaliou crianças com DC e genótipo NOD2 que se associa ao acometimento do íleo, não encontraram correlação com atraso ou insuficiência de crescimento.11 Levine et al. avaliaram os efeitos dos polimorfismos do promotor do fator de necrose tumoral (TNF) no atraso do crescimento em crianças com DC. Os pacientes portadores de polimorfismos com perda de função (ou seja, menor produção do TNF) apresentaram maiores escores‐z da altura média e tinham menor probabilidade de desenvolver atraso no crescimento.12
Russell et al. avaliaram 299 crianças escocesas (200 com DC, 74 com RCU e 25 com CI) e verificaram que os doentes com o haplótipo OCTN1/OCTN2da suscetibilidade à doença do locus IBD5 apresentaram maior probabilidade de ser mais baixos.13
Com o aumento da permeabilidade intestinal devido à quebra de barreira da mucosa intestinal, ocorre grande exposição a antígenos, principalmente bacterianos, ao sistema imunológico. A primeira linha de defesa contra esses antígenos é o sistema imune inato, mediado principalmente pelos neutrófilos, macrófagos e células dendríticas e pela produção de citocinas pró‐inflamatórias como IL‐1β, IL‐6, IL‐18, TNF, IL‐12, IL‐23 e IFN‐α e IFN‐β.14
Assim como a imunidade inata, a resposta imune adaptativa também se encontra ativada na DII, ocasiona persistência do estado de inflamação crônica. Há participação da imunidade humoral, linfócitos T efetores (TH), linfócitos T regulatórios (Treg), células NK e células linfoides inatas da mucosa intestinal. Historicamente, a DC era caracterizada com predomínio do perfil TH1 e consequente aumento das IL‐2, IL‐12 e IFN‐γ. Por outro lado, a RCU era caracterizada como um perfil TH2 atípico, uma vez que apresenta baixa concentração da IL‐4 e aumento da IL‐5 e IL‐13. No entanto, com a descoberta das células TH17, foi observado que ambas as doenças apresentam também o perfil TH17 e suas principais interleucinas, como IL‐17A, IL‐21 e IL‐23.14
Recentemente, microRNAs (RNAs pequenos, de fita simples, não codificadores de proteínas) que exercem papel importante na regulação gênica foram associados à imunopatogênese da DII.14 Desregulação desses microRNAs pode resultar num excesso de inflamação.15
Crescimento linear ósseoO crescimento linear ósseo em crianças e adolescentes é conduzido essencialmente pelo processo de condrogênese na placa de crescimento. A placa de crescimento apresenta um único tipo celular, o condrócito, distribuído em três camadas: zonas de repouso, proliferativa e hipertrófica. O processo de condrogênese é caracterizado pela proliferação e hipertrofia dos condrócitos associadas com secreção da matriz extracelular. Em seguida, a zona hipertrófica é invadida por vasos sanguíneos, osteoclastos e osteoblastos e a cartilagem recém‐formada é remodelada em tecido ósseo, o que aumenta o tamanho do osso longitudinalmente.16
Os principais fatores que regulam o crescimento linear ósseo são a ingestão alimentar e os hormônios. Tanto uma situação de desnutrição quanto de obesidade podem acarretar alterações no crescimento linear. Os hormônios da tireoide, hormônio do crescimento (GH), fator de crescimento insulina símile‐1 (IGF1), andrógeno e estrógeno, regulam positivamente o crescimento linear. Já os glicocorticoides, sejam endógenos ou exógenos, regulam negativamente o crescimento linear. O eixo GH/IGF1, dentre os hormônios descritos acima, apresenta papel essencial na regulação do crescimento após o nascimento. O receptor de GH é expresso amplamente no corpo, inclusive fígado e placa de crescimento. Uma vez ligado ao seu receptor, o GH induz a produção do IGF1. Assim, o GH apresenta ação direta na zona de repouso, estimula a diferenciação dos condrócitos e indiretamente via IGF1, o qual promove a hipertrofia dessas células. O IGF1 é produzido tanto no fígado quanto na própria placa de crescimento e sua expressão é aumentada pelo GH.16
As citocinas pró‐inflamatórias, principalmente TNF, IL‐1β e IL‐6, exercem papel importante no controle do crescimento linear em crianças e adolescentes com DII, atuam tanto sistemicamente no eixo GH/IGF1 quanto por suas ações diretas na placa de crescimento. A associação existente entre retardo de crescimento e baixa concentração de IGF1 já é bem estabelecida em pacientes pediátricos com DII. Nesses pacientes está caracterizado um estado de resistência ao GH, uma vez que a sua produção habitualmente está normal.17
O TNF diminui a expressão dos receptores de GH no fígado, consequentemente diminui a produção de IGF1.18 Terapia com infliximabe demonstrou aumento nos níveis de IGF1 tanto em modelos animais de colite quanto em pacientes pediátricos com DC.17 Em ação sinérgica com IL‐1β, ambos inibem na placa de crescimento a proliferação e hipertrofia dos condrócitos, assim como aceleram a apoptose dessas células.19 Além disso, TNF e IL‐1β inibem a produção dos esteroides sexuais diretamente nas gônadas, hormônios esses também responsáveis pelo crescimento ósseo.18
Em modelos animais de camundongos transgênicos com superexpressão do TNF foi demonstrado retardo de crescimento quando comparados com camundongos selvagens.20 Além disso, em experimento que usou cultura de ossos de feto de ratos cultivados com TNF foi observado menor crescimento ósseo nesse grupo quando comparado com o grupo controle. Em seguida, tratamento com etanercepte (receptor solúvel do TNF) acarretou melhoria no crescimento longitudinal desses ossos em cultura. Com esse mesmo modelo de experimento, foi encontrado resultado semelhante quando os ossos de feto de ratos foram cultivados com IL‐1β. Apresentaram menor crescimento ósseo quando comparados com o grupo controle e melhoria no crescimento quando tratados com anakinra (antagonista recombinante do receptor da IL‐1β).19
Modelo animal de camundongo transgênico com superexpressão de IL‐6 demonstrou redução no crescimento entre 50% a 70% quando comparado com camundongo selvagem.21 O retardo de crescimento nesses camundongos estava associado com redução no IGF1 e da proteína ligadora do fator de crescimento insulina símile tipo 3 (IGFBP3), com produção normal de GH.21,22 Segundo Benedetti et al., a redução na concentração sérica de IGF1 deve‐se ao aumento na proteólise da IGFBP3 que consequentemente diminui o tempo de meia‐vida da IGF1. Esse achado também foi encontrado em crianças com artrite idiopática juvenil forma sistêmica, nas quais altas concentrações da IL‐6 apresentaram correlação negativa com IGF1 e IGFBP3.21,22
Na placa de crescimento, IL‐6 aumenta a osteoclastogênese e reduz a atividade dos osteoblastos. Esse desequilíbrio favorece um afilamento da cartilagem na placa de crescimento com menor crescimento ósseo.17
Metabolismo ósseo e DIIA massa óssea depende da homeostase da remodelação óssea, ou seja, da dinâmica balanceada entre a atividade dos osteoblastos e osteoclastos, firmemente controlada pelo sistema imunológico.23 A formação do osso envolve a proliferação e migração das células osteoprogenitoras e a diferenciação dos osteoblastos. Mas se esse balanço ocorrer em favor da atividade dos osteoclastos, haverá reabsorção óssea.24
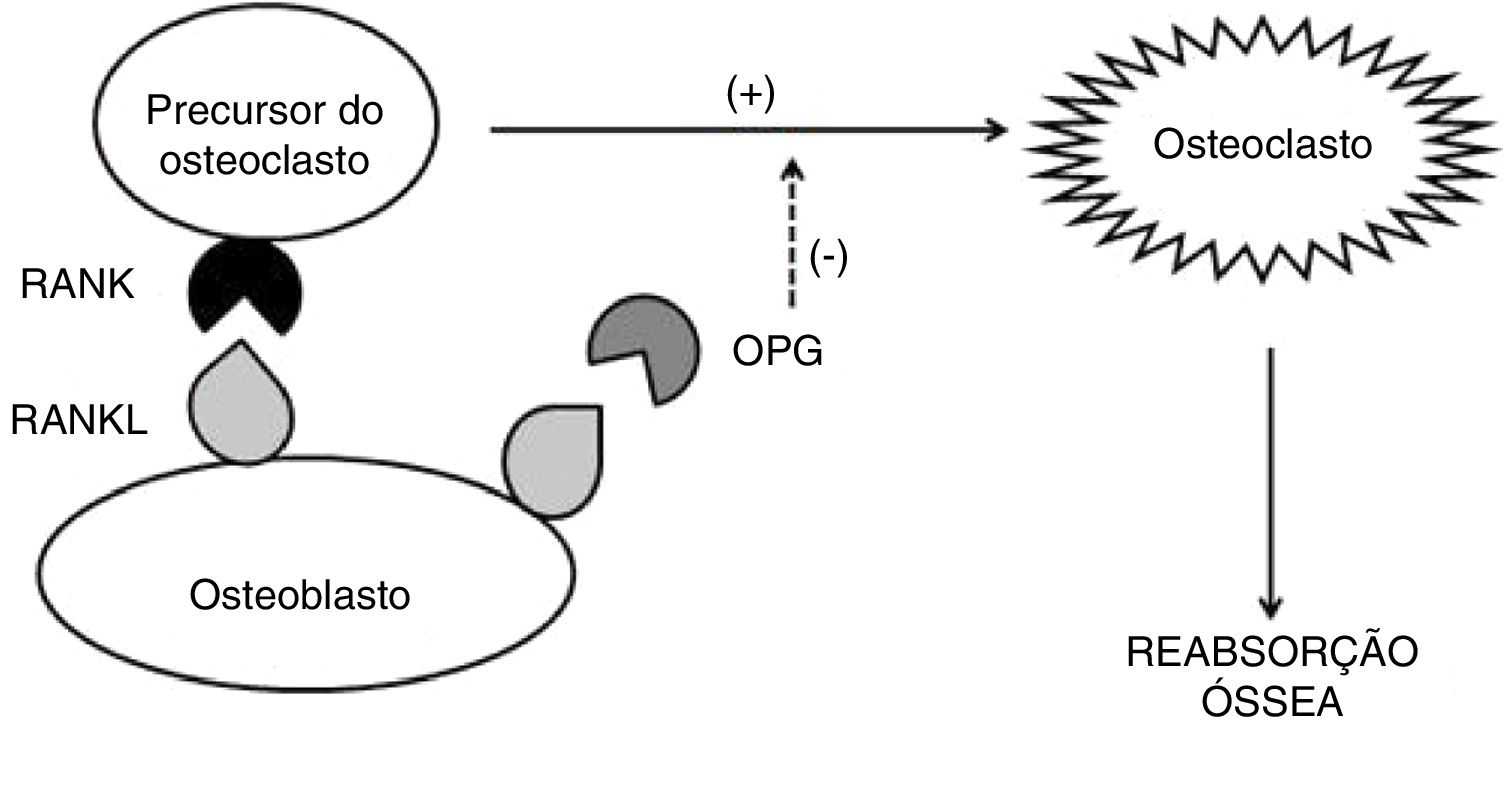
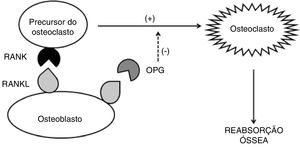
Algumas citocinas estão envolvidas nesse processo: IL‐1β, IL‐6 e TNF, que estimulam a atividade dos osteoclastos de forma autócrina; RANKL (ligante do receptor ativador nuclear kappa beta – da família do TNF), que se liga aos receptores transmembrana RANK (receptor ativador nuclear kappa beta) dos osteoclastos e induz a osteoclastogênese; a osteoprotegerina (OPG), que regula negativamente a formação e ativação dos osteoclastos, interrompe a ligação RANK‐RANKL por ligar‐se ao RANKL. A OPG é produzida primariamente pelos osteoblastos e seus precursores, mas também pode ser expressa pelas células B e células dendríticas (fig. 1). Em contrapartida, o fator de crescimento transformador beta (TGF‐β), produzido pelos osteoblastos e pelas células da medula óssea, é o mais abundante dos fatores de crescimento armazenado no osso e estimula a formação óssea, como também inibe a diferenciação, formação e atividade dos osteoclastos maduros.25
Em condições fisiológicas, a formação de osteoclastos é ditada pela interação de RANKL com seu receptor RANK. Enquanto altos níveis de RANKL são potencialmente osteoclastogênicos, baixos níveis de RANKL podem realmente aumentar a formação óssea. O aumento em excesso de RANKL, que é tipicamente o evento crucial que rege a reabsorção óssea, é regulado negativamente pela OPG. Ou seja, a ligação de RANKL à OPG limita a osteoclastogênese e por consequência a reabsorção óssea.25
Contudo, uma série de citocinas inflamatórias pode contribuir para a perda óssea. A expressão de RANKL é induzida por IL‐1β, IL‐6, IL‐11, IL‐17 e TNF, que não só aumentam a expressão do RANKL como induzem a liberação da forma de RANKL solúvel e suprem a produção de OPG. Esses mecanismos ocorrem em muitas doenças autoimunes e inflamatórias.24,26
Os níveis séricos de muitas interleucinas pro inflamatórias (inclusive IL‐1β, IL‐6 e TNF) estão aumentados na DII, favorecem a via da reabsorção óssea. A chave do mecanismo regulatório da diferenciação e da atividade osteoclástica estaria, portanto, na relação do RANKL e OPG. O aumento dos níveis de OPG pode representar uma resposta homeostática contínua, tentar reverter a osteoclastogênese e assim manter a massa óssea normal.27
As alterações na relação RANKL/OPG podem ser responsáveis pela perda óssea em pacientes com DII e levar à osteopenia e osteoporose.27 Em estudo caso‐controle que dosou níveis de OPG e RANKL em pacientes com DII, foi observado que níveis de OPG estavam elevados 2,4 vezes na DC e 1,9 vez na RCU, enquanto os níveis de RANK não foram significativamente diferentes nos pacientes com DII em comparação com controles saudáveis. Contudo, uma correlação negativa significativa foi encontrada entre os níveis plasmáticos de OPG e a densidade mineral óssea. Isso sugere que a perda óssea na DII está associada a alterações no sistema RANK/OPG.28
Glicocorticoides e crescimento linearDentre as ações dos glicocorticoides (GC) sobre hormônios e citocinas responsáveis pelo crescimento linear dos ossos destacam‐se: diminuição da secreção de GH por mecanismo de feedback negativo, redução da atividade do IGF1 sem diminuição da concentração sérica e queda nos pulsos das gonadotrofinas, o que leva ao atraso puberal e do estirão do crescimento.29 Além desses efeitos, os GC atuam diretamente nas células ósseas, inibem a reprodução das células da linhagem osteoblástica e induzem apoptose de osteoblastos maduros e osteócitos. Adicionalmente, estimulam a osteoclastogênese, aumentam a expressão do RANKL e diminuem a expressão de OPG nas células osteoblásticas30 (tabela 2).
Efeitos dos glicocorticoides no metabolismo ósseo e no crescimento linear
| Diminuição da secreção de GH |
| Redução da atividade do IGF1 |
| Atraso puberal e do estirão do crescimento |
| Inibição da reprodução dos osteoblastos |
| Estímulo à osteoclastogênese |
| Aumento da expressão do RANKL |
| Diminuição da expressão da OPG |
Embora os GC possam suprimir o crescimento ósseo, a diminuição da altura já no momento do diagnóstico de DII demonstra que esse resultado é uma consequência da doença, e não apenas um efeito adverso do tratamento. Vários estudos não encontraram um efeito independente dos GC sobre o crescimento, especialmente com o tratamento de curta duração ou baixas doses, e reforçam a hipótese de que a gravidade da DII é muito mais importante como fator de risco para o atraso no crescimento.31 Outro ponto relevante é que as doses diárias e cumulativas de GC e o tempo de duração do tratamento são fatores muito importantes na patogênese da redução da massa óssea nos pacientes.32
Métodos de avaliação do crescimento linear e do metabolismo ósseoDentre os métodos usados, destacam‐se a estatura‐para‐idade e o cálculo da velocidade de crescimento (VC).33,34
A estatura‐para‐idade (E/I) expressa o crescimento linear da criança. É o índice que melhor indica o efeito cumulativo de situações adversas sobre o crescimento da criança.33 Nas curvas de crescimento da OMS, um ponto de corte de dois ou mais DP abaixo da média é usado para identificar crianças com baixa estatura para a idade.33
Entretanto, estudos que definem a falha do crescimento linear com base apenas na estatura podem subestimar o crescimento de algumas crianças, uma vez que pacientes com estaturas relativamente normais podem ter crescido pouco durante um período de tempo. Como o que ocorre nas crianças com DII que diminuem a velocidade de crescimento nos períodos de atividade da doença e tendem a melhorá‐la quando a doença entra em remissão.34
A VC é calculada como a diferença entre duas medidas de altura em determinado intervalo de tempo. Geralmente é expressa em centímetros por ano (cm/ano). O intervalo mínimo de tempo para a aferição das duas medidas recomendado é de seis meses. Após o cálculo, coloca‐se o valor no gráfico de velocidade de crescimento para a idade (como é uma diferença de aferições em dois momentos, o ponto no gráfico deve ser inserido no intervalo médio entre as duas idades de aferição).35
Tanner et al. publicaram em 1966 os primeiros gráficos de VC para meninos e meninas e ainda hoje são usados em todo o mundo para avaliação de VC. As crianças e adolescentes devem, idealmente, crescer no mesmo percentil para VC, em torno do 50° percentil, e não abaixo do 25° percentil ou acima do 75° percentil.36,37
Identificar indivíduos com baixa massa óssea já no início da vida pode ser uma estratégia importante para que medidas preventivas e terapêuticas sejam tomadas para aprimorar o ganho de massa óssea e promover o crescimento saudável do esqueleto. A absorciometria por duplo feixe de raios X ou densitometria óssea (DXA), método mais usado para avaliar a densidade mineral óssea (DMO), é considerada o padrão‐ouro.38
A DXA apresenta como vantagens ser amplamente disponível no nosso meio, ser de rápida execução, ter boa precisão e usar baixos níveis de radiação ionizante. Porém, a interpretação das medidas densitométricas é muito mais complexa no indivíduo em crescimento do que nos adultos.39 Por esse motivo, em 2013, a International Society for Clinical Densitometry (ISCD) revisou diretriz específica para feitura e interpretação da densitometria em crianças e adolescentes. Baixa DMO é definida quando o escore‐z é menor ou igual a ‐2 DP para idade.40
Marcadores bioquímicos do turnover ósseo também podem ser usados para avaliar as taxas de formação e reabsorção ósseas que refletem a atividade osteoblástica e osteoclástica respectivamente. O principal sistema envolvido no desenvolvimento da osteopenia/osteoporose na DII e em outras doenças inflamatórias é provavelmente o RANK/RANKL/OPG.27
Dessa forma, a razão OPG/RANKL pode ser útil para determinar a taxa de reabsorção óssea em vários estados patológicos, especialmente em doenças inflamatórias.41,42
Intervenções para aprimoramento do crescimento e da massa ósseaO tratamento da insuficiência do crescimento é feito, principalmente, através do controle da atividade inflamatória, tanto na fase aguda quanto na manutenção da remissão da doença.43
A terapia enteral exclusiva com fórmula polimérica, além de restabelecer o estado nutricional do paciente com oferta adequada de nutrientes, é usada para indução da remissão da doença.44 Além disso, a velocidade de crescimento é significativamente melhorada quando se usa a indução de remissão com dieta enteral exclusiva, em relação ao tratamento com corticosteroides, com a vantagem de não apresentar efeitos colaterais.45
Devido aos efeitos colaterais, o uso de corticosteroides deve ser por períodos curtos e de preferência associados a aminossalicilatos ou a terapia imunossupressora com tiopurinas para a manutenção de remissão persistente.46
A terapia com imunobiológico anti‐TNF, infliximabe ou adalimumabe, é indicada especialmente para os pacientes que não apresentam resposta ao tratamento com tiopurinas e necessitam de corticoterapia para controle da inflamação com maior frequência.47 Estudos demonstram bons resultados na recuperação do crescimento linear em adolescentes e crianças, além de efeito benéfico para o metabolismo ósseo.42,48
A reposição de hormônio de crescimento ainda é controversa e pouco se sabe sobre os possíveis efeitos benéficos do uso de GH no crescimento linear de pacientes com DII. Pode ser considerada em casos selecionados que apresentem atraso puberal, mas uso prolongado não mostrou melhores resultados do que o controle da atividade da doença.47,49
Naqueles pacientes que apresentem baixa densidade mineral óssea, as terapias de primeira linha recomendadas para pacientes pediátricos incluem a suplementação de cálcio e vitamina D e a implantação de exercícios regulares. A monitoração deve ser feita através de densitometria óssea.5,50 É preciso reforçar os cuidados e as relações com a família, a presença de atividade física, a importância do autocuidado para o sucesso do tratamento.
Considerações finaisOs efeitos deletérios sobre o crescimento linear e a massa óssea constituem uma preocupação fundamental para os profissionais que atendem pacientes com doenças inflamatórias intestinais na faixa etária pediátrica, dada a evidência clínica de doentes com atraso grave de crescimento, que ocorre independentemente do controle da inflamação e da nutrição adequada.
No contexto de pacientes moradores de países em desenvolvimento, vale ressaltar a possibilidade de outra condição que pode estar sobreposta à DII: a disfunção entérica ambiental (enteropatia ambiental) que pode comprometer o crescimento linear (stunting) através de mecanismos patogênicos que se superpõem aos descritos na DII.51
Mais estudos são necessários para consolidar o conhecimento dos mecanismos que levam à insuficiência do crescimento e à baixa densidade mineral óssea, bem como formas de intervir nesse processo de forma a garantir o crescimento linear das crianças e adolescentes acometidos por DII.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Ferreira PV, Cavalcanti AS, Silva GA. Linear growth and bone metabolism in pediatric patients with inflammatory bowel disease. J Pediatr (Rio J). 2019;95:S59–S65.