To assess the relationship between mouth breathing and growth disorders among children and teenagers.
Data sourceSearch on MEDLINE database, over the last 10 years, by using the following terms: “mouth breathing”, “adenotonsilar hypertrophy”, “allergic rhinitis”, “sleep disturbance” AND “growth impairment”, “growth hormone”, “failure to thrive”, “short stature”, or “failure to thrive”.
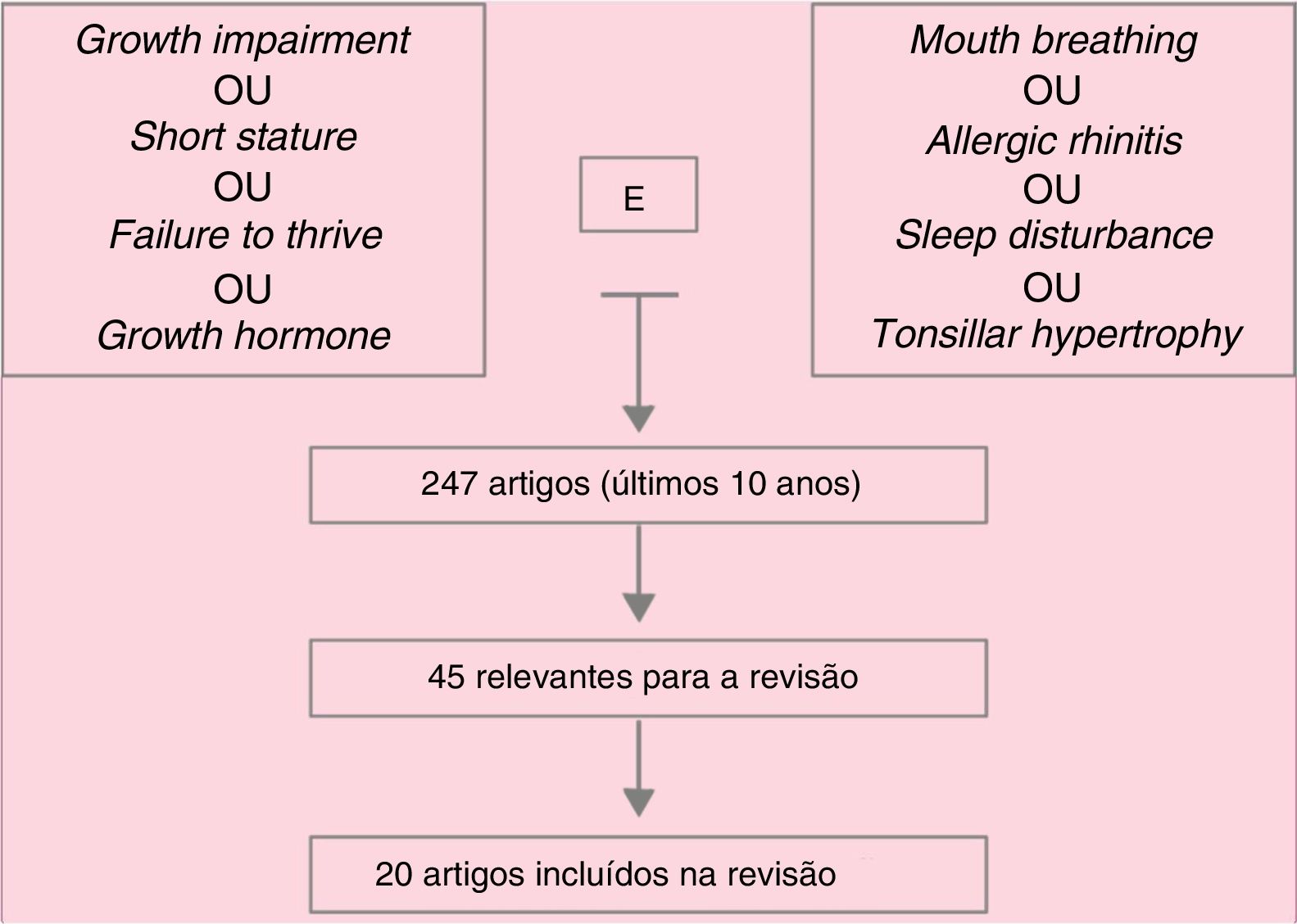
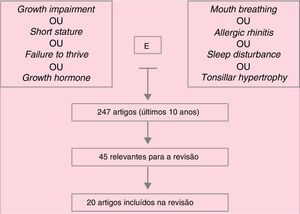
Data summaryA total of 247 articles were identified and, after reading the headings, this number was reduced to 45 articles, whose abstracts were read and, of these, 20 were deemed important and were included in the review. In addition of these articles, references mentioned in them and specific books on mouth breathing deemed important were included. Hypertrophy of palatine and/or pharyngeal tonsils, whether associated with allergic rhinitis, as well as poorly controlled allergic rhinitis, are the main causes of mouth breathing in children. Respiratory sleep disorders are frequent among these patients. Several studies associate mouth breathing with reduced growth, as well as with reduced growth hormone release, which are reestablished after effective treatment of mouth breathing (clinical and/or surgical).
ConclusionsMouth breathing should be considered as a potential cause of growth retardation in children; pediatricians should assess these patients in a broad manner.
Avaliar a relação entre respiração oral e distúrbios do crescimento entre crianças e adolescentes.
Fonte de dadosBusca na base de dados do MEDLINE, nos últimos 10 anos, com o emprego dos seguintes termos: “mouth breathing” ou “adenotonsilar hypertrophy”, ou “allergic rhinitis” ou sleep disturbance” AND “growth impairment” ou “growth hormone” ou “failure to thrive” ou “short stature” ou “failure to thrive”.
Síntese dos dadosForam identificados 247 artigos, que após a leitura dos títulos foram reduzidos a 45, cujos resumos foram lidos e desses 20 foram considerados de importância e integraram a revisão. Além desses, referências por eles citadas e livros‐texto específicos sobre respiração oral considerados importantes foram incluídos. A hipertrofia de tonsilas palatinas e/ou faríngeas, associada ou não à rinite alérgica, assim como a rinite alérgica mal controlada, é a principal causa de respiração oral na criança. Distúrbios respiratórios do sono são frequentes entre esses pacientes. Vários estudos associam a respiração oral à redução do crescimento, bem como à redução de liberação de hormônio do crescimento, que são restabelecidos após o tratamento efetivo da respiração oral (clínico e/ou cirúrgico).
ConclusõesA respiração oral deve ser cogitada como possível causa de retardo de crescimento em crianças e cabe ao pediatra a tarefa de investigar esses pacientes de forma mais abrangente.
Define‐se como respirador oral todo indivíduo que respira pela boca em decorrência de adaptação patológica, na presença ou não de obstrução nasal e/ou faríngea.1 A função primordial do nariz é levar o ar inspirado aos pulmões em condições ideais para que ocorra a hematose, ou seja, aquecido, umidificado, livre de micro‐organismos e de poluentes presentes no ar ambiente.2
Na criança, a respiração nasal é muito importante se comparada à do adulto. Já ao nascimento, a respiração nasal é condição obrigatória em virtude do posicionamento alto da laringe em relação à cavidade oral, o que lhe permite ser amamentado e respirar. A localização alta da epiglote, nesse caso, dificulta a entrada de ar às vias aéreas inferiores quando o fluxo é oriundo da boca, promove intenso desconforto respiratório na presença de obstrução nasal bilateral.1,2
Além disso, a respiração nasal na criança auxilia no crescimento dos ossos centrais da face e no arranjo funcional de toda a musculatura relacionada à respiração e à mastigação.1,2 Em condições de obstrução nasal crônica pode ocorrer hipodesenvolvimento dos processos palatinos da maxila, que levam ao aparecimento de palato duro em ogiva. Além disso, a respiração oral exige diversas adaptações musculares e posturais para se adequar a uma nova forma de respirar, de mastigar e mesmo de deglutir os alimentos.2
É comum, por exemplo, encontrar‐se abaixamento da mandíbula, musculatura labial hipotônica e alterações nas fases da deglutição nessas crianças que, se não identificadas e tratadas precocemente, podem se tornar irreversíveis. Além disso, a respiração oral concomitante à obstrução nasal pode predispor ao colapso de vias aéreas e, consequentemente, a distúrbios respiratórios do sono (DRS). Na figura 1 apresentamos o mecanismo de busca para os textos usados na presente revisão.
Prevalência de respiradores oraisA prevalência de respiração oral crônica em crianças tem sido pouco estudada e desconhece‐se a sua distribuição nas diferentes faixas etárias. Valores entre 3,4% e 56,8% têm sido documentados na dependência da população estudada (sadia, com problemas odontológicos, respiratórios ou outros), faixa etária avaliada e método diagnóstico empregado (questionário, exame físico).3–5
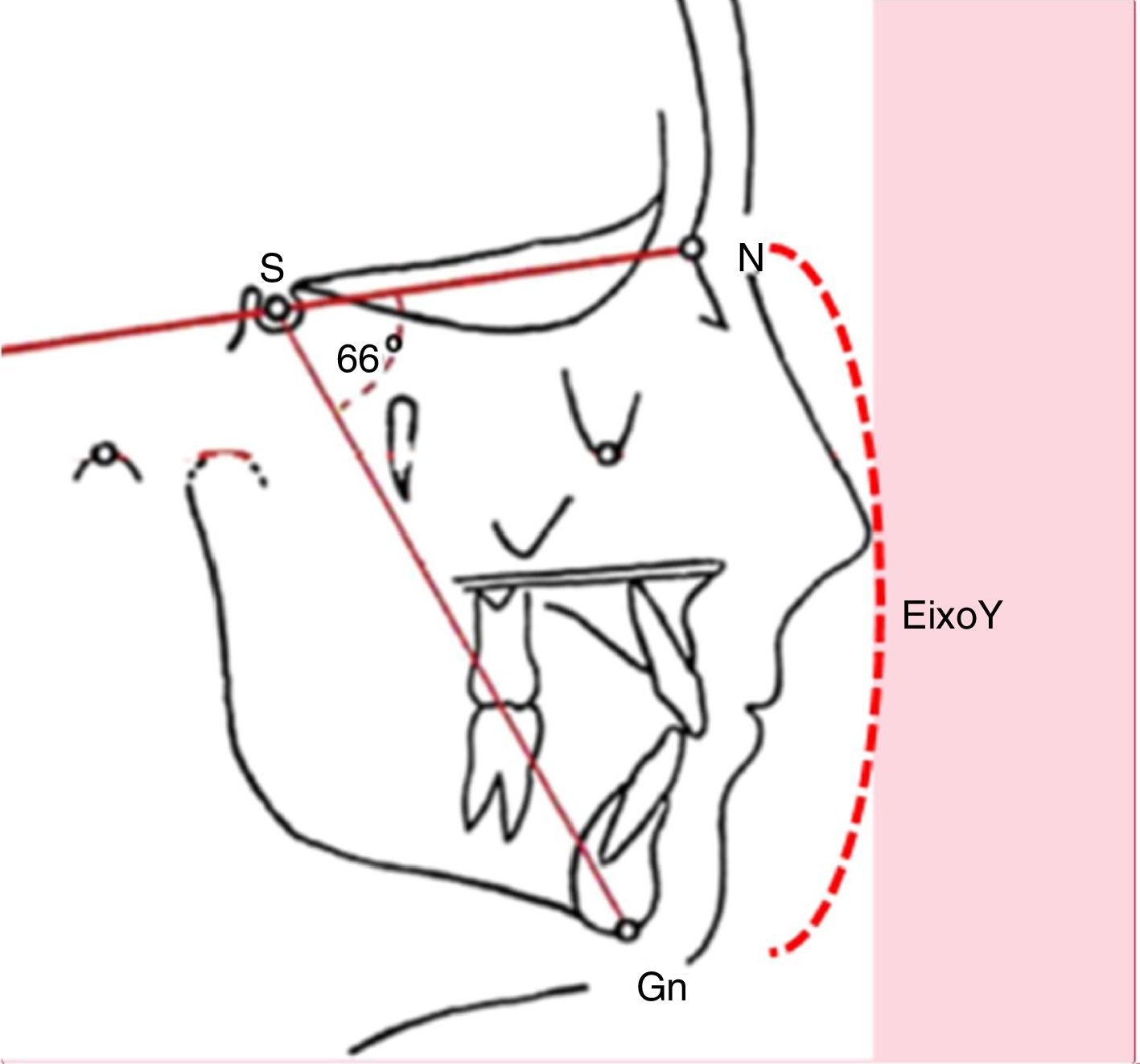
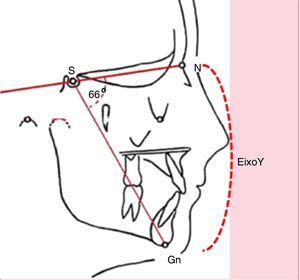
Quadro clínicoA respiração oral crônica pode determinar alterações esqueléticas e miofuncionais que comprometem o crescimento facial. Muitas crianças com respiração oral apresentam fácies alongada, fechamento incompleto dos lábios, lábio superior encurtado com acentuada concavidade, lábio inferior evertido e presença de olheiras. Caracterizam o que se denomina de fácies adenoidiana.6–9 À avaliação cefalométrica documenta‐se aumento do eixo Y (fig. 2).
A presença de roncos, associados ou não à apneia ou dificuldade respiratória durante o sono, é queixa muito referida entre pais ou cuidadores dessas crianças, seguida por sono agitado, despertares noturnos frequentes,1 bruxismo10 e, algumas vezes, sonambulismo.10–12 Frequentemente a respiração oral associa‐se a outros hábitos orais deletérios, como chupar o dedo, chupar chupeta, chupar e morder os lábios, roer as unhas, entre outros, com comprometimento da qualidade de vida.13
São observados também problemas de mastigação, deglutição e fala (fonemas linguodentais). É comum haver atresia do arco maxilar e a presença de palato ogival, associadas à mordida cruzada, que podem ser observadas já em pré‐escolares.6–9,11
Além disso, entre esses pacientes é comum a presença de DRS, tais como roncos, aumento da resistência das vias aéreas ou mesmo apneia, com frequência variável entre 3,3% (crianças com 5‐6 anos) e 42% (respiradores orais).5 A síndrome de apneia obstrutiva do sono (SAOS) é a forma mais grave e intensa de DRS e as crianças acometidas podem ter comprometimento neurocognitivo revelado por déficit de atenção e concentração, hiperatividade, cansaço matutino, diminuição na habilidade conceitual e de raciocínio verbal e não verbal, transtornos escolares,14,15 ou mesmo retardo de ganho pôndero‐estatural.1,2Cor pulmonale16 e hipertensão arterial sistêmica17 são complicações atualmente muito raras associadas a SAOS.
Etiologia da respiração oral em criançasEntre as várias causas de respiração oral na criança as mais frequentes são a hipertrofia de tonsilas faríngeas (adenoides) e/ou palatinas (amigdalas) e a rinite alérgica não tratada e, consequentemente, não controlada, embora não possamos esquecer outras etiologias, como a atresia de coanas uni ou bilateral, as variações anatômicas das conchas nasais, o corpo estranho nasal, as deformidades septais ou as massas nasais e entidades ainda mais raras que podem provocar congestão nasal, como a fibrose cística, a discinesia ciliar primária e as imunodeficiências primárias.
A hipertrofia de tonsilas faríngeas e/ou palatinas, embora possa estar presente em fase precoce da vida, em geral torna‐se aparente ao redor dos dois anos de vida, pois acompanham o desenvolvimento do sistema linfoide e podem acentuar‐se com o progredir da idade. Na maioria das vezes o seu diagnóstico é confirmado pela radiografia simples lateral da face e em casos duvidosos pela nasofibroscopia. A hipertrofia das tonsilas palatinas pode ser confirmada pela simples oroscopia.
A rinite pode ser definida como a inflamação sintomática da mucosa nasal e caracteriza‐se por obstrução nasal, rinorreia (anterior e posterior), espirros e prurido nasal. Constitui um problema muito comum desde a idade pré‐escolar, pode atingir até 40% das crianças.18 Foi demonstrado que a congestão nasal era a queixa mais frequente nas crianças com rinite em idade pré‐escolar.19
A rinite alérgica, quando não adequadamente controlada, pode evoluir com obstrução nasal crônica e, consequentemente, respiração oral de suplência. Além do quadro clínico característico, o exame físico desses pacientes evidencia hiperemia da conjuntiva ocular, olheiras, sulco nasal transverso e conchas nasais hipertrofiadas, que dificultam a livre passagem do ar. Muitas vezes, existe associação da rinite alérgica com a hipertrofia de tonsilas faríngeas,20–22 o que piora consideravelmente o quadro respiratório.23,24 Quando avaliadas por questionários específicos, crianças com rinite alérgica persistente moderada‐grave apresentam maior frequência de distúrbios do sono do que crianças controle, particularmente nos domínios de distúrbios respiratórios noturnos, sonolência diurna e parassonias.25,26 Além disso, há evidências de associação entre a gravidade da rinite alérgica e a intensidade dos distúrbios do sono.25,27
Cho et al. confirmaram essa afirmação ao estudar a presença de sensibilização alérgica como fator de risco para quadros mais graves de hipertrofia de tonsilas faríngeas e/ou palatinas.21 Os autores determinaram os níveis de IgE específica (sIgE) a alérgenos em soro e em tecido tonsilar extirpado (obtido em cirurgia de remoção) de 102 crianças respiradoras orais e com hipertrofia de tonsila faríngea. Segundo a presença ou não de sIgE, identificaram três grupos: alérgico (sIgE em soro e tecido, n=55), com alergia local (sIgE apenas tecidual, n=17) e sem alergia (ausente no soro e no tecido, n=32). Na população total, 70,6% dos pacientes eram sensíveis a pelo menos um alérgeno (soro e/ou tecido). Os níveis teciduais de sIgE foram significantemente mais elevados do que os séricos e com predomínio de sIgE a inalantes no tecido da tonsila faríngea e sIgE a alimentos na tonsila palatina. Prevalência significantemente mais elevada de asma, de rinite alérgica, de sintomas mais intensos e maior consumo de medicamentos de alívio foram observados entre os alérgicos em comparação com os não alérgicos. Esses dados são evidência inequívoca de que a associação de alergia agrava os quadros alérgicos nesses pacientes.21 Entretanto, esse fato não se confirmou em pacientes com dermatite atópica.23
O sono e crescimentoOs distúrbios respiratórios do sono (DRS, roncos, respiração oral e apneia obstrutiva do sono) têm sido identificados como fatores de risco para o retardo de crescimento associado à obstrução crônica das vias aéreas superiores, seja por hipertrofia de tonsilas faríngeas e/ou palatinas ou rinite alérgica.28–35
O sono é definido como um estado reversível de desengajamento perceptivo e falta de resposta ao meio ambiente.36 Em mamíferos são identificados pelo menos dois estágios básicos de sono documentados por sinais de atividade cortical (eletroencefalograma, EEG), movimentos rápidos dos olhos e tônus muscular: o estágio de sono sincronizado ou de sono não REM (Rapid eye moviment; NREM) e o de sono REM (Rapid eye movement).36
De maneira simplista, o sono inicia‐se pelo estágio de sono NREM, que é caracterizado por movimentos oculares rotatórios lentos, redução do tônus muscular e atividade cerebral fragmentada e de baixa amplitude.37 Esse estágio é composto por três fases: a primeira é uma fase transitória e curta que é seguida por uma segunda em que a atividade cerebral tem maior amplitude, a terceira é caracterizada por ondas lentas de grande amplitude e é conhecida como sono profundo, no qual há o aparecimento de ondas delta e liberação do hormônio de crescimento (GH).
O segundo estágio, denominado de sono REM, não é dividido em estágios e caracteriza‐se por movimentos rápidos dos olhos, variações de frequência cardíaca e respiratória, pressão arterial e fluxo sanguíneo cerebral diminuído. A atividade mental durante o sono REM está associada ao sonho, tem‐se como base a lembrança de sonhos relatada após cerca de 80% dos despertares nesse estado de sono.38,39 Os estágios do sono ocorrem de maneira cíclica durante a noite com a sucessão dos estágios 1 a 3 do sono NREM e sono REM em ciclos de 70 a 110 minutos com aumento da duração dos períodos de sono REM e redução do sono de ondas lentas.
Como mencionado anteriormente, é durante o sono profundo ou de ondas lentas (delta) que há a maior liberação do hormônio liberador do GH (GHRH) pelo hipotálamo.40–42 Estudos experimentais em animais documentaram que a administração do hormônio liberador de GH (GHRH) aumenta o sono NREM e que a inibição da sua secreção suprime a duração e profundidade do sono.43–46 Uma vez liberado, o GH atuaria em sítios específicos (via eixo GH‐IGF) e desenvolveria as suas diferentes funções, entre elas o crescimento. Alterações na homeostase do processo do sono poderão interferir com a liberação fisiológica dessa rede hormonal.
Respirador oral e retardo de crescimentoEvidências apontam para a redução da liberação hipofisária do GH em indivíduos com obstrução das vias aéreas.46 Embora a causa do retardo de crescimento não seja totalmente esclarecida, especula‐se que os níveis noturnos de GH sejam baixos, haja falta de apetite e disfagia que resultem em ingestão calórica baixa, hipoxemia noturna, acidose noturna e aumento do consumo energético após o aumento do trabalho de respiração. A remoção cirúrgica das tonsilas faríngeas e palatinas tem se acompanhado por retomada do crescimento normal para a idade nessas crianças,28–31,47 assim como o controle da rinite alérgica.34
Estudo experimental com ratos documentou estar a obstrução de vias aéreas superiores acompanhada por redução nos níveis hipotalâmicos e séricos de GHRH, assim como nos níveis de receptores para GHRH.43 Nesses animais, o tempo de vigília estava aumentado e o sono de ondas lentas, o sono paradoxal e as ondas de baixa atividade estavam reduzidos. A administração de ritanserina (antagonista seletivo do receptor de serotonima) aliviou esses efeitos, ou seja, normalizou o conteúdo hipotalâmico de GHRH, diminuiu a duração da onda, aumentou a duração e a profundidade do sono de ondas lentas e reduziu o retardo de crescimento observado nesses animais. Assim, os autores sugerem estar o retardo de crescimento observado nesses animais, com obstrução de vias aéreas superiores, associado ao GHRH hipotalâmico.43 Anormalidades no eixo GHRH/GH são subjacentes a ambos, com retardo de crescimento e sono de ondas lentas associado à obstrução de vias aéreas superiores.43
Em humanos, a avaliação de pacientes com hipertrofia das tonsilas faríngeas e/ou palatinas tem fornecido subsídios importantes para o melhor entendimento da relação entre obstrução de vias aéreas e déficit de crescimento. Revisão sistemática, seguida por metanálise, identificou 20 estudos entre 211 citações em que se avaliou a relação entre a presença de tonsilas faríngeas hipertrofiadas, crescimento, marcadores do crescimento e distúrbios respiratórios do sono em crianças.35 A análise conjunta dos dados de mais de 300 pacientes possibilitou confirmar, de modo mais efetivo, os resultados obtidos previamente. Houve aumento significante em relação aos valores pré‐cirúrgicos de peso (Diferença mínima significante (DMS)=0,57; IC95% 0,44 a 0,70), estatura (DMS=0,34; IC95%=0,20 a 0,47), avaliados por escore‐z, assim como dos níveis séricos de IGF‐1 (DMS=0,53; IC95%=0,33 a 0,73) e IGFBP‐3 (DMS=0,59; IC95%=0,34 a 0,83). Concluem os autores que médicos de atenção primária e especialistas devam considerar um quadro de DRS ao avaliar crianças com déficit de crescimento.35
Todavia, a falta de homogeneidade das populações avaliadas foi um fator limitante para as conclusões observadas e fez com que novos estudos fossem feitos. Tatlıpınar et al. avaliaram os níveis séricos de IGF‐1 e de IGFBP‐3, assim como a relação entre o volume da tonsila faríngea e a nasofaringe (TF/N), de pacientes (três a 10 anos) com apneia do sono secundária à hipertrofia de tonsilas faríngeas.48 A remoção cirúrgica acompanhou‐se por aumento de peso, de estatura e dos níveis séricos de IGF‐I e IGF‐BP3. Entretanto, não houve correlação significante entre a elevação dos biomarcadores e o índice TF/N.48
Estudo mais recente em crianças pré‐púberes, maiores de cinco anos, com quadro de hipertrofia de tonsilas faríngeas, documentou, após a extirpação das tonsilas, além de aumento significante do peso, da estatura e do índice de massa corporal, aumento significante dos níveis séricos de IGF‐1 e de grelina. A grelina está predominantemente envolvida na regulação do ciclo sono‐vigília, está associada a privação do sono, além de ter papel na regulação do metabolismo. Definida como o hormônio da fome, interage com o GH, leptina e orexinas na regulação do circuito do sono, enfatiza exercer papel no balanço energético durante o sono.49 Segundo os autores, o retardo de crescimento nessas crianças estudadas estaria relacionado aos menores níveis séricos de IGF‐1.50
Considerações finaisO nariz é o órgão responsável pelo olfato, essencial à respiração, através da umidificação, do aquecimento e da filtragem do ar inalado, permitindo ainda a drenagem dos seios paranasais. As vias aéreas superiores sofrem alterações importantes durante a infância e idade pré‐escolar, com um aumento de 6% para 40% do volume respiratório nasal, relativamente ao adulto, durante os primeiros cinco anos vida.51
Desde os primeiros meses de vida, justificado pelas condicionantes anatômicas, a respiração nasal é preferencial,1,52 metade das crianças apresenta hipoxemias significativas se o nariz estiver congestionado.52
A respiração oral pode ter consequências dramáticas, inclusive retardo no crescimento, realça a importância do reconhecimento precoce dessa entidade, que deve ser diagnosticada e corretamente controlada, seja por abordagem clínica ou mesmo cirúrgica.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.