To compare mortality and morbidity in very low birth weight infants (VLBWI) born to women with and without diabetes mellitus (DM).
MethodsThis was a cohort study with retrospective data collection (2001 – 2010, n=11.991) from the Neocosur network. Adjusted odds ratios and 95% confidence intervals were calculated for the outcome of neonatal mortality and morbidity as a function of maternal DM. Women with no DM served as the reference group.
ResultsThe rate of maternal DM was 2.8% (95% CI: 2.5‐3.1), but a significant (p=0.019) increase was observed between 2001‐2005 (2.4%, 2.1‐2.8) and 2006‐2010 (3.2%, 2.8‐3.6). Mothers with DM were more likely to have received a complete course of prenatal steroids than those without DM. Infants of diabetic mothers had a slightly higher gestational age and birth weight than infants of born to non‐DM mothers. Distribution of mean birth weight Z‐scores, small for gestational age status, and Apgar scores were similar. There were no significant differences between the two groups regarding respiratory distress syndrome, bronchopulmonary dysplasia, intraventricular hemorrhage, periventricular leukomalacia, and patent ductus arteriosus. Delivery room mortality, total mortality, need for mechanical ventilation, and early‐onset sepsis rates were significantly lower in the diabetic group, whereas necrotizing enterocolitis (NEC) was significantly higher in infants born to DM mothers. In the logistic regression analysis, NEC grades 2‐3 was the only condition independently associated with DM (adjusted OR: 1.65 [95% CI: 1.2 ‐2.27]).
ConclusionsVLBWI born to DM mothers do not appear to be at an excess risk of mortality or early morbidity, except for NEC.
Comparar mortalidade e morbidade em crianças de muito baixo peso (MBP) filhas de mães com e sem diabetes mellitus (DM).
MétodosEstudo de coorte com coleta retrospectiva de dados (2001‐2010, n=11.991) da rede Neocosur. Odds ratios ajustados foram calculados para mortalidade e morbilidade neonatal em função da DM materna. Mulheres sem DM serviram como grupo de referência.
ResultadosA taxa de DM materna foi de 2,8% (IC 95% 2,5‐3,1), mas um aumento significativo (p=0,019) entre 2001‐2005 (2,4%) e 2006‐2010 (3,2%) foi observado. As mães com DM eram mais propensas a ter recebido um curso completo de esteroides pré‐natais do que as sem DM. Os bebês de mães diabéticas tinham uma idade gestacional e peso ao nascer um pouco maior do que crianças filhas de não DM. A distribuição dos escores z do peso ao nascer, pequeno para idade gestacional e de Apgar foi semelhante. Não houve diferenças significativas entre os dois grupos em termos de síndrome do desconforto respiratório, displasia broncopulmonar, hemorragia intraventricular, leucomalácia periventricular e persistência do ductus arteriosus. Mortalidade na sala de parto, mortalidade total, necessidade de ventilação mecânica e taxas de sepse neonatal precoce foram significativamente menores no grupo diabético, enquanto enterocolite necrosante (NEC) foi significativamente maior em recém‐nascidos de mães diabéticas. Em análises de regressão logística NEC foi a única condição independentemente associada com DM (OR ajustado 1,65 [IC 95% 1,21 ‐2,27]).
ConclusõesCrianças MBP de DM não parecem estar em um excesso de risco de mortalidade ou morbidade precoce, exceto NEC.
A diabetes mellitus (DM) representa o problema médico mais comum que causa complicações na gravidez. Estima‐se que 0,2% a 0,3% de todos os casos de gravidez são complicados pela DM pré‐gestacional e outro percentual de 1% a 5% pela DM gestacional.1
Vários estudos indicam que as taxas de complicações perinatais entre mulheres diabéticas ainda são substancialmente maiores que aquelas da população em geral.2
Apesar de ter havido um progresso considerável no cuidado das mulheres grávidas diabéticas, o risco de parto prematuro ainda é elevado.3 A incidência exata de prematuridade nas mulheres grávidas diabéticas é controversa. Uma grande série relatou que 36% dos neonatos nascidos de mães com DM gestacional ou daquelas com DM pré‐existente dependente de insulina nasceram prematuramente, em comparação com 9,7% na população em geral.4
O cuidado pré‐concepcional e gestacional adequado reduz a frequência de malformações congênitas e melhora o desfecho da gravidez.5 Apesar das reduções substanciais nas taxas de morbidade e mortalidade atingidas com avanços recentes no cuidado neonatal, a prematuridade continua sendo o mais importante fator determinante da morbidade neonatal em casos de gravidez com diabetes.6 Apesar de um grande número de pesquisadores ter examinado a influência de vários fatores de risco perinatal no desfecho de crianças com muito baixo peso ao nascer (CMBPN), são escassos os estudos que têm como foco, especificamente, o desfecho de CMBPN nascidas de mães diabéticas.7–9 Adicionalmente, a maioria desses dados foi obtida de centros com um interesse especial em diabetes e gravidez e não foi apresentada diferença entre a DM pré‐gestacional e gestacional.
O objetivo deste estudo era comparar as taxas de mortalidade e as taxas de morbidade precoce e tardia em crianças com muito baixo peso ao nascer nascidas de mulheres com e sem DM em uma coorte de nascimento regional durante um período de 10 anos.
MétodosColeta de dadosA rede Neocosur da América do Sul (http://www.neocosur.org/neocosur/) é uma associação voluntária sem fins lucrativos de unidades de terapia intensiva neonatais (UTINs) de seis países da América do Sul (Argentina, Brasil, Chile, Paraguai, Peru e Uruguai), cujo objetivo principal é melhorar a saúde neonatal. Resumidamente, essa rede fornece uma base de dados continuamente atualizada que reúne, de forma prospectiva, informações de todas as CMBPN vivas (com peso ao nascer de 500g a 1.500g) nos centros participantes.
Um formulário estruturado é preenchido para cada criança com critérios diagnósticos predefinidos sobre os dados demográficos maternos, histórico da gravidez e cuidados pré‐natais, parto, situação da criança no parto, diagnósticos, procedimentos e complicações durante a internação e o desfecho na alta. Desde 2001, os dados são prospectiva e rotineiramente coletados e registrados on‐line na Rede Neocosur. Os dados foram extensivamente validados e as análises dos subconjuntos foram relatadas em muitos trabalhos até o momento.10,11
Este é um estudo de coorte com coleta de dados retrospectivos pela Rede Neocosur entre 2001 e 2010. Para fazer a triagem e diagnosticar a DM, foi empregado o protocolo da Organização Mundial de Saúde, pois é mais inclusivo e simples, com um teste oral de tolerância à glicose de 75g recomendado entre 24‐28 semanas para todas as mulheres com fatores de risco de diabetes gestacional.12 Como este foi um estudo em 22 maternidades, esses critérios não foram seguidos universalmente e algumas maternidades usaram critérios locais para fazer a triagem e diagnosticar a DM.
Medidas dos desfechosA idade gestacional (IG) nas semanas concluídas foi definida como a melhor estimativa de IG com base no último período menstrual e no exame de ultrassom pré‐natal precoce. A prematuridade foi definida de acordo com a OMS13 e foi classificada nos seguintes subgrupos: prematuridade extrema (< 28 semanas), muito prematuro (28‐31 semanas) e prematuridade tardia ou moderada (32‐36,6 semanas).
Como o corte na entrada da base de dados é determinado pelo peso ao nascer de < 1.500g e como neonatos pequenos para a idade gestacional podem, teoricamente, ser representados excessivamente, optamos por incluir nesta análise somente aqueles que nasceram antes de 36 semanas completas, o que resultou na exclusão de 20 neonatos. Também excluímos 22 neonatos abaixo de 22 semanas de gestação porque a maioria não sobreviveu. Três neonatos adicionais foram excluídos devido à sua IG desconhecida e 110 pelo estado diabético desconhecido da mãe. Assim, 10.867 partos e 11.991 neonatos foram incluídos na análise.
O escore Z| do peso ao nascer específico do sexo foi calculado com relação a um gráfico local de crescimento intrauterino.14 Segundo Gruenwald,15 as medidas pequeno para a idade gestacional (PIG) e grande para a idade gestacional (GIG) foram definidas quando os pesos para a idade gestacional e o sexo eram de mais ou menos de dois escores Z separados de sua mediana esperada, respectivamente. Os desfechos de PIG (n=308) e os desfechos de GIG (n=1055) são apresentados apenas para a IG de 22‐32 semanas a fim de evitar a representação excessiva de ambas as doenças.
A síndrome do desconforto respiratório (SDR) foi diagnosticada de acordo com critérios clínicos e radiológicos. A enterocolite necrosante (NEC) foi diagnosticada pela presença de características clínicas e radiológicas de acordo com os critérios de Bell et al.16 Foi incluída apenas a NEC definida (graus 2 e 3 de Bell). A hemorragia intraventricular (IVH) e a leucomalácia periventricular (PVL) foram diagnosticadas com a ultrassonografia craniana e a IVH foi estabelecida com a classificação de Papile et al.17 A displasia broncopulmonar (DBP) foi definida de acordo com os critérios de Bancalari & Claure, incluindo características clínicas e radiológicas, juntamente com a exigência de suplementação de oxigênio aos 28 dias de idade ou em 36 semanas de idade pós‐menstrual.18 A persistência do ductus arteriosus (PCA) foi diagnosticada de acordo com os critérios clínicos e de ultrassonografia. A sepse neonatal precoce foi definida na presença de hemocultura positiva antes de 72 horas de vida. A reanimação na sala de parto foi definida como um ou mais dos seguintes: tratamento com oxigênio, ventilação por respirador manual Ambu, intubação para ventilação, massagem cardíaca e administração de epinefrina. A taxa combinada de mortalidade ou complicações graves incluiu óbito ou DBP, IVH graus III e IV e NEC graus II e III.
A pontuação Neocosur é uma pontuação dos riscos de mortalidade neonatal desenvolvida para CMBPN com base em variáveis existentes no nascimento, antes da internação na unidade de terapia intensiva neonatal. É uma ferramenta importante de comparação entre UTINs em países em desenvolvimento.10 O tratamento surfactante para neonatos prematuros era o padrão de cuidado em todas as UTINs da Neocosur durante o período do estudo.
Análise estatísticaUm cálculo do tamanho da amostra que pressupôs 25% de taxa de mortalidade hospitalar de crianças nascidas de mães não diabéticas mostrou que, com 80% de poder e 5% de nível de significância, este estudo poderia detectar um risco de 1,5 em 144 neonatos nascidos de mães diabéticas (NMD) e 577 neonatos nascidos de mães não diabéticas.
As características maternas e os desfechos neonatais entre grupos com DM e sem DM foram comparados com o teste qui‐quadrado para variáveis categóricas e o teste t de Student ou o teste de Mann‐Whitney para variáveis contínuas. Uma análise bivariada foi feita para examinar o efeito da situação diabética da mãe (com ou sem DM) sobre a mortalidade e diversas morbidades de crianças com MBPN. Uma análise multivariada de regressão logística foi feita para avaliar o efeito independente da situação da DM sobre a mortalidade e outras complicações da prematuridade. Um conjunto fixo de variáveis clinicamente importantes foi introduzido nos modelos. As variáveis incluídas foram: idade da mãe, gravidez múltipla, doenças hipertensivas maternas, tratamento com esteroides no pré‐natal, tipo de parto, necessidade de reanimação na sala de parto, sexo, IG e escore Z do peso ao nascer.
Os desfechos dos modelos logísticos são apresentados como odds ratios ajustados com intervalos de confiança de 95%. O software Stata 9.2 (College Station, Texas, EUA) foi usado para todos os cálculos estatísticos. Um nível de significância de 5% foi usado, porém, devido aos grandes números, muitas das diferenças examinadas eram extrema e estatisticamente significativas, então, por conveniência, qualquer valor de p < 0,001 foi truncado a esse valor.
Adicionalmente, como é provável que, em nossa população, as maternidades públicas e privadas apresentem diferentes desfechos de CMBPN durante o período do estudo, também investigamos as taxas de DM e comparamos os desfechos perinatais entre ambos os grupos para mães diabéticas. Além disso, comparamos os períodos de 2001‐2005 e 2006‐2010 para explorar se houve algum impacto sobre os diagnósticos ou as práticas de tratamento dos desfechos perinatais de grávidas diabéticas durante esse tempo.
A pesquisa foi feita de acordo com os princípios éticos vigentes e foi aprovada pelo Conselho de Revisão Institucional da Pontifícia Universidade Católica.
ResultadosDe janeiro de 2001 a dezembro de 2010, 12.146 CMBPN foram registradas na base de dados e representaram > 93% de todas as CMBPN vivas nos centros da Neocosur.
Foram identificadas 304 gestações de mulheres com diabetes pré‐existentes (tipo 1: doença autoimune; tipo 2: resistente à insulina, porém controlada por medicação ou insulina) ou diabetes gestacional (dependente de insulina ou não) que terminaram durante o período de avaliação de 10 anos. O restante (n=10.563) eram gestações de mulheres sem diabetes.
A taxa de ‘gravidez de mulheres com diabetes’ foi de 2,8% (IC de 95%; 2,5‐3,1) ou 1 em cada 35 partos. Os números correspondentes para os centros públicos e privados foram de 2,8% (238/8238, 1:33) e 2,5% (66/2629, 1:39) (p=0,305), respectivamente. A tendência secular mostrou um aumento estatisticamente significativo nos casos de gravidez de mulheres com DM entre 2001‐2005 (2,4%, IC de 95%; 2,1‐2,8) e 2006‐2010 (3,2%, IC de 95%; 2,8‐3,6) (p=0,019).
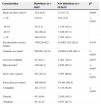
A tabela 1 lista as características demográficas, de gravidez e parto entre mulheres com DM em comparação com mulheres não diabéticas. Resumidamente, as mães no grupo com DM eram mais velhas, tinham maior probabilidade de receber maior cuidado pré‐natal assistido, apresentaram gravidez múltipla, doenças hipertensivas, partos cesáreos e receberam um curso completo de esteroides pré‐natais. Não foi constatada interação entre as doenças hipertensivas e o PIG (p para interação 0,701).
Comparação das características demográficas, de gravidez e parto de mães diabéticas e não diabéticas
| Característica | Diabéticas (n=304)a | Não diabéticas (n=10.563)a | pb |
|---|---|---|---|
| Idade da mãe (anos)c | 32,6 (6,5) | 27,4 (7,3) | 0,008 |
| < 16 | 2 (0,5) | 243 (2,3) | < 0,001 |
| 16‐19 | 10 (3,1) | 1.510 (14,2) | |
| 20‐35 | 184 (60,4) | 7.108 (67,3) | |
| > 35 | 108 (35,8) | 1.702 (16,1) | |
| Escolaridade (ensino médio) | 179/219 (82) | 6.109/7.162 (85,3) | 0,143 |
| Cuidado pré‐natal | 294/301 (97,9) | 9.039/10.426 (86,7) | < 0,001 |
| Gravidez múltipla | 43 (14,1) | 1.081 (10,2) | 0,027 |
| Hipertensãod | 140 (46,1) | 2.820 (26,7) | < 0,001 |
| Parto não vaginal | 253 (83,5) | 7.267 (68,8) | < 0,001 |
| Esteroides pré‐natais | 300 (98,8) | 10.402 (98,4) | |
| Completo | 221 (73,7) | 5.715 (54,9) | < 0,001 |
| Parcial | 45 (14,8) | 2.010 (19,3) | |
| Nenhum | 34 (11,4) | 2.677 (25,7) |
A tabela 2 apresenta as características dos neonatos e, devido aos nascimentos múltiplos, os números são maiores do que os das mães. O grupo com DM apresentou uma idade gestacional ligeiramente maior, menor proporção de neonatos extremamente prematuros e menor necessidade de reanimação na sala de parto, porém apresentou uma média mais elevada de peso ao nascer do que o grupo sem DM. O escore médio padronizado do peso ao nascer (escore Z) foi quase idêntico em ambos os grupos.
Comparação das características dos neonatos nascidos de mães diabéticas e não diabéticas
| Característica | Diabéticas (n=347)a | Não diabéticas (n=11.644)a | pb |
|---|---|---|---|
| Sexo masculinoc | 171/346 (49,4) | 5.930/11.618 (51,4) | 0,552 |
| Idade gestacional (semanas)c | 29,6 (2,6) | 28,9 (2,9) | < 0,001 |
| Extremamente prematurod | 73 (21,2) | 3.644 (31,3) | < 0,001 |
| Muito prematurod | 187 (53,8) | 5.595 (48,1) | 0,031 |
| Prematuro tardiod | 87 (25,0) | 2.405 (20,6) | 0,045 |
| Peso ao nascer (g)c | 1.138 (262) | 1.085 (279) | < 0,001 |
| Escore Z do peso ao nascerc | –1,29 (2,3) | –1,14 (2,1) | 0,207 |
| Escore Z do peso ao nascerc,e | –0,64 (1,4) | –0,55 (1,2) | 0,241 |
| PIGd,e | 11/300 (3,6) | 297/10.265 (2,9) | 0,432 |
| GIGd,e | 38/300 (12,6) | 1.017/1.0265 (9,9) | 0,116 |
| Escore de Apgar em 5min ≤ 3d | 16/345 (4,6) | 736/11.514 (6,4) | 0,187 |
| Reanimação na sala de partod,f | 154/342 (45,0) | 6.410/11.550 (55,5) | < 0,001 |
PIG, pequeno para a idade gestacional (menos de dois escores Z além da média esperada); GIG, grande para a idade gestacional (mais de dois escores Z além da média esperada).
A tabela 3 compara as taxas de mortalidade e complicações neonatais graves entre os dois grupos. A pontuação Neocosur, as taxas de óbito na sala de parto, a mortalidade no hospital, a ventilação mecânica, a sepse neonatal precoce e as complicações graves combinadas foram significativamente menores no grupo com diabetes. Vale ressaltar que a taxa de NEC foi a única morbidade significativamente maior no grupo com diabetes.
Mortalidade e morbidade infantis em filhos de mães diabéticas e não diabéticas
| Característica | Diabéticas (n=347)a | Não diabéticas (n=11.644)a | pb |
|---|---|---|---|
| Pontuação Neocosur c | 0,189 (0,246) | 0,242 (0,265) | 0,002 |
| Óbito na sala de parto d | 6/291 (2,0) | 433/9.468 (4,5) | 0,041 |
| Todos os óbitos no hospital d | 65/344 (18,9) | 2.919/11.541 (25,3) | 0,007 |
| SDR d | 242/341 (70,9) | 8.244/11.270 (73,1) | 0,370 |
| Ventilação mecânica d | 197/341 (57,7) | 7.205/11.252 (64,0) | 0,017 |
| Ventilação mecânica (dias) e | 1 (5) | 2 (7) | 0,008 |
| CPAP (dias) e | 1 (3) | 1 (4) | 0,572 |
| Doses de surfactante e | 1 (2) | 1 (2) | 0,454 |
| DBP – 28 dias d | 80/336 (23,8) | 2.688/10.996 (24,4) | 0,789 |
| DBP – 36 semanas d | 56/309 (18,1) | 1.805/10.357 (17,4) | 0,751 |
| NEC graus II e III d | 52/340 (15,3) | 1.238/11.256 (11,0) | 0,013 |
| IVH graus III e IV d | 9/309 (2,9) | 456/1.1991 (3,8) | 0,417 |
| PVL d | 13/329 (3,9) | 552/10.781 (5,1) | 0,341 |
| PCA d | 86/338 (25,4) | 2875/11.179 (25,7) | 0,909 |
| Sepse neonatal precoce d | 5/335 (1,5) | 409/11.172 (3,6) | 0,035 |
| Complicações graves combinadas d (óbito ou DBP/IVH graus III e IV/NEC graus II e III) | 190/347 (54,7) | 7.208/11.644 (61,9) | 0,006 |
SDR, síndrome do desconforto respiratório; CPAP, pressão positiva contínua nas vias aéreas; DBP, displasia broncopulmonar; NEC, enterocolite necrosante; IVH, hemorragia intraventricular; PVL, leucomalácia periventricular; PCA, persistência do canal arterial.
Após o ajuste nas análises de regressão logística, a NEC graus II e III foi a única doença independentemente relacionada ao grupo com DM (tabela 4).
Odds ratios brutos e ajustados e IC de 95% para mortalidade e morbidade entre CMBPN prematuras nascidas de mães diabéticas
| Variável | OR bruto (IC de 95%) | OR ajustado (IC de 95%)a |
|---|---|---|
| Óbito na sala de parto | 0,43 (0,19‐0,99) | 1,14 (0,44‐2,92) |
| Todos os óbitos no hospital | 0,68 (0,52‐0,90) | 1,19 (0,86‐1,65) |
| SDR | 0,89 (0,70‐1,13) | 1,18 (0,90‐1,56) |
| Ventilação mecânica | 0,76 (0,61‐0,95) | 1,08 (0,82‐1,41) |
| DBP – 28 dias | 0,96 (0,74‐1,24) | 1,20 (0,91‐1,58) |
| DBP – 36 semanas | 1,04 (0,78‐1,40) | 1,22 (0,89‐1,67) |
| IVH graus III e IV | 0,63 (0,48‐0,83) | 0,87 (0,65‐1,17) |
| PVL | 0,76 (0,43‐1,33) | 0,97 (0,55‐1,72) |
| NEC graus II e III | 1,46 (1,08‐1,97) | 1,65 (1,21‐2,27) |
| PCA | 0,99 (0,77‐1,28) | 1,17 (0,89‐1,54) |
| Sepse neonatal precoce | 0,39 (0,16‐0,96) | 0,45 (0,16‐1,24) |
| Complicações graves combinadas | 0,74 (0,59‐0,91) | 1,01 (0,71‐1,43) |
OR, odds ratio; IC, intervalo de confiança.
As maternidades públicas (n=9090) apresentaram um risco cada vez maior de NEC graus II e III quando comparadas com as maternidades privadas (n=2901) para CMBPN nascidas de mães diabéticas (OR ajustado 1,67; IC de 95%; 1,22‐2,28, p<0,001); os outros desfechos perinatais não foram significativamente diferentes entre as maternidades. Além disso, a NEC graus II e III foi a única doença que apresentou um risco cada vez maior de 2006‐2010 (n=6684), em comparação com 2001‐2005 (n=5307), para CMBPN nascidas de mães diabéticas (p=0,001), ao passo que os outros desfechos não diferiram entre os períodos.
DiscussãoAté onde sabemos, este é o primeiro estudo na América Latina que investiga a relação entre DM materna e desfechos perinatais em CMBPN na última década. O tamanho da amostra foi grande e o período do estudo permitiu a análise de tendências temporais.
O atual estudo mostra, inesperadamente, que o risco de mortalidade ou de morbidade precoce não aumentou para um grande número de NMD prematuros, todos nascidos com peso ao nascer de < 1.500g, em comparação com neonatos nascidos de mães não diabéticas em uma coorte de nascimento regional em 10 anos. Ademais, a análise multivariada não identificou a DM materna como um fator de risco para a mortalidade ou a morbidade precoce, exceto a NEC, nessa população de crianças com MBPN prematuras.
Nos últimos anos, o cuidado de pacientes obstétricas diabéticas mudou e é provável que isso possa ter desfecho na tendência de melhorias na detecção, no controle glicêmico e nos desfechos da gravidez entre pacientes obstétricas diabéticas.
Em uma análise recente da prevalência de diabetes gestacional em países da Europa, os números relatados estavam entre 2,0 e 6,0% em mais da metade deles.2 Em um estudo anterior de DM em gestações de crianças com MBPN, a prevalência foi maior (5,4%) em comparação com o nosso número de 2,8%.6 Entretanto, a estimativa da prevalência de diabetes gestacional se torna difícil devido à ausência de critérios diagnósticos universalmente aceitos.19
O baixo controle glicêmico está associado a um risco cada vez maior de pré‐eclâmpsia20 e pode explicar que a taxa de doenças hipertensivas da mãe era mais prevalente no grupo com DM. Além disso, foi relatado que a obesidade, além da DM, estava associada a um risco cada vez maior de pré‐eclâmpsia do que a qualquer outro fator isolado. Isso implica outros mecanismos possíveis, como a inflamação no desenvolvimento de pré‐eclâmpsia nesse grupo de alto risco.21
As mulheres com DM tinham mais probabilidade de ter um parto cesáreo e um parto vaginal do que mulheres normoglicêmicas. Além disso, a tendência de IMC pré‐gestacional aumentado observada na América Latina,22 aliado a partos múltiplos e hipertensão mais elevados, poderá explicar parcialmente, neste estudo, o fato de a melhor opção para pacientes diabéticos ser evitar o parto vaginal.2
Na literatura internacional, as pacientes com DM gestacional ou pré‐existente geralmente estão expostas a um risco mais elevado de parto prematuro.23 Uma possível explicação é que as pacientes com DM que não atingiram o nível de controle glicêmico desejado refletem um subgrupo de pacientes com menor aderência e maior risco de parto prematuro com MBPN.
A duração da gestação foi de certa forma maior, ao passo que no grupo com DM foi observada uma proporção menor de neonatos extremamente prematuros. Isso pode resultar da gestão moderna e de controles glicêmicos adequados na gravidez que levaram a uma gestação prolongada e menor risco de mortalidade neonatal com MBPN e morbidade nas gestações com complicações causadas por DM.
De acordo com um estudo feito em Israel com base na população,7 não houve diferenças significativas nas características antropométricas entre os dois grupos no nascimento (exceto o peso ao nascer).
Os escores de Apgar foram semelhantes em ambos os grupos, de acordo com estudos anteriores,7‐9 apesar de a reanimação fornecida ter sido significativamente menor no grupo com DM.
A Pontuação Neocosur significativamente menor observada no grupo com DM está de acordo com a mortalidade total durante a internação, que foi significativamente maior no grupo sem diabetes.
A prevalência de morbidade respiratória foi semelhante nas duas populações estudadas, ao passo que a gravidade, ilustrada pela necessidade de suporte de respiração e o número mediano de dias com relação à ventilação mecânica, foi estatisticamente menor no grupo com DM. Os estudos clínicos sobre os efeitos da diabetes materna na maturação pulmonar fetal geraram dados conflitantes,9,24 possivelmente devido às diferenças no controle da diabetes, no uso de esteroides pré‐natais, na distribuição do sexo, na IG, no tipo de parto, em casos de asfixia no nascimento, na definição de SDR e na gravidade da doença em diferentes populações estudadas. Nossos achados ainda apoiam essa observação; ou seja, após o controle da IG, do sexo e do tipo de parto, não houve aumento na probabilidade de SDR.
Isso também foi verdade para outras complicações graves de prematuridade, como as taxas de DBP na idade pós‐menstrual de 28 dias ou 36 semanas, as taxas de PCA, IVH ou PVL. Por outro lado, a sepse neonatal precoce e as complicações graves combinadas foram mais frequentes no grupo sem DM.
Em análises bivariadas, o odds ratio de morte na sala de parto, todas as mortes no hospital, a ventilação mecânica, o IVH graus III e IV, a sepse neonatal precoce e as complicações graves combinadas pareceram significativamente menores para CMPBN no grupo com DM do que no grupo de controle. Especulamos que essas diferenças possam ter ocorrido, em parte, como desfecho de uma combinação de fatores como (1) IG e peso ao nascer no grupo com DM ligeiramente maiores e (2) uma taxa significativamente maior de cursos completos de esteroides pré‐natais no grupo com DM que pode estar atrelada a um melhor cuidado pré‐natal. Em nosso estudo, aproximadamente 80% dos neonatos em ambos os grupos foram expostos a esteroides pré‐natais. Ademais, uma análise de Cochrane revelou que a terapia pré‐natal com esteroides diminui os riscos de DBP e IVH.25 Um terceiro fator foram as diferenças no tipo de parto: houve uma taxa maior de partos cesáreos no grupo com DM. Embora o assunto seja altamente controverso, alguns estudos retrospectivos indicam que pode haver uma taxa reduzida de complicações relacionadas à prematuridade quando o neonato nasce por parto cesáreo.26 Outros fatores influenciadores incluem diferenças na taxa de doenças hipertensivas maternas que, conforme esperado, foram mais prevalentes no grupo com DM e parece que a pré‐eclâmpsia pode reduzir o risco de a paciente desenvolver SDR.27
Nas análises multivariadas, apenas a NEC persistiu de maneira independente, relacionada a um maior risco em CMBPN com DM. Essa patogênese é multifatorial e envolve uma resposta exagerada do sistema imunológico a um distúrbio (infeccioso ou uma resposta à translocação de bactérias entéricas normais).28 Como os indivíduos nascidos por parto cesáreo não têm contato com as bactérias vaginais e intestinais maternas, isso pode levar a mudanças de longo prazo na microbiota intestinal que podem contribuir para o desenvolvimento de NEC. Adicionalmente, a NEC foi a única morbidade observada com maior frequência em centros públicos e demonstrou ser uma tendência significativa no período do estudo. Em um estudo da população, a NEC não estava associada à DM, embora as taxas fossem iguais à metade das observadas neste estudo.7
Este é um estudo de coorte retrospectivo com 22 unidades de maternidade diferentes na região da América Latina e, consequentemente, existiria alguma inconsistência nos métodos de exame e diagnóstico da DM. Isso pode ter levado ao não relato de casos de DM em algumas unidades e, consequentemente, à inclusão de algumas mulheres com diabete oculta no grupo sem DM.
Outra limitação de nosso estudo é que o tipo de DM e o grau de controle glicêmico não foram registrados de forma prospectiva na base de dados. Embora a DM pré‐gestacional e gestacional envolva alterações metabólicas distintas, o caso da população infantil de nosso estudo representa o grupo das CMBPN após a exposição à DM da mãe no útero. Além disso, os estudos anteriores não demonstravam diferenças estatisticamente significativas em condições sociodemográficas ou desfechos perinatais entre ambos os grupos.7,29 Além da menor taxa de DM pré‐gestacional (0,2 a 0,3%) em outros estudos,1 é provável que nossas observações representem as tendências gerais no desfecho desses neonatos.
Nossos dados sugerem que, com gestão moderna e cuidado pré‐natal adequados, não existe aumento significativo nas taxas de mortalidade ou de morbidade precoce nas CMBPN nascidas de mães com DM, exceto NEC. Parece que, com controle diabético razoável, é o estado de prematuridade, e não o estado diabético, que determina o desfecho neonatal.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Agradecemos a todos os centros da Neocosur que participaram neste estudo. O presente estudo contou com a colaboração da Rede Neonatal Neocosur:
Argentina: Guillermo Colantonio, Gabriel Musante, Luis Prudent, Liliana Rochinotti, Ines Galindez, Mariana Sorgetti, Lorena Soler (Clinica y Maternidad Suizo Argentina, BuenosAires); Isabel Kurlat, Oscar Di Siervi, Adriana Escarate (Hospital de Clínicas José de San Martin, Buenos Aires); Gonzalo Mariani, Jose María Ceriani, Silvia Fernandez, Carlos Fustiñana (Hospital Italiano, Buenos Aires); Jorge Tavosnaska, Liliana Roldan, Hector Sexer, Elizabeth Lombardo (Hospital Juan Fernandez, Buenos Aires); Gabriela Torres, Daniel Agost, Augusto Fischetti, Monica Rinaldi (Hospital Lagomaggiore, Mendoza); Carlos Grandi, Claudio Solana, Javier Meritano, Miguel Larguia (Maternidad Sarda, Buenos Aires), Marcelo Decaro, Lionel Cracco, Gustavo Bassi, Noemi Jacobi, Andrea Brum, Nestor Vain (Sanatorio de la Trinidad, Buenos Aires); Adriana Aguilar, Miriam Guerrero, Edgardo Szyld, Alcira Escandar (Hospital Dr. Diego Paroissien, Buenos Aires); Horacio Roge, Mario Marsano, Elisa Fehlmann, Jorge Rios (Hospital Español de Mendoza, Mendoza).
Brasil: Vanda Simões, Marynea do Vale Nunes, Marilia Martins (Hospital Universitário Materno Infantil, Universidade Federal do Maranhão).
Chile: Jorge Fabres, Alberto Estay, Alvaro Gonzalez, Sandra Vignes, Mariela Quezada, Jose L. Tapia, Soledad Urzua (Hospital Clinico Universidad Catolica de Chile, Santiago); Rodrigo Ramírez, Maria Eugenia Hübner, Jaime Burgos, Jorge Catalan (Hospital Clinico Universidad de Chile, Santiago); Lilia Campos, Aldo Bancalari, Lilian Cifuentes, Jorge Leon, Eduardo Broitman, Roxana Aguilar (Hospital Guillermo Grant, Concepción); Jane Standen, Marisol Escobar, Alejandra Nuñez (Hospital Gustavo Fricke, Viña del Mar); Agustina González, Ana Luisa Candia, Lorena Tapia, Giovanna Loguercio, Claudia Avila (Hospital San Jose, Santiago); Claudia Toro, Patricia Mena, Angelica Alegria, Adolfo Llanos (Hospital Dr. Sotero del Rio, Santiago); Veronica Peña, Marianne Bachler, Patricia Duarte (Hospital San Borja Arriaran, Santiago); Ivonne D‘Apremont, Guillermo Marshall, Sandra Vignes, Mariela Quezada, Luis Villarroel, Angelica Dominguez (Unidad Base de Datos, Pontifícia Universidad Catolica, Santiago).
Paraguay: Jose Lacarruba, Elizabeth Cespedes, Ramon Mir, Elvira Mendieta, Larissa Genes, Carlos Caballero Caballero (Departamento de Pediatria, Hospital de Clinicas de Asuncion, Asuncion).
Peru: Jaime Zegarra, Veronica Webb, Fabiola Rivera, Marilu Rospigliosi, Silvia Febres, Enrique Bambaren (Hospital Cayetano Heredia, Lima); Rosa Unjan, Walter Cabrera, Raul Llanos, Anne Castañeda, Oscar Chumbes, Roberto Rivera (Hospital Guillermo Almenara, Lima).
Uruguay: Ruben Panizza, Sandra Gugliucci, Silvia Fernandez, Eduardo Mayans, Alicia Prieto, Cristina Hernandez (Facultad de Medicina, Servicio de Recien Nacidos, Montevideo).
Como citar este artigo: Grandi C, Tapia JL, Cardoso VC. Impact of maternal diabetes mellitus on mortality and morbidity of very low birth weight infants: a multicenter Latin America study. J Pediatr (Rio J). 2015;91:234–41.
Estudo feito no Departamento de Pediatria, Faculdade de Medicina, Universidade Católica do Chile, Santiago, Chile.