To characterize the deaths of 193 children with sickle cell disease screened by a neonatal program from 1998 to 2012 and contrast the initial years with the final years.
MethodsDeaths were identified by active surveillance of children absent to scheduled appointments in Blood Banks. Clinical and epidemiological data came from death certificates, neonatal screening database, medical records, and family interviews.
ResultsBetween 1998 and 2012, 3,617,919 children were screened and 2,591 had sickle cell disease (1:1,400). There were 193 deaths (7.4%): 153 with SS/Sβ0‐talassemia, 34 SC and 6 Sβ+thalassemia; 76.7% were younger than five years; 78% died in the hospital and 21% at home or in transit. The main causes of death were infection (45%), indeterminate (28%), and acute splenic sequestration (14%). In 46% of death certificates, the term “sickle cell” was not recorded. Seven‐year death rate for children born between 1998 and 2005 was 5.43% versus 5.12% for those born between 2005 and 2012 (p = 0.72). Medical care was provided to 75% of children; 24% were unassisted. Medical care was provided within 6hours of symptom onset in only half of the interviewed cases. In 40.5% of cases, death occurred within the first 24hours. Low family income was recorded in 90% of cases, and illiteracy in 5%.
ConclusionsAlthough comprehensive and effective, neonatal screening for sickle cell disease was not sufficient to significantly reduce mortality in a newborn screening program. Economic and social development and increase of the knowledge on sickle cell disease among health professionals and family are needed to overcome excessive mortality.
Caracterizar os 193 óbitos de crianças com doença falciforme diagnosticadas por programa de triagem neonatal entre 1998‐2012 e comparar os primeiros com os últimos anos.
MétodosOs óbitos foram identificados pela busca ativa das crianças ausentes nas consultas agendadas nos hemocentros. Dados clínicos e epidemiológicos provieram dos documentos de óbito, banco de dados da triagem neonatal, prontuários médicos e das entrevistas com parentes.
ResultadosEntre 1998‐2012 foram triadas 3.617.919 crianças, 2.591 com doença falciforme (1:1.400). Ocorreram 193 óbitos (7,4%): 153 com SS/Sβ0‐talassemia, 34 SC e 6 Sβ+‐talassemia; 76,7% em crianças com menos de cinco anos; 78% faleceram em hospitais e 21% em domicílio ou trânsito. Causas principais do óbito: 45% infecção, 28% indeterminada, 14% sequestro esplênico agudo. Em 46% dos documentos de óbito, não houve registro do termo “falciforme”. A taxa de mortalidade até sete anos das crianças nascidas entre 1998‐2005 foi 5,43% versus 5,12%, entre 2005‐2012 (p=0,72). Receberam assistência médica 75% das crianças; 24% ficaram desassistidas. Pelas entrevistas, atendimento médico teria ocorrido nas primeiras seis horas do início dos sintomas em metade dos casos. O óbito ocorreu em 40,5% dos casos, nas primeiras 24 horas. Baixa renda familiar foi registrada em 90% dos casos e analfabetismo em 5%.
ConclusõesA triagem para doença falciforme, mesmo abrangente e eficaz, não foi suficiente para reduzir significativamente a mortalidade no Programa de Triagem Neonatal. Necessita‐se de desenvolvimento econômico e social do Estado e ampliação, pela educação continuada, do conhecimento sobre a doença falciforme entre os profissionais de saúde e parentes.
A doença falciforme (DF) engloba um grupo de desordens hematológicas de origem genética, cuja principal característica é a predominância da hemoglobina S (HbS) nas hemácias. A DF tem grande importância epidemiológica e clínica e é considerada questão de saúde pública no Brasil.1‐3
A HbS em homozigose (HbSS), denominada anemia falciforme (AF), representa o genótipo mais comum e a apresentação clínica mais grave da doença. O conceito de DF engloba, também, a dupla heterozigose da HbS com outras hemoglobinas variantes (HbSC, HbSD‐Punjab e outras) e a interação da HbS com as beta talassemias (HbS/β0 e HbS/β+ talassemias).4,5 Os principais determinantes das manifestações clínicas da doença são os fenômenos vaso‐oclusivos e a hemólise crônica.4
As hemoglobinopatias são responsáveis, mundialmente, por 3,4% dos óbitos em crianças abaixo de cinco anos.6 Os pacientes com DF apresentam altos índices de morbidade e mortalidade, principalmente nos países em desenvolvimento.7 Mesmo nos países desenvolvidos, embora a mortalidade nas crianças tenha diminuído, a DF ainda é causa significativa de mortalidade em adolescentes e adultos.8
Estima‐se a prevalência de 25.000 a 30.000 pessoas com DF no Brasil e a incidência de 3.500 casos a cada ano.9 Em Minas Gerais (MG), a incidência da DF é de 1:1.400 recém‐nascidos triados e tem como base o Programa de Triagem Neonatal (PTN‐MG).10
Estudo feito em MG10 caracterizou o óbito de 78 crianças com DF triadas pelo PTN‐MG de 1998 a 2005 e concluiu que a maioria dos óbitos ocorreu em crianças com idade abaixo de dois anos e portadoras de HbSS, devido, principalmente, à infecção (septicemia e pneumonia). Foi notado predominância de óbitos hospitalares. Contudo, a ocorrência de óbitos domiciliares ou em trânsito ainda foi significativa. Causa mortis indeterminada no atestado de óbito foi frequente, o que indicaria falta de conhecimento dos médicos sobre a DF e eventos agudos determinantes dos óbitos.
Este estudo teve como objetivo caracterizar os óbitos ocorridos nas crianças com DF triadas pelo PTN‐MG entre 1998 e 2012. Foi feita, quando possível, análise comparativa da ocorrência de óbitos de crianças nascidas entre março de 1998 e fevereiro de 2005 com aquelas nascidas entre março de 2005 e dezembro de 2012, com o intuito de descrever possíveis mudanças em relação à qualidade da assistência prestada a essas crianças.
MétodosA população investigada neste estudo constituiu‐se de 117 crianças diagnosticadas com DF pelo PTN‐MG acompanhadas nos hemocentros da Fundação Hemominas e que evoluíram para óbito de 1 de março de 2005 a 29 de fevereiro de 2012. Em várias análises adicionaram‐se 76 óbitos ocorridos entre março de 1998 e fevereiro de 2005 (dos 78 óbitos relatados, foram excluídas duas crianças cujo nascimento foi anterior a 01/03/1998),10 o que totalizou 193 óbitos. Completou‐se, assim, o estudo relativo a 14 anos.
O PTN‐MG faz a triagem para DF desde março de 1998. Todos os 853 municípios do estado estão cadastrados. Em 2010, 91,44% dos recém‐nascidos mineiros fizeram a triagem por meio do Nupad (Núcleo de Ações e Pesquisa em Apoio Diagnóstico) e foram oferecidos tratamento e acompanhamento médicos gratuitos àqueles com DF.
A informação do óbito resulta da investigação feita pelo Setor de Controle e Tratamento do Nupad sobre o motivo de não comparecimento à consulta agendada no hemocentro. As ações de busca ativa feitas abrangem a totalidade dos pacientes triados com DF em acompanhamento nos ambulatórios da Fundação Hemominas em todo o estado. Portanto, é possível afirmar que todos os óbitos ocorridos no período do estudo foram registrados.
Os dados para esta pesquisa provieram do banco de dados do Nupad, dos documentos de óbito, da base de dados do Sistema Único de Saúde (Datasus) e do Instituto Brasileiro de Geografia e Estatística (IBGE), prontuários médicos da Fundação Hemominas e entrevista com os parentes das crianças.
Para se efetuar a busca ativa das 117 famílias cujas crianças evoluíram a óbito entre 2005 e 2012, usaram‐se as informações contidas no banco de dados do Nupad. A entrevista foi feita com o responsável pela criança a partir de roteiro semiestruturado, usado por Fernandes et al. 10 Foram entrevistadas 81 famílias pela pesquisadora e três famílias pelos enfermeiros das unidades básicas de saúde de referência. Cinco famílias recusaram‐se à entrevista, uma não teve condições de falar sobre o assunto e 27 não foram localizadas. A entrevista abordou cinco aspectos: (1) circunstâncias relacionadas ao evento óbito; (2) acompanhamento da DF e ocorrência de outros eventos agudos; (3) condição socioeconômica e cultural familiar, em que foram consideradas a renda per capita, escolaridade, ocupação dos pais e as condições de moradia; (4) impressões sobre as experiências vividas com a criança; (5) aplicação da escala de conhecimento nas famílias sobre a DF, constituída de 20 questões com opções para a marcação: “certo”, “errado” ou “não sei”. A entrevista foi condicionada à assinatura de termo de consentimento que abrangeu os objetivos, a finalidade e os benefícios da pesquisa.
Na apuração das causas de óbito, considerou‐se indeterminada aquela sobre a qual, independentemente do local de ocorrência do óbito e de ter havido assistência ou não à criança, os médicos apresentaram ambiguidade nos registros dos documentos de óbito, o que impossibilitou aos pesquisadores determinarem a causa.
Para a análise estatística, comparações das frequências entre variáveis nominais foram feitas com o teste de qui‐quadrado, sem correção de continuidade. Consideraram‐se significativos os testes cuja probabilidade de erro alfa fosse igual ou inferior a 0,05.
A pesquisa foi aprovada pelos Comitês de Ética da Universidade Federal de Minas Gerais (UFMG) e da Fundação Hemominas.
ResultadosPeríodo de março de 1998 a fevereiro de 2012Foram triadas 3.617.919 crianças pelo PTN‐MG. Dessas, 2.591 tiveram perfil hemoglobínico compatível com DF e foram identificadas 193 que foram a óbito (7,4%), das quais 97 eram do gênero masculino (50,3%). Em relação aos genótipos, 153 eram SS/Sβ0‐talassemia (79,3%), 34 SC (17,6%) e 6 Sβ+‐talassemia (3,1%).
A maioria das crianças que evoluíram a óbito (77,7%) residia na área urbana dos municípios. Se forem considerados os municípios mineiros em que se registraram óbitos, 98 em 378 crianças diagnosticadas com DF (25,9%) faleceram em municípios de pequeno porte, isto é, aqueles com até 50 mil habitantes. Essa proporção contrasta com 93 óbitos em 1.228 crianças (7,6%) nos municípios de médio ou grande porte, acrescidos das metrópoles (p < 0,000001). Duas crianças faleceram fora de MG.
A mediana da idade à coleta do sangue para a triagem foi de 6 dias e 75% das crianças foram triadas até oito dias de vida. A mediana da idade à primeira consulta no hemocentro foi de 1,4 mês. Doze crianças (6,2%) faleceram antes da primeira consulta: nove antes de completar 60 dias, período máximo de marcação da primeira consulta nos hemocentros, a maioria por motivo de prematuridade e suas complicações, segundo os atestados de óbito examinados pelos pesquisadores. Três crianças faleceram com 105, 122 e 131 dias, duas delas com cardiomiopatia congênita grave e uma com sequestro esplênico agudo, em Vitória (ES), sem fazer consulta no hemocentro de Valadares (MG); duas famílias foram entrevistadas pelos pesquisadores.
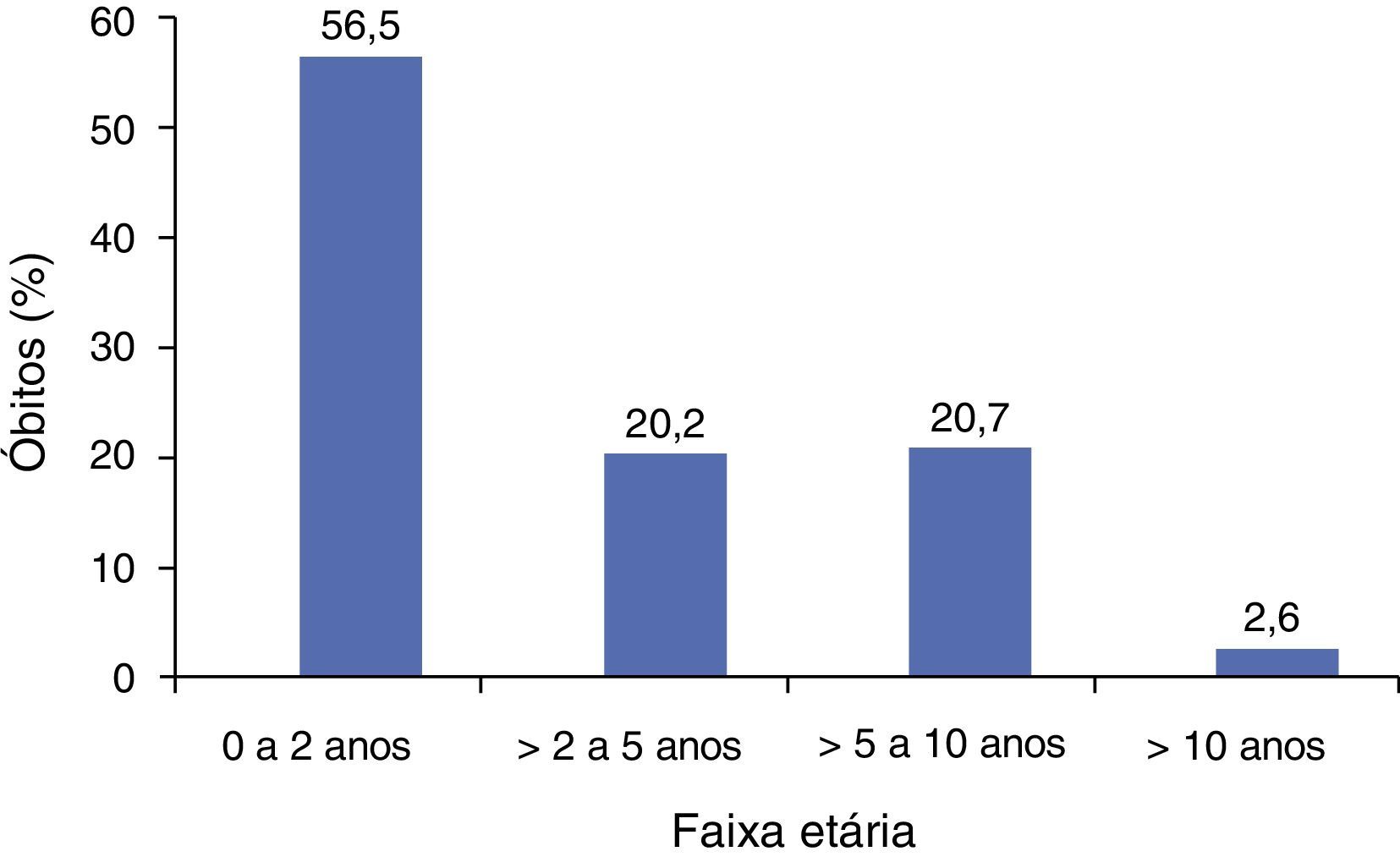
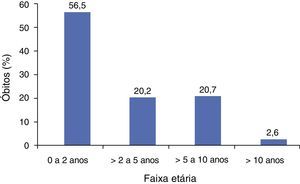
Observou‐se que 56,5% dos óbitos ocorreram em crianças abaixo de dois anos e 76,7% ocorreram em crianças abaixo de cinco. A mediana da idade ao óbito foi de 1,7 ano. A figura 1 mostra a distribuição por faixa etária.
Segundo informações dos documentos de óbito e das entrevistas com os parentes, houve prevalência de óbitos hospitalares (78%), porém deve‐se enfatizar a ocorrência de 21 óbitos domiciliares (11%) e 19 em trânsito (10%).
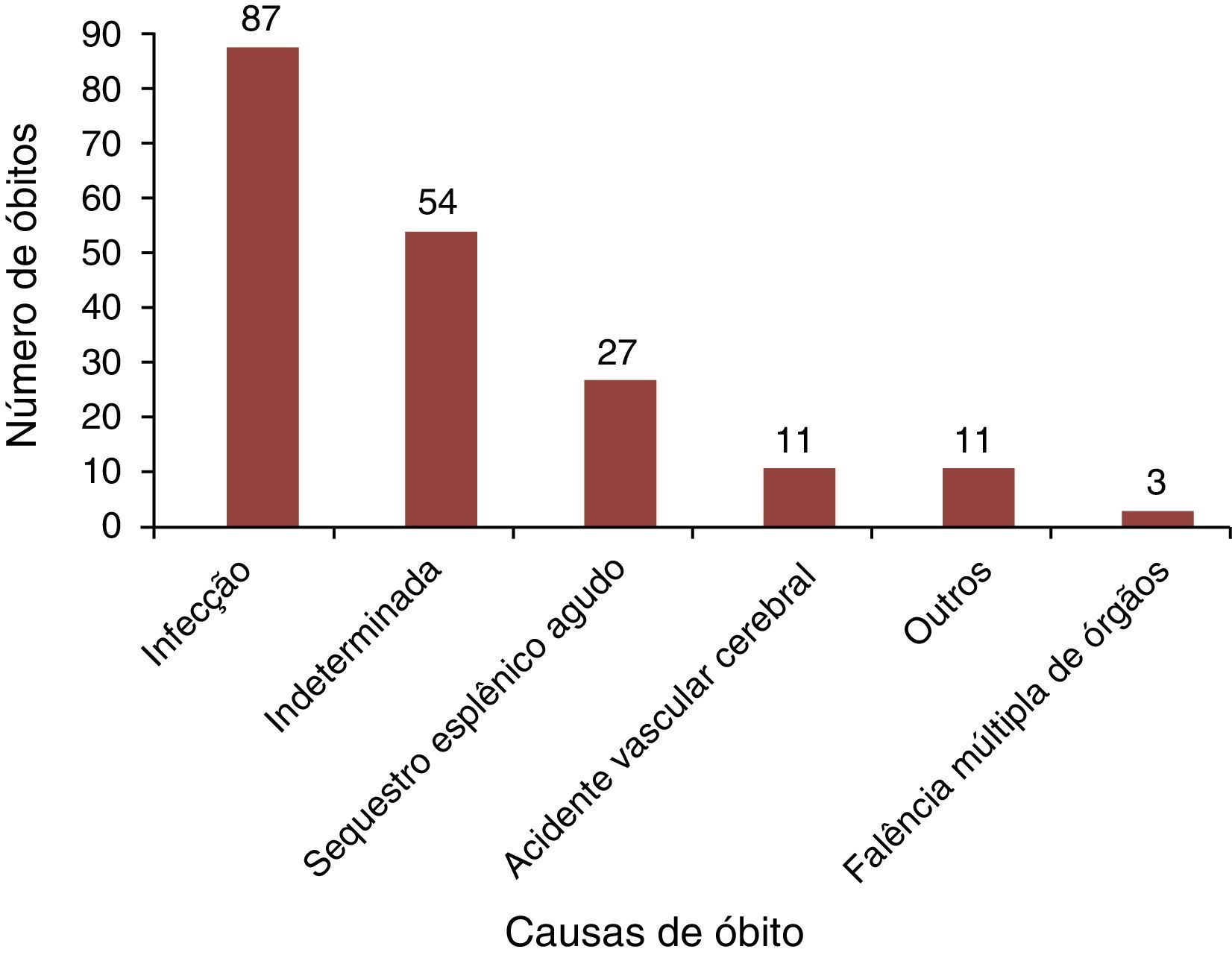
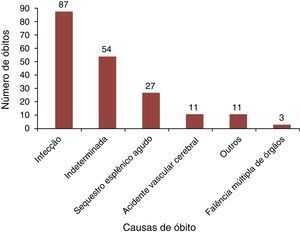
Infecção, incluindo septicemia, pneumonia/síndrome torácica aguda e gastroenterite foram as principais causas de óbitos nesse grupo (45%), seguidas pela indeterminada (28%). O sequestro esplênico agudo (SEA) foi a terceira causa (14%), conforme ilustrado na figura 2. Entre as crianças SS/Sβ0‐talassemia, o SEA foi a causa mortis em 17,6%.
A maioria das crianças (75%) recebeu assistência médica antes do óbito. Contudo, foi relevante o número de crianças desassistidas (24%). Não houve registro do termo “doença falciforme” ou “anemia falciforme” citado como causa mortis em número expressivo dos documentos de óbito (46%).
Período de março de 2005 a fevereiro de 2012 (117 óbitos)As entrevistas (n=84) revelaram que 46,4% das crianças foram atendidas nas primeiras seis horas após o início dos sintomas por ocasião do evento que motivou o óbito, 64,3% em até 24 horas e 26,2% faleceram sem receber assistência médica. O óbito ocorreu nas primeiras 12 horas de início dos sintomas em 30% dos casos e em 40,5% nas primeiras 24 horas. Febre, dor, palidez e vômito foram, pelo relato das famílias, os sintomas iniciais mais frequentes relacionados ao óbito. O hospital foi o primeiro serviço de saúde procurado por cerca de 60% das famílias, seguido pelas UBSs (12%). Após o primeiro atendimento, encaminhamento para outras unidades assistenciais foi a conduta para 30 crianças, 24 por ambulâncias. Dessas, três faleceram durante a transferência e uma antes de o transporte chegar. Apenas 13,8% das crianças foram transportadas em uso de medicamentos.
O uso regular do antibiótico profilático e ácido fólico foi relatado por cerca de 90% das famílias. Cerca de 74% das crianças receberam imunobiológicos especiais. Quanto à evolução clínica anterior ao óbito, 58,3% das crianças já haviam sido admitidas em hospitais pelo menos uma vez e 23,8%, mais de três vezes. A crise álgica já tinha acontecido em quase 60% das crianças, antes do óbito, e 46,4% já havia recebido transfusão. O SEA já tinha ocorrido em 27,4% das crianças.
Quanto à situação socioeconômica das famílias, 91,6% tinham renda per capita mensal inferior ou igual a um salário mínimo e 50% recebiam benefícios federais. Quanto à escolaridade, 5% das famílias eram analfabetas.
Apenas 54,8% das famílias recebiam regularmente visita do Programa de Saúde da Família (PSF) quando a criança era viva. O questionário cognitivo aplicado às famílias (n=41) mostrou que 85,4% acertaram mais de 60% das questões.
Considerando o total de 1.733 consultas agendadas nos hemocentros para as 117 crianças que faleceram, 359 agendamentos (20,7%) não foram cumpridos porque as famílias não compareceram. Todas as consultas foram reagendadas, mas o sistema de controle não fornece o sucesso de tal procedimento.
Comparações entre períodos do estudoNos primeiros sete anos foram triadas 1.399 crianças e ocorreram 76 óbitos até 28 de fevereiro de 2005, taxa de mortalidade de 5,43%. Nos últimos sete anos foram triadas 1.192 crianças e faleceram 61, taxa de 5,12% (p=0,72). No primeiro período, 55/76 óbitos (72,4%) ocorreram antes de dois anos; no segundo período, 47/61 (77,0%; p=0,53). Os demais 56 óbitos, que perfizeram o total de 193, ocorreram em crianças nascidas nos primeiros sete anos, mas que faleceram no segundo período e não podem entrar nesses cálculos estatísticos.
No primeiro período de sete anos ocorreram 25,3% de óbitos no domicílio ou em trânsito; no segundo, houve diminuição para 18,1% (p=0,28). A ausência de assistência médica no momento do óbito também diminuiu de 28,0% para 21,6% (p=0,39). A citação do termo “falciforme” nos documentos de óbito foi significativamente mais frequente (60,5%) nos últimos sete anos, em relação aos primeiros sete (42,1%, p = 0,017).
DiscussãoA casuística reflete a realidade global de saúde das crianças triadas com DF decorridos 14 anos do PTN‐MG, pois todos os óbitos das crianças em acompanhamento pelos hemocentros foram informados. Isso representa sua totalidade, o que configura um estudo com base populacional.
No presente relato, como em outros,11,12 não houve diferença significativa na incidência dos óbitos entre os gêneros na faixa etária estudada.
Este e vários outros estudos11,13‐17 comprovaram que a maior frequência de óbitos ocorreu em pacientes com HbSS (79,3%), genótipo mais comum e clinicamente mais grave. A frequência relativamente elevada de óbitos em crianças com Sβ+ talassemia (6,5%) não deve corresponder à realidade, pois somente a partir de 2010 todos os casos com suspeita de DF no PTN‐MG passaram a ser confirmados por técnicas de biologia molecular. O diagnóstico desse subtipo de DF pode ser superestimado no período neonatal por conta de transfusão sanguínea não relatada pelos parentes ou de erros na interpretação de pequenas concentrações da HbA.
Três quartos das crianças diagnosticadas entre 2005 e 2012 fizeram a triagem neonatal para a DF até oito dias de vida, tempo inferior ao de 18 dias no período inicial entre 1998 e 2005,10 o que revela aperfeiçoamento do PTN‐MG.
A distribuição por faixa etária das crianças, quando do óbito, mostra concentração da ocorrência de óbitos até cinco anos de idade, semelhantemente ao observado por outros.11,18‐22 Alguns autores4,8,12,16,23,24 têm relatado, contudo, que a taxa de mortalidade infantil pela DF está diminuindo e a idade mediana de morte se elevando. No presente estudo, a elevada mortalidade em crianças abaixo de cinco anos é explicada pela maior incidência de eventos potencialmente fatais nesse grupo, como infecções e SEA.
Embora prevalecessem os óbitos hospitalares, ressalta‐se a ocorrência de um quinto deles em domicílio ou em trânsito. Isso pode ser explicado por diversos fatores, tais como residência da família localizada distante do serviço de saúde, dificuldade de deslocamento até esse serviço, baixos níveis socioeconômico e de escolaridade, além do despreparo da família em identificar situações de risco na criança. O aumento, estatisticamente não significativo, de 11% no número de óbitos hospitalares denota avanço, mesmo que discreto, na assistência à saúde de crianças com DF nos últimos seis anos. Os autores de estudo feito em Angola25 concluíram que pacientes com DF que residiam no interior ou em comunidades rurais tiveram probabilidade três vezes maior de falecer durante a internação, devido a fatores socioeconômicos e à falta de acesso imediato a cuidados médicos.
Neste, como em muitos trabalhos publicados,11,14,15,18,25‐27 a infecção aparece como a principal causa de óbito, considerando os grupos etários estudados. O elevado número de causas indeterminadas sugere dificuldade dos médicos e equipes de saúde em reconhecer a DF e seus eventos agudos graves determinantes do óbito, assim como no estudo de Alves,28 uma vez que a maior parte dos registros foi proveniente de óbitos hospitalares. O SEA foi a terceira causa, o que reflete o despreparo das equipes de saúde e das famílias na identificação de tal complicação clínica. A proporção de óbitos por SEA em crianças SS foi semelhante ao relatado em estudo anterior, restrito a crianças SS.29 Outros autores13,15,19 apontaram o SEA como principal causa de óbito em crianças até três anos.
Em número expressivo (46%) de documentos de óbito não houve citação do termo “falciforme” registrado na causa mortis. Entretanto, a proporção de documentos com menção a esse termo aumentou significativamente nos últimos sete anos, o que indica maior visibilidade e conhecimento da doença pelos médicos.
A maioria das crianças recebeu assistência médica antes do óbito, porém um quarto delas ficou desassistida. Notou‐se aumento, porém não significativo, de 13% na frequência da assistência médica prestada às crianças com DF antes do óbito, o que novamente aponta para provável ampliação do conhecimento acerca da DF pelos médicos.
O atendimento médico ocorreu nas primeiras seis horas em quase metade dos casos e em dois terços no período até 24 horas. O óbito ocorreu nas primeiras 24 horas do início dos sintomas em cerca de 40% dos casos. Manci et al.15 apontaram que as primeiras 24 horas após a instalação do processo patológico representam o período de maior risco de óbito para os pacientes com DF. Isso salienta a rapidez com que o quadro clínico se agrava e culmina em óbito.
A alta adesão à profilaxia com antibióticos e ácido fólico, além do uso regular dos imunobiológicos especiais, indica que esses dados podem estar superestimados, pois foram obtidos a posteriori e na presença de “autoridade”, no caso a entrevistadora. Estudo feito no Hemocentro de MG evidenciou níveis mais baixos de adesão à profilaxia com antibióticos.30 A incorporação das “vacinas especiais” ao calendário básico de vacinação ocorreu recentemente e pode ter contribuído para a baixa adesão das famílias. Isso, provavelmente, deve‐se ao desconhecimento, pelos profissionais de saúde, a respeito do calendário vacinal especial e à falta de prioridade na solicitação dos imunobiológicos especiais pelos municípios.
Na ocasião do óbito da criança, apenas um pouco mais da metade das famílias recebia regularmente visita da equipe do PSF. Considerando‐se que a DF é uma doença de caráter crônico e com possibilidade de eventos agudos graves, além de acometer famílias com baixa renda, esperava‐se maior monitoramento do PSF, por meio de visitas domiciliares, a fim de garantir a porta de entrada no sistema de saúde.
Ausência de prioridade e/ou demora no atendimento, déficit de conhecimento da equipe e infraestrutura precária dos serviços de saúde foram dificuldades relatadas pelas famílias e que podem ter contribuído para o óbito. Reduzida escolaridade dos pais e baixa renda familiar constituíram entraves adicionais. Estudo feito no Gabão, África,21 também registrou que a grande maioria (91,3%) das crianças com DF que faleceram eram de famílias de baixo nível socioeconômico. As condições inadequadas do transporte também foram relatadas por algumas famílias, tais como: cilindro de oxigênio com volume insuficiente ou ausente para todo percurso da transferência, máscara facial de tamanho inadequado para a criança, entre outros.
O questionário cognitivo aplicado a 41 famílias indica que o conhecimento sobre a DF ainda é precário, mesmo tendo ocorrido evento tão marcante como o óbito de uma criança.
A principal limitação do estudo foi seu caráter retrospectivo, pois a localização das famílias é dificultada com o passar dos anos, assim como a impossibilidade delas de determinar precisamente alguns dados. As entrevistas acrescentaram ao estudo um caráter qualitativo mais apurado do que a simples inspeção de documentos de óbito. A nosso ver, a ausência de 33 entrevistas, em 117, não comprometeu os objetivos almejados.
Conclui‐se que os baixos níveis socioeconômico e de escolaridade das famílias, as dificuldades de acesso aos serviços de saúde, a falta de transporte, a ausência de prioridade no atendimento e o déficit de conhecimento sobre a DF pelos profissionais de saúde foram fatores agravantes do quadro clínico da criança.
A triagem para DF, mesmo feita de maneira abrangente e eficaz, não foi suficiente ainda para reduzir a taxa de mortalidade no PTN‐MG. É necessário progresso no desenvolvimento social e econômico do estado. Atendimento a eventos agudos, consultas especializadas, transporte adequado dos pacientes e educação continuada para parentes e equipes de saúde devem ser reconhecidos como prioridade na linha de cuidados de pacientes com DF.
FinanciamentoConselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e Núcleo de Ações e Pesquisa em Apoio Diagnóstico (Nupad).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
A todos os parentes que aquiesceram ser entrevistados em suas residências, apesar dos sofrimentos despertados pela recordação do óbito de suas crianças. Ao Nupad/UFMG pelo apoio logístico financeiro nas diversas fases da pesquisa. Ao CNPq, que, com parte dos recursos provenientes do Projeto de Demanda Universal 471019/2011‐9, possibilitou algumas visitas para coleta de dados. À Dra. Ana Paula Pinheiro Chagas Fernandes pela sugestão do tema, pelo auxílio e incentivo em todas as etapas da pesquisa.
Como citar este artigo: Sabarense AP, Lima GO, Silva LM, Viana MB. Characterization of mortality in children with sickle cell disease diagnosed through the Newborn Screening Program. J Pediatr (Rio J). 2015;91:242–7.
Estudo conducido no Núcleo de Ações e Pesquisa em Apoio Diagnóstico (Nupad), Faculdade de Medicina, Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil.