To analyze the fecal microbiota composition of children living in an urban slum in Brazil, with or without small intestinal bacterial overgrowth, and to investigate the occurrence of stunting and anemia.
MethodsA total of 100 children were studied, aged 5–11 years, from the municipality of Osasco, São Paulo. Small intestinal bacterial overgrowth was screened through hydrogen and methane breath test with lactulose. Weight and height were measured, and the height‐for‐age and body mass‐for‐age anthropometric indexes were calculated. The occurrence of anemia was investigated by capillary hemoglobin. Analysis of bacterial phylum, genus, and species was performed by real‐time polymerase chain reaction in fecal samples.
ResultsSmall intestinal bacterial overgrowth was identified in 61.0% of the children. A lower mean of height‐for‐age Z‐score ([−0.48±0.90] vs. [−0.11±0.97]; p=0.027), as well as capillary hemoglobin ([12.61±1.03g/dL] vs. [13.44±1.19g/dL]; p<0.001) was demonstrated in children with SIBO when compared with children without small intestinal bacterial overgrowth. Children with small intestinal bacterial overgrowth presented a higher frequency of Salmonella spp., when compared to those without small intestinal bacterial overgrowth (37.7% vs. 10.3%; p=0.002). Higher counts of total Eubacteria (p=0.014) and Firmicutes (p=0.038) were observed in children without small intestinal bacterial overgrowth; however, a higher count of Salmonella (p=0.002) was found in children with small intestinal bacterial overgrowth.
ConclusionChildren who lived in a slum and were diagnosed with small intestinal bacterial overgrowth showed lower H/A Z‐scores and hemoglobin levels. Furthermore, differences were observed in the fecal microbiota of children with small intestinal bacterial overgrowth, when compared to those without it; specifically, a higher frequency and count of Salmonella, and lower counts of Firmicutes and total Eubacteria.
Analisar a composição da microbiota fecal de crianças moradoras de uma favela urbana no Brasil, com e sem sobrecrescimento bacteriano no intestino delgado, e investigar a ocorrência de déficit de crescimento e anemia.
MétodosForam estudadas 100 crianças, com idade entre 5 e 11 anos, na cidade de Osasco, São Paulo. Sobrecrescimento bacteriano no intestino delgado foi pesquisado por teste respiratório do hidrogênio e metano no ar expirado com lactulose. Foram mensurados peso, estatura e calculados os índices antropométricos estatura para idade e índice de massa corporal para idade. Foi investigada a ocorrência de anemia, pela avaliação da hemoglobina capilar. A análise dos filos, gêneros e espécies bacterianas em amostras de fezes foi realizada por polymerase chain reaction em tempo real.
ResultadosSobrecrescimento bacteriano no intestino delgado foi diagnosticado em 61,0% das crianças avaliadas. Foi verificada menor média do escore Z do índice estatura para idade (‐0,48 ± 0,90 vs.‐0,11 ± 0,97 DP) e de hemoglobina capilar (12,61 ± 1,03 vs. 13,44 ± 1,19g/dL) no grupo de crianças com sobrecrescimento bacteriano no intestino delgado, quando comparadas àquelas sem sobrecrescimento bacteriano no intestino delgado (p<0,05). Nas crianças com sobrecrescimento bacteriano no intestino delgado foi observada maior frequência de Salmonella spp., quando comparadas àquelas sem sobrecrescimento bacteriano no intestino delgado (37,7% vs. 10,3%; p=0,002). Maior contagem de Eubactérias totais (p=0,014) e Firmicutes (p=0,038) foi observada nas crianças sem sobrecrescimento bacteriano no intestino delgado, enquanto que as crianças com sobrecrescimento bacteriano no intestino delgado apresentaram maior contagem de Salmonella (p=0,002).
ConclusãoNas crianças com diagnóstico de sobrecrescimento bacteriano no intestino delgado verificaram‐se menores valores de estatura para idade e de hemoglobina. Foram constatadas diferenças na microbiota fecal das crianças com sobrecrescimento bacteriano no intestino delgado, especificamente, maior frequência e contagem de Salmonella spp. e menores contagens de Firmicutes e Eubactérias totais.
Ao longo dos últimos anos, vários estudos foram feitos com vistas a ampliar o conhecimento sobre a composição da microbiota intestinal humana. Nas fezes encontra‐se uma grande biomassa de células bacterianas que representam uma combinação de bactérias de mucosa e aquelas transitoriamente presentes no lúmen intestinal.1 Entretanto, pouco se conhece sobre as comunidades bacterianas que se aderem ao e colonizam o intestino delgado, em consequência das dificuldades técnicas para a coleta de amostras para análise do conteúdo intestinal nessa região do trato gastrointestinal.2
O aumento da quantidade de bactérias no intestino delgado, especialmente de espécies comuns ao cólon, caracteriza o sobrecrescimento bacteriano no intestino delgado (SBID).3 Essa condição clínica frequentemente encontra‐se associada à enteropatia ambiental, recentemente reclassificada como “disfunção entérica ambiental”,4 em indivíduos expostos a ambientes insalubres.5 Dessa forma, podem ser observadas alterações morfológicas e funcionais do intestino delgado, derivadas de um processo inflamatório local4,5 pela atuação de bactérias patogênicas, em especial as Gram negativas,3 desencadeiam um quadro de má absorção crônica de nutrientes e consequente déficit de crescimento em crianças,4–6 mesmo que essas se apresentem assintomáticas.4,7
Os testes respiratórios se constituem em uma opção não invasiva para a pesquisa de SBID.8 Em indivíduos saudáveis, a produção de hidrogênio e metano ocorre predominantemente pela fermentação bacteriana anaeróbia no intestino grosso. No caso de SBID, a produção desses gases também pode ser verificada no intestino delgado, pela ação de bactérias contaminantes.8 Nesse contexto, estudo feito por nosso grupo de pesquisa,7 com crianças em condições de pobreza, constatou que aquelas diagnosticadas com SBID apresentam um maior potencial de fermentação não apenas em intestino delgado, mas também no cólon, sugere uma situação de disbiose ao longo de todo o trato gastrointestinal na vigência dessa condição clínica.
Considerando o fato de que a composição da microbiota intestinal pode ser influenciada pelo ambiente e pelas condições de vida aos quais o indivíduo está exposto9 e as consequências negativas da disfunção entérica ambiental na infância,4,5 o presente estudo tem como objetivo analisar a composição da microbiota fecal de crianças moradoras de uma favela urbana no Brasil, com e sem SBID, bem como investigar a ocorrência de déficit de crescimento e anemia.
MétodosDelineamentoEstudo de corte transversal feito no município de Osasco, Região Metropolitana de São Paulo, Brasil. A população do estudo foi composta por crianças de baixo nível socioeconômico, moradoras de uma favela urbana, constitui uma amostragem por conveniência.
Como critérios de inclusão foram considerados idade entre cinco e 11 anos, ausência de diarreia (evacuações líquidas ou aquosas) e não uso de antibióticos, pelo período mínimo de um mês. A não feitura de teste respiratório e/ou não entrega de amostra de fezes constituíram‐se em perdas amostrais. Não foram incluídas no estudo crianças com evidências clínicas de doenças crônicas graves (ex. cardiopatias).
Com a ajuda de um líder comunitário, os habitantes da localidade foram convidados a participar do estudo. Apresentaram‐se voluntariamente 122 crianças, acompanhadas de seus responsáveis; entretanto, 22 não preencheram os critérios para participação no estudo.
Este projeto foi aprovado pelo Comitê de Ética em Pesquisa da Universidade Federal de São Paulo. A assinatura do termo de consentimento livre e esclarecido foi obtida pelos responsáveis de cada participante, no momento da admissão no estudo.
Condições de moradia, antropometria e dosagem de hemoglobinaForam obtidas informações sobre as condições de moradia, pelos responsáveis. Para aferição de peso e altura foram usadas balança digital (Filizola SA Pesagem e Automação, São Paulo, Brasil) com capacidade de 150kg e sensibilidade de 100g e antropômetro vertical (Seca GmbhCo. Kg., Hamburgo, Alemanha), com medição de até 190cm e sensibilidade de 0,1cm. Os escores Z de estatura para idade e índice de massa corporal para idade foram obtidos.10
A concentração de hemoglobina capilar, obtida em amostra de sangue coletada por punção da polpa digital, foi determinada por fotômetro portátil (Hemocue®, Ängelholm, Suécia), consideraram‐se anemia os níveis de hemoglobina inferiores a 11,5g/dL.11
Teste respiratório com lactuloseO teste foi feito após jejum de oito horas e higiene bucal com solução antisséptica. Após coleta da amostra basal de ar expirado, foram administrados, por via oral, 10g de lactulose7,12 (Daiichi Sankyo, São Paulo, Brasil) em solução aquosa a 10%. Novas amostras de ar expirado foram coletadas aos 15, 30, 45, 60, 90, 120 e 180 minutos após a ingestão de lactulose. As amostras foram coletadas em uma única expiração forçada, em sacos hermeticamente fechados. As concentrações de hidrogênio (H2) e metano (CH4) foram mensuradas por cromatografia gasosa (MicroLyzer SC, Quintron Instrument Co. Inc., Wisconsin, EUA).
SBID foi caracterizado pelo aumento nas concentrações de H2 ≥ 20ppm e/ou de CH4 ≥ 10ppm, no ar expirado, em relação às concentrações em amostras de jejum, até 60 minutos do teste.7,12
PCR em tempo real (Real‐time polymerase chain reaction)A coleta das fezes foi feita pelos responsáveis, orientados previamente. As amostras foram armazenadas em coletor universal e, posteriormente, conservadas em congelador doméstico por até 24h (período entre a evacuação e entrega). No laboratório, uma alíquota de fezes, de aproximadamente um grama, foi transferida para criotubo estéril, contendo tampão ASL do kit QiaAmp mini Stool (Qiagen, Hilden, Alemanha), foram mantidas a ‐20°C até o momento da extração de DNA, o DNA genômico bacteriano foi extraído das amostras conforme protocolo sugerido pelo fabricante. O DNA purificado foi diluído em solução tampão a volume final de 200μL. A quantificação de DNA foi feita no espectofotômetro Nanodroop 1000 (ThermoScientific, Waltham, USA). Todas as amostras de DNA foram diluídas para a concentração de 20 ng/μL e armazenadas a ‐20°C. Os primers usados (fig. 1) foram destinados para a identificação e quantificação de eubactérias totais,13 filos Firmicutes e Bacteroidetes,14 gêneros Lactobacillus spp.,15Salmonella spp.,16Bifidobacterium spp.17 e espécies Bacteroides fragilis,18Escherichia coli,19Staphylococcus aureus,20Clostridium difficile,15Clostridium perfringens21 e Methanobrevibacter smithii.22 O DNA de todas as amostras fecais foi submetido ao ensaio de PCR (Polymerase Chain Reaction) em tempo real.
Todas as reações foram feitas em duplicata, em volume final de 10μL com 5μL de Rotor‐gene SYBR Green PCR Master Mix (Qiagen, Hilden, Alemanha), 0,2μL (10pmol/μL) dos primers forward e reverso de cada bactéria, 0,5μl da amostra de DNA (20 ng/μL) e 4,1μL de água DEPC (dietilpirocarbonato) (Qiagen, Hilden, Alemanha). A termociclagem foi feita no equipamento Rotor‐gene Q (Qiagen, Hilden, Alemanha), de acordo com as seguintes condições: cinco minutos a 95°C, seguidos de 40 ciclos de 95°C por 10 segundos e 60°C por 15 segundos. O ciclo de dissociação dos produtos para a curva de desnaturação (melting curve) foi: 95°C por um minuto e uma etapa para feitura da curva de desnaturação que variou de 70°C até 95°C, com aumento gradual na temperatura de 1°C/s.
Para todas as amostras fez‐se um controle interno de reação com primers desenhados para detecção de eubactérias totais,23 serviu como padrão para quantificação relativa do DNA bacteriano total. Como controle negativo, usou‐se uma reação com todos os reagentes, com exceção da amostra de DNA. A curva padrão para todas as análises foi feita pela amplificação de um plasmídeo TopoTA (Invitrogen ®, EUA), constou nesse o fragmento do gene referente a cada bactéria, previamente amplificado por PCR convencional, a sua especificidade foi confirmada por sequenciamento e alinhamento no sistema BLAST (Canablast®, Canada).
Análise estatísticaPara análise dos resultados foi usado, para comparar dois grupos independentes, o teste de Mann‐Whitney ou t de Student, para variáveis numéricas contínuas, e o teste do qui‐quadrado, para variáveis categóricas. Os cálculos foram feitos no programa Sigma Stat (Systat Software, Inc, versão 3.1, USA), fixou‐se em 5% o nível para rejeição da hipótese de nulidade.
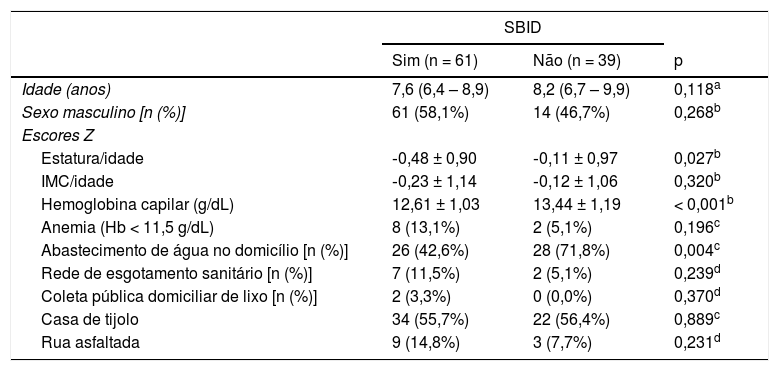
ResultadosSBID foi diagnosticado em 61/100 (61,0%) crianças. Na tabela 1 estão apresentados os dados demográficos, antropométricos, frequência de anemia e valores médios de hemoglobina. O grupo de crianças com SBID apresentou valores inferiores do escore Z de estatura‐idade e de hemoglobina (p < 0,05), quando comparadas com aquelas sem SBID. Constatou‐se, também, associação entre SBID e ausência de abastecimento de água no domicílio.
Dados antropométricos e condições de moradia das crianças, moradoras de uma favela urbana, com ou sem sobrecrescimento bacteriano no intestino delgado (SBID)
| SBID | |||
|---|---|---|---|
| Sim (n = 61) | Não (n = 39) | p | |
| Idade (anos) | 7,6 (6,4 – 8,9) | 8,2 (6,7 – 9,9) | 0,118a |
| Sexo masculino [n (%)] | 61 (58,1%) | 14 (46,7%) | 0,268b |
| Escores Z | |||
| Estatura/idade | ‐0,48 ± 0,90 | ‐0,11 ± 0,97 | 0,027b |
| IMC/idade | ‐0,23 ± 1,14 | ‐0,12 ± 1,06 | 0,320b |
| Hemoglobina capilar (g/dL) | 12,61 ± 1,03 | 13,44 ± 1,19 | < 0,001b |
| Anemia (Hb < 11,5 g/dL) | 8 (13,1%) | 2 (5,1%) | 0,196c |
| Abastecimento de água no domicílio [n (%)] | 26 (42,6%) | 28 (71,8%) | 0,004c |
| Rede de esgotamento sanitário [n (%)] | 7 (11,5%) | 2 (5,1%) | 0,239d |
| Coleta pública domiciliar de lixo [n (%)] | 2 (3,3%) | 0 (0,0%) | 0,370d |
| Casa de tijolo | 34 (55,7%) | 22 (56,4%) | 0,889c |
| Rua asfaltada | 9 (14,8%) | 3 (7,7%) | 0,231d |
Hb, hemoglobina; IMC, índice de massa corporal.
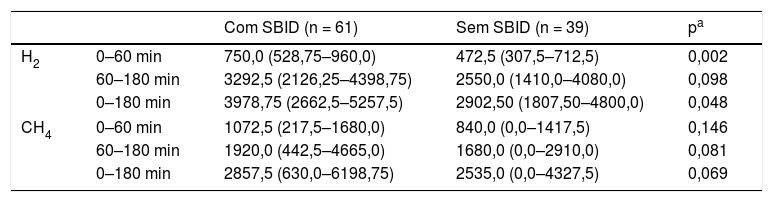
Na tabela 2, a produção de hidrogênio e metano, obtida no teste respiratório com lactulose, está expressa como áreas sob curvas individuais. Foi observado que as crianças com SBID apresentaram maior produção de hidrogênio durante a primeira hora de teste (p = 0,002), presumivelmente no intestino delgado. Essa diferença não foi verificada com as concentrações de metano. Entre 60 e 180 minutos, período no qual a produção de gases ocorre predominantemente no intestino grosso, as crianças com SBID apresentaram maiores concentrações de hidrogênio e metano, entretanto as diferenças não atingiram significância estatística (p = 0,081 e 0,098, respectivamente).
Área sob a curva da concentração, em ppm/minutos, de hidrogênio (H2) e metano (CH4) obtidos no teste respiratório com lactulose de crianças, moradoras de uma favela urbana, com ou sem sobrecrescimento bacteriano no intestino delgado (SBID), durante os primeiros 60 minutos, entre 60 e 180 minutos e no período total do teste
| Com SBID (n = 61) | Sem SBID (n = 39) | pa | ||
|---|---|---|---|---|
| H2 | 0–60 min | 750,0 (528,75–960,0) | 472,5 (307,5–712,5) | 0,002 |
| 60–180 min | 3292,5 (2126,25–4398,75) | 2550,0 (1410,0–4080,0) | 0,098 | |
| 0–180 min | 3978,75 (2662,5–5257,5) | 2902,50 (1807,50–4800,0) | 0,048 | |
| CH4 | 0–60 min | 1072,5 (217,5–1680,0) | 840,0 (0,0–1417,5) | 0,146 |
| 60–180 min | 1920,0 (442,5–4665,0) | 1680,0 (0,0–2910,0) | 0,081 | |
| 0–180 min | 2857,5 (630,0–6198,75) | 2535,0 (0,0–4327,5) | 0,069 | |
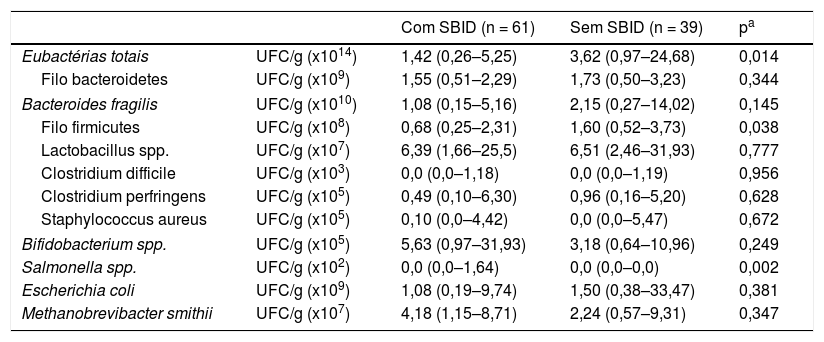
Em todas as crianças (100,0%) foram identificados: Bacteroides fragilis, Escherichia coli, Lactobacillus spp., Bifidobacterium spp. e Methanobrevibacter smithii. Quanto aos demais gêneros e espécies analisados, foram observadas frequências variáveis nas crianças com e sem SBID, respectivamente: Salmonella spp. (37,7% vs. 10,3%; p = 0,002), Staphylococcus aureus (52,5% vs. 41,0%; p = 0,267), Clostridium difficile (44,3% vs. 41,0%; p = 0,751) e Clostridium perfringens (91,8% vs. 92,3%; p = 0,928).
Foi verificada maior contagem de eubactérias totais (p = 0,014) e do filo Firmicutes (p = 0,038), no grupo de crianças sem SBID; entretanto, maior contagem de Salmonella (p = 0,002) foi constatada nas crianças com SBID. A quantificação de filos, gêneros e espécies bacterianas, de acordo com a presença ou ausência de SBID, encontra‐se descrita na tabela 3.
Filos, gêneros e espécies bacterianas (unidades formadoras de colônias: UFC/g de fezes) que representam a microbiota fecal de crianças, moradoras de uma favela urbana, com ou sem sobrecrescimento bacteriano no intestino delgado (SBID)
| Com SBID (n = 61) | Sem SBID (n = 39) | pa | ||
|---|---|---|---|---|
| Eubactérias totais | UFC/g (x1014) | 1,42 (0,26–5,25) | 3,62 (0,97–24,68) | 0,014 |
| Filo bacteroidetes | UFC/g (x109) | 1,55 (0,51–2,29) | 1,73 (0,50–3,23) | 0,344 |
| Bacteroides fragilis | UFC/g (x1010) | 1,08 (0,15–5,16) | 2,15 (0,27–14,02) | 0,145 |
| Filo firmicutes | UFC/g (x108) | 0,68 (0,25–2,31) | 1,60 (0,52–3,73) | 0,038 |
| Lactobacillus spp. | UFC/g (x107) | 6,39 (1,66–25,5) | 6,51 (2,46–31,93) | 0,777 |
| Clostridium difficile | UFC/g (x103) | 0,0 (0,0–1,18) | 0,0 (0,0–1,19) | 0,956 |
| Clostridium perfringens | UFC/g (x105) | 0,49 (0,10–6,30) | 0,96 (0,16–5,20) | 0,628 |
| Staphylococcus aureus | UFC/g (x105) | 0,10 (0,0–4,42) | 0,0 (0,0–5,47) | 0,672 |
| Bifidobacterium spp. | UFC/g (x105) | 5,63 (0,97–31,93) | 3,18 (0,64–10,96) | 0,249 |
| Salmonella spp. | UFC/g (x102) | 0,0 (0,0–1,64) | 0,0 (0,0–0,0) | 0,002 |
| Escherichia coli | UFC/g (x109) | 1,08 (0,19–9,74) | 1,50 (0,38–33,47) | 0,381 |
| Methanobrevibacter smithii | UFC/g (x107) | 4,18 (1,15–8,71) | 2,24 (0,57–9,31) | 0,347 |
No presente estudo foram observadas diferenças na composição da microbiota fecal de crianças moradoras de uma favela urbana com SBID, mais precisamente maior frequência e contagem de Salmonella spp. e menores contagens de Firmicutes e eubactérias totais, quando comparadas com aquelas sem SBID.
Em trabalho anterior feito por nossa equipe de pesquisa, uma constatação que motivou o estudo da microbiota fecal de crianças expostas a condições de pobreza e diagnosticadas com SBID, foi um padrão diferenciado de fermentação no cólon, caracterizada pela maior produção de hidrogênio no teste respiratório,9 um resultado que pressupõe que indivíduos com SBID possivelmente apresentem uma situação de disbiose nas diferentes porções intestinais, e não apenas em intestino delgado. Entretanto, esse padrão de maior produção de hidrogênio, e até mesmo de metano, no cólon de crianças com SBID, apesar de sugestiva, não se confirmou nos resultados atuais.
O estudo da composição bacteriana intestinal é possibilitado pela análise de amostras fecais.1 Por outro lado, procedimentos endoscópicos, associados à análise do conteúdo intestinal (aspirado jejunal), seriam necessários para a caracterização da microbiota do intestino delgado, esse é até considerado padrão‐ouro no diagnóstico de SBID.3,8,24 Contudo, as características invasivas do método e o seu alto custo8 o tornam inviável na avaliação de indivíduos assintomáticos ou com sintomas inespecíficos, além de que seu uso pode não ser adequado do ponto de vista ético para objetivos de pesquisa.24
Em indivíduos saudáveis, é pequena a colonização de bactérias no intestino delgado proximal (102 UFC/g de conteúdo intestinal), quando comparado com o cólon (1010 – 1012 UFC/g de fezes). A menor densidade bacteriana tanto em estômago como em intestino delgado deve‐se à ação do suco gástrico e das enzimas digestivas, além dos movimentos peristálticos, como parte do complexo motor migratório (CMM), observados nesses segmentos.24 Por outro lado, em sua caracterização, o SBID é geralmente associado a mudanças quali‐quantitativas dos gêneros e das espécies bacterianas no intestino delgado.3
As bactérias implicadas na ocorrência de SBID são principalmente Gram negativas, que apresentam lipopolissacarídeo (LPS) em suas membranas celulares. Os LPS estão associados ao desencadeamento de processo inflamatório local, ocasionam lesões em mucosa e aumento da permeabilidade intestinal,3,6 com consequente síndrome disabsortiva,4–6 e elevada fermentação de nutrientes em cólon.3 Também é atribuído ao LPS bacteriano uma ação inibitória do CMM, que ocasionaria uma estase do conteúdo luminal em período interdigestivo, favoreceria o crescimento excessivo de bactérias comuns ao cólon, no intestino delgado.24
A disfunção entérica intestinal se associa a infecção por microrganismos potencialmente patogênicos, o que permeia uma condição de disbiose intestinal.5Salmonella e Escherichia coli25 são espécies com cepas de alto potencial patogênico, têm grande parte das vezes a diarreia como sintoma gastrointestinal. Em nosso estudo, verificamos elevada frequência de Salmonella spp. nas crianças com SBID, além de maior contagem nas amostras fecais, quando comparadas com as crianças sem SBID, resultado que indica um número de portadores assintomáticos maior do que o esperado.
Menor quantificação de Firmicutes foi observada no grupo com SBID. De acordo com alguns autores, uma maior variabilidade na composição bacteriana intestinal pode refletir uma maior resistência à invasão por agentes patogênicos.26 A diversidade bacteriana intestinal parece conferir uma resiliência e, consequentemente, maior estabilidade do ecossistema bacteriano.27 Entretanto, a maior quantificação de um filo bacteriano não necessariamente se relaciona a um maior número ou diversidade de gêneros e espécies bacterianas colonizadores. Do mesmo modo, a maior quantificação de eubactérias totais no grupo de crianças com SBID pode ser interpretada, pode essa refletir, apenas, uma maior concentração bacteriana. A variabilidade genética dos microrganismos que compõem a microbiota de indivíduos com e sem SBID poderia ser identificada com o uso de tecnologias de sequenciamento de nova geração, o que pode ser objetivo de futuros estudos. A técnica usada no presente trabalho se constitui em um fator limitante, uma vez que permite, apenas, o estudo de alguns grupos bacterianos pré‐selecionados.
No estudo não foram constatadas outras diferenças na composição da microbiota fecal das crianças com e sem SBID. A partir de tal observação, foi analisado o poder do teste, foram considerados para cálculo os resultados das contagens de Escherichia coli, uma vez que a interpretação de seus resultados apresenta plausibilidade biológica, na vigência de SBID. Considerando o teste estatístico (Mann‐Whitney) e o tamanho de efeito (d = 0,45), calculado a partir das médias e desvios‐padrão da contagem de Escherichia coli (UFC/g de fezes) de ambos os grupos, identificou‐se que o poder (1‐β) para essa análise foi de 56,6%. Para obtenção de um poder de 80%, com manutenção do tamanho de efeito e α = 5%, seriam necessários 164 indivíduos (Software G*Power, versão. 3.1.9.2). Portanto, isso também se constitui em limitação do estudo, pode justificar o não alcance de evidência estatística em algumas análises.
A ocorrência de SBID em crianças expostas a condições insalubres de moradia e a veículos de contaminação se constitui no principal indicador de enteropatia ambiental.7 No presente estudo, foi verificada elevada a ocorrência de SBID (61,0%), um resultado expressivamente superior ao verificado em outros trabalhos.7,12 Nesse contexto, podemos destacar o menor acesso ao abastecimento domiciliar de água pelas crianças com SBID. Estudo anterior,7 feito nessa mesma comunidade, demonstrou que o abastecimento clandestino de água ocorria em 41,2% dos domicílios, no grupo de crianças com SBID presença de coliformes fecais foi verificada em 80,8% das amostras de água analisadas.
Na enteropatia ambiental pode ser observada no intestino delgado atrofia vilositária, hiperplasia de criptas e infiltrado linfoplasmocitário em lâmina própria.5 Má absorção de macronutrientes e micronutrientes é caracterizada, essas disfunções digestivo‐absortivas podem se associar à ocorrência de baixa estatura, em crianças de países em desenvolvimento.24
Diferentes autores, que estudaram o comportamento de biomarcadores da enteropatia ambiental, em crianças expostas a condições de pobreza, no Nordeste do Brasil6 e em Bangladesh,28 verificaram redução da ação de barreira intestinal e função absortiva, a partir do aumento de permeabilidade intestinal, verificada por níveis séricos de zonulina6 e teste de absorção de lactulose e manitol,6,28 respectivamente. Também, verificou‐se associação com a resposta inflamatória sistêmica induzida por produtos microbianos, como o LPS,6 os biomarcadores foram apresentados como fatores associados ao déficit de crescimento em crianças. Entretanto, esses são dados que precisam ser analisados com cautela, devido à complexidade dos mecanismos que envolvem a resposta inflamatória intestinal e sistêmica.28
A maior suscetibilidade de crianças moradoras de favela a agravos nutricionais já está bem demonstrada na literatura.7,9 Entretanto, os achados atuais demonstram, também, maior frequência de baixa estatura nutricional nos portadores de SBID, quando comparados com aqueles em SBID, ambos os grupos são expostos aos mesmos fatores de risco. Estudo feito em Bangladesh com 90 crianças em condições de pobreza, aos dois anos, verificou que o principal fator associado ao SBID foi a diminuição do escore Z de estatura para idade, em comparação com os parâmetros de nascimento, independentemente das crianças apresentarem ou não doença diarreica recente ou frequente.29
Outro resultado que, assim como a baixa estatura, vem reforçar a ocorrência de síndrome disabsortiva, foi menores médias de hemoglobina verificadas no grupo de crianças com SBID. Outro estudo,30 com crianças moradoras de favela, encontrou associação entre ocorrência de anemia e anormalidade na função intestinal, caracterizada por menor absorção de D‐xilose.
É importante enfatizar a originalidade dos nossos achados, o que pode auxiliar no entendimento da disfunção entérica ambiental e suas consequências, mais precisamente a associação com o SBID e alterações na microbiota intestinal. Deve‐se destacar a constatação de menores valores de estatura para idade e hemoglobina nas crianças com SBID, quando comparadas com aquelas sem SBID, mesmo provenientes de uma mesma favela urbana. Tal resultado pode sugerir que a exposição a microrganismos com alto potencial patogênico, aqui caracterizado pela maior frequência e contagem de Salmonella, em crianças com SBID, poderia representar um importante fator associado ao desenvolvimento de baixa estatura e anemia.
Ainda há muito a ser elucidado a respeito das comunidades bacterianas e suas interações com o organismo humano. Entretanto, a partir da hipótese de que indivíduos suscetíveis à contaminação bacteriana por espécies potencialmente patogênicas podem sofrer sérios prejuízos à saúde e nutrição, é necessário ressaltar a importância de políticas públicas que sejam efetivas para a melhoria das condições de moradia e saneamento básico da população vulnerável que desse modo contribuam para a erradicação da enteropatia ambiental.
FinanciamentoFundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Mello CS, Rodrigues MS, Filho HB, Melli LC, Tahan S, Pignatari AC, et al. Fecal microbiota analysis of children with small intestinal bacterial overgrowth among residents of an urban slum in Brazil. J Pediatr (Rio J). 2018;94:483–90.