To review the available literature on the association between acute viral respiratory tract infection and the onset of asthma exacerbations, identifying the most prevalent viruses, detection methods, as well as preventive and therapeutic aspects.
SourcesA search was conducted in PubMed, Lilacs, and SciELO databases, between the years 2002 and 2013, using the following descriptors: asthma exacerbation, virus, child, and acute respiratory infection.
Summary of the findingsA total of 42 original articles addressing the identification of respiratory viruses during episodes of asthma exacerbation were selected, mostly cross‐sectional studies. There was a wide variation in the methodology of the assessed studies, particularly in relation to the children's age and methods of collection and viral detection. The results indicate that, in up to 92.2% of exacerbations, a viral agent was potentially the main triggering factor, and human rhinovirus was the most frequently identified factor. The pattern of viral circulation may have been responsible for the seasonality of exacerbations. The association between viral infections and allergic inflammation appears to be crucial for the clinical and functional uncontrolled asthma, but few studies have evaluated other triggering factors in association with viral infection.
ConclusionsRespiratory viruses are present in the majority of asthmatic children during episodes of exacerbation. The involved physiopathological mechanisms are yet to be fully established, and the synergism between allergic inflammation and viral infection appears to determine uncontrolled disease. The role of other triggering and protective agents is yet to be clearly determined.
Rever a literatura disponível sobre a relação entre infecção viral aguda do trato respiratório e o desencadeamento de exacerbações da asma, identificando os vírus mais prevalentes, os métodos de detecção, bem como os aspectos preventivos e terapêuticos.
Fonte dos dadosFoi realizada uma busca nas bases de dados PubMed, SciELO e Lilacs utilizando os descritores: asma, exacerbação, vírus, criança e infecção respiratória aguda, entre os anos de 2002 e 2013.
Síntese dos dadosForam selecionados 42 artigos originais que tratavam da identificação de vírus respiratórios durante episódios de exacerbação da asma, em sua maioria estudos transversais. Houve ampla variação na metodologia dos trabalhos avaliados, principalmente em relação à idade das crianças e métodos de coleta e detecção viral. Os resultados apontam que, em até 92,2% das exacerbações, um agente viral foi potencialmente o principal fator desencadeante, sendo o rinovírus humano o mais identificado. O padrão de circulação viral pode ter sido responsável pela sazonalidade das exacerbações. A associação entre infecção viral e inflamação alérgica parece ser determinante para levar ao descontrole clínico‐funcional da asma, porém poucos estudos avaliaram outros fatores desencadeantes em associação com a infecção viral.
ConclusõesOs vírus respiratórios estão presentes na maioria das crianças asmáticas durante os episódios de exacerbação. Os mecanismos fisiopatológicos envolvidos ainda não estão totalmente estabelecidos e o sinergismo entre a inflamação alérgica e infecção viral parece determinar o descontrole da doença. O papel dos outros agentes desencadeantes e protetores não estão claramente determinados.
A asma é uma doença crônica, geneticamente determinada, cuja prevalência na faixa etária pediátrica varia entre 19,0% e 24,3%, respectivamente, entre adolescentes e escolares brasileiros.1 Do ponto de vista fisiopatológico, caracteriza‐se por uma inflamação crônica com envolvimento de vários tipos celulares, associada à hiperresponsividade das vias aéreas, com limitação reversível episódica ao fluxo aéreo. Clinicamente, manifesta‐se por episódios recorrentes de exacerbações, também denominados “crise asmática” ou, mais apropriadamente, asma aguda, caracterizadas pelo progressivo agravamento da dispneia, tosse, chiado, sensação de aperto no peito ou a combinação destes.2
A perda de controle clínico‐funcional da asma ocorre habitualmente de forma progressiva, mas pode se instalar de forma abrupta em um subgrupo de pacientes.2 Representa uma das principais causas de consultas em emergência, tendo sido responsável por 195 mortes em menores de 19 anos no ano de 2007, no Brasil.3 Políticas públicas têm sido desenvolvidas no sentido de divulgar tanto os conhecimentos científicos sobre a doença quanto o seu manejo, e ainda organizar programas de assistência em saúde pública, os quais incluem, entre outros, a dispensação de medicamentos. Entretanto, as exacerbações continuam ocupando lugar de destaque nas estatísticas, gerando grande impacto nos sistemas de saúde público e privado.2
É bem conhecida a origem multicausal do descontrole clínico‐funcional da doença e, desde o início dos anos 70, os vírus respiratórios vêm sendo relacionados ao desencadeamento das exacerbações da asma em adultos e crianças.3 Nos anos 90, o desenvolvimento de técnicas moleculares mais sensíveis e específicas possibilitou a ampliação da detecção dos vírus respiratórios, e, portanto, para o melhor esclarecimento dessa associação. Pesquisas que utilizam a reação em cadeia de polimerase pós‐transcrição reversa (reverse transcriptase polymerase chain reaction – RT‐PCR) como técnica de detecção isolada ou complementar a métodos tradicionais demonstraram positividade para vírus respiratórios em até 92,2% dos episódios de agudização da asma em crianças.4
Considerando a possibilidade de relação causal entre infecção por vírus respiratórios em crianças e desencadeamento de crise asmática e as implicações dessa associação, assim como a possibilidade de profilaxia e terapêutica específica para estes agentes, justifica‐se uma atenção especial a este assunto. Neste intuito, foi concebida esta revisão da literatura, que tem como objetivo a análise dos artigos publicados entre os anos de 2002 e 2013 sobre a associação entre exacerbação da asma e infecção viral aguda das vias aéreas.
MétodosFoi realizada uma busca em bases de dado eletrônicas, a saber: PubMed, Lilacs e SciELO. Com a utilização dos descritores: “Asthma Exacerbation”, “Viral Infection” and “Child”, foi encontrado um total de 283 referências no período acima referido. Após selecionadas as publicações de língua portuguesa, inglesa, espanhola ou francesa, restaram 195 deles. Mediante leitura dos títulos e resumos, foram selecionados 42 artigos originais que avaliaram infecção viral do trato respiratório em crianças asmáticas durante a exacerbação. Alguns artigos de importância histórica ou de revisão que contemplaram os três descritores foram acrescentados para gerar a bibliografia final desta revisão. A lista de referências foi inserida no Endnote X6 (Thompson Corp., CA, EUA), software de gerenciamento de citações bibliográficas.
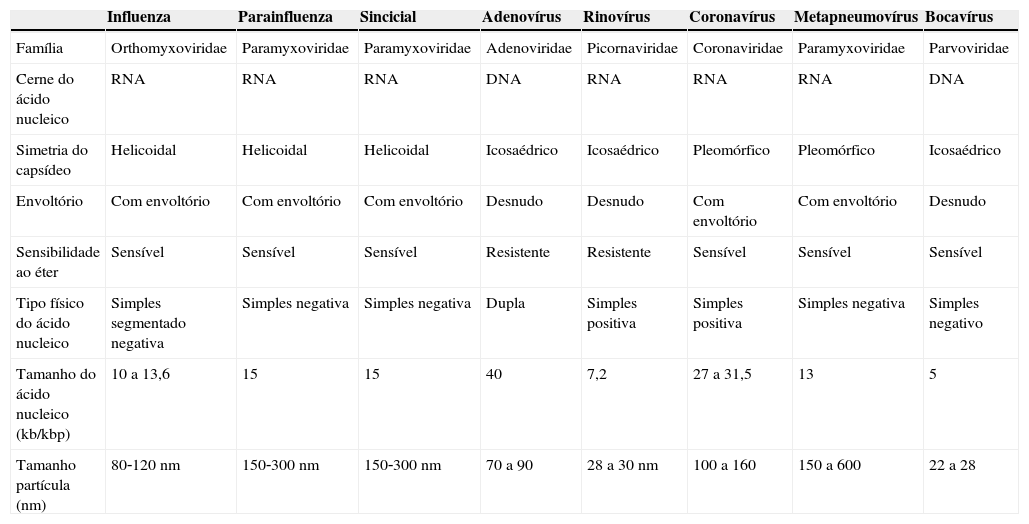
ResultadosVírus respiratórios e resposta imuneOs vírus respiratórios mais identificados em associação com a exacerbação da asma são o rinovírus humano (hRV), vírus sincicial respiratório (VSR), adenovírus (hAdV), influenza (Flu), parainfluenza (PFlu), metapneumovírus humano (hMPV) e coronavírus (hCoV). Dos vírus listados, a maioria possui RNA como ácido nucleico e suas características biológicas e taxonomia5 são descritas na tabela 1.
Características biológicas e taxonomia dos principais vírus respiratórios
| Influenza | Parainfluenza | Sincicial | Adenovírus | Rinovírus | Coronavírus | Metapneumovírus | Bocavírus | |
|---|---|---|---|---|---|---|---|---|
| Família | Orthomyxoviridae | Paramyxoviridae | Paramyxoviridae | Adenoviridae | Picornaviridae | Coronaviridae | Paramyxoviridae | Parvoviridae |
| Cerne do ácido nucleico | RNA | RNA | RNA | DNA | RNA | RNA | RNA | DNA |
| Simetria do capsídeo | Helicoidal | Helicoidal | Helicoidal | Icosaédrico | Icosaédrico | Pleomórfico | Pleomórfico | Icosaédrico |
| Envoltório | Com envoltório | Com envoltório | Com envoltório | Desnudo | Desnudo | Com envoltório | Com envoltório | Desnudo |
| Sensibilidade ao éter | Sensível | Sensível | Sensível | Resistente | Resistente | Sensível | Sensível | Sensível |
| Tipo físico do ácido nucleico | Simples segmentado negativa | Simples negativa | Simples negativa | Dupla | Simples positiva | Simples positiva | Simples negativa | Simples negativo |
| Tamanho do ácido nucleico (kb/kbp) | 10 a 13,6 | 15 | 15 | 40 | 7,2 | 27 a 31,5 | 13 | 5 |
| Tamanho partícula (nm) | 80‐120 nm | 150‐300 nm | 150‐300 nm | 70 a 90 | 28 a 30 nm | 100 a 160 | 150 a 600 | 22 a 28 |
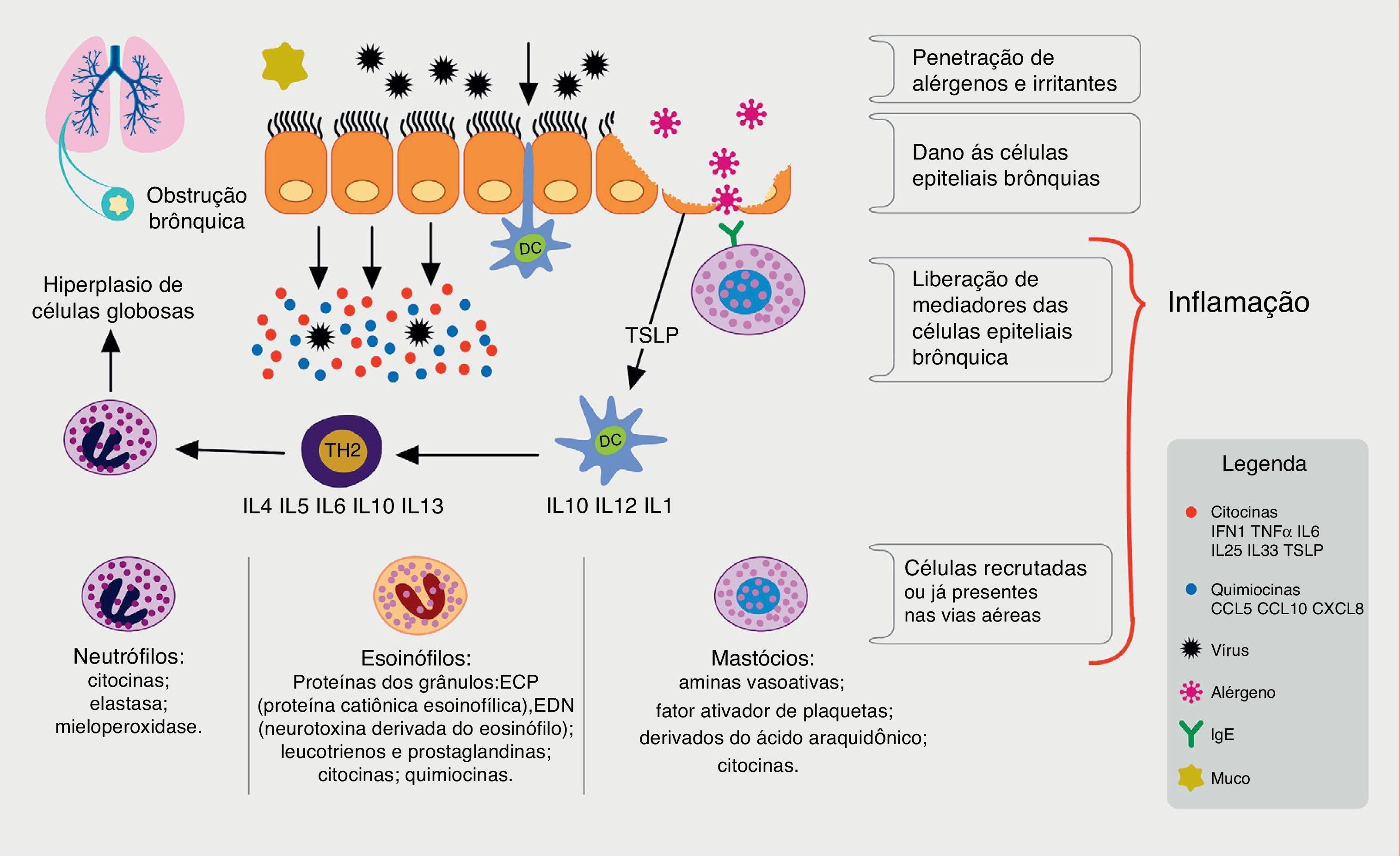
A principal forma de contágio desses vírus ocorre através de fômites contaminados, perdigotos, aerossóis ou de forma direta. Ao infectar as células do epitélio nasal, esses agentes desencadeiam uma resposta imunológica, que envolve principalmente as células dendríticas, células NK (natural killer) e a indução de liberação de uma série de citocinas e quimiocinas pró‐inflamatórias pelas células epiteliais infectadas, como interferons (IFN‐1) e fator de necrose tumoral (TNFα), dentre outras (fig. 1).
Processo imune envolvido na resposta aos vírus respiratórios e relação com a inflamação alérgica. Os vírus respiratórios infectam as células epiteliais brônquicas (bronchial epithelial cells, BECs) através de receptores (tool‐like receptors, TLRs). Durante a replicação desencadeiam processo inflamatório com indução da produção de citocinas e quimiocinas pela BECs, dentre elas o INF‐1, TNFα, IL33, IL 25 e linfopoetina tímica estromal (thymic stromal lymphopoietin, TSLP). As células dendríticas (dendritic cells, DC), componentes da imunidade inata, após capturarem os antígenos virais dirigem‐se aos órgãos linfoides secundários, e lá estimulam as células linfoides, protagonistas da resposta imune específica. Nos asmáticos, a produção de IFNs é reduzida, o que permite maior replicação viral e, com o estímulo da TSLP, ocorre um desvio do perfil linfoide para linfócitos tipo 2 (Th2), promovendo menor resposta antiviral e maior inflamação alérgica, com hiper‐reatividade brônquica e aumento na produção de muco, acarretando obstrução brônquica e exacerbação da asma.
Nos asmáticos, a infecção viral ocasiona um desequilíbrio na homeostase imunológica do sistema respiratório. Vários mecanismos relacionados à infecção viral e à inflamação alérgica, bem como o seu papel no desencadeamento da asma aguda, têm sido propostos, entre eles a deficiência na função da barreira epitelial causada pelos vírus, que tem sido apontada como fator predisponente por alguns.6 Entretanto, tanto a asma quanto a atopia são associadas a danos epiteliais, o que pode contribuir para maior susceptibilidade a infecções, inclusive as de etiologia viral, e à sensibilização por aeroalérgenos.7 Outro fator avaliado foi a produção de muco como mecanismo de defesa das vias aéreas, tendo sido demonstrado em estudos utilizando ratos que a inflamação alérgica e a infecção viral atuam sinergicamente aumentando a sua produção, o que pode levar à impactação e à obstrução das vias aéreas em asmáticos.8
Alterações no padrão de produção de interferon induzidas por vírus têm sido encontradas. Por exemplo, estudos in vivo e in vitro em células epiteliais de adultos saudáveis e asmáticos infectadas por hRV demonstraram diminuição na produção de interferon tipo I (α e β) em asmáticos, tornando‐os mais susceptíveis à exacerbação associada à infecção viral.6,9 Resultados semelhantes foram obtidos em estudo realizado em crianças, onde a produção de interferon e citocinas Th2 por células do epitélio brônquico foram avaliadas após infecção pelo rinovírus 16. Foi demonstrada uma menor produção de interferon e maiores concentrações de RNA viral em crianças asmáticas, independentemente do seu estado atópico, e em crianças atópicas não asmáticas, sugerindo que a resposta imune deficiente à infecção viral ocorra não apenas em asmáticos, mas em crianças com outras desordens associadas aos linfócitos Th2.10 Entretanto, outros estudos não conseguiram demostrar a mesma redução na produção de interferon e outros ainda encontraram até mesmo aumento em sua produção em asmáticos exacerbados.11,12
O epitélio brônquico produz algumas citocinas, entre elas as interleucinas 25 e 33, bem como a linfopoeitina tímica estromal, que promove a diferenciação das células linfoides inatas em padrão Th2. Essa última pode ser induzida pela infecção viral, e sua produção pode ser aumentada pela interleucina‐4 (IL‐4), sugerindo que a interação entre os vírus e a inflamação alérgica das vias aéreas pode intensificar a resposta inflamatória de padrão Th2 e potencialmente reduzir a resposta antiviral.11,13
Métodos de coleta e detecção viralA detecção viral é altamente dependente da qualidade da amostra coletada, do tempo de início dos sintomas ao momento da coleta (idealmente até 72 horas) e do transporte e armazenamento da amostra antes do teste. A pesquisa de vírus respiratórios deve ser feita em material proveniente das vias aéreas. Na maioria dos casos utiliza‐se secreção de vias aéreas superiores, sendo vários os métodos utilizados para esta coleta, como aspirado nasofaríngeo(ANF), swab nasofaríngeo (SNF), lavado nasofaríngeo e o swab nasal‐oral combinado, sendo a primeira técnica considerada o padrão‐ouro.14
Recentemente foram desenvolvidos novos swabs de material floculado (flocked swabs – Copan, Brescia, Itália) com melhor rendimento durante a coleta. Estudos recentes utilizando este tipo de swab demonstraram sensibilidade comparada ao ANF quando a detecção é feita por PCR, sugerindo que o swab possa ser utilizado em pesquisas epidemiológicas e estudos de vigilância, devido à maior facilidade técnica para a sua realização.15,16
Existem poucos dados que suportem o uso do swab nasal‐oral combinado para a detecção de vírus, sendo sua sensibilidade inferior ao swab ou aspirado nasofaríngeo, o que pode ser explicado pela menor carga viral na orofaringe do que em nasofaringe. A coleta poderá ser realizada também de material proveniente de vias aéreas inferiores, como o escarro induzido e o lavado brônquico.17
Os métodos de detecção dos vírus respiratórios são variados e compreendem testes rápidos para detecção de antígenos, cultura, imunofluorescência direta e indireta e reações de amplificação de ácido nucleico, como a RT‐PCR, que são capazes de detectar um único agente (monoplex) ou realizar múltiplas detecções (multiplex). A sensibilidade destes últimos é maior, sendo utilizados na maioria dos estudos recentes.18,19 As reações de imunofluorescência têm menor custo e rapidez de execução, sendo também capazes de detectar múltiplos vírus. Em geral, utilizam um painel de sete vírus (influenza A e B, parainfluenza 1 a 3, adenovírus e vírus sincicial respiratório). Alguns vírus, como o rinovírus e o bocavírus, só podem ser pesquisados através das reações de amplificação de ácido nucleico.17
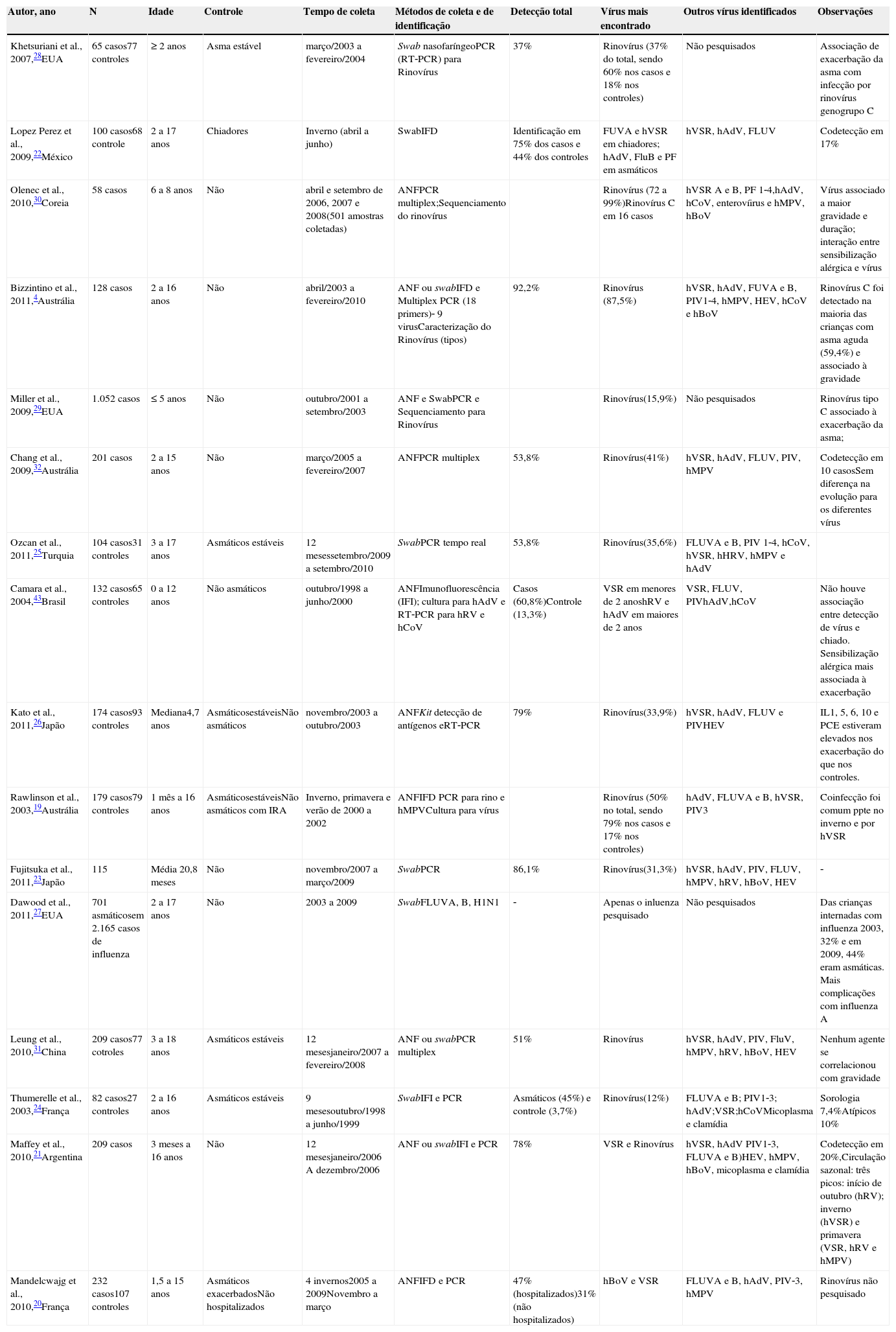
Vírus e exacerbaçãoVários autores realizaram estudos visando à pesquisa de vírus em secreção respiratória de asmáticos exacerbados, revelando uma prevalência de identificação viral que varia de acordo com alguns fatores, tais como faixa etária dos pacientes, período do ano, método de coleta da amostra e de detecção viral. A tabela 2 mostra os artigos originais que demostram resultados de pesquisa viral em crianças asmáticas exacerbadas. A maioria dos trabalhos encontrou prevalência entre 36,0%20 e 92,2%5 e, nestes casos, o vírus mais frequentemente identificado foi o rinovírus humano.
Estudos que pesquisaram infecção viral em crianças asmáticas exacerbadas e incluídos na revisão bibliográfica
| Autor, ano | N | Idade | Controle | Tempo de coleta | Métodos de coleta e de identificação | Detecção total | Vírus mais encontrado | Outros vírus identificados | Observações |
|---|---|---|---|---|---|---|---|---|---|
| Khetsuriani et al., 2007,28EUA | 65 casos77 controles | ≥ 2 anos | Asma estável | março/2003 a fevereiro/2004 | Swab nasofaríngeoPCR (RT‐PCR) para Rinovírus | 37% | Rinovírus (37% do total, sendo 60% nos casos e 18% nos controles) | Não pesquisados | Associação de exacerbação da asma com infecção por rinovírus genogrupo C |
| Lopez Perez et al., 2009,22México | 100 casos68 controle | 2 a 17 anos | Chiadores | Inverno (abril a junho) | SwabIFD | Identificação em 75% dos casos e 44% dos controles | FUVA e hVSR em chiadores; hAdV, FluB e PF em asmáticos | hVSR, hAdV, FLUV | Codetecção em 17% |
| Olenec et al., 2010,30Coreia | 58 casos | 6 a 8 anos | Não | abril e setembro de 2006, 2007 e 2008(501 amostras coletadas) | ANFPCR multiplex;Sequenciamento do rinovírus | Rinovírus (72 a 99%)Rinovírus C em 16 casos | hVSR A e B, PF 1‐4,hAdV, hCoV, enterovíirus e hMPV, hBoV | Vírus associado a maior gravidade e duração; interação entre sensibilização alérgica e vírus | |
| Bizzintino et al., 2011,4Austrália | 128 casos | 2 a 16 anos | Não | abril/2003 a fevereiro/2010 | ANF ou swabIFD e Multiplex PCR (18 primers)‐ 9 virusCaracterização do Rinovírus (tipos) | 92,2% | Rinovírus (87,5%) | hVSR, hAdV, FUVA e B, PIV1‐4, hMPV, HEV, hCoV e hBoV | Rinovírus C foi detectado na maioria das crianças com asma aguda (59,4%) e associado à gravidade |
| Miller et al., 2009,29EUA | 1.052 casos | ≤ 5 anos | Não | outubro/2001 a setembro/2003 | ANF e SwabPCR e Sequenciamento para Rinovírus | Rinovírus(15,9%) | Não pesquisados | Rinovírus tipo C associado à exacerbação da asma; | |
| Chang et al., 2009,32Austrália | 201 casos | 2 a 15 anos | Não | março/2005 a fevereiro/2007 | ANFPCR multiplex | 53,8% | Rinovírus(41%) | hVSR, hAdV, FLUV, PIV, hMPV | Codetecção em 10 casosSem diferença na evolução para os diferentes vírus |
| Ozcan et al., 2011,25Turquia | 104 casos31 controles | 3 a 17 anos | Asmáticos estáveis | 12 mesessetembro/2009 a setembro/2010 | SwabPCR tempo real | 53,8% | Rinovírus(35,6%) | FLUVA e B, PIV 1‐4, hCoV, hVSR, hHRV, hMPV e hAdV | |
| Camara et al., 2004,43Brasil | 132 casos65 controles | 0 a 12 anos | Não asmáticos | outubro/1998 a junho/2000 | ANFImunofluorescência (IFI); cultura para hAdV e RT‐PCR para hRV e hCoV | Casos (60,8%)Controle (13,3%) | VSR em menores de 2 anoshRV e hAdV em maiores de 2 anos | VSR, FLUV, PIVhAdV,hCoV | Não houve associação entre detecção de vírus e chiado. Sensibilização alérgica mais associada à exacerbação |
| Kato et al., 2011,26Japão | 174 casos93 controles | Mediana4,7 anos | AsmáticosestáveisNão asmáticos | novembro/2003 a outubro/2003 | ANFKit detecção de antígenos eRT‐PCR | 79% | Rinovírus(33,9%) | hVSR, hAdV, FLUV e PIVHEV | IL1, 5, 6, 10 e PCE estiveram elevados nos exacerbação do que nos controles. |
| Rawlinson et al., 2003,19Austrália | 179 casos79 controles | 1 mês a 16 anos | AsmáticosestáveisNão asmáticos com IRA | Inverno, primavera e verão de 2000 a 2002 | ANFIFD PCR para rino e hMPVCultura para vírus | Rinovírus (50% no total, sendo 79% nos casos e 17% nos controles) | hAdV, FLUVA e B, hVSR, PIV3 | Coinfecção foi comum ppte no inverno e por hVSR | |
| Fujitsuka et al., 2011,23Japão | 115 | Média 20,8 meses | Não | novembro/2007 a março/2009 | SwabPCR | 86,1% | Rinovírus(31,3%) | hVSR, hAdV, PIV, FLUV, hMPV, hRV, hBoV, HEV | ‐ |
| Dawood et al., 2011,27EUA | 701 asmáticosem 2.165 casos de influenza | 2 a 17 anos | Não | 2003 a 2009 | SwabFLUVA, B, H1N1 | ‐ | Apenas o inluenza pesquisado | Não pesquisados | Das crianças internadas com influenza 2003, 32% e em 2009, 44% eram asmáticas. Mais complicações com influenza A |
| Leung et al., 2010,31China | 209 casos77 cotroles | 3 a 18 anos | Asmáticos estáveis | 12 mesesjaneiro/2007 a fevereiro/2008 | ANF ou swabPCR multiplex | 51% | Rinovírus | hVSR, hAdV, PIV, FluV, hMPV, hRV, hBoV, HEV | Nenhum agente se correlacionou com gravidade |
| Thumerelle et al., 2003,24França | 82 casos27 controles | 2 a 16 anos | Asmáticos estáveis | 9 mesesoutubro/1998 a junho/1999 | SwabIFI e PCR | Asmáticos (45%) e controle (3,7%) | Rinovírus(12%) | FLUVA e B; PIV1‐3; hAdV;VSR;hCoVMicoplasma e clamídia | Sorologia 7,4%Atípicos 10% |
| Maffey et al., 2010,21Argentina | 209 casos | 3 meses a 16 anos | Não | 12 mesesjaneiro/2006 A dezembro/2006 | ANF ou swabIFI e PCR | 78% | VSR e Rinovírus | hVSR, hAdV PIV1‐3, FLUVA e B)HEV, hMPV, hBoV, micoplasma e clamídia | Codetecção em 20%,Circulação sazonal: três picos: início de outubro (hRV); inverno (hVSR) e primavera (VSR, hRV e hMPV) |
| Mandelcwajg et al., 2010,20França | 232 casos107 controles | 1,5 a 15 anos | Asmáticos exacerbadosNão hospitalizados | 4 invernos2005 a 2009Novembro a março | ANFIFD e PCR | 47% (hospitalizados)31%(não hospitalizados) | hBoV e VSR | FLUVA e B, hAdV, PIV‐3, hMPV | Rinovírus não pesquisado |
ANF, aspirado nasofaríngeo; IFI, imunofluorescência indireta; IFD, imunofluorescência direta; PCR, reação de polimerase em cadeia; RT‐PCR, reação em cadeia de polimerase pós‐transcrição reversa; hRV, rinovírus; hAdV, adenovírus; hVSR, vírus sincicial respiratório; FLUV, influenza; FLUVA, influenza A; FLUVB, influenza B; HPIV1, parainfluenza 1; HPIV2, parainfluenza 2; HPIV3, parainfluenza 3; hCoV, coronavírus; hMPV, metapneumovírus; hBoV, bocavírus humano; HEV, vírus da hepatite E; ECP, proteína catiônica eosinofílica; URTI, infecções do trato respiratório superior.
Pesquisa de vírus respiratórios realizada em 209 crianças com idade entre três meses e 16 anos hospitalizadas por exacerbação da asma foi conduzida em um período de 12 meses, em Buenos Aires, Argentina. Devido à possibilidade de outros diagnósticos para episódios de sibilância em lactentes, a definição de asma foi baseada nos critérios de Castro‐Rodrigues para os menores de três anos, e nos critérios do GINA para os maiores. Foi realizada imunofluorescência e PCR na secreção nasofaríngea das crianças, que obtiveram uma taxa de positividade de 78,0% para os vírus de uma forma geral, sendo o rinovírus e o sincicial respiratório os mais identificados. Houve ainda 20,0% de detecção dupla, com o envolvimento de todos os vírus pesquisados.21
No México, a frequência de positividade viral à imunofluorescência foi maior em crianças asmáticas (75,0%) do que em um grupo controle constituído por sibilantes não asmáticos (44,0%). O rinovírus não foi incluído na pesquisa viral desse estudo e os vírus influenza, parainfluenza e adenovírus foram os mais identificados no grupo dos asmáticos.22 No Japão, os vírus respiratórios foram detectados por PCR multiplex em 86,1% de 115 crianças asmáticas exacerbadas, com idade média de 20,8 meses. O vírus sincicial respiratório esteve relacionado a episódio único de sibilância (p<0,05).23 O rinovírus esteve mais presente em pacientes com história de asma (p<0.,05).
Um grupo de 82 crianças francesas exacerbadas e tratadas em domicílio foi comparado a 27 crianças asmáticas estáveis. A imunofluorescência, PCR, sorologia para vírus, Mycoplasma pneumoniae e Chlamydophila pneumoniae evidenciaram detecção de algum patógeno em 45,0% das amostras, com frequência significativamente maior nos casos do que nos controles (3,7%). Os testes de detecção viral foram positivos em 38% dos casos, sendo o rinovírus o mais frequente (12,0%). Em 10,0% dos casos, os testes sorológicos foram positivos para os dois germes atípicos.24
Outra série de 104 crianças exacerbadas comparadas a outras 31 controladas, estudadas por autores turcos, evidenciou positividade de 53,8% nos casos e 22,6% nos controles, mediante reação de RT‐PCR. O rinovírus foi o mais encontrado, estando presente em 35,6% das amostras.25 No Japão, 174 crianças com asma aguda foram comparadas a 79 asmáticas estáveis e 14 crianças não asmáticas. Através da utilização kit de detecção de antígenos e RT‐PCR, detectaram vírus respiratórios em 79,0% das amostras de aspirado nasal das crianças asmáticas exacerbadas, sendo o rinovírus o mais frequente (33,9%). Paralelamente, a avaliação de marcadores inflamatórios mostrou elevação significativa (p<0,01) das interleucinas IL‐1, 5, 6 e 10 no soro e no aspirado nasal dos pacientes em exacerbação, bem como elevação sérica da proteína catiônica eosinofílica (p<0,01).26
O vírus influenza, embora menos frequentemente associado a estes episódios, parece ser responsável por maior morbidade em pacientes com doença crônica subjacente, aqui incluída a asma. De 2.165 crianças entre dois a 17 anos internadas com diagnóstico de infecção pelo vírus influenza A e B entre 2003 e 2009 nos Estados Unidos, 44,0% eram asmáticas, sendo as complicações significativamente mais associadas ao vírus A da influenza (p<0,01). Outros vírus não foram pesquisados nessa população.27
Outro estudo comparou crianças exacerbadas tratadas em ambiente hospitalar (n=232) com aquelas tratadas em ambiente domiciliar (n=107). Foi realizada imunofluorescência para o vírus influenza, adenovírus, sincicial respiratório e parainfluenza, bem como PCR para bocavírus. Obteve‐se taxa de 36,0% de detecção viral, não tendo sido encontrada diferença de perfil viral entre os pacientes internados e os não internados. Os vírus mais encontrados foram o sincicial respiratório (15,0%) e o bocavírus (12,0%), mas o rinovírus não foi incluído no painel viral desse estudo.20
Um grupo de 179 crianças australianas com idade até 16 anos teve sua secreção nasal coletada em três períodos, entre os anos de 2000 e 2002, tendo sido comparado com grupo controle de crianças não asmáticas com infecção do trato respiratório superior (ITRS) no mesmo período e outro grupo de 28 crianças com asma controlada, avaliadas em consulta de rotina. O rinovírus e o metapneumovírus foram pesquisados por RT‐PCR e um painel de sete vírus (influenza A e B, parainfluenza 1 a 3, adenovírus e sincicial respiratório) foi pesquisado por reação de imunofluorescência. A infecção por rinovírus foi responsável por 50,0% das ITRS de crianças não asmáticas, sendo a coinfecção comum, principalmente com o vírus sincicial respiratório, mais frequente em menores de dois anos.
Crianças com asma sintomática tiveram as maiores taxas de infecção por rinovírus (79,0% vs. 52,0% entre todas as crianças). Por fim, as crianças asmáticas controladas tiveram as menores taxas de identificação do rinovírus (17,0% vs. 79,0%).19
Estudos conduzidos em 200728 e 2009,29 direcionados à pesquisa de rinovírus em asmáticos exacerbados através da RT‐PCR, encontraram frequência global de identificação viral de 37,0% e 15,9%, respectivamente. No primeiro estudo foi utilizado grupo de comparação composto por asmáticos estáveis, nos quais a porcentagem de identificação foi menor (18,0%) do que no grupo caso (60,0%). Os dois estudos encontraram maior associação entre exacerbação e a presença de rinovírus C.
Vírus e gravidade da exacerbaçãoOutra questão importante na complexa relação entre vírus e asma é em relação à associação da intensidade da exacerbação com a infecção viral. Nesse sentido, vários estudos4,30–34 apresentam resultados ainda inconclusivos, apesar de o rinovírus ter sido relacionado à maior gravidade ou pior resposta ao tratamento.30,33,34 A relação da infecção viral com a gravidade da asma aguda foi avaliada em 128 crianças entre dois e 16 anos. Foi observada uma taxa de 92,2% de positividade para vírus através de imunofluorescência direta (IFD) e PCR multiplex, sendo o rinovírus detectado em 87,5% dos casos e o tipo C encontrado na metade dos casos e associado à maior gravidade.4
Cinquenta e oito crianças asmáticas com idade entre seis e oito anos foram monitoradas durante um período de cinco semanas, entre setembro e abril de 2009. Tiveram amostras de lavado nasal coletadas semanalmente para a realização de PCR multiplex, além de diário de sintomas, pico de fluxo expiratório e anotações sobre uso de medicação de resgate. Em 36,0 a 50,0% dos espécimes foi detectado algum vírus, sendo o rinovírus identificado em 72,0 a 99,0% das amostras positivas e associado à maior gravidade dos sintomas.30
Entretanto, a pesquisa viral por PCR multiplex para 20 patógenos em 209 crianças asmáticas exacerbadas comparadas com 77 asmáticas controladas, conduzida em Hong Kong entre os anos de 2007 e 2008, não demonstrou relação entre a presença do vírus e a gravidade da exacerbação. Em 51,0% dos casos algum vírus foi identificado, e essa detecção esteve, de forma geral, mais associada às exacerbações (OR 2,77; 95% IC 1,51‐5,11; p<0,01). Quando analisado de forma individual, nenhum vírus esteve associado à exacerbação, apesar de o rinovírus ter sido o mais frequente, identificado em 26,2% dos exacerbados e em 13,0% dos asmáticos controlados, embora sem diferença significativa (p=0,27).31
Amostras de aspirado nasofaríngeo de 201 crianças asmáticas com idade entre dois e 15 anos coletadas durante episódios de exacerbação foram encaminhadas para identificação viral por PCR. A taxa de positividade foi de 53,8%, sendo rinovírus o mais frequente (41,0%), seguido pelo sincicial respiratório (9,0%). Não houve associação com a gravidade da exacerbação.32
Um estudo comparou a resposta ao tratamento com broncodilatadores entre crianças exacerbadas (n=168) com sintomas de infecção respiratória viral e outro grupo sem tais sintomas (n=50). A média de idade foi de 6,6 anos e a gravidade da exacerbação não diferiu entre os grupos. As crianças com sintomas virais tiveram pior resposta aos broncodilatadores, necessitando de mais doses dos beta‐agonistas em 6, 12 e 24 horas. A pesquisa viral foi feita em 77,0% dos casos e o rinovírus foi o mais encontrado (61,4%).33
Em outra investigação, 78 crianças exacerbadas foram tratadas em ambiente hospitalar e comparadas a 78 adultos assintomáticos. As reações PCR multiplex para oito vírus respiratório e monoplex para enterovírus, bocavírus e rinovírus detectaram a presença de vírus respiratórios em 65,4% dos casos, sendo o rinovírus, novamente, o mais frequente (52,6%). A genotipagem constatou maior frequência (56,0%) do rinovírus tipo C e associação do tipo A com pior evolução clínica.34
Sazonalidade das exacerbaçõesAs exacerbações da asma têm distribuição sazonal, ocorrendo de forma cíclica tanto em adultos quanto em crianças, podendo ser explicada pelo padrão de circulação viral ou variação no nível de poluentes e aeroalérgenos. Exemplo disso é o que ocorre em países de clima temperado, onde é previsível maior ocorrência entre os escolares no outono e na primavera.35 Na tentativa de explicar esse fenômeno, há uma conjunção de fatores, como a maior circulação de rinovírus no final do verão e início do outono, maior circulação de poluentes e aeroalérgenos e o retorno à escola após as férias de verão. A influência do retorno às atividades escolares pode ser justificada pela menor adesão ao tratamento de manutenção no período de férias. A circulação dos outros vírus foi descrita em países do hemisfério norte, com destaque para o vírus sincicial respiratório no período de outono‐inverno, o influenza no inverno, o parainfluenza 1 e 2 no outono e o para influenza 3 na primavera.36,37
No Brasil, dados sobre a circulação viral foram coletados a partir do sistema brasileiro de vigilância epidemiológica sobre o vírus influenza e seus congêneres, no período entre 2000 e 2010. Amostras obtidas através de swab nasofaríngeo de pacientes em diferentes unidades sentinela distribuídas em todo o país foram submetidos à análise por imunofluorescência. Estas revelam uma predominância dos vírus influenza e sincicial respiratório, com circulação ao longo de todo o ano, com picos para este último entre março e junho, e entre maio e agosto para o vírus influenza.38 Não foram localizados dados referentes à circulação do rinovírus no nosso país.
Poucos dados publicados referentes à sazonalidade das exacerbações foram encontrados. Para fazer um paralelo entre a circulação de vírus e a ocorrência das exacerbações, nos voltamos para os dados obtidos em alguns estudos, como o realizado no Distrito Federal, que evidenciou uma maior frequência no mês de março.39 Ainda na região Centro‐Oeste, no estado de Goiás foi documentado maior frequência de sintomas respiratórios, não especificados como asma, de forma significativa no inverno.40 Observação acerca de distribuição da ocorrência de asma no estado de Minas Gerais também mostrou maior concentração no outono‐inverno, entre maio e julho,41 apontando para uma predominância de sintomas respiratórios e/ou asmáticos nas estações do outono‐inverno brasileiro.
Infecção viral e sensibilização alérgicaAlém da variação sazonal dos vírus, outros fatores envolvidos na gênese da exacerbação asmática podem explicar essa oscilação, como os aeroalérgenos e poluentes, que também variam ao longo das diferentes estações, sendo provável que a combinação destes e outros fatores resultem nos picos sazonais observados nas exacerbações. No mês de abril dos anos de 2006 e 2008, foi realizado um estudo na Coreia com o intuito de monitorar infecção viral e identificar sensibilização a aeroalérgenos em 58 crianças com asma aguda ou com diagnóstico de resfriado, cuja média de idade foi de 6,5 anos. As crianças com sensibilização alérgica comprovada tiveram o mesmo número de infecções virais, porém com mais sintomas do que as não sensibilizadas.30 Em outro estudo realizado na Inglaterra, em Manchester, foram avaliadas 84 crianças hospitalizadas por exacerbação que foram comparadas a crianças com asma estável e crianças internadas por doença não respiratória. Os autores concluíram que a associação entre infecção viral e exposição alergênica aumentou o risco de admissão hospitalar em 19,4 vezes.42
No Brasil, Camara e col.43 investigaram o papel das infecções virais, sensibilização e exposição a aeroalérgenos como fatores de risco para chiado em crianças com idade até 12 anos. Nos menores de dois anos, a frequência de positividade viral foi significativamente maior nos casos (60,8%) do que nos controles (13,3%). Já nos maiores não houve diferença significativa, sendo 69,7% dos casos e 43,4% dos controles positivos. Eles concluíram que, em menores de dois anos, os fatores de risco associados à sibilância foram a infecção viral e a história familiar de atopia, e entre as crianças maiores, a sensibilização a alérgenos inalantes foi o evento mais importante para desencadeamento das crises.
Poluentes e aeroalérgenosO efeito de poluentes presentes no ar é normalmente colocado em segundo plano, diante dos vírus ou aeroalérgenos. Entretanto, existem evidências de que a exposição aguda a poluentes específicos possa contribuir para os sintomas e gravidade das exacerbações. Por exemplo, a fumaça do cigarro induz a um modelo de inflamação não eosinofílica com relativa resistência aos corticosteroides.44 O tabagismo passivo é bastante frequente em residências de crianças asmáticas, causando impacto negativo no controle da doença. Na Escócia, legislação de 2006 que proibiu o tabagismo em lugares públicos teve impacto na redução das internações por asma em 18,2%.45
Outros poluentes parecem contribuir para as exacerbações da asma, como poluentes da combustão de gás natural e óleo de motor, como o dióxido de nitrogênio (NO2). Crianças passam a maior parte do tempo fora de casa e respiram maior quantidade de poluentes por quilograma de peso, comparado aos adultos, e o aumento dos níveis de NO2 está associado à gravidade das exacerbações induzidas por vírus. Isso ressalta um potencial sinergismo entre esses dois estímulos inflamatórios.44
Além disso, a exposição controlada em asmáticos demonstrou que o NO2 aumenta a resposta a alérgenos inalados. Uma coorte de 114 crianças asmáticas com idade entre oito e 11 anos foram monitorizadas quanto aos sintomas, medida do pico de fluxo expiratório, medida da exposição ao NO2 e presença de vírus na secreção nasal durante um período de 13 meses. Um ou mais vírus foram detectados em 78% dos episódios relatados de sintomas respiratórios e foi demonstrado que a alta exposição ao NO2 na semana antes do início de uma infecção respiratória viral esteve associada à gravidade da exacerbação.46
Estudo longitudinal nos Estados Unidos mediu a exposição à fumaça de cigarro em 1.444 crianças com asma e de NO2 em um subgrupo de 663 delas, durante um período de nove meses. Houve aumento de sintomas naquelas expostas ao NO2, mas apenas entre crianças não atópicas, com risco relativo 1,8 (IC 95% 1,1 a 2,8). Não houve associação entre sintomas e maior exposição à fumaça de cigarro.47 Dois estudos transversais compararam crianças expostas a diferentes índices de fumaça de cigarro, e demostraram que aquelas expostas a elevados índices apresentavam maiores escores de sintomas (p<0,01), sintomas noturnos (OR 3,4 (95% IC: 1,3 a 8,8) e necessidade de utilização de medicamentos de alívio (p=0,03) e de controle (p=0,02).48
Estudo em que 937 crianças com idade entre cinco e 11 anos foram randomizadas para intervenção com orientações de educação ambiental, objetivando redução da exposição, demostrou redução na exposição no grupo que recebeu as instruções por um período de 14 meses. O grupo intervenção apresentou menos dias com sintomas (p<0,01) ao final de um ano de seguimento, além de redução dos níveis de ácaros (Dermatophagoides farinae e Dermatophagoides pteronyssinus) e antígenos da barata em ambientes da casa.49
A sensibilização a fungos é prevalente em crianças asmáticas, embora poucos estudos tratem do assunto, comparado aos estudos relacionados aos ácaros. Um estudo demonstrou que crianças com teste cutâneo positivo para fungos tinham mais dias de sintomas comparadas àquelas com teste negativo (6,3 vs. 5,7 por duas semanas, p=0,04). Durante o período do estudo foram cultivados fungos do ambiente intra e extradomiciliar, e o aumento da exposição aos fungos esteve associado ao aumento de dias de sintomas e de consultas médicas não programadas por asma.44
Aspectos preventivos e terapêuticosA preponderância da participação dos vírus dentre os agentes infecciosos nas exacerbações torna injustificada a prescrição indiscriminada de antibióticos nesta situação, na grande maioria dos casos. Estudos prévios sugerem que a radiografia de tórax é utilizada de forma abusiva e desnecessária em crianças e adultos com asma aguda atendidos em unidades de emergência.50 Devido às alterações normalmente encontradas nos pacientes durante as crises, como hiperinsulflação, extravasamento de fluido e atelectasias associadas à hipoxemia,51 é comum a interpretação errônea desses achados como sinal de pneumonia e, consequentemente, uso desnecessário de antibióticos.
Estudo multicêntrico com 734 pacientes asmáticos atendidos em unidades de emergência avaliou a solicitação de exames complementares, nesse caso a radiografia de tórax e exames de sangue. Foram excluídos pacientes muito graves, os menores de um ano e aqueles com alguma comorbidade. Um total de 302 (41,0%) crianças foi submetido a testes complementares, como radiografia do tórax (27,0%) e exames de sangue (14,0%). Após a exclusão de pacientes febris ou hipoxêmicos,32,0% ainda foram submetidos a pelo menos um dos exames complementares.50 Apesar de não dispormos de dados brasileiros, a rotina dos serviços de pronto‐atendimento pediátrico no país parece não fugir a esta regra.
No sentido de prevenir a ampla disseminação dos agentes virais, devido à alta capacidade de disseminação viral através de fômites e perdigotos, a lavagem das mãos e o uso de máscaras respiratórias simples são estratégias que se mostraram eficazes.52 O afastamento de situações que propiciem o aglomerado de pessoas durante os períodos de maior circulação viral tem sido recomendado, embora sem estudos que comprovem a eficácia dessa estratégia.52,53 O uso de substâncias como preparações da planta equinácea e vitamina C tem sido avaliado; porém, estudos duplo‐cegos, controlados com placebo, não conseguiram documentar seu benefício.54
A prevenção das infecções virais por meio de vacinas tem sido a maneira mais efetiva de controlar as doenças causadas por vírus. No caso dos vírus respiratórios, com exceção à importante vacina contra o vírus influenza, não existem outras disponíveis, embora existam estudos em andamento para o desenvolvimento de vacinas para outros vírus respiratórios, principalmente o rinovírus. No entanto, sua grande diversidade antigênica dificulta o sucesso das pesquisas, e estudos recentes tentam estabelecer na estrutura viral um alvo antigênico mais adequado.54,55 A imunoglobulina específica para o vírus sincicial respiratório tem sido utilizada com sucesso na redução das hospitalizações por bronquiolite viral, e novas perspectivas para tratamento das exacerbações desencadeadas por infecções virais têm surgido a partir de estudos direcionados para agonistas sintéticos do receptor TLR3, agonista IFN‐ β, antagonistas da IL33 e IL25, entre outros.56,57
Para a maioria dos vírus respiratórios não existe tratamento específico. Alguns antivirais têm sido utilizados com sucesso, como no caso da infecção pelo vírus influenza, como a amantadina, rimantadina, fosfato de oseltamivir e zanamivir, sendo o último não indicado para pacientes asmáticos. A ribavirina é indicada para o tratamento de infecções graves causadas pelo vírus sincicial respiratório. Outros agentes antivirais estão sendo estudados e ainda não foram liberados para o uso clínico, como o pleconaril, vapendavir, pirodavir e rupintrivir.54
Os glicocorticoides possuem potente ação anti‐inflamatória e têm sido utilizados com sucesso no tratamento de manutenção nos asmáticos persistentes, controlando a inflamação e prevenindo as exacerbações. Alguns estudos tentam avaliar a sua ação na asma induzida por vírus. A supressão da liberação de mediadores pró‐inflamatórios induzida por infecção in vitro por rinovírus em células epiteliais brônquicas, como CCL5, CCL10, CXCL8 e IL6, bem como a redução de fatores associados ao remodelamento foi obtida após o uso da budesonida.58 Outros estudos in vitro documentam a ação de outros corticosteroides isoladamente ou em associação a broncodilatadores ou antagonistas dos leucotrienos na redução da liberação de várias moléculas inflamatórias, com potencial modulação dos efeitos deletérios dos vírus na população asmática.51,59 Apesar dos benefícios comprovados dos corticosteroides inalatórios no controle da asma desencadeada por múltiplos fatores, a sua ação nas exacerbações induzidas por vírus não está clara. O uso de baixas a moderadas doses de corticosteroides inalatórios como tratamento de manutenção não consegue prevenir o chiado intermitente induzido por vírus.60,61
Porém, melhores resultados têm sido obtidos com o uso intermitente de corticosteroides inalatórios em altas doses.62
DiscussãoO emprego de técnicas de detecção viral de elevadas sensibilidade e especificidade permitiu ampliar a identificação de alguns vírus respiratórios em crianças com exacerbação da asma. As reações de imunofluorescência direta ou indireta ainda têm grande importância prática, pois conseguem detectar um painel de sete vírus (influenza A e B, parainfluenza 1 a 3, adenovírus e vírus sincicial respiratório), sendo um método economicamente acessível, de rápida execução e boa sensibilidade, principalmente em crianças.18 Atualmente, é utilizado pelo Ministério da Saúde (MS) na triagem dos vírus respiratórios para o diagnóstico da síndrome gripal aguda grave e da síndrome gripal nas unidades sentinelas. As técnicas de amplificação de ácido nucleico (RT‐PCR) são mais dispendiosas, porém mais sensíveis, sendo utilizadas em pesquisas e atualmente também utilizadas pelo MS para a identificação e genotipagem do vírus influenza.38 Além disso, permitem identificar alguns vírus de significativa importância clínica e epidemiológica, como o rinovírus e o bocavírus, não identificado por imunofluorescência.17,54
Quanto à forma de obtenção da amostra, vale ressaltar a questão controversa do swab nasofaríngeo na pesquisa viral. Embora tenha se consolidado na pesquisa de infecções bacterianas (S. pneumoniae e S. aureus), o seu papel na investigação viral ainda merece algumas considerações. Concordamos que, do ponto de vista prático, é mais factível, dispensando o uso de sistema de aspiração, sondas e treinamento mais especializado, quando comparado ao aspirado ou lavado; porém, somente aqueles com tecnologia mais avançada (swab floculado – flocked swab), que proporcionam melhor captação e liberação das células e, consequentemente dos vírus, têm equivalência ao aspirado na qualidade da amostra. Entretanto tal swab não é rotineiramente utilizado nos serviços e nas pesquisas em nosso meio.38
No que se refere à relação entre a infecção viral e a exacerbação da asma, observamos ampla variação em relação aos métodos dos estudos que realizaram pesquisa de infecção viral em crianças asmáticas exacerbadas, por nós avaliados. Por exemplo, o tamanho da amostra variou entre os estudos de 58 a 1.052 casos, e a faixa etária, desde zero a 17 anos. Este dado é importante dada à dificuldade na definição de asma em menores de três anos, o que deve ser considerado na seleção dos casos.2,21 Além do mais, sabemos da existência de considerável diferença entre as faixas etárias e os vírus mais prevalentes, como é o caso do vírus sincicial respiratório.60 Em relação aos métodos de coleta da secreção respiratória dentre os estudos citados, não houve uniformidade, sendo que o aspirado foi utilizado em 43,8% dos estudos, o swab em 31,6%, ambos em 25%, e o flocked swab em nenhum deles. Houve ampla variação quanto aos métodos de detecção e em relação a alguns desfechos.
Além dessas diferenças na forma de obtenção das amostras, ressaltamos que todos esses estudos são transversais, não permitindo o estabelecimento de uma associação causa‐efeito entre a infecção viral e o desencadeamento da exacerbação podendo sugerir tal ligação. Em relação aos outros fatores sabidamente associados ao descontrole da asma, como alérgenos e irritantes, a maioria dos estudos não incluiu essas variáveis na avaliação. Quando ao processo inflamatório típico da asma associa‐se uma infecção respiratória viral, há uma tendência à maior gravidade, duração e pior resposta ao tratamento convencional do episódio agudo.32,33 Os mecanismos envolvidos ainda necessitam de elucidação definitiva, havendo indícios do efeito sinérgico entre a infecção viral e a inflamação alérgica das vias aéreas na patogênese da exacerbação.30,43
Outra questão pertinente é o papel dos corticosteroides inalados na atenuação do quadro inflamatório desencadeado pelos vírus, também pouco mencionada nesses estudos. A sua ação no controle e redução de morbidade associada à asma já é bem estabelecida,2 porém, na prevenção do chiado induzido por vírus ainda é assunto controverso. Sua eficácia no processo inflamatório desencadeado por vírus tem sido demostrada em estudos in vitro,51,58,59 entretanto, estudos que avaliam o seu benefício clínico apresentam resultados ainda não conclusivos.61,62
Independentemente da direção da interação vírus‐alérgeno, achados atuais sugerem fortemente que uma estratégia adequada para prevenir exacerbações induzidas por vírus deverá ser focada em duas vias, a saber, a melhora da resposta antiviral e a redução da sensibilização alérgica ou inflamação. Esta última pode ser obtida com o tratamento adequado do asmático de risco com medicações que reduzam a inflamação da via aérea. Por outro lado, as medidas preventivas de aquisição da infecção viral e o seu diagnóstico em tempo hábil possibilitam o manejo adequado das exacerbações e a redução do número de internações e de exames complementares desnecessários, especialmente naquelas crianças que se apresentam febris no momento da avaliação.
A relação entre a infecção viral e a asma na infância ainda apresenta vários pontos não claramente respondidos, principalmente o real papel dos vírus no desencadeamento das exacerbações e dos corticosteroides inalatórios na sua atenuação.
FinanciamentoFundação de Amparo à Pesquisa do Estado de Goiás (No 20120267001128).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Ao Laboratório de Virologia do Instituto de Patologia Tropical e Saúde Pública do IPTSP da Universidade Federal de Goiás.
Como citar este artigo: Costa LD, Costa PS, Camargos PA. Exacerbation of asthma and airway infection: is the virus the villain? J Pediatr (Rio J). 2014;90:542–55.
Estudo conduzido no Departamento de Pediatria, Universidade Federal de Goiás (UFG), Goiânia, GO, Brasil.