To longitudinally assess bone mineral content (BMC), bone mineral density (BMD), and whole‐body lean mass obtained through bone densitometry by dual‐energy X‐ray absorptiometry (DXA) in preterm newborns (PTNs) and compare them with full‐term newborns (FTNs) from birth to 6 months of corrected postnatal age.
MethodsA total of 28 adequate for gestational age (AGA) newborns were studied: 14 preterm and 14 full‐term newborns. DXA was used to determine BMC, BMD, and lean mass in three moments: 40 weeks corrected post‐conceptual age, as well as 3 and 6 months of corrected postnatal age. PTNs had gestational age ≤ 32 weeks at birth and were fed their mother's own milk or milk from the human milk bank.
ResultsAll infants had an increase in BMC, BMD, and lean body mass values during the study. PTNs had lower BMC, BMD, and lean mass at 40 weeks of corrected post‐conceptual age in relation to FTNs (p<0.001, p<0.001, p=0.047, respectively). However, there was an acceleration in the mineralization process of PTNs, which was sufficient to achieve the normal values of FTNs at 6 months of corrected age.
ConclusionsThis study suggests that bone densitometry by dual‐energy X‐ray absorptiometry is a good method for the assessment of body composition parameters at baseline, and at the follow‐up of these PTNs.
Avaliar longitudinalmente o conteúdo mineral ósseo (CMO), a densidade mineral óssea (DMO) e a massa magra do corpo inteiro obtidos através da densitometria óssea de dupla absorção de Raios‐X (DXA) em recém‐nascidos pré‐termo (RNPT) e comparar com seus pares a termo (RNT) desde o nascimento até 6 meses de idade pós‐natal corrigida.
MétodosForam estudados 28 recém‐nascidos adequados para a idade gestacional: 14 recém‐nascidos pré‐termo e 14 recém‐nascidos a termo. Utilizando‐se a DXA, foram determinados CMO, DMO e massa magra em três momentos: 40 semanas de idade pós‐concepcional corrigida, 3 e 6 meses de idade pós‐natal corrigida. Os recém‐nascidos pré‐termo apresentavam ao nascimento uma idade gestacional igual ou inferior a 32 semanas e receberam leite da própria mãe ou leite humano de banco.
ResultadosTodos os recém‐nascidos apresentaram um aumento nos valores de CMO, DMO e massa magra durante o estudo. Os recém‐nascidos pré‐termo apresentaram menor CMO, DMO e massa magra, com 40 semanas de idade pós‐concepcional corrigida, em relação aos recém‐nascidos a termo (p<0,001, p<0,001, e p=0,047, respectivamente). Entretanto, houve uma aceleração no processo de mineralização nos pré‐termos, suficiente para atingirem os valores normais do recém‐nascidos a termo aos 6 meses de idade corrigida.
ConclusõesEste estudo sugere que a densitometria óssea de dupla absorção de Raios‐X constitui um bom método para a avaliação dos parâmetros de composição corporal no início e no seguimento destes recém‐nascidos pré‐termo.
A doença metabólica óssea é caracterizada por alterações de mineralização esquelética decorrentes do deficiente acréscimo do conteúdo mineral ósseo (CMO). No recém‐nascido pré‐termo (RNPT), o CMO é inversamente proporcional ao peso de nascimento e à idade gestacional; um CMO diminuído também está relacionado ao aporte inadequado de cálcio e fósforo na vida extrauterina.1–3
Os fatores de risco relacionados a uma mineralização inadequada são: muito baixo peso ao nascer, restrição de crescimento intrauterino, uso prolongado de nutrição parenteral, uso de diuréticos e glicocorticoides, displasia broncopulmonar, retardo na introdução da alimentação, baixa oferta mineral na dieta e longos períodos de imobilização.4–6 O uso do leite humano adicionado de suplemento é capaz de proporcionar crescimento e mineralização óssea adequados em curto prazo.7
A doença metabólica óssea do RNPT não tem apresentação clínica característica. Pode‐se observar desde uma parada no crescimento longitudinal, manutenção do perímetro cefálico, até sinais radiológicos semelhantes ao raquitismo, com fraturas espontâneas descritas em 10% dos RNPT de muito baixo peso ao nascer.8
Nos RNPT com deficiência mineral, alguns marcadores bioquímicos podem estar alterados. Observa‐se hipofosfatúria e hipercalciúria que antecedem as alterações séricas (redução de cálcio e fósforo e elevação da fosfatase alcalina) e radiológicas.5,9 Outros marcadores séricos ou urinários mais específicos, como a fosfatase alcalina específica do osso (BAP), deoxipiridinolina (DPD), osteocalcina, telopeptídeo C‐terminal do colágeno tipo I (CTX) e o peptídeo natriurético tipo C (CNP), podem ser utilizados para avaliação do crescimento e remodelamento ósseo.10–12
Além disso, a densitometria óssea de dupla absorção de Raios‐X (DXA) tem sido considerada como método de escolha padrão ouro para avaliar a mineralização óssea em recém‐nascidos, mostrando grande precisão e acurácia.4,10,11,13–15
O objetivo do presente estudo foi avaliar a mineralização óssea por DXA nos primeiros seis meses de idade corrigida em recém‐nascidos pré‐termo, comparados com recém‐nascidos a termo.
MétodosTrata‐se de um estudo longitudinal envolvendo recém‐nascidos admitidos na Unidade Neonatal do Hospital Universitário da Universidade de São Paulo (USP) com idade gestacional igual ou inferior a 32 semanas, seguidos no período de julho de 2006 a setembro de 2008. Como grupo controle, foi selecionado um grupo de recém‐nascidos a termo (RNT), nascidos no mesmo período.
Recém‐nascidos com malformações congênitas, cromossomopatias ou doenças genéticas foram excluídos, assim como os filhos de mães diabéticas. Foram também excluídos tanto os recém‐nascidos pequenos como os grandes para a idade gestacional. O consentimento livre e esclarecido foi obtido de todos os pais dos recém‐nascidos avaliados. O estudo foi aprovado pelo Comitê de Ética do Hospital Universitário da USP.
Neste período, 42 RN (17 RNPT e 25 RNT) foram selecionados. Dentre eles, 14 recém‐nascidos (3 RNPT e 11 RNT) foram excluídos por: não terem completado o seguimento (10); diagnóstico de cardiopatia grave (1); desnutrição (1); não consentimento por parte dos pais (1); e avaliação inadequada pela DXA (1). Após as exclusões, foram avaliados 28 recém‐nascidos: 14 pré‐termo (nove meninos e cinco meninas); e 14 a termo (dez meninos e quatro meninas). Os RNPT apresentaram idade gestacional entre 28,4 a 32,0 semanas (média de 31,1), e os RNT entre 38 a 41,8 semanas (média de 40,1). O peso ao nascer dos RNPT variou de 1.115g a 2.130g (média de 1.540g), e dos RNT variou de 2.900g a 3.700g (média de 3.260g). Todos apresentavam peso entre os percentis 10 e 90da curva de referência de Alexander et al.16
Cálculo da amostraDe acordo com os valores de referência do conteúdo mineral ósseo de recém‐nascidos pré‐termo e a termo, a variabilidade estimada é de aproximadamente 6,5g (DP=6,5g) na idade de 40 semanas corrigida.2 Supondo encontrar a diferença no CMO entre recém‐nascidos pré‐termo e a termo aos seis meses de seguimento de pelo menos 7g (sendo que a diferença inicial era de 10g entre os dois grupos), espera‐se uma melhora de pelo menos 30% nos pacientes pré‐termo, com poder de 80% e confiança de 95%. Com base neste cálculo, a amostra necessária para realização do estudo seria de 14 pacientes em cada grupo.
Os fatores de risco para uma mineralização inadequada (patologias e medicamentos) encontrados nos RNPT foram: sepse com hemocultura positiva foi observada em 28,5%; enterocolite necrosante (critérios de Bell) com tratamento clínico em 14,3%; e displasia broncopulmonar (necessidade de oxigenoterapia por 28 dias ou mais) em 35,7%. Do total de RNPT com displasia broncopulmonar, três receberam hidroclorotiazida e dois, furosemida. Onze receberam nutrição parenteral, sendo dois por menos de uma semana e nove entre uma semana e um mês, e o tempo médio de uso da nutrição parenteral foi de 12 dias. A dieta enteral foi introduzida no primeiro dia de vida. Durante a internação na Unidade Neonatal, todos os RNPT receberam leite humano, sendo tanto o da própria mãe como o do banco de leite do hospital. Apenas quatro dos sete RNPT com peso ao nascer inferior a 1.500g receberam leite humano suplementado com aditivo (FM85®) em leite materno ordenhado ou leite humano, pasteurizado e administrado através de sonda orogástrica ou em copo. Os três RN restantes apresentaram hipofosfatúria (fósforo urinário < 1mg kg–1 d–1), e por isso receberam oferta adicional de cálcio e fósforo para atingirem o consumo de 200mg de cálcio e 110mg de fósforo/kg por dia.9 Todos os recém‐nascidos (RNPT e RNT) receberam suplementação enteral de vitamina D na dose de 400UI/dia, a qual foi mantida durante os primeiros dois anos de idade.
Após a alta hospitalar, as crianças foram avaliadas mensalmente. Durante o período do estudo, todos os recém‐nascidos receberam leite humano exclusivo. As crianças com indicação de aditivação receberam uma solução composta de gluconato e cálcio e fosfato dibásico de cálcio entre as mamadas ao seio, sendo mantido durante os primeiros seis meses de vida (idade corrigida para os RNPT e idade cronológica para os RNT), não tendo sido introduzida alimentação complementar.
Todos os recém‐nascidos foram pesados em uma balança comercial eletrônica (modelo Baby, Filizola, São Paulo), e a estatura foi obtida através de régua antropométrica graduada em centímetros.
No grupo de RNPT foram realizadas dosagens séricas de cálcio, fósforo e fosfatase alcalina nas idades de 40 semanas pós‐concepcionais e com seis meses de idade pós‐natal corrigida. Além disso, determinamos a concentração de cálcio e fósforo em amostras de urina de 6 horas entre a 3a e a 4a semanas de vida (idade não corrigida).
No grupo de RNT foram realizadas dosagens séricas de cálcio, fósforo e fosfatase alcalina apenas na idade de 40 semanas pós‐concepcionais, pois a coleta sanguínea aos seis meses não foi aprovada pela comissão de ética.
Foi realizada a densitometria óssea no Laboratório de Metabolismo Ósseo da Disciplina de Reumatologia da Faculdade de Medicina da USP. Foram avaliados: conteúdo mineral ósseo (CMO); e densidade mineral óssea (DMO) e massa magra em três momentos: 40 semanas de idade pós‐concepcional corrigida, três e seis meses de idade pós‐natal corrigida. O CMO traduz a quantidade total de material (osso mineral) medida por absorciometria, em gramas. A DMO é o conteúdo mineral ósseo dividido pela área óssea, em grama por centímetro quadrado, e a massa magra é aquela livre de gordura.
Utilizou‐se um aparelho de dupla emissão de fonte de Raios‐X (DXA; Discovery A; Hologic Inc., Bedford, EUA) com o Infant Whole‐Body scanning mode (software versão 12.3.3; Hologic Inc.).
O software utilizado é considerado superior ao pediátrico para análise da mineralização óssea, com precisão validada tanto para o RNT como RNPT.17 Além disso, a técnica fan bean, utilizada no estudo, torna o scanner Discovery A mais preciso quando comparado à técnica anterior, pencil bean.18 O estudo de Blake et al. mostrou que o scanner Discovery A apresenta vantagens adicionais, pois requer menor dose de radiação em relação aos modelos Discovery W (Hologic Inc., Bedford, EUA) e QDR 4500 (Hologic Inc., Bedford, EUA) utilizados anteriormente. Para o RN, a dose de radiação efetiva é de 8,9μSv para o corpo inteiro, e de 7,5μSv para uma criança de um ano de idade.19
Os exames foram realizados sem sedação, logo após o aleitamento materno. O coeficiente de variação para a DMO de corpo inteiro foi de 0,004g/cm2 (0,4%), e a mínima variação significativa para os RN avaliados no estudo foi de 1,2% (95% de intervalo de confiança). Estes valores são apropriados, uma vez que na literatura são descritos valores de coeficiente de variação de 0,8 a 2,2%.20
Análise estatísticaA análise estatística foi realizada através do Statistical Analysis System, versão 9.1.3 (SAS Institute, Cary, NC, EUA), sendo que a ANOVA com medida repetida foi realizada no módulo PROC MIXED do SAS (SAS Institute, Cary, NC, EUA). Posteriormente à análise de variância foram realizadas comparações múltiplas de Tukey, que permitiram detectar onde se encontravam as diferenças. Para verificar associação de variáveis com o grupo foi utilizado o teste exato de Fisher. Foi adotado nível de significância de 5%.
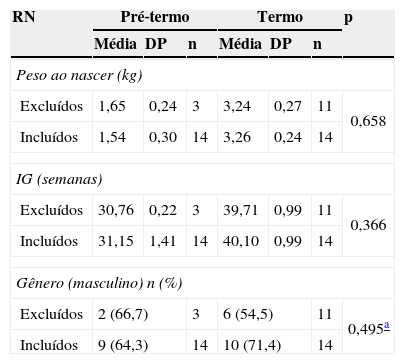
ResultadosForam avaliados 28 recém‐nascidos: 14 RNPT e 14 RNT. A idade gestacional dos RNPT variou de 28,4 a 32,0 semanas (média de 31,1 semanas). O peso ao nascer foi de 1.115 a 2.130g (média de 1.540g) e de 2.900 a 3.700g (média de 3.260g) para os RNPT e RNT respectivamente, sendo todos adequados para a idade gestacional. Foram excluídas 14 crianças (11 a termo e três pré‐termo), que não completaram as análises, sendo semelhantes em peso, idade gestacional e gênero àquelas incluídas no estudo (p>0,05) (tabela 1).
Comparação do peso ao nascer, idade gestacional e gênero das crianças excluídas e incluídas no estudo
| RN | Pré‐termo | Termo | p | ||||
|---|---|---|---|---|---|---|---|
| Média | DP | n | Média | DP | n | ||
| Peso ao nascer (kg) | |||||||
| Excluídos | 1,65 | 0,24 | 3 | 3,24 | 0,27 | 11 | 0,658 |
| Incluídos | 1,54 | 0,30 | 14 | 3,26 | 0,24 | 14 | |
| IG (semanas) | |||||||
| Excluídos | 30,76 | 0,22 | 3 | 39,71 | 0,99 | 11 | 0,366 |
| Incluídos | 31,15 | 1,41 | 14 | 40,10 | 0,99 | 14 | |
| Gênero (masculino) n (%) | |||||||
| Excluídos | 2 (66,7) | 3 | 6 (54,5) | 11 | 0,495a | ||
| Incluídos | 9 (64,3) | 14 | 10 (71,4) | 14 | |||
Resultado da ANOVA.
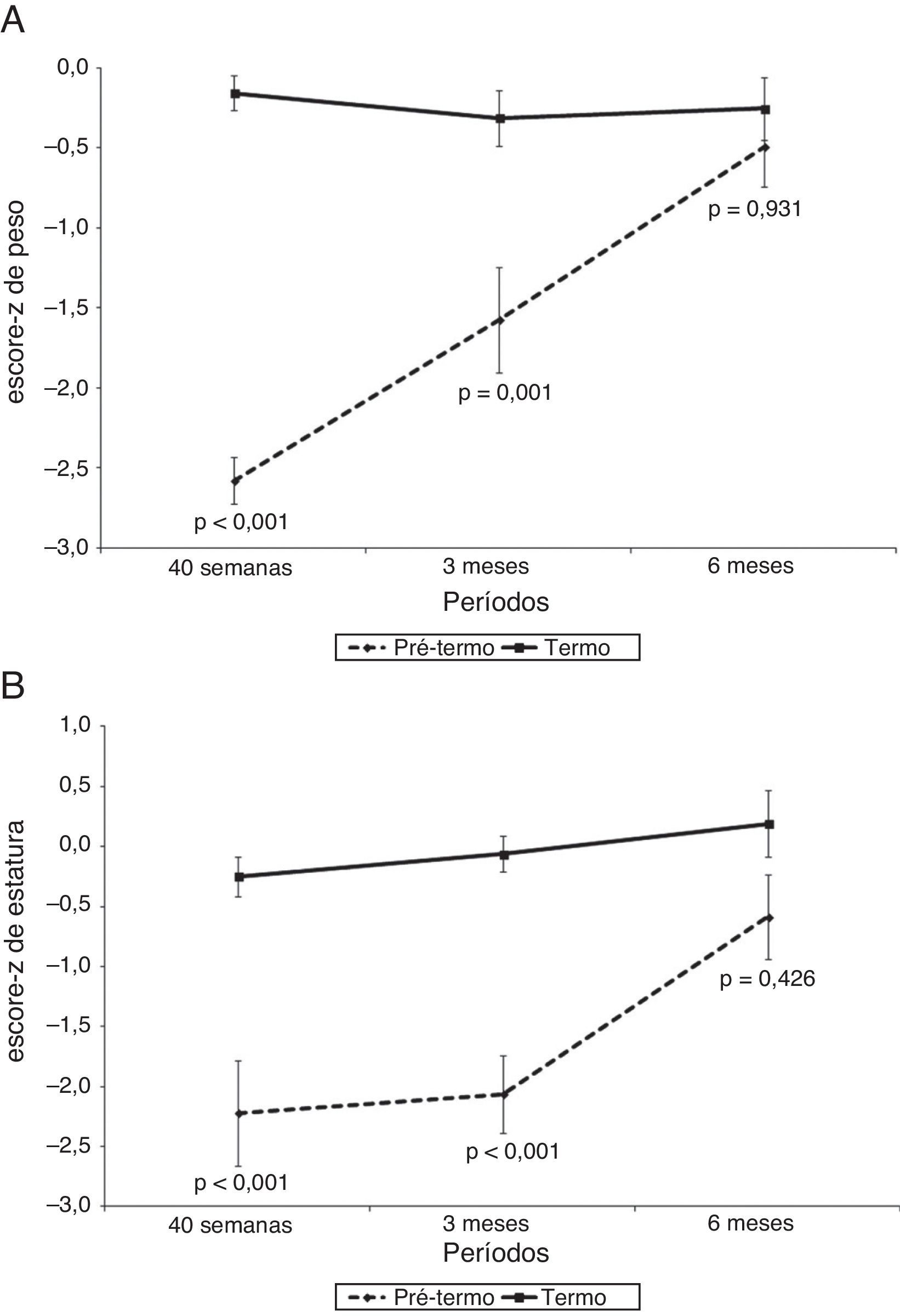
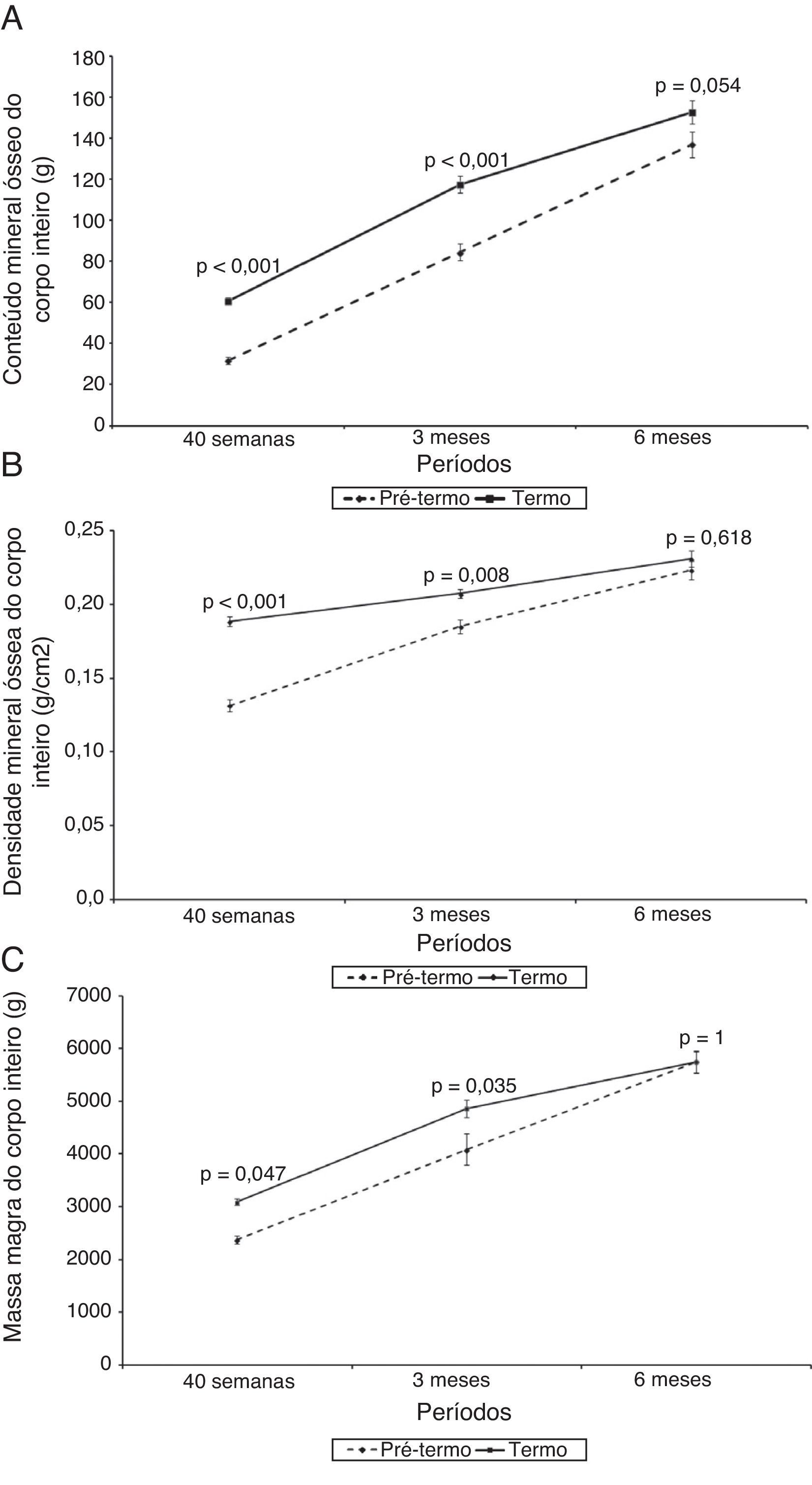
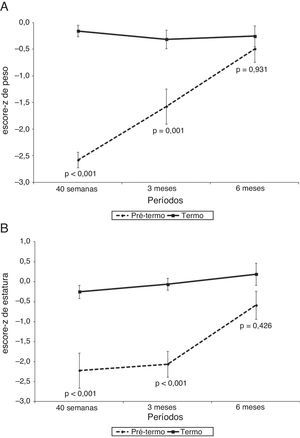
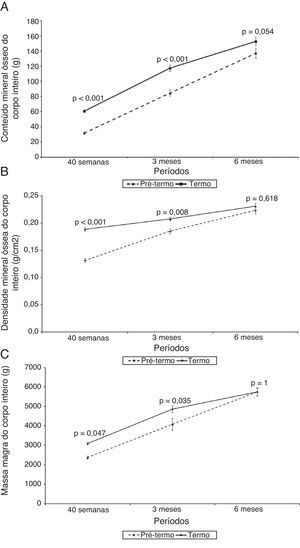
A figura 1 mostra o escore‐z do peso (kg) e estatura (cm) e a figura 2 mostra o CMO (g), o DMO (g/cm2) e a massa magra (g) dos RNPT e RN a termo ao longo do tempo de seguimento, com 40 semanas de idade pós‐concepcional, aos três e aos seis meses de idade gestacional corrigida. Em todos os momentos, foram observadas diferenças entre os RNPT e os RNT, tanto nas medidas de escores‐z de peso e estatura como também do CMO, do DMO e da massa magra. A comparação entre os RNPT e os RNT mostrou que, na avaliação inicial (40 semanas de idade pós‐concepcional), os RNPT tiveram menores valores em relação aos RNT: peso, escores‐z de peso e estatura, CMO, DMO e massa magra, (p<0,05) (tabela 2). Contudo, estas diferenças desapareceram na avaliação de seis meses de idade pós‐natal, quando todos os parâmetros mostraram médias semelhantes entre os RNPT e os RNT (p>0,05) (tabela 2).
Evolução do crescimento com escores‐z de peso e comprimento dos recém‐nascidos pré‐termo com relação a seus pares a termo, com 40 semanas, três meses e seis meses de idade corrigida.
N da amostra: 40 semanas (Pré‐termo e Termo)=14; 3 meses (Pré‐termo e A termo)=12; 6 meses (Pré‐termo e A termo)=13.
Evolução do conteúdo mineral ósseo (g), da densidade mineral óssea (g/cm2) e da massa magra (g) dos recém‐nascidos pré‐termo com relação a seus pares a termo avaliados pela DXA.
N da amostra: 40 semanas (Pré‐termo e A termo)=14; 3 meses (Pré‐termo e A termo)=12; 6 meses (Pré‐termo e A termo)=13.
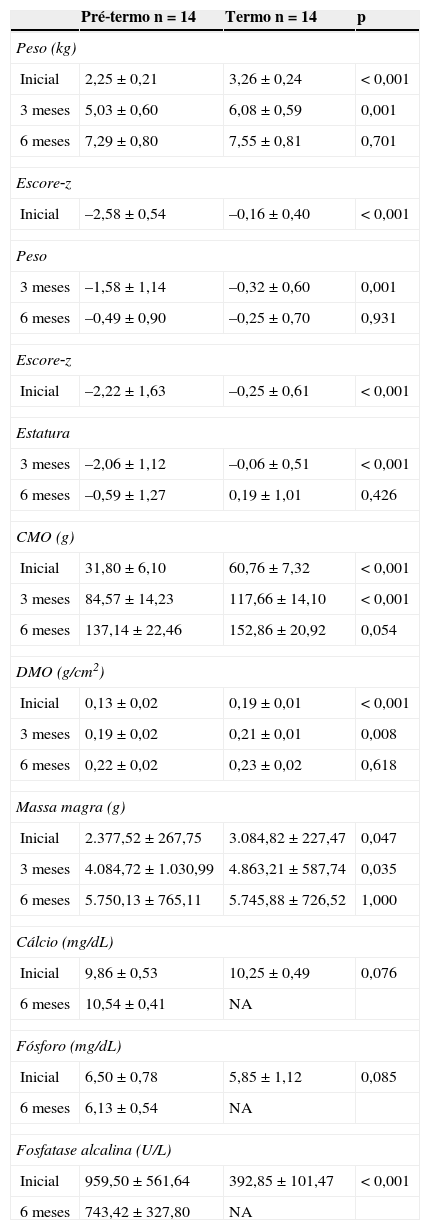
Medidas de peso, escore‐z de peso e estatura, conteúdo mineral ósseo (CMO), densidade mineral óssea (DMO), massa magra, cálcio, fósforo e fosfatase alcalina em recém‐nascidos pré‐termo e a termo com 40 semanas de idade gestacional corrigida (inicial)/ou ao nascimento, três e seis meses de idade corrigida
| Pré‐termo n=14 | Termo n=14 | p | |
|---|---|---|---|
| Peso (kg) | |||
| Inicial | 2,25±0,21 | 3,26±0,24 | < 0,001 |
| 3 meses | 5,03±0,60 | 6,08±0,59 | 0,001 |
| 6 meses | 7,29±0,80 | 7,55±0,81 | 0,701 |
| Escore‐z | |||
| Inicial | –2,58±0,54 | –0,16±0,40 | < 0,001 |
| Peso | |||
| 3 meses | –1,58±1,14 | –0,32±0,60 | 0,001 |
| 6 meses | –0,49±0,90 | –0,25±0,70 | 0,931 |
| Escore‐z | |||
| Inicial | –2,22±1,63 | –0,25±0,61 | < 0,001 |
| Estatura | |||
| 3 meses | –2,06±1,12 | –0,06±0,51 | < 0,001 |
| 6 meses | –0,59±1,27 | 0,19±1,01 | 0,426 |
| CMO (g) | |||
| Inicial | 31,80±6,10 | 60,76±7,32 | < 0,001 |
| 3 meses | 84,57±14,23 | 117,66±14,10 | < 0,001 |
| 6 meses | 137,14±22,46 | 152,86±20,92 | 0,054 |
| DMO (g/cm2) | |||
| Inicial | 0,13±0,02 | 0,19±0,01 | < 0,001 |
| 3 meses | 0,19±0,02 | 0,21±0,01 | 0,008 |
| 6 meses | 0,22±0,02 | 0,23±0,02 | 0,618 |
| Massa magra (g) | |||
| Inicial | 2.377,52±267,75 | 3.084,82±227,47 | 0,047 |
| 3 meses | 4.084,72±1.030,99 | 4.863,21±587,74 | 0,035 |
| 6 meses | 5.750,13±765,11 | 5.745,88±726,52 | 1,000 |
| Cálcio (mg/dL) | |||
| Inicial | 9,86±0,53 | 10,25±0,49 | 0,076 |
| 6 meses | 10,54±0,41 | NA | |
| Fósforo (mg/dL) | |||
| Inicial | 6,50±0,78 | 5,85±1,12 | 0,085 |
| 6 meses | 6,13±0,54 | NA | |
| Fosfatase alcalina (U/L) | |||
| Inicial | 959,50±561,64 | 392,85±101,47 | < 0,001 |
| 6 meses | 743,42±327,80 | NA | |
Dados apresentados como média±DP.
U/L, Unidades internacionais/litro; Inicial, 40 semanas de idade gestacional corrigida; NA, não avaliado.
Os parâmetros bioquímicos séricos não diferiram entre RNPT e RNT, exceto a fosfatase alcalina que foi estatisticamente superior nos RNPT em relação aos RNT (tabela 2). Apenas dois pacientes, ambos RNPT, apresentaram valores de fosfatase alcalina superiores a 1.200UI/L, valor considerado como sugestivo de doença metabólica óssea.
Entre os RNPT, três (21,4%) apresentaram resultados dos exames urinários sugestivos de síndrome da deficiência de fósforo (cálcio urinário>4mg/kg por dia e fósforo urinário<1mg/kg por dia). Por esse motivo, foi indicado o uso da solução oral de cálcio e fósforo, a qual foi mantida até a idade corrigida de seis meses.
Além desta suplementação com solução oral de cálcio e fósforo, o aditivo do leite humano foi utilizado em quatro RNPT, completando um total de 50% dos RNPT que necessitaram de suplementação do leite humano.
DiscussãoNo Brasil, este foi o primeiro estudo realizado sobre evolução da composição corpórea de recém‐nascidos pré‐termo e a termo, alimentados com leite humano, através da DXA após a alta hospitalar.
A mineralização óssea do recém‐nascido pré‐termo é abordada na literatura com relevância, e a DXA tornou‐se o método de escolha para avaliação da composição corporal dos recém‐nascidos.21–24
O nosso estudo demonstrou, através da avaliação por DXA, que crianças pré‐termo atingem um conteúdo mineral ósseo e uma densidade mineral óssea, após seis meses de idade corrigida, semelhantes às crianças a termo.
A amostra deste estudo constou de 14 recém‐nascidos pré‐termo, sendo a metade de muito baixo peso ao nascer. Para um crescimento adequado destas crianças com peso abaixo de 1,500g houve necessidade de um suporte nutricional, com uma oferta elevada de cálcio, fósforo e proteínas, uma vez que estas apresentaram um ritmo acelerado de remodelação óssea. Ao nascimento, estes RNPT apresentaram um menor conteúdo e densidade mineral ósseos, em relação ao RNT, que persistiram até os seis meses de idade corrigida. Esta observação está de acordo com a literatura, que aponta relatos de recém‐nascidos pré‐termo que, mesmo recebendo suplementação do leite humano, não melhoraram significantemente a mineralização óssea até atingirem o termo.4
Este estudo demonstrou, através da análise por DXA, que o processo de mineralização óssea apresentou uma aceleração importante no RNPT, porém ainda aquém dos RNT até os seis meses de idade corrigida, sugerindo o uso de suplementação de minerais por um período prolongado em recém‐nascidos de muito baixo peso.
Nos recém‐nascidos pré‐termo, as concentrações urinárias de cálcio e fósforo dependem de uma interação complexa entre ingesta, absorção e função renal destas crianças. Alguns autores recomendam a análise urinária destes íons como método para determinação da necessidade de suplementação, objetivando melhorar o conteúdo mineral ósseo e reduzir a incidência da doença metabólica óssea. No entanto, estas análises não parecem substituir as medidas diretas de CMO e DMO.9,25 De fato, no presente estudo encontramos que o CMO e a DMO foram significativamente menores no RNPT em relação ao RNT, mesmo naquelas crianças com dosagens urinárias e séricas normais.
Entre os marcadores séricos da doença metabólica óssea, o mais utilizado é a fosfatase alcalina. Entretanto, o valor de corte para definição da osteopenia é muito variável na literatura, entre 300 e 1.200 UI/L. Nesse sentido, Figueras‐Aloy et al. avaliaram a fosfatase alcalina e a DMO em 336 crianças pré‐termo, e consideraram doença metabólica óssea quando ambas as variáveis estivessem alteradas (fosfatase alcalina superior a 500 UI/L e DMO<0,068g/cm2) na alta hospitalar.26
Embora a doença metabólica óssea da prematuridade seja um processo autolimitado, a rápida recuperação do conteúdo mineral ósseo (catch up) tem inúmeras vantagens: melhora o crescimento em estatura e perímetro cefálico, previne fraturas e reduz a osteopenia do adulto.27
A massa magra também teve sua normalização no RNPT com seis meses de idade pós‐natal corrigida, um achado semelhante ao relatado por Cooke et al., porém em crianças avaliadas com 12 meses de idade corrigida.28 Estes autores encontraram que a massa magra foi menor no RNPT quando corrigida pela idade. Contudo, quando corrigida pelo peso, o RNPT apresentava valores de massa magra semelhante ao valor de referência para o RNT.
Assim sendo, o presente estudo demonstrou que recém‐nascidos pré‐termo apresentam recuperação do conteúdo e densidade mineral ósseos e da massa magra com seis meses de idade corrigida, e sugere a densitometria óssea como um bom método para a avaliação destes parâmetros no início e, principalmente, no seguimento dessas crianças.
FinanciamentoConselho Nacional de Ciência e Tecnologia (CNPQ). Processo n° 305691/2006‐6.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Quintal VS, Diniz EM, Caparbo VF, Pereira RM. Bone densitometry by dual‐energy X‐ray absorptiometry (DXA) in preterm newborns compared with full‐term peers in the first six months of life. J Pediatr (Rio J). 2014;90:556–62.