Childhood obesity has been associated with metabolic syndrome and cardiovascular diseases. This study aimed to compare plasma levels of traditional metabolic markers, adipokines and soluble tumor necrosis factor receptor type 1 (sTNFR1) in overweight, obese and lean children. We also assessed the relationships of these molecules with classical metabolic risk factors.
MethodsThis study included 104 children and adolescents, which were grouped as: lean (n=24), overweight (n=30), and obese subjects (n=50). They were subjected to anthropometrical, clinical and laboratorial measurements. All measurements were compared between groups. Correlation analyses were also performed to evaluate the association between clinical data, traditional metabolic markers, adipokines and sTNFR1.
ResultsFasting glucose, insulin, homeostatic model assessment of insulin resistance (HOMA‐IR), LDL‐cholesterol and triglycerides were comparable in lean, overweight and obese subjects. Plasma levels of sTNFR1 were similar in lean and overweight subjects, but significantly increased in obese group. Leptin, adiponectin and resistin levels did not differ when overweight were compared to obese subjects. However, all adipokines differed significantly when lean subjects were compared to overweight and obese individuals. Plasma levels of adiponectin were negatively correlated with body mass index (BMI), whereas leptin, resistin and sTNFR1 concentrations positively correlated with BMI.
ConclusionOur results showed significant differences in circulating levels of the evaluated markers when lean, overweight and obese individuals were compared, suggesting that these biomarkers may change from lean to overweight and from overweight to obesity.
A obesidade na infância tem sido associada à síndrome metabólica e a doenças cardiovasculares. O objetivo deste estudo foi comparar níveis plasmáticos de marcadores metabólicos tradicionais, adipocinas e do receptor solúvel de fator de necrose tumoral tipo 1 (sTNFR1) em crianças com sobrepeso, obesas e magras. Também avaliamos as relações dessas moléculas com fatores de risco metabólico clássicos.
MétodosEste estudo incluiu 104 crianças e adolescentes, agrupados da seguinte forma: indivíduos magros (n=24), com sobrepeso (n=30) e obesos (n=50). Eles foram submetidos a medições antropométricas, clínicas e laboratoriais. Todas as medições foram comparadas entre os grupos. Também foram feitas análises de correlação para avaliar a associação entre dados clínicos, marcadores metabólicos tradicionais, adipocinas e sTNFR1.
ResultadosGlicemia de jejum, insulina, modelo de avaliação da homeostase da resistência à insulina (HOMA‐IR), colesterol LDL e triglicerídeos foram comparáveis em indivíduos magros, com sobrepeso e obesos. Os níveis plasmáticos de sTNFR1 foram similares em indivíduos magros e com sobrepeso, porém significativamente maiores no grupo obeso. Os níveis de leptina, adiponectina e resistina não diferiram quando indivíduos com sobrepeso foram comparados aos obesos. Contudo, todas as adipocinas diferiram significativamente quando indivíduos magros foram comparados a indivíduos com sobrepeso e obesos. Os níveis plasmáticos de adiponectina estavam negativamente correlacionados ao índice de massa corporal (IMC), ao passo que as concentrações de leptina, resistina e sTNFR1 estavam positivamente correlacionadas ao IMC.
ConclusãoNossos resultados mostraram diferenças significativas nos níveis circulantes dos marcadores avaliados ao comparar indivíduos magros, com sobrepeso e obesos. Isso sugere que esses biomarcadores poderão mudar de indivíduos magros para indivíduos com sobrepeso e de indivíduos com sobrepeso para obesos.
A obesidade infantil aumenta em prevalência e está fortemente associada à obesidade na vida adulta.1,2 As crianças obesas correm risco de síndrome metabólica, doenças cardiovasculares e maior morbidez e mortalidade na vida adulta.3,4
Adipocinas são hormônios secretados pelo tecido adiposo que desempenham uma função na homeostase metabólica.5 A obesidade também induz a produção de citocinas inflamatórias e a infiltração de células imunitárias no tecido adiposo, o que determina um estado de inflamação crônica de baixo grau. A inflamação metabólica tem sido reconhecida como um mecanismo unificador, liga a obesidade a um amplo espectro de doenças, como aterosclerose, diabetes tipo 2 e complicações vasculares sistêmicas.5–7
O presente estudo analisou os níveis plasmáticos de adipocinas (adiponectina, resistina e leptina) e do receptor solúvel de fator de necrose tumoral tipo 1 (sTNFR1), a sensibilidade à insulina e o metabolismo lipídico em crianças e adolescentes com sobrepeso e obesos em comparação com indivíduos magros. Também avaliamos as relações dessas moléculas com fatores de risco metabólico clássicos. Os níveis circulantes de sTNFR1 são considerados marcadores inflamatórios, refletem a atividade do fator de necrose tumoral alfa (TNF‐α) melhor do que a mensuração do próprio TNF‐α.5–9 Trabalhamos com a hipótese de que as adipocinas, a inflamação de baixo grau, a sensibilidade à insulina e o metabolismo lipídico gradualmente mudam de magro para sobrepeso e de sobrepeso para obesidade.
MétodosIndivíduosEste estudo transversal apresentou uma amostra de conveniência de 104 crianças e adolescentes, entre 6 e 18 anos. Todos os indivíduos que atenderam aos critérios de inclusão e aceitaram fazer parte do estudo foram recrutados no Serviço de Endocrinologia Pediátrica e no Centro Geral de Pediatria de nossa instituição por 2 anos. Assim, foram avaliados 50 indivíduos obesos, 30 com sobrepeso e 24 magros.
Critérios de inclusãoO critério de obesidade foi o índice de massa corporal (IMC) acima do 95° percentil para idade e sexo de acordo com os padrões do Centro Nacional de Estatística da Saúde (NCHS).10 O sobrepeso foi definido como os percentis de IMC>85° e<95° para idade e sexo. O grupo de magros incluiu indivíduos com percentis de IMC>10° e<85° para idade e sexo.
Critérios de exclusãoForam excluídos indivíduos com doenças genéticas, obesidade secundária e comorbidades como diabetes, doenças cardíacas, pulmonares e neurológicas ou infecções agudas. Indivíduos que recebiam terapia médica também ficaram inelegíveis. O estado de saúde foi determinado por meio de histórico de saúde e relato dos pais ou autorrelato para descartar doenças crônicas ou agudas.
Protocolo do estudoNa internação, todos os indivíduos foram submetidos a exames clínicos, incluindo avaliação de peso, estatura, IMC, pressão arterial, circunferência abdominal (CA) e estágio puberal. O peso foi obtido com balanças digitais calibradas e arredondado para o 0,1kg mais próximo. A altura de pé foi considerada a média de três medidas, arredondadas para o milímetro mais próximo, com um estadiômetro fixo. A CA foi obtida com fita métrica, logo acima da borda lateral superior do ílio direito após uma expiração normal, e registrada no milímetro mais próximo, conforme recomendado pelo NCHS.11 O estágio puberal foi determinado de acordo com os critérios de Tanner12 e os pacientes foram classificados da seguinte forma: (i) pré‐púbere: meninos no estágio genital I, meninas no estágio de mama I; (ii) início da puberdade: meninos no estágio genital II‐III, meninas no estágio de mama II‐III; (iii) fim da puberdade/pós‐púbere: meninos no estágio genital ≥ IV, meninas no estágio de mama ≥ IV. As pressões arteriais sistólica e diastólica foram aferidas em três ocasiões, no braço direito, após um descanso de 10 minutos na posição supina, com um esfigmomanômetro calibrado, e a média dos dois valores foi calculada. As medições de pressão arterial também foram avaliadas de acordo com as recomendações do Quarto Relatório da Força‐Tarefa do Instituto Nacional de Coração, Pulmão e Sangue.13
Amostragem de sangueApós o consentimento informado, todos os indivíduos foram submetidos à coleta de sangue para medição de glicemia de jejum, insulina, colesterol total, colesterol da lipoproteína de alta densidade (HDL), colesterol da lipoproteína de baixa densidade (LDL), colesterol da lipoproteína de muito baixa densidade (VLDL), triglicerídeos, adiponectina, leptina, resistina e sTNFR1. A amostragem de sangue ocorreu em uma ocasião, após 12 horas de jejum noturno e por meio de punção venosa periférica. Uma amostra era para as medições de glicemia de jejum, insulina, colesterol total, colesterol HDL, colesterol LDL e triglicerídeos, de acordo com as recomendações padrão. A segunda amostra era para medições de adiponectina, leptina, resistina e sTNFR1. No que diz respeito a essas medições, as amostras foram imediatamente imersas em gelo e processadas em 30 minutos após a coleta. As células foram centrifugadas a 70g por 10 minutos a 4°C; então o plasma sobrenadante foi coletado e centrifugado novamente por mais 20 minutos a 1.300g para sedimentar plaquetas. O plasma livre de células foi dividido em amostras de 0,5ml armazenadas a ‐80°C até as medições.
MediçõesOs níveis de glicemia de jejum, colesterol e triglicerídeos foram determinados por ensaio colorimétrico enzimático (Advia Chemistry®; Siemens®; Los Angeles, EUA), ao passo que a insulina foi medida por quimioluminescência, valor de referência:<29μUI/mL (Immulite® 2000, Los Angeles, EUA). A resistência à insulina foi estimada pelo modelo de avaliação da homeostase da resistência à insulina (HOMA‐IR).14 Os níveis plasmáticos de adiponectina, leptina, resistina e sTNFR1 foram medidos por kits específicos de ensaio imunossorvente ligado a enzima (Elisa) (R&D Systems®, Minneapolis, EUA) de acordo com as instruções do fabricante. Todas as amostras foram analisadas em duplicata em um único ensaio para evitar variação entre ensaios. Nossa variação entre ensaios foi abaixo de 3%. Os limites de detecção foram de 5pg/mL para adiponectina, resistina e leptina e 10pg/mL para sTNFR1.
Análise estatísticaAs análises estatísticas foram feitas com a versão 19.0 do software SPSS (SPSS Inc., Chicago, EUA). O tamanho da amostra foi estimado em pelo menos 96 indivíduos, considerando um poder de 0,80 (1‐β), uma diferença de 20% entre grupos, um nível de significância (α) de 0,05 e um desvio padrão não superior a 25%. Todas as variáveis foram testadas para verificar a existência de normalidade de distribuição pelo teste de Shapiro‐Wilk. A associação entre variáveis dicotômicas foi avaliada pelo teste qui‐quadrado ou pelo teste exato de Fisher. As diferenças entre grupos foram comparadas com o teste de Kruskal‐Wallis e o pós‐teste de comparação múltipla de Dunn. A análise de correlação de Spearman foi feita para examinar relação entre adipocinas, níveis de sTNFR1 e idade, IMC, glicose, insulina, HOMA‐IR, colesterol HDL, colesterol LDL e triglicerídeos. O nível de significância foi estabelecido em p<0,05.
Questões éticasO Comitê de Ética de nossa instituição aprovou o estudo de acordo com o protocolo ETIC 0415/06. O consentimento informado foi obtido dos indivíduos e de seus pais. O protocolo de pesquisa não interferiu em qualquer receita médica e o acompanhamento foi garantido mesmo nos casos de recusa em participar do estudo.
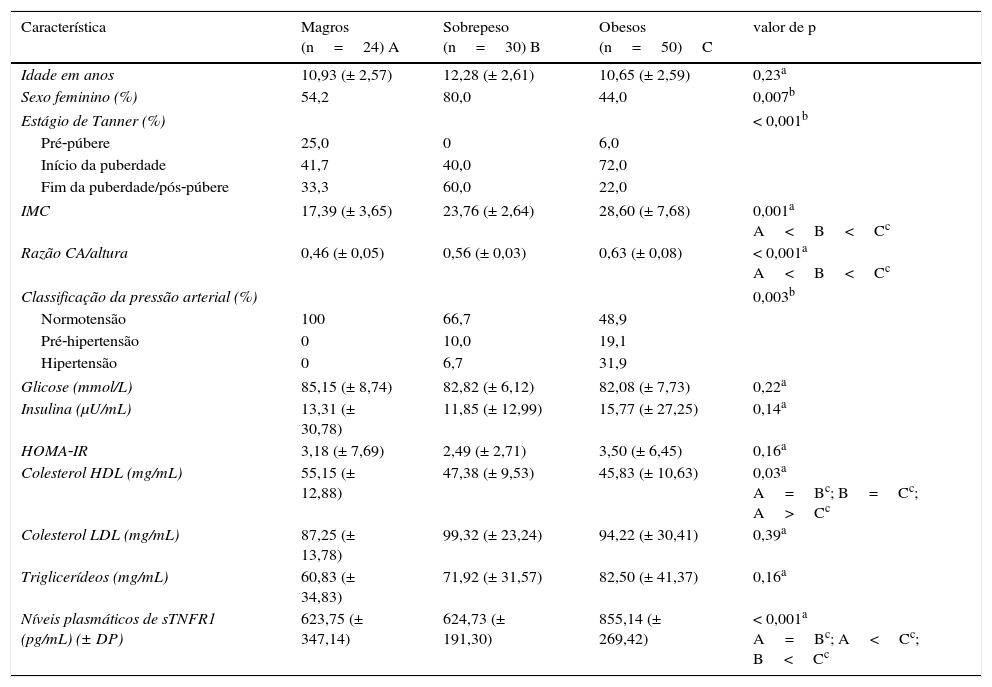
ResultadosCaracterísticas antropométricas, clínicas e laboratoriais em grupos obesos, com sobrepeso e magrosOs indivíduos foram alocados em três grupos: magros (n=24, 54,2% do sexo feminino), sobrepeso (n=30, 80% do sexo feminino) e obesos (n=50, 44% do sexo feminino). As características antropométricas, clínicas e laboratoriais estão na tabela 1. Os indivíduos magros e obesos foram comparáveis com relação a idade e distribuição de sexo. Houve uma maior frequência de mulheres no grupo sobrepeso em comparação com os indivíduos obesos (p=0,02). Na análise univariada, os grupos diferiram de acordo com o estágio de Tanner, IMC, CA/altura, classificação de pressão arterial e níveis de colesterol HDL (p<0,05, tabela 1). O grupo obeso apresentou IMC, razão CA/altura e prevalência de hipertensão significativamente maiores do que os indivíduos magros e com sobrepeso. Os níveis de colesterol HDL eram significativamente menores nos grupos obesos e sobrepeso do que nos indivíduos magros. Contudo, a glicemia de jejum, a insulina, o HOMA‐IR, o colesterol LDL e os triglicerídeos foram comparáveis em indivíduos magros, com sobrepeso e obesos (p>0,05, tabela 1).
Características clínicas e laboratoriais (média±DP) de indivíduos magros, com sobrepeso e obesos
| Característica | Magros (n=24) A | Sobrepeso (n=30) B | Obesos (n=50)C | valor de p |
|---|---|---|---|---|
| Idade em anos | 10,93 (± 2,57) | 12,28 (± 2,61) | 10,65 (± 2,59) | 0,23a |
| Sexo feminino (%) | 54,2 | 80,0 | 44,0 | 0,007b |
| Estágio de Tanner (%) | < 0,001b | |||
| Pré‐púbere | 25,0 | 0 | 6,0 | |
| Início da puberdade | 41,7 | 40,0 | 72,0 | |
| Fim da puberdade/pós‐púbere | 33,3 | 60,0 | 22,0 | |
| IMC | 17,39 (± 3,65) | 23,76 (± 2,64) | 28,60 (± 7,68) | 0,001a A<B<Cc |
| Razão CA/altura | 0,46 (± 0,05) | 0,56 (± 0,03) | 0,63 (± 0,08) | < 0,001a A<B<Cc |
| Classificação da pressão arterial (%) | 0,003b | |||
| Normotensão | 100 | 66,7 | 48,9 | |
| Pré‐hipertensão | 0 | 10,0 | 19,1 | |
| Hipertensão | 0 | 6,7 | 31,9 | |
| Glicose (mmol/L) | 85,15 (± 8,74) | 82,82 (± 6,12) | 82,08 (± 7,73) | 0,22a |
| Insulina (μU/mL) | 13,31 (± 30,78) | 11,85 (± 12,99) | 15,77 (± 27,25) | 0,14a |
| HOMA‐IR | 3,18 (± 7,69) | 2,49 (± 2,71) | 3,50 (± 6,45) | 0,16a |
| Colesterol HDL (mg/mL) | 55,15 (± 12,88) | 47,38 (± 9,53) | 45,83 (± 10,63) | 0,03a A=Bc; B=Cc; A>Cc |
| Colesterol LDL (mg/mL) | 87,25 (± 13,78) | 99,32 (± 23,24) | 94,22 (± 30,41) | 0,39a |
| Triglicerídeos (mg/mL) | 60,83 (± 34,83) | 71,92 (± 31,57) | 82,50 (± 41,37) | 0,16a |
| Níveis plasmáticos de sTNFR1 (pg/mL) (± DP) | 623,75 (± 347,14) | 624,73 (± 191,30) | 855,14 (± 269,42) | < 0,001a A=Bc; A<Cc; B<Cc |
DP, desvio padrão; HDL, lipoproteína de alta densidade; HOMA‐IR, modelo de avaliação da homeostase da resistência à insulina; IMC, índice de massa corporal; LDL, lipoproteína de baixa densidade; sTNFR, receptor solúvel de fator de necrose tumoral.
Como também mostra a tabela 1, os níveis plasmáticos de sTNFR1 eram semelhantes nos indivíduos magros e com sobrepeso (p>0,05), porém aumentaram significativamente em indivíduos obesos (p<0,01 no grupo com sobrepeso em comparação com o grupo obeso e p<0,001 no grupo magro em comparação com o grupo obeso).
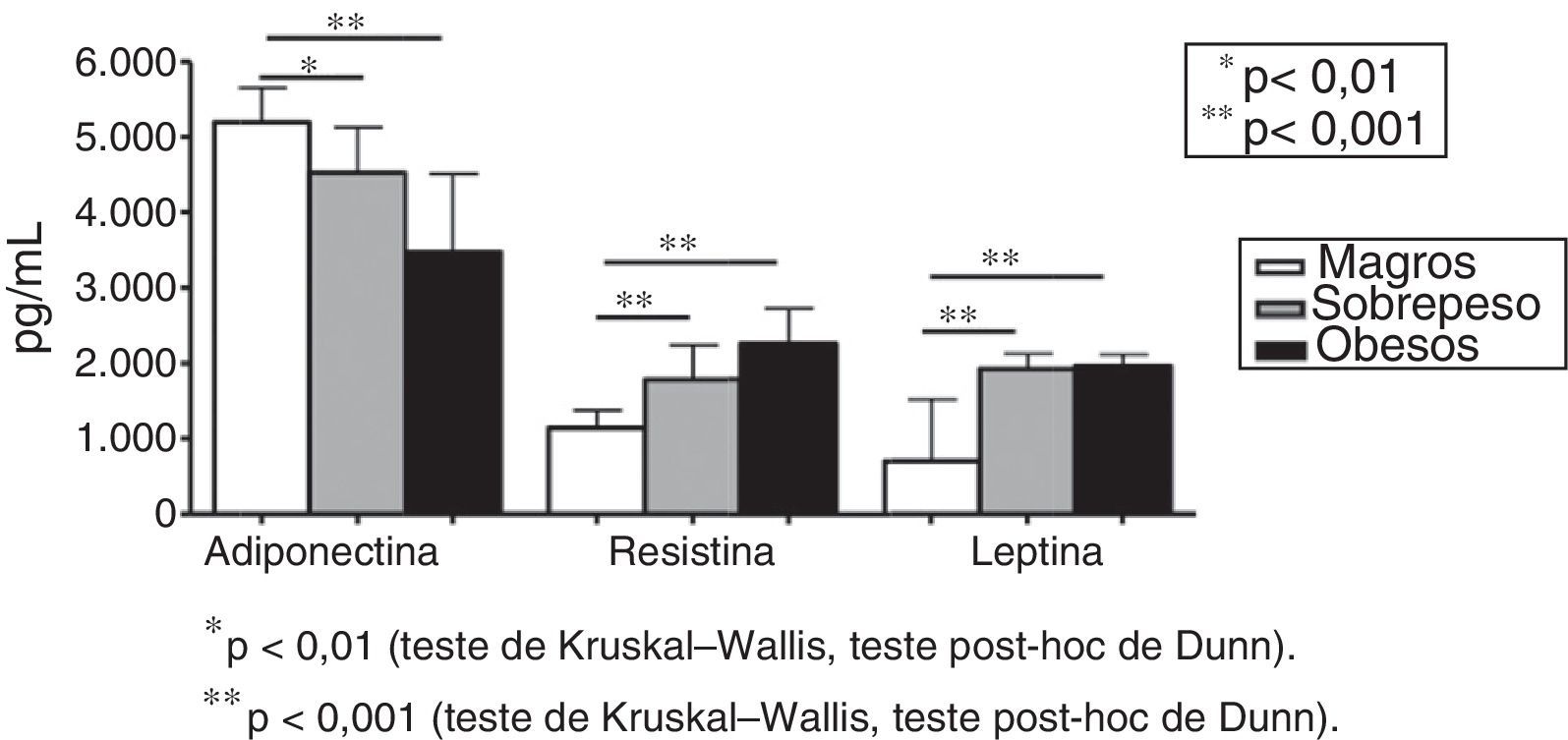
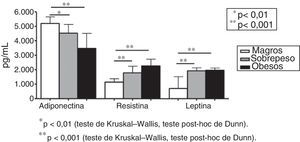
A figura 1 mostra os níveis plasmáticos de adiponectina, resistina e leptina em indivíduos obesos, com sobrepeso e magros. As adipocinas não foram diferentes na comparação entre indivíduos com sobrepeso e obesos (fig. 1). Os níveis de adiponectina (pg/mL) apresentaram redução em indivíduos com sobrepeso e obesos em comparação com indivíduos magros [5.199,18 em indivíduos magros; 4.537,57 no grupo com sobrepeso; 3.467,57 no grupo obeso (p<0,001 no grupo sobrepeso em comparação com o grupo magro e p<0,001 no grupo obeso em comparação com o grupo magro, fig. 1)]. Os níveis plasmáticos de resistina (pg/mL) apresentaram aumento nos grupos sobrepeso e obeso em comparação com indivíduos magros [1.140,38 no grupo magro; 1.788,51 no grupo sobrepeso; 2.256,39 no grupo obeso (p<0,001 no grupo sobrepeso em comparação com o grupo magro e p<0,001 no grupo obeso em comparação com o grupo magro, fig. 1)]. O mesmo perfil foi detectado nos níveis de leptina [702,54pg/mL no grupo magro; 1.933,04pg/mL no grupo sobrepeso; 1.965,91pg/mL no grupo obeso (p<0,001 no grupo sobrepeso em comparação com o grupo magro e p<0,001 no grupo obeso em comparação com o grupo magro, fig. 1)].
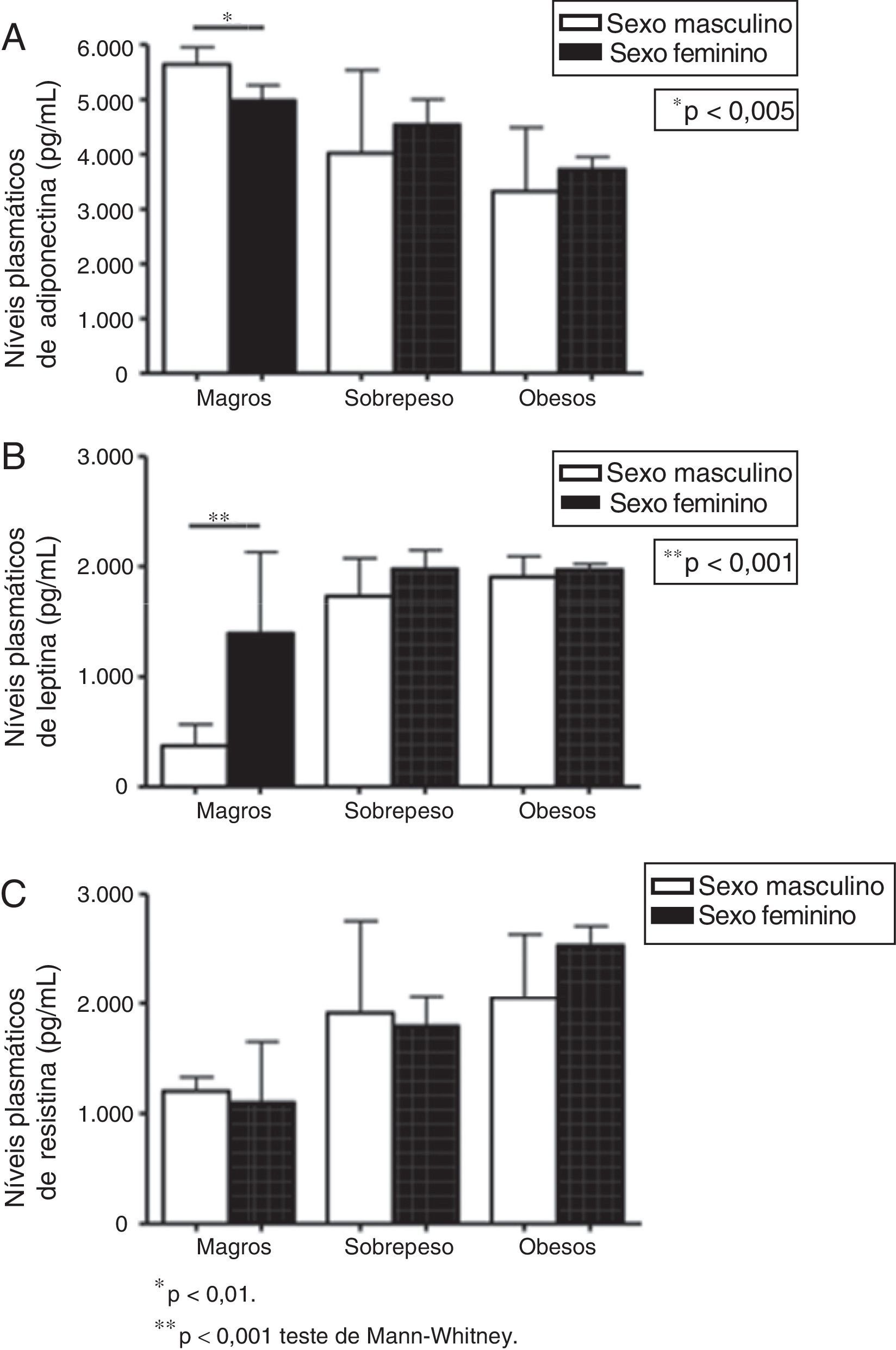
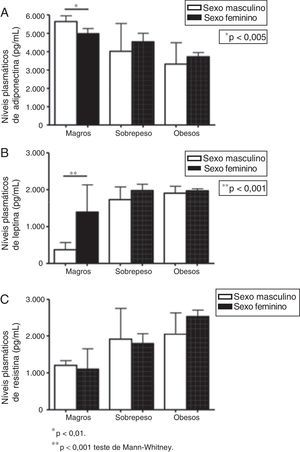
Para avaliar a influência do gênero, também comparamos os níveis plasmáticos de adipocinas em meninos e meninas de cada grupo (indivíduos magros, com sobrepeso e obesos), como mostra a figura 2. No grupo magro, os meninos apresentaram níveis mais altos de adiponectina (5.642,81 em comparação com 4.983,64pg/mL em meninas, p=0,005) e concentrações mais baixas de leptina do que as meninas (371,79pg/mL em meninos em comparação com 1.391,26pg/mL em meninas, p<0,001). Nenhum outro indicador foi diferente na comparação entre meninos e meninas. Nenhuma diferença foi detectada nos níveis de leptina, resistina e adiponectina nas comparações entre meninos e meninas nos grupos sobrepeso e obeso (fig. 2).
Para investigar uma possível interferência do estágio de Tanner, comparamos os níveis de adipocina nos estágios pré‐púbere, início da puberdade e fim da puberdade de cada grupo (indivíduos magros, com sobrepeso e obesos). Nenhuma diferença foi detectada nos níveis de resistina e adiponectina nas comparações entre as classificações dos estágios de Tanner em todos os grupos. Os níveis de leptina apresentaram um leve aumento de acordo com a progressão do estágio de Tanner apenas no grupo obeso (dados não apresentados).
Análise da correlaçãoConsiderando todos os indivíduos (n=104), os níveis plasmáticos de adiponectina estavam negativamente correlacionados com o IMC (p<0,001; ρ=‐0,402), a insulina; (p=0,02; ρ=‐0,247), o HOMA‐IR (p=0,02; ρ=‐0,263) e os triglicerídeos (p=0,02; ρ=‐0,261). Os níveis de leptina estavam positivamente correlacionados com a idade (p<0,001; ρ=0,425), o IMC (p<0,001; ρ=0,577), a insulina (p<0,001; ρ=0,500), o HOMA‐IR (p<0,001; ρ=0,497) e os triglicerídeos (p=0,003; ρ=0,325) e negativamente com o colesterol HDL (p=0,03; ρ=‐0,240). As concentrações de resistina estavam positivamente correlacionadas com o IMC (p<0,001; ρ=0,469) e negativamente com o colesterol HDL (p=0,02; ρ=‐0,247). Os níveis plasmáticos de sTNFR1 estavam positivamente correlacionados com o IMC (p<0,001; ρ=0,338) e negativamente com os níveis de adiponectina (p=0,03; p=‐0,212).
DiscussãoEste estudo mostrou que os níveis circulantes de adipocinas diferenciaram indivíduos magros de indivíduos com sobrepeso/obesos. Indivíduos com sobrepeso e obesos apresentaram níveis semelhantes de todas as adipocinas avaliadas. Os níveis de adiponectina diminuíram consideravelmente, ao passo que os níveis de leptina e resistina aumentaram consideravelmente nos grupos sobrepeso e obeso em comparação com o grupo magro. Os parâmetros metabólicos tradicionais foram semelhantes em todos os grupos, ao passo que os níveis de sTNFR1 foram mais elevados no grupo obeso em comparação com os grupos sobrepeso e magro.
Glicemia de jejum, insulina, HOMA‐IR, colesterol LDL e triglicerídeos são fatores usados tradicionalmente para avaliar riscos metabólicos e cardiovasculares na obesidade15 e seus valores médios foram comparáveis entre os grupos magro, sobrepeso e obeso em nosso estudo. Por outro lado, os níveis de sTNFR1 foram mais elevados em indivíduos obesos do que nos grupos magro ou sobrepeso. Níveis mais elevados de sTNFR1 justificam a ideia geral de estado inflamatório de baixo grau na obesidade.5,8,9 Adicionalmente, as adipocinas eram significativamente diferentes em indivíduos com sobrepeso e obesos em comparação com indivíduos magros. Isso sugere que as adipocinas poderão ser marcadores precoces de mudança de estado magro para sobrepeso/obeso, mesmo antes da ocorrência de alterações metabólicas. Da mesma forma, outros estudos demonstraram que os níveis séricos de leptina e resistina eram significativamente mais elevados em crianças obesas do que em crianças magras.16–18 Além disso, o IMC está correlacionado positivamente com a leptina e a resistina e negativamente com os níveis de adiponectina, conforme descrito anteriormente.17–20 Em contrapartida, outro estudo relatou níveis semelhantes de resistina em indivíduos obesos e magros.21 Contudo, quando as crianças obesas foram estratificadas pelos valores de resistência à insulina, as crianças obesas com resistência à insulina apresentaram maiores níveis de resistina do que as crianças com peso normal ou as crianças obesas sem resistência à insulina.21 Adamska et al. corroboraram nossos dados e relataram níveis elevados de sTNFR1 e níveis reduzidos de adiponectina em adultos com sobrepeso e obesos em comparação com indivíduos magros.9 Por outro lado, a relação entre o sTNFR e o IMC é controversa. Se considerarmos que também havia uma correlação positiva entre o IMC e o sTNFR1 em nossa amostra, Huang et al. não detectaram associação.18 Nenhuma correlação significativa foi observada anteriormente entre os sTNFRs e o perfil lipídico,18,22 ao passo que, em nosso estudo, o sTNFR1 foi negativamente correlacionado com o colesterol HDL.
Há uma insuficiência de dados sobre o papel das adipocinas na transição de magro para sobrepeso e de sobrepeso para obeso, principalmente em pacientes pediátricos sem síndrome metabólica ou comorbidades. Em comparação com o grupo de controle, descobrimos que os níveis circulantes de adipocinas já são alterados em indivíduos com sobrepeso, que apresentam um perfil semelhante ao do grupo obeso. Da mesma forma, Ko et al. mostraram que os níveis de leptina estavam associados ao risco cada vez maior das crianças com sobrepeso.17 A leptina é essencial para a regulação metabólica ao sinalizar a situação nutricional ao hipotálamo, que, por sua vez, produz neuropeptídios e neurotransmissores para modular a ingestão de alimentos e o gasto de energia.5,23 Os níveis de leptina estão positivamente correlacionados com a insulina, o HOMA‐IR e os triglicerídeos e negativamente com o colesterol HDL.17 Johnson et al. encontraram uma associação significativa entre os níveis de leptina e o aumento de massa de gordura em crianças.24 Duas possíveis explicações são que a resistência às ações da leptina no nível do receptor pode contribuir para o sobrepeso e as alterações homeostáticas precedem a ocorrência de obesidade.25,26
Neste estudo, os níveis plasmáticos de adiponectina estão negativamente correlacionados com a insulina, o HOMA‐IR e os triglicerídeos, ao passo que as concentrações de leptina estavam positivamente correlacionadas com os mesmos parâmetros metabólicos. Adamska et al. mostraram que a sensibilidade à insulina está correlacionada positivamente com a adiponectina e negativamente com os níveis de sTNFR1 e sTNFR2 em adultos obesos. Os receptores solúveis de TNF e a adiponectina também estão negativamente correlacionados com a sensibilidade à insulina e esses marcadores causam vários efeitos sobre o metabolismo da glicose e de lipídios na obesidade.9 Os níveis plasmáticos de adiponectina estavam negativamente correlacionados com a insulina, o HOMA‐IR e os triglicerídeos21,27 e positivamente com a sensibilidade à insulina.9 Nossos resultados também mostraram uma correlação negativa entre níveis de sTNFR1 e adiponectina, o que justifica a ideia geral de que o aumento das concentrações de adiponectina poderá compensar a inflamação de baixo grau. De fato, a adiponectina tem efeitos anti‐inflamatórios que contribuem para seu papel protetor contra estresse metabólico na obesidade.5,28 Nesse contexto, o aumento das concentrações de adiponectina poderá estar relacionado com um melhor perfil metabólico, apesar de uma massa de gordura maior. Contudo, a maior parte dos estudos incluiu adultos obesos que já mostravam alterações significativas nos parâmetros metabólicos, ao passo que nossa amostra apresentava apenas indivíduos pediátricos sem comorbidades ou síndrome metabólica. Portanto, a redução dos níveis de adiponectina parece ocorrer depois das alterações nas concentrações de leptina, porém poderá ocorrer antes das alterações metabólicas na obesidade pediátrica.
Os níveis circulantes de resistina também foram associados positivamente com a massa de gordura corporal.29,30 Da mesma forma, um estudo com crianças e adolescentes mexicanos encontrou uma correlação negativa entre níveis de resistina e colesterol HDL.18 Estudos também associaram altos níveis de resistina a um alto risco de doenças metabólicas e cardiovasculares.5 Da mesma forma que a adiponectina, a elevação dos níveis de resistina provavelmente precede as comorbidades relacionadas com a obesidade em pacientes pediátricos.
Estamos cientes das limitações de nosso estudo. Primeiro, o modelo transversal impede a avaliação de interações entre variáveis. Segundo, nossa amostra era relativamente pequena, considerava principalmente indivíduos com sobrepeso e magros. Terceiro, o uso de uma amostra de conveniência torna a homogeneidade entre os grupos selecionados muito difícil de ser alcançada, pois diferenças no sexo e estágio de Tanner poderão alterar os níveis de adipocina. Contudo, nenhuma diferença foi detectada nos níveis de resistina e adiponectina nas comparações entre meninos e meninas e entre o estágio de Tanner nos grupos sobrepeso e obeso. Os níveis de leptina apresentaram apenas um leve aumento de acordo com o estágio de Tanner no grupo obeso. Contudo, outros aspectos fortalecem nossos achados, como critérios de inclusão e exclusão rigorosos, protocolo bem estabelecido para medições e número representativo de indivíduos obesos.
Em conclusão, nossos achados sugerem que alterações nos níveis plasmáticos de adipocinas (leptina, resistina e adiponectina) podem aparecer antes de alterações em marcadores metabólicos tradicionais de obesidade em pacientes pediátricos. São necessários estudos longitudinais com amostras maiores para elucidar como as adipocinas interagem com marcadores clínicos, metabólicos e inflamatórios na obesidade pediátrica.
FinanciamentoBolsas da Fundação de Amparo à Pesquisa do Estado de Minas Gerais (Fapemig) e do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Mantovani RM, Rocha NP, Magalhães DM, Barbosa IG, Teixeira AL, Simões e Silva AC. Early changes in adipokines from overweight to obesity in children and adolescents. J Pediatr (Rio J). 2016;92:624–30.