To assess clinical and laboratory data, and acute kidney injury (AKI) in HIV‐infected children using and not using highly active antiretroviral therapy (HAART) prior to admission.
MethodsA retrospective study was conducted with HIV‐infected pediatric patients (<16 years). Children who were using and not using HAART prior to admission were compared.
ResultsSixty‐three patients were included. Mean age was 5.3±4.27 years; 55.6% were females. AKI was observed in 33 (52.3%) children. Patients on HAART presented lower levels of potassium (3.9±0.8 vs. 4.5±0.7mEq/L, p=0.019) and bicarbonate (19.1±4.9 vs. 23.5±2.2mEq/L, p=0.013) and had a higher estimated glomerular filtration rate (102.2±36.7 vs. 77.0±32.8mL/min/1.73m2, p=0.011) than those not on HAART. In the multivariate analysis, the use of HAART prior to the admission was a protective factor for AKI (p=0.036; OR=0.30; 95% CI=0.097–0.926).
ConclusionAKI is a common complication of pediatric HIV infection. Use of HAART prior to the admission preserved glomerular filtration and was a protective factor for AKI, but increased medication side effects, such as hypokalemia and renal metabolic acidosis.
Avaliar dados clínicos e laboratoriais, bem como ocorrência de lesão renal aguda (LRA), em crianças HIV positivas com e sem uso de terapia antirretroviral altamente ativa (TARV) antes da admissão.
MétodosEstudo retrospectivo em pacientes pediátricos HIV positivos (< 16 anos). Foram comparadas as crianças que estavam em uso com aquelas sem uso de TARV prévia à internação.
ResultadosForam incluídos 63 pacientes, com média de 5,3±4,27 anos, 55,6% do sexo feminino. LRA foi encontrada em 33 casos (52,3%). Os pacientes que usavam TARV apresentaram menores níveis de potássio (3,9±0,8 vs. 4,5±0,7 mEq/L, p=0,019) e bicarbonato (19,1±4,9 vs. 23,5±2,2 mEq/L, p=0,013), bem como maior taxa de filtração glomerular estimada (102,2±36,7 vs. 77,0±32,8mL/min/1,73m2, p=0,011), do que o pacientes sem TARV prévia. Na análise multivariada o uso de TARV prévia à internação foi fator protetor contra LRA (p=0,036; RC=0,30; IC de 95%=0,097‐0,926).
ConclusãoA LRA é uma complicação comum da infecção pediátrica pelo HIV. O uso de TARV antes da internação foi associado a melhor taxa de filtração glomerular e foi fator de proteção contra LRA, porém desencadeou efeitos colaterais como hipocalemia e acidose metabólica.
De acordo com o Programa das Nações Unidas sobre HIV/Aids (Unaids), estimou‐se que aproximadamente 35 milhões de pessoas em todo o mundo eram portadoras do HIV ou tinham a síndrome da imunodeficiência adquirida (Aids) em 2012. Além disso, o número anual de novas infecções por HIV em 2012 foi calculado em aproximadamente 2,5 milhões. Mais de 12% delas (330.000 casos em todo o mundo) ocorreram na população pediátrica com menos de 15 anos. Em 2011, 230.000 crianças morreram devido ao HIV/Aids ao redor do mundo.1
A prevalência de doenças renais em pacientes pediátricos infectados por HIV varia substancialmente entre regiões e períodos. Na era anterior à terapia antirretroviral altamente ativa (TARV), a maioria das crianças infectadas nos EUA costumava falecer de complicações não renais da Aids, como infecções oportunistas (IOs). Esse fenômeno ainda é comum em alguns países em desenvolvimento, onde essa terapia não está disponível para todos os pacientes. Contudo, após o estabelecimento da TARV em países desenvolvidos, o número de crianças infectadas por HIV que precisam de terapia renal substitutiva aumentou consideravelmente.2 A infecção pelo HIV com complicações renais atualmente está entre as dez doenças não infecciosas mais comuns, ocorre em crianças e adolescentes infectados pelo HIV no período perinatal na era da TARV, com uma taxa de incidência de 2,6 a cada 100 pacientes.3
Os pacientes com HIV têm risco elevado de desenvolver lesão renal aguda (LRA) e doença renal crônica (DRC) devido a vários fatores.4 Nesse contexto, o espectro de doenças renais na população pediátrica infectada por HIV é diferente de adultos e inclui: doenças glomerulares crônicas, como nefropatia associada ao HIV; doença renal do complexo imune associada ao HIV; alguns tipos de microangiopatias trombóticas, como formas atípicas de síndrome hemolítico‐urêmica e púrpura trombocitopênica; doenças tubulares e LRA.5
O objetivo deste estudo é avaliar os dados clínicos e laboratoriais, bem como a ocorrência de LRA, pelos critérios pediátricos modificados de RIFLE (risk, injury, failure, loss, end‐stage kidney disease) (pRIFLE) em crianças infectadas por HIV e comparar grupos de acordo com o uso de TARV antes de internação hospitalar.
Pacientes e métodosAmbiente e seleção de pacientesEste é um estudo retrospectivo feito com crianças infectadas por HIV internadas no Hospital São José de Doenças Infecciosas, no Nordeste do Brasil, de janeiro de 2007 a dezembro de 2012. Todas as crianças com menos de 16 anos com sorologia confirmada para infecção por HIV foram incluídas. Essa é a mesma faixa etária para a qual a equação de Schwartz foi validada.6 Os pacientes com histórico de doenças renais anteriores, hipertensão arterial, diabetes mellitus, nefrolitíase, uso de medicamentos nefrotóxicos (exceto TARV) e outras comorbidades que podem afetar a função renal foram excluídos.
Parâmetros estudadosForam analisadas características demográficas como idade e sexo, bem como o tempo de internação, coinfecções, uso de TARV e manifestações clínicas na internação, dados laboratoriais, exigência de diálise e mortalidade. As investigações clínicas incluíram um registro de todos os sinais e sintomas clínicos apresentados por pacientes na internação e durante o tempo de internação.
Os dados laboratoriais incluíram avaliações de creatinina sérica (Cr), ureia (Ur), sódio (Na), potássio (K), albumina (Alb), alanina aminotransferase (ALT), aspartato aminotransferase (AST), lactato desidrogenase (LDH), hemoglobina (Hb), hematócrito (Ht), plaquetas, leucócitos, linfócitos, pH sérico (pH), pressão parcial do CO2 (pCO2), bicarbonato (HCO3), pH da urina e densidade da urina. A carga viral média (CV) e a contagem de CD4 também foram avaliadas. Os valores de CV=100.000 cópias/mm3 e a contagem de CD4=200/mm3 foram estabelecidos como pontos de corte a fim de comparar pacientes com uso de TARV e pacientes sem uso de TARV, pois esses valores foram previamente associados ao desenvolvimento de LRA e a resultados insatisfatórios.7
DefiniçõesA lesão renal aguda foi definida de acordo com critérios pediátricos do RIFLE (pRIFLE) com o uso da equação de Schwartz para calcular a taxa de filtração glomerular estimada (TFGe).6 As categorias de pRIFLE incluem:8,9
- ‐
Risco: redução da TFGe em 25% ou diurese<0,5mL/kg/h por 8 horas.
- ‐
Lesão: redução da TFGe em 50% ou diurese<0,5mL/kg/h por 16 horas.
- ‐
Falência: redução da TFGe em 75% ou TFGe<35mL/min/1,73 m2 ou diurese<0,3mL/kg/h por 24 horas ou anúria por 12 horas.
- ‐
Perda: falência persistente>4 semanas.
- ‐
Estágio final da doença renal: falência persistente>3 meses.
Uma TFGe básica de 120mL/min/m2 foi atribuída a todas as crianças conforme relatado anteriormente, pois nenhuma das crianças apresentou níveis de creatinina sérica disponíveis medidos até 3 meses antes da internação.8,9 A TFGe das crianças foi calculada com a creatinina sérica na internação hospitalar. O percentual de queda da TFGe foi avaliado [100 x (TFGe básica ‐ TFGe na internação)/TFGe básica] para determinar a categoria pRIFLE. Os pacientes foram classificados de acordo com a categoria pRIFLE na internação. Devido à ausência de dados antropométricos nos prontuários, a estatura média de cada idade e sexo foi obtida de dados de Crescimento da Organização Mundial de Saúde (OMS) para calcular a TFGe.10,11
A oligúria foi definida como diurese<1mL/kg/h em neonatos (0 a 12 meses) e<0,5mL/kg/h em crianças que haviam sido hidratadas de maneira efetiva. A diálise foi indicada nos pacientes que continuaram oligúricos após a hidratação efetiva, nos casos em que a uremia foi associada a insuficiência respiratória hemorrágica ou grave e naqueles com hipercalemia ou acidose metabólica refratária a tratamento clínico. A diálise foi indicada nos pacientes que continuaram oligúricos após a hidratação efetiva, com rápida elevação do nitrogênio ureico sanguíneo (estado de hipercatabolismo), nos casos em que a uremia foi associada a insuficiência respiratória hemorrágica ou grave e naqueles com hipercalemia ou acidose metabólica refratária a tratamento clínico.
As crianças foram divididas em dois grupos: aquelas que usavam a TARV antes da internação e aquelas que não estavam. Os dados demográficos, clínicos e laboratoriais dos dois grupos foram comparados.
TratamentoOs medicamentos da TARV usados no tratamento foram: zidovudina (AZT), didanosina (ddI), lamivudina (3TC), estavudina (D4T), abacavir (ABC), fumarato de tenofovir disoproxil (TDF), lopinavir (LPV), nelfinavir (NFV), saquinavir (SQV), ritonavir (RTV), amprenavir (APV), efavirenz (EFZ) e nevirapina (NVP), de acordo com protocolos do Ministério da Saúde.
Análise estatísticaO software SPSS para Windows (IBM Corp. Released 2011. IBM SPSS Statistics for Windows, versão 20.0, EUA) foi usado para a análise estatística. O teste qui‐quadrado foi usado para analisar as frequências nos grupos dos pacientes. Todas as variáveis independentes foram testadas para verificar a distribuição normal com o teste de Kolmogorov‐Smirnov. As diferenças entre duas variáveis independentes foram avaliadas com o teste t de Student ou o teste de Mann‐Whitney, conforme adequado. Os dados foram expressos em médias±DP e p ≤ 0,05 foi considerado estatisticamente significativo.
Uma regressão logística multivariada foi feita para analisar os possíveis fatores de risco associados à LRA. Inicialmente, uma análise univariada foi feita com todas as variáveis dicotômicas disponíveis, incluindo sexo, presença de cada sintoma e comorbidades, uso da TARV, carga viral>100.000 cópias e contagem de CD4<200/mm3. Esses parâmetros foram avaliados para verificar a diferença significativa entre grupos com LRA e sem LRA por meio do teste qui‐quadrado e das tabulações cruzadas. Em segundo lugar, os parâmetros incluídos no modelo multivariado foram aqueles que apresentaram nível de significância (p ≤ 0,05) na análise univariada. Apenas um deles (uso de TARV) foi significativamente diferente. Assim, ele foi avaliado como fator de risco de LRA por meio do cálculo da razão de chance (RC) ajustada e intervalo de confiança de 95% (IC de 95%).
ÉticaO protocolo do estudo foi analisado e aprovado pelos Comitês de Ética do Hospital Universitário Walter Cantídio e do Hospital São José de Doenças Infecciosas.
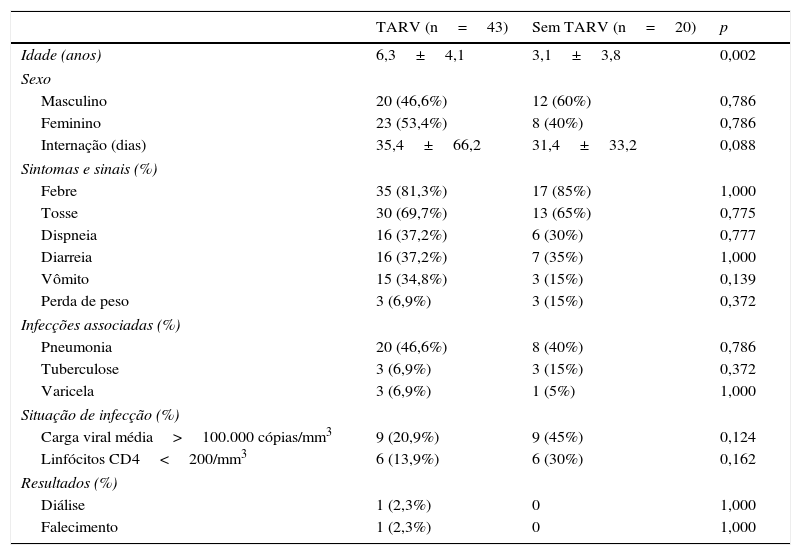
ResultadosForam incluídas 63 crianças, com média de 5,3±4,27 anos (intervalo de 1 a 14); 44 (69,8%) tinham menos de 7; 35 (55,6%) eram do sexo feminino; 43 (68,3%) usavam TARV antes da internação, ao passo que 20 (31,7%) não usavam. Entre todos os pacientes que usavam TARV, 37 (58,7%) usavam Lamivudina, 31 (49,2%) Zidovudina, 16 (35,4%) Lopinavir e cinco (7,9%) Tenofovir. O tempo de internação variou entre 1 e 352 dias (média de 34,2±57,8 dias). Um paciente precisou de hemodiálise (3,2%) e um faleceu (3,2%). Nenhum precisou de tratamento intensivo. Apenas 16 tiveram amostras de urina coletadas. Uma delas apresentou hematúria microscópica e três apresentaram proteinúria, porém nenhuma proteinúria na faixa nefrótica. A comparação de dados demográficos, principais sinais e sintomas, infecções relacionadas, estado imunológico e resultados entre os dois grupos está resumida na tabela 1. Entre todos os pacientes, as infecções oportunistas (IOs) mais frequentes foram pneumonia (44,4%), tuberculose pulmonar (9,5%) e varicela‐zóster/catapora (6,3%).
Dados demográficos, manifestações clínicas, situação de infecção e resultados de crianças portadoras de HIV de acordo com o uso de TARV
| TARV (n=43) | Sem TARV (n=20) | p | |
|---|---|---|---|
| Idade (anos) | 6,3±4,1 | 3,1±3,8 | 0,002 |
| Sexo | |||
| Masculino | 20 (46,6%) | 12 (60%) | 0,786 |
| Feminino | 23 (53,4%) | 8 (40%) | 0,786 |
| Internação (dias) | 35,4±66,2 | 31,4±33,2 | 0,088 |
| Sintomas e sinais (%) | |||
| Febre | 35 (81,3%) | 17 (85%) | 1,000 |
| Tosse | 30 (69,7%) | 13 (65%) | 0,775 |
| Dispneia | 16 (37,2%) | 6 (30%) | 0,777 |
| Diarreia | 16 (37,2%) | 7 (35%) | 1,000 |
| Vômito | 15 (34,8%) | 3 (15%) | 0,139 |
| Perda de peso | 3 (6,9%) | 3 (15%) | 0,372 |
| Infecções associadas (%) | |||
| Pneumonia | 20 (46,6%) | 8 (40%) | 0,786 |
| Tuberculose | 3 (6,9%) | 3 (15%) | 0,372 |
| Varicela | 3 (6,9%) | 1 (5%) | 1,000 |
| Situação de infecção (%) | |||
| Carga viral média>100.000 cópias/mm3 | 9 (20,9%) | 9 (45%) | 0,124 |
| Linfócitos CD4<200/mm3 | 6 (13,9%) | 6 (30%) | 0,162 |
| Resultados (%) | |||
| Diálise | 1 (2,3%) | 0 | 1,000 |
| Falecimento | 1 (2,3%) | 0 | 1,000 |
Idade e tempo de internação apresentados como média±DP. O resto dos dados é apresentado como um número (percentual). Foram usados o teste t de Student e o teste qui‐quadrado. Os valores de p ≤ 0,05 foram considerados estatisticamente significativos.
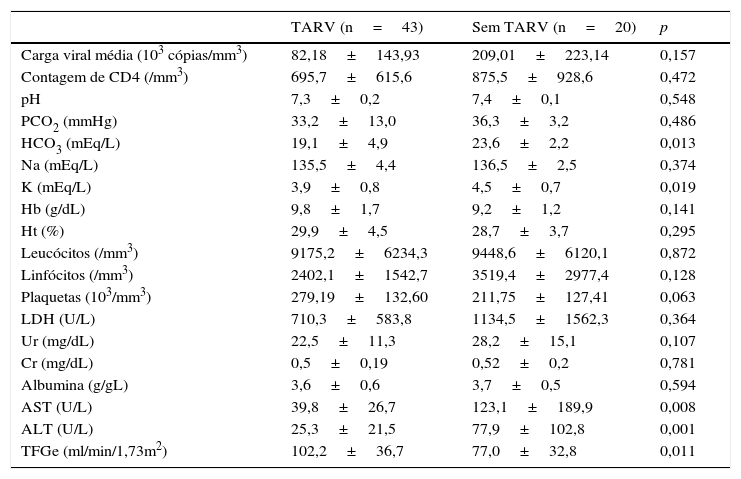
Ao comparar os grupos, foi observado que os pacientes que usavam TARV apresentaram níveis significativamente menores de bicarbonato sérico (19,1±4,9 vs. 23,6±2,2 mEq/L, p=0,013) e potássio sérico (3,9±0,8 vs. 4,5±0,7 mEq/L, p=0,019) do que aqueles que não usavam TARV, respectivamente. Além disso, os pacientes que não usavam TARV apresentaram níveis significativamente maiores de AST (123,1±189,9 U/L vs. 39,8±26,7, p=0,008) e de ALT (77,9±102,8 U/L vs. 25,3±21,5, p=0,001) do que aqueles que usavam TARV, respectivamente. Além disso, a TFGe estava consideravelmente mais elevada em pacientes com uso de TARV do que em pacientes sem uso de TARV (102,2±36,7 vs. 77,0±32,8mL/min/1,73 m2, p=0,011). Não houve diferença significativa entre os dois grupos na comparação do percentual de pacientes que apresentaram CD4<200/mm3 e CV>100.000 cópias/mm3. Uma comparação de dados laboratoriais entre os grupos é apresentada na tabela 2.
Comparação de dados laboratoriais entre crianças portadoras de HIV de acordo com o uso de TARV
| TARV (n=43) | Sem TARV (n=20) | p | |
|---|---|---|---|
| Carga viral média (103 cópias/mm3) | 82,18±143,93 | 209,01±223,14 | 0,157 |
| Contagem de CD4 (/mm3) | 695,7±615,6 | 875,5±928,6 | 0,472 |
| pH | 7,3±0,2 | 7,4±0,1 | 0,548 |
| PCO2 (mmHg) | 33,2±13,0 | 36,3±3,2 | 0,486 |
| HCO3 (mEq/L) | 19,1±4,9 | 23,6±2,2 | 0,013 |
| Na (mEq/L) | 135,5±4,4 | 136,5±2,5 | 0,374 |
| K (mEq/L) | 3,9±0,8 | 4,5±0,7 | 0,019 |
| Hb (g/dL) | 9,8±1,7 | 9,2±1,2 | 0,141 |
| Ht (%) | 29,9±4,5 | 28,7±3,7 | 0,295 |
| Leucócitos (/mm3) | 9175,2±6234,3 | 9448,6±6120,1 | 0,872 |
| Linfócitos (/mm3) | 2402,1±1542,7 | 3519,4±2977,4 | 0,128 |
| Plaquetas (103/mm3) | 279,19±132,60 | 211,75±127,41 | 0,063 |
| LDH (U/L) | 710,3±583,8 | 1134,5±1562,3 | 0,364 |
| Ur (mg/dL) | 22,5±11,3 | 28,2±15,1 | 0,107 |
| Cr (mg/dL) | 0,5±0,19 | 0,52±0,2 | 0,781 |
| Albumina (g/gL) | 3,6±0,6 | 3,7±0,5 | 0,594 |
| AST (U/L) | 39,8±26,7 | 123,1±189,9 | 0,008 |
| ALT (U/L) | 25,3±21,5 | 77,9±102,8 | 0,001 |
| TFGe (ml/min/1,73m2) | 102,2±36,7 | 77,0±32,8 | 0,011 |
Albumina, albumina sérica; ALT, alanina aminotransferase; AST, aspartato aminotransferase; Cr, creatinina sérica; Hb, hemoglobina; HCO3, bicarbonato sérico; Ht, hematócrito; K, potássio sérico; LDH, lactato desidrogenase; Na, sódio sérico; PCO2, pressão parcial do dióxido de carbono; pH, potencial hidrogeniônico sérico; Ur, ureia sérica; TFGe, taxa de filtração glomerular estimada.
Dados apresentados como média±DP. Foram usados o teste t de Student e o teste de Mann‐Whitney. Os valores de p ≤ 0,05 foram considerados estatisticamente significativos.
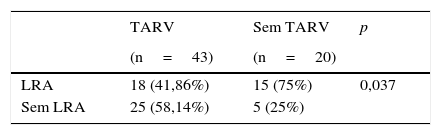
A LRA foi observada em 33 (52,3%) crianças. Elas foram classificadas como risco (19; 57,5%), lesão (13; 39,4%) e falência (1; 3,1%). A prevalência da LRA foi menor naquelas com uso de TARV do que naquelas sem uso de TARV (41,86% em comparação com 75%, p=0,037). Em uma análise multivariada, o uso da TARV antes da internação foi um fator protetor contra LRA (p=0,036; RC=0,30; IC95%=0,097‐0,926). A comparação da prevalência de LRA entre os grupos é apresentada na tabela 3.
Comparação da prevalência de LRA de acordo com o uso de TARV
| TARV | Sem TARV | p | |
|---|---|---|---|
| (n=43) | (n=20) | ||
| LRA | 18 (41,86%) | 15 (75%) | 0,037 |
| Sem LRA | 25 (58,14%) | 5 (25%) |
Dados apresentados como um número (percentual). Foi usado o teste qui‐quadrado.
Os valores de p ≤ 0,05 foram considerados estatisticamente significativos.
Este é o primeiro estudo a avaliar os dados demográficos, clínicos e laboratoriais das crianças infectadas pelo HIV internadas em um hospital de doenças infecciosas em Fortaleza, Ceará, Brasil, com foco na função renal e no desenvolvimento da LRA. Observamos que a TARV parece ser um fator protetor contra a LRA em crianças portadoras de HIV.
No presente estudo, a idade média das crianças era de 5,3 anos, com a predominância de meninas, o que é semelhante a estudos anteriores que avaliaram a doença renal em crianças infectadas por HIV.12–14 Além disso, os sintomas mais prevalentes no presente estudo foram febre e tosse, que refletem as principais infecções associadas, principal causa da internação. Em dois estudos pediátricos recentes, os principais sintomas eram idênticos aos de nosso grupo.15,16 Com relação à situação viral e imunológica, a maioria dos pacientes apresentou níveis elevados de carga viral média e contagem baixa de CD4, mas não houve uma diferença significativa entre os grupos.
Entre todas as crianças no presente estudo, a hipocalemia foi observada em 22,2%. Também observamos que o potássio sérico médio era significativamente menor em pacientes com uso de TARV do que em pacientes sem uso de TARV. Esse distúrbio eletrolítico foi associado ao uso de antirretrovirais, principalmente tenofovir, muito provavelmente devido à sua nefrotoxicidade bem conhecida.17,18 De acordo com um estudo feito por Kohler et al., foi observado que a toxicidade renal do tenofovir e a consequente hipocalemia acontecem devido a anomalias ultraestruturais mitocondriais tubulares proximais induzidas por esse medicamento.19 Além disso, peso corporal menor e uma dose elevada do medicamento foram significativamente associados à nefrotoxicidade induzida pelo tenofovir em crianças infectadas por HIV do Reino Unido.20
Além da hipocalemia, a acidose láctica também foi relatada como consequência da toxicidade da TARV, especificamente pelos inibidores da transcriptase reversa análogos de nucleosídeos (ITRN). Essa é uma causa importante da acidose em pacientes infectados por HIV, tanto crianças quanto adultos.21,22 No presente estudo, observamos níveis médios de bicarbonato sérico menores em pacientes com uso de TARV do que em pacientes sem uso de TARV, o que indica maior incidência de acidose metabólica no primeiro grupo. Adicionalmente, a toxicidade mitocondrial em células tubulares proximais é responsável por outra causa bem descrita de acidose em pacientes com HIV que usam TARV: a síndrome de Fanconi.23,24 Assim, a toxicidade da TARV provavelmente é a principal causa de acidose metabólica na presente coorte em vez de redução da TFGe, pois o bicarbonato sérico era menor em pacientes com uso de TARV, que apresentaram níveis elevados de TFGe.
Outros achados interessantes no presente estudo são níveis médios mais elevados de AST e ALT em pacientes sem uso de TARV em comparação com os com uso de TARV, o que pode indicar lesão no fígado. De acordo com uma análise recente da doença hepática em pacientes adultos infectados por HIV, existem diversos fatores relacionados à lesão hepática e ao HIV, incluindo a coinfecção por vírus de hepatites B e C; esteatose e esteato‐hepatite não alcoólica (EHNA); mudanças metabólicas como resistência à insulina; toxicidade hepática dos medicamentos, principalmente TARV; e também o efeito direto do HIV no fígado.25 Alguns desses fatores provavelmente contribuíram para a elevação de AST e ALT na presente coorte. Como níveis maiores de enzimas hepáticas foram apresentados pelos pacientes sem uso de TARV, a insuficiência hepática provavelmente é devida a outras causas que não a toxicidade dos medicamentos.
Desde a introdução da TARV, as doenças crônicas, como a doença renal, têm aumentado como causas importantes de morbidez e mortalidade de pacientes portadores de HIV. No presente estudo, observou‐se que aqueles sem uso de TARV apresentaram um impressionante comprometimento da função renal e maior incidência de LRA em comparação com pacientes com uso de TARV. Além disso, a LRA é uma complicação comum em pacientes adultos ambulatoriais infectados por HIV tratados com TARV e foi associada a insuficiência renal anterior, níveis menores de CD4, Aids, coinfecção por vírus de hepatite C e doença hepática.26,27 Normalmente, o desenvolvimento da LRA nesses pacientes é multifatorial, incluindo sepse, medicamentos nefrotóxicos, depleção de volume e uso de contraste radiológico.28
Na análise multivariada, o uso da TARV antes da internação foi um fator protetor contra LRA. Isso pode ser explicado pelos benefícios da TARV na redução da carga viral e, depois, na redução dos efeitos renais do HIV. Há evidências para comprovar a eficácia da TARV na prevenção de nefropatia associada ao HIV e no atraso da progressão da doença renal em estágio final (DREF) em pacientes adultos infectados por HIV.29,30
Em conclusão, a incidência de doença renal tem aumentado como uma importante complicação de longo prazo da infecção por HIV em crianças em todo o mundo. A comparação entre os dois grupos mostrou que crianças que usam TARV antes da internação apresentaram TFGe maior, mas níveis menores de potássio e bicarbonato. O uso da TARV mostrou‐se um fator protetor contra LRA. Esses achados poderão indicar que o uso de TARV antes da internação preservou a filtração glomerular e reduziu a incidência de LRA, mas aumentou o efeito colateral da medicação, como hipocalemia e acidose metabólica renal, relacionadas principalmente a alguns antirretrovirais, como o tenofovir.
Limitações do estudoAs limitações do estudo incluem alguns dados em falta devido à natureza retrospectiva da pesquisa e à seleção de amostras, que teve como base apenas pacientes hospitalizados. Não tivemos acesso à diurese das crianças, já que foi um estudo retrospectivo. Em geral, as unidades de cuidados não intensivos não registram de forma precisa a diurese, principalmente na população pediátrica. Alguns dados antropométricos, como estatura e peso, também não estavam disponíveis nos prontuários das crianças, então foi necessário obter alguns deles das curvas de crescimento da OMS para estimar a TFG com a fórmula de Schwartz. A duração da TARV também não estava disponível nos registros dos pacientes. A creatinina sérica de três meses antes da internação também não estava disponível, então assumimos uma TFGe básica de 120mL/min/1,73 m2 para todas as crianças, já que não apresentaram fator identificado de doença renal crônica anterior e não foi possível estimar a TFG real. Usar a LRA como resultado de interesse pode ter reduzido a precisão de resultados de regressão logística, já que o número de pacientes com LRA era limitado (apenas 33), mas não prejudicou a importância de achados de análise multivariada.
FinanciamentoConselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Somos muito gratos à equipe de médicos, residentes, estudantes de medicina e enfermeiros do Hospital São José de Doenças Infecciosas por prestar apoio técnico para desenvolvermos esta pesquisa e pelo atendimento excepcional aos pacientes.
Como citar este artigo: Soares DS, Cavalcante MG, Ribeiro SM, Leitão RC, Vieira AP, Pires Neto RJ, et al. Acute kidney injury in HIV‐infected children: comparison of patients according to the use of highly active antiretroviral therapy. J Pediatr (Rio J). 2016;92:631–7.