(a) To determine the 3rd, 50th, and 97th percentiles of weight, length, and head circumference of newborns from the Ribeirão Preto BRISA cohort, according to gender and gestational age, and compare them with the Intergrowth‐21st standard; (b) To estimate the small for gestational age (<3rd percentile), large for gestational age (>97th percentile), stunting (length<3rd percentile), and wasting (body mass index<3rd percentile).
MethodsObservational study of a cohort of 7702 newborns between 01/01/2010 and 12/31/2010 in the city of Ribeirão Preto, SP, Brazil. The 3rd, 50th, and 97th percentiles were determined for the anthropometric measurements using fractional polynomial regression.
ResultsThe weight difference between Ribeirão Preto and Intergrowth-21st was small, being more pronounced in preterm infants (mean difference between the two populations of +266g); for full‐term newborns, there was a mean difference of +66g, and for post‐term infants, of −113g. For length, the mean variation was always <1cm; whereas for head circumference, preterm newborns showed a variation >1cm, and full‐term and post‐term newborns showed a variation of <1cm. The small and large for gestational age detection rates were 2.9% and 4.3%, respectively. Stunting affected 6.5% of all newborns and wasting, 1.5%, with a predominance in girls and in full‐term pregnancies; both conditions were present in 0.4% of the sample.
ConclusionsNewborns from Ribeirão Preto, when compared to the Intergrowth‐21 standard, are heavier, longer, and have a larger head circumference until they reach full‐term.
Determinar os percentis 3, 50 e 97 de peso, comprimento e perímetro cefálico de recém‐nascidos da Coorte BRISA Ribeirão Preto, segundo sexo e idade gestacional, e comparar com o padrão Intergrowth‐21st; b) Estimar os fenótipos pequeno para idade gestacional (< percentil 3), grande para idade gestacional (> percentil 97), stunting (comprimento < percentil 3) e waisting (índice de massa corporal < percentil 3).
MétodoEstudo observacional de uma coorte de 7.702 recém‐nascidos entre 01/01 e 31/12/2010 na cidade de Ribeirão Preto, SP, Brasil. Os percentis 3, 50 e 97 para as medidas antropométricas foram determinados com regressão polinomial fracionária.
ResultadosA diferença de peso entre Ribeirão Preto e Intergrowth‐21st foi pequena, mais acentuada nos recém‐nascidos pré‐termo (diferença média entre as duas populações foi de + 266 gramas); para os recém‐nascidos a termo a diferença média foi de + 66 gramas e para os pós‐termo de ‐113 gramas. Para comprimento, a variação média foi sempre < 1cm; enquanto que para perímetro cefálico os recém‐nascidos pré‐termo apresentaram variação > 1cm e os recém‐nascidos a termo e pós‐termo tiveram variação < 1cm. As taxas de detecção de pequeno e grande para idade gestacional foram 2,9% e 4,3%, respectivamente. Stunting afetou 6,5% de todos os recém‐nascidos e waisting 1,5%, com predomínio em meninas e em gestações a termo; ambas as condições estavam presentes em 0,4% da amostra.
ConclusõesOs recém‐nascidos de Ribeirão Preto, quando comparados com o padrão Intergrowth‐21st, apresentam‐se mais pesados, mais longos e com maior circunferência craniana até chegarem a termo.
O crescimento intrauterino é entendido como o resultado de diversos fatores, inclusive a expressão de informações genéticas, nutrição materna,1 doenças maternas como pré‐eclâmpsia, fatores socioeconômicos e fatores ambientais como hipóxia.2 O indicador de desnutrição fetal universalmente usado é o baixo peso ao nascer (< 2.500 gramas),3 mas ele não faz distinção entre stunting (baixo comprimento para a idade) e waisting (baixo índice de massa corporal [IMC] para idade). Outros termos existentes para descrever a desnutrição pré‐natal incluem: pequeno para a idade gestacional (PIG), restrição de crescimento intrauterino (RCIU) e insuficiência placentária. Tradicionalmente o critério de Battaglia e Lubchenco tem sido usado para classificar os recém‐nascidos (RN) em pequenos, adequados e grandes para idade gestacional (IG) em relação aos percentis 10 e 90 quanto à variável peso.4 Informações como ter nascido PIG são importantes do ponto de vista clínico e social, pois mostram correlação com importantes desfechos, como mortalidade neonatal e infantil, baixo crescimento na infância e doenças crônicas na vida adulta.5,6
Curvas de referência neonatais têm sido publicadas em certos países, mas nenhuma delas serve como padrão internacional de crescimento,7 Atualmente o uso dessas curvas é questionado pois elas foram produzidas para serem usadas como referência de um país a fim de comparar as características antropométricas de RN em relação à população em geral, ou seja, sem a natureza prescritiva de um padrão aplicável a diferentes populações.8
The International Fetal and Newborn Growth Consortium for the 21 Century (Intergrowth‐21st) é um estudo transversal, multicêntrico e transcultural do crescimento de RN, feito com a mesma abordagem prescritiva e desenho metodológico que o usado para a produção do padrão de avaliação do crescimento infanto‐juvenil da Organização Mundial de Saúde (OMS) vigente no Brasil.9 Intergrowth‐21st (IG‐21), que permite a análise antropométrica de RN, foi planejado para ser um padrão de crescimento fetal “prescritivo”, isto é, servir de base para recomendar como os fetos saudáveis nascidos de mães saudáveis em ambientes saudáveis “deveriam” crescer, em vez de uma mera referência de como fetos nascidos nos mesmos países “realmente crescem”.10
Nesse contexto, os objetivos do presente estudo foram: a) comparar dados antropométricos (peso, comprimento e perímetro cefálico) da coorte de nascimentos de Ribeirão Preto 2010 (Brisa‐RP) com o padrão IG‐21 e b) estimar fenótipos de RN (PIG, grande para idade gestacional [GIG], stunting e waisting) segundo sexo e IG.
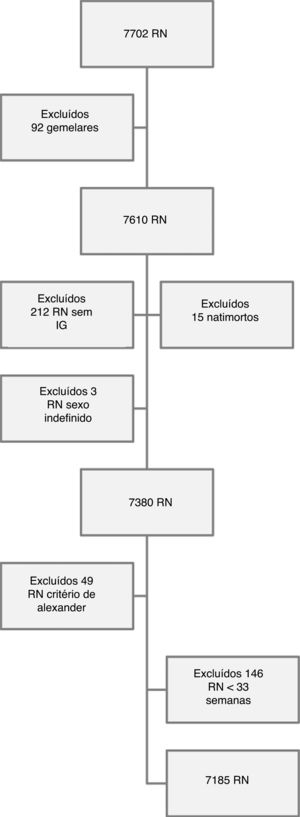
MétodosAnálise secundária transversal com abordagem descritiva de dados obtidos de um estudo de coorte (Brazilian Ribeirão Preto and São Luís Birth Cohort Studies ‐ Brisa) cujo objetivo foi encontrar novos fatores de risco para nascimento pré‐termo.11 Foram estudados todos os RN vivos entre 01/01 e 31/12/2010 na cidade de Ribeirão Preto (RP), São Paulo, Brasil. No período foram avaliados 7.702 RN, o equivalente a 98% dos partos hospitalares do município.
Os critérios de inclusão foram RN de partos hospitalares, filhos de mulheres residentes em RP e os critérios de exclusão foram RN gemelares, natimortos, sem IG definida pelos critérios adotados, sem sexo definido e RN que tinham valores de peso ao nascer incompatíveis com a idade gestacional12 (fig. 1).
Os dados foram obtidos a partir de entrevista com as mães após o parto e de informações contidas no prontuário médico dos RN.
Variáveis estudadasIdade materna (anos), cor da pele (branca ou não branca), escolaridade (anos), situação conjugal (com ou sem companheiro), ocupação do chefe da família (de acordo com a classificação proposta por Olsen e Frische13), critério de classificação econômica do Brasil segundo a Associação Brasileira de Empresas de Pesquisa (CCEB‐Abep),14 quantidade diária de cigarros fumados durante a gravidez, paridade, hipertensão arterial (prévia ou gestacional), diabetes (prévia ou gestacional), índice de massa corporal (IMC, kg/m2) materno prévio à gestação (categorizado em baixo peso [< 18,5kg/m2], peso adequado [≥ 18,5kg/m2 e < 25kg/m2], sobrepeso [≥ 25kg/m2 e < 30kg/m2]), obesidade (≥ 30kg/m2) e pré‐natal (adequado ≥ 4 consultas).
As variáveis neonatais estudadas foram sexo, peso ao nascer (PN), comprimento e perímetro cefálico (PC). Stunting foi definido como comprimento < percentil 3, wasting como IMC < percentil 3, PIG como peso ao nascer < percentil 3 e GIG como peso a nascer > percentil 97 do estudo IG‐21.10,15
A IG foi estimada por data da última menstruação (DUM) e informação do exame de ultrassonografia (USG) mais precoce. Foi calculada uma margem de erro de ± 7 dias para data encontrada na primeira USG.16
Análises estatísticasA estatística descritiva incluiu média, proporção, desvio‐padrão (DP) e intervalo de confiança de 95% (IC 95%). Foram usados polinômios fracionários para ajustar os modelos das três medidas antropométricas (PN, comprimento e PC). Os modelos aditivos generalizados para localização, escala e forma (GAMLSS) fornecem a opção de distribuições diferentes da normal (distribuições de viés e curtose) e modelagem de outros parâmetros de uma distribuição que determina a escala e a forma com o uso de polinômios fracionários.17 Em todos os casos, foi aplicada a técnica de suavização polinomial fracionária por sexo para os percentis 3, 50 e 97. Para comparação das curvas com o padrão IG‐21 foi adotado como limite inferior 33+0 semanas, pelo fato de que a IG21 apresenta uma curva muito questionável abaixo de 33 semanas face ao pequeno número de recém‐nascidos incluídos”.
De acordo com o estudo IG‐21, os percentis suavizados de peso, comprimento e perímetro cefálico para RN são apresentados em semanas exatas da idade gestacional apenas para evitar a publicação de longas tabelas para cada dia de gravidez. Por exemplo, a IG exata para o valor da 36a semana é de 36 semanas mais 0 dia.18 Todos os modelos e avaliações de bondade do ajuste foram feitos com o software estatístico R, com o uso do suporte GAMLSS. Todos os gráficos foram produzidos com R.
O projeto foi aprovado pelo Comitê de Ética em Pesquisa do HCFMRP (processo n° 11157/2008). Todas as grávidas que concordaram em participar da pesquisa assinaram o termo de consentimento livre e esclarecido.
ResultadosA média de idade materna foi 27 anos (DP = 6,2), a porcentagem de mães jovens e idosas foi semelhante. A maior parte da população se declarou como branca, cerca de metade das mães tinha escolaridade entre nove e 11 anos e a grande maioria das mães declarou ter companheiro. Na maioria das famílias a ocupação do chefe era trabalhador manual não qualificado ou semiqualificado. As classes sociais altas e intermediária tiveram representação semelhante (tabela 1, Material suplementar).
Cerca de 1/3 das mães apresentou sobrepeso e obesidade, pouco mais de 10% disseram ser fumantes. Das mães, 13% eram hipertensas e 6% diabéticas. A maioria das mães era primípara e apenas 2% das gestantes apresentaram pré‐natal inadequado (tabela 2, Material suplementar).
A distribuição por sexo foi equivalente. Houve 13% de nascimentos pré‐termo e quase 8% de RN de baixo peso. A taxa de PIG foi 2,9%, enquanto que a de GIG foi 4,3%, observou‐se uma relação inversa com a IG. Stunting afetou 6,5% e waisting 1,5% (tabela 1), com predomínio em meninas e em gestações a termo; ambas as condições estavam presentes em 0,4% da amostra.
Fenótipos de RN segundo sexo e idade gestacional (33 ‐ 42 sem) (Coorte Brisa‐RP, 2010)
| Fenótipo | n | % | IC 95% |
|---|---|---|---|
| Stunting | |||
| Meninos | 214 | 6,1 | 5,3 ‐ 6,9 |
| Meninas | 246 | 6,3 | 6,1 ‐ 7,8 |
| Total | 460 | 6,5 | 5,9 – 7,1 |
| Por idade gestacional (sem) | |||
| 33 ‐ 37 | 78/1208 | 6,4 | 5,1 ‐ 8,0 |
| 38 ‐ 42 | 382/5887 | 6,5 | 5,9 ‐ 7,2 |
| Waisting | |||
| Meninos | 46 | 1,3 | 1,0 ‐ 1,7 |
| Meninas | 56 | 1,6 | 1,2 ‐ 2,0 |
| Total | 102 | 1,5 | 1,2 ‐ 1,8 |
| Por idade gestacional (sem) | |||
| 33 ‐ 37 | 19/1208 | 1,6 | 1,0 ‐ 2,4 |
| 38 ‐ 42 | 83/5887 | 1,4 | 1,1 ‐ 1,7 |
| PIG | |||
| Meninos | 93 | 2,6 | 2,1 ‐ 3,2 |
| Meninas | 112 | 3,1 | 2,6 – 3,7 |
| Total | 205 | 2,9 | 2,5 – 3,3 |
| Por idade gestacional (sem) | |||
| 33 ‐ 37 | 35/1222 | 2,7 | 2,0 – 3,9 |
| 38 ‐ 42 | 170/5899 | 2,9 | 2,5 – 3,3 |
| GIG | |||
| Meninos | 153 | 4,3 | 3,7 – 5,1 |
| Meninas | 153 | 4,3 | 3,6 – 4,9 |
| Total | 306 | 4,3 | 3,8 – 4,8 |
| Por idade gestacional (sem) | |||
| 33 ‐ 37 | 131/1222 | 10,7 | 9,0 – 12,6 |
| 38 ‐ 42 | 175/5899 | 3,0 | 2,6 – 3,4 |
RN, recém‐nascidos.
Stunting, comprimento < percentil 3 de IG‐21.
Waisting, BMI < percentil 3 de IG‐21.
PIG (pequeno para idade gestacional): peso ao nascer < percentil 3 de IG‐21.
GIG (grande para idade gestacional): peso ao nascer > percentil 97 de IG‐21.
A figura 1 (Material suplementar) mostra os histogramas de peso ao nascer de Brisa‐RP de acordo com o sexo. As distribuições são muito semelhantes, embora a das meninas apresente uma maior curtose.
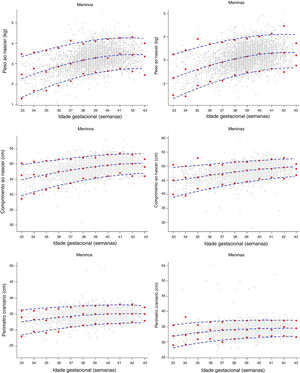
Foram construídas curvas de distribuição de PN, comprimento e PC da Coorte Brisa‐RP, segundo IG e sexo. A figura 2 apresenta os valores individuais (valores observados) e os percentis 3, 50 e 97 suavizados (valores estimados), com o uso de polinômios fracionais. Observam‐se poucos valores fora dos percentis (outliers) depois das 37+0 semanas de IG para PN e valores quase idênticos para o comprimento e PC.
Curvas de percentis 3°, 50° e 97° suavizados (linhas azuis) para peso ao nascer, comprimento ao nascimento e perímetro cefálico de acordo com a idade gestacional. Mostra valores empíricos para cada semana de gestação (círculos vermelhos) e as observações reais (círculos cinzas). Coorte Brisa‐RP, 2010.
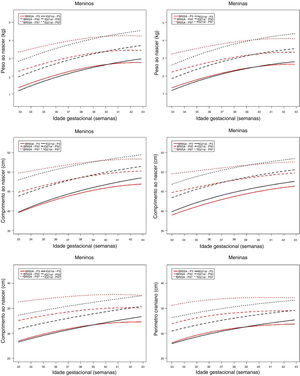
Foram comparadas as curvas de percentis 3, 50 e 97da Coorte Brisa‐RP com IG‐21 por IG e sexo. Para peso, em ambos os sexos, observa‐se que entre as semanas 33+0 e 39+6 os percentis 50° e 97° da Coorte Brisa‐RP são mais elevados do que IG‐21; em seguida, ambos os percentis cruzam o padrão IG‐21 e descem até a semana 42+6. Para o percentil 3o o comportamento é semelhante, mas mais suave (fig. 3). Em termos numéricos, a divergência entre Brisa‐RP e IG‐21 é mais acentuada entre os RN pré‐termo (33 a 36 semanas), em que a diferença média entre as duas populações é de +263g para meninos e +270g para meninas; nos RN a termo (37 a 40 semanas), a diferença média foi de +81g para meninos e +52g para meninas; e nos pós‐termo (41 e 42 semanas) a diferença média foi de ‐120g para meninos e ‐106g para meninas (tabela 3, Material suplementar).
Para comprimento, a curva de crescimento (percentis 500 e 970) aumentou constantemente da 33ª semana de gestação até as semanas 37‐39 na Coorte Brisa‐RP e em seguida cruzou a curva IG‐21. O percentil 3 permaneceu sempre abaixo do padrão (fig. 3). Numericamente, a variação média ficou sempre menor do que 1cm tanto em meninos quanto em meninas (tabela 4, Material suplementar).
Por último, o perímetro craniano, para ambos os sexos, mostrou uma grande separação entre os percentis 50 e 97da Coorte Brisa‐RP e a curva IG‐21 até chegar ao período pós‐termo; enquanto a trajetória do percentil 3 foi paralela com o padrão IG‐21 até a semana 39, quando o cruza (fig. 3). Nas diferenças numéricas observou‐se que os RN pré‐termo apresentaram variação maior do que 1cm (1,33cm para meninos e 1,39cm para meninas), enquanto para RN a termo e pós‐termo a variação foi menor do que 1cm (tabela 5, Material suplementar).
DiscussãoPara nosso conhecimento, este é o primeiro estudo brasileiro que compara uma coorte ao nascimento com o padrão internacional IG‐21 no que diz respeito a tamanho do recém‐nascido para idade gestacional e sexo.
Entre 7.185 nascidos vivos únicos, aqueles abaixo do percentil 3 (PIG) e acima do percentil 97 (GIG) de peso ao nascer do padrão IG‐21 apresentaram taxas de detecção de 2,9% e 4,3%, respectivamente. Para stunting e waisting, os valores foram de 6,5% e 1,5%, respectivamente.
Foram calculados os percentis ajustados com base em dados individuais de mais de 7.000 recém‐nascidos com a regressão polinomial fracionária e os dados foram relatados de acordo com as semanas completas de gestação como percentis suavizados (fig. 2), que se mostraram consistentes com os dados brutos, o que aumentou a confiança nas curvas. PIG foi definido como peso
Fica evidente que as curvas de peso ao nascer da Coorte Brisa‐RP e o padrão IG‐21, embora semelhantes no período a termo, são muito diferentes nas idades gestacionais mais precoces. Enquanto que às 40 semanas de IG não houve diferença nas medianas, com 33 semanas a mediana Brisa‐RP foi quase 300g maior. Isso faz com que a prevalência de PIG na prematuridade seja maior na Coorte Brisa‐RP do que na curva‐padrão. As prováveis razões para maior frequência de GIG na Coorte Brisa‐RP foram aumentos no índice de massa corporal pré‐gestacional materno, paridade, ganho de peso e diabetes gestacional, bem como a redução do tabagismo materno, que estão ligados a maior peso ao nascer e a parto prematuro.19 Esses fatores frequentes na Coorte Brisa‐RP (tabela 2, Material suplementar) foram critérios de exclusão no estudo IG‐21.10
A escassa divergência de peso ao nascer encontrada nas curvas de gestações a termo pode sugerir que as mulheres que chegaram até o termo tendem a ser mais saudáveis e com menor risco, com perfil similar àquelas incluídas no estudo IG‐21.
Outras possíveis explicações para as diferenças encontradas entre o estudo Brisa‐RP e IG‐21 podem ser atribuídas à abordagem prescritiva de IG‐21 (populações com baixo risco de comprometimento do crescimento fetal; na Coorte Brisa‐RP a população não foi selecionada), estimação da idade gestacional (na Coorte Brisa‐RP a IG foi definida por uma combinação de métodos clínicos e estimação pelo exame da USG mais precoce; no estudo IG‐21a IG foi estimada precocemente por meio de USG feito antes da 14a semana de gestação), tamanho amostral (na Coorte Brisa‐RP foram incluídos 7.702 pares mães‐filhos, enquanto no IG‐21 foram avaliados 20486 RN). Em geral, pequenas amostras afetam a estimativa de percentis em IG extremas.20 Isso se reflete na figura 3, onde as maiores diferenças entre a referência e o padrão foram observados nas IG extremas. Além disso, houve diferença na frequência de parto prematuro; IG‐21 apresentou uma taxa muito baixa (5,5%), consistiu principalmente em partos prematuros tardios – 33 a 37 semanas de gestação – e de RN de baixo peso nascidos a termo (3,2%), provavelmente devido a sua abordagem prescritiva. Já no estudo Brisa‐RP, o parto prematuro atingiu 13,2%, mais do que o dobro de IG‐21, ainda que a taxa de baixo peso a termo tenha sido similar (3,3%).
Na América Latina, não existem informações comparáveis sobre a prevalência de fenótipos nutricionais em recém‐nascidos avaliados com o IG‐21, exceto um estudo argentino, no qual a prevalência do fenótipo PIG foi 3,6% com a referência local e 2,0% com IG‐21, bastante semelhante ao presente estudo.21 Um estudo peruano de recém‐nascidos acima de 3.400 metros do nível do mar não encontrou diferenças significativas com o padrão IG‐21, mas os fenótipos não foram avaliados.22 Em um estudo da Nova Zelândia, as proporções de PIG e GIG foram 1,06% e 6,2%, respectivamente.23
Os autores do estudo transversal de RN IG‐21 admitiram que o uso de um único ponto de corte para definir restrição de crescimento tem suas limitações e que a avaliação da velocidade de crescimento ou avaliação funcional do neonato podem fornecer um meio melhor para identificar RN desnutridos.10
Nesse sentido, o stunting constitui um indicador global de bem‐estar infantil, refletiu as desigualdades sociais e descreveu resultados específicos do período neonatal.24 O stunting pode estar relacionado com condições orgânicas e é amplamente considerado como um processo cumulativo e de longo prazo, análogo à desnutrição crônica em crianças, que requer exposição a um ou mais fatores de risco por vários meses ou durante a gestação.25 Por esse motivo, recentemente a avaliação desse indicador em recém‐nascidos tem ganhado destaque na perspectiva dos primeiros 1.000 dias de vida. Este estudo incorpora, pela primeira vez na rotina dos cuidados neonatais, um método para o diagnóstico precoce de stunting que pode ser monitorado durante a infância com os correspondentes Padrões de Crescimento Infantil da OMS.9
Alternativamente, é provável que waisting neonatal reflita exposições agudas nas semanas anteriores ao parto, período em que a deposição de gordura é mais importante. Alguns autores, no entanto, sugerem que diferenças na severidade, em vez do tempo e da duração dos insultos, resultem em fenótipos distintos de comprometimento do crescimento fetal, o waisting representa os casos mais graves.26 Em um estudo anterior, stunting afetou 3,8% e waisting 3,4% de uma população de baixo risco.15
As prevalências observadas dos fenótipos de recém‐nascidos foram relativamente baixas, principalmente para PIG e stunting, pois também são inferiores aos pontos de corte com significância clínica sugeridos pela OMS.3Stunting ao nascimento parece ter uma prevalência relativamente baixa, mesmo em países de baixa renda, mas aumenta com a idade gestacional (tabela 1).27 Uma possível explicação do menor valor de stunting do presente estudo (1,5%) seriam as interrupções eletivas da gestação devido à restrição do crescimento fetal. Isso é confirmado pela taxa 17% maior de cesárea às 33‐37 semanas do que entre 38‐42 semanas (p < 0,001, dados não apresentados).
Do ponto de vista da prática clínica, o padrão IG‐21 poderia subestimar a frequência do RN GIG a termo e pós‐termo na Coorte Brisa‐RP, com implicações no declínio de controles e testes bioquímicos. Por outro lado, com IG‐21 se reduziria o diagnóstico de PIG até o termo. Apesar de a variação média no comprimento ter sido sempre inferior a 1cm, com IG‐21 se aumentaria o diagnóstico de stunting em toda a gestação. Finalmente, enquanto a trajetória do percentil 3o do perímetro craniano foi paralela até a semana 40a, os RN pré‐termo apresentaram variação maior do que 1cm com a referência Brisa‐RP, o que pode influenciar em uma sobre‐estimação da microcefalia, atualmente o primeiro passo para o diagnóstico da infecção por vírus Zika.
Recomenda‐se que as curvas de referência de cada país sejam comparadas gráfica e numericamente com um padrão (como IG‐21) para detectar resultados perinatais adversos (como os fenótipos usados neste estudo) e seus efeitos em longo prazo.28,29 Como com qualquer padrão internacional, a validação local é necessária antes da implantação.
A principal força do estudo diz respeito ao tamanho amostral, com dados relativamente recentes, coletados de forma rigorosa e padronizada, provenientes de um estudo de coorte (Brisa‐RP) com uma população não selecionada de puérperas. O estudo demonstra a aplicação prática dos padrões internacionais de crescimento recomendados para a estimativa da prevalência de quatro fenótipos. No entanto, é limitado a um único município, o que impede a sua generalização.
Apesar da importância de comparar populações locais com curvas padrão, a adoção de curvas, tanto de referência como padrão, para estudos epidemiológicos, ainda requer sua validação por meio de indicadores de morbidade e mortalidade em RN, assim como pela ocorrência de doenças crônicas não transmissíveis ao longo do ciclo da vida.
Os RN do estudo Brisa‐RP, quando comparados com o padrão IG‐21, apresentam‐se mais pesados, mais longos e com maior circunferência craniana até chegarem ao termo.
FinanciamentoFundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp): Processo n° 08/53593‐0. Fundação de Apoio ao Ensino, Pesquisa e Assistência do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (Faepa). Bolsa Institucional de Iniciação Científica da USP.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Pimenta JR, Grandi C, Aragon DC, Cardoso VC. Comparison of birth weight, length, and head circumference between the BRISA-RP and Intergrowth‐21st cohorts. J Pediatr (Rio J). 2020;96:511–9.
Estudo vinculado a Universidade de Ribeirão Preto (USP), Faculdade de Medicina de Ribeirão Preto (FMRP), Ribeirão Preto, SP, Brasil.