Mannose‐binding lectin, which belongs to the collectin family, is an acute‐phase reactant that activates the complement system. This study aimed to investigate the effect of MBL2 gene polymorphism on short‐term outcomes in preterm infants.
MethodInfants of <37 gestational weeks who were admitted to the neonatal intensive care unit during a two‐year period were enrolled in this prospective study. The neonates were categorized into two groups according to their MBL2 genotypes. Normal MBL2 genotype was defined as MBL2 wild‐type (AA genotype), whereas mutant MBL2 genotype was defined as MBL2 variant‐type (AO/OO genotype). The relationship between MBL2 genotype and short‐term morbidity and mortality was evaluated.
ResultsDuring the two‐year study period, 116 preterm infants were enrolled in this study. In MBL2 variant‐type, mannose‐binding lectin levels were significantly lower and incidences of mannose‐binding lectin deficiency (MBL level<700ng/mL) were higher (p<0.001). In this group, the prevalence of respiratory distress syndrome and mortality was significantly higher (p<0.001, p=0.03 respectively). In the MBL2 wild‐type group, the prevalence of necrotizing enterocolitis (NEC) was higher (p=0.01). Logistic regression analyses revealed that MBL2 variant‐type had a significant effect on respiratory distress syndrome development (odds ratio, 5.1; 95% confidence interval, 2.2–11.9; p<0.001).
ConclusionsMBL2 variant‐type and mannose‐binding lectin deficiency are important risk factors for respiratory distress syndrome development in preterm infants. Additionally, there is an association between MBL2 wild‐type and NEC. Further studies on this subject are needed.
A lectina ligante de manose (MBL, do inglês mannose‐binding lectin), que pertence à família das colectinas, é um reagente de fase aguda que ativa o sistema complemento. Este estudo teve como objetivo investigar o efeito do polimorfismo do gene MBL2 em desfechos de curto prazo em prematuros.
MétodoEste estudo prospectivo incluiu crianças com menos de 37 semanas de gestação admitidas na unidade de terapia intensiva neonatal durante dois anos. Os neonatos foram categorizados em dois grupos de acordo com os genótipos do MBL2. O genótipo normal do gene MBL2 foi definido como MBL2 do tipo selvagem (genótipo AA), enquanto o genótipo mutante do gene MBL2 foi definido como o gene variante (genótipo AO/OO). Foi avaliada a relação entre o genótipo MBL2 e a morbidade e mortalidade em curto prazo.
ResultadosDurante o período de dois anos, 116 bebês prematuros foram incluídos neste estudo. Os níveis de lectina ligante de manose foram significativamente menores nos variantes do MBL2 e as incidências de deficiência de lectina ligante de manose (nível de MBL < 700 ng/mL) foram maiores (p < 0,001). Nesse grupo, a prevalência de síndrome do desconforto respiratório (SDR) e a mortalidade foram significativamente maiores (p < 0,001, p = 0,03, respectivamente). No grupo MBL2 do tipo selvagem, a prevalência de enterocolite necrosante foi maior (p = 0,01). Análises de regressão logística revelaram que os genes variantes do MBL2 apresentaram um efeito significativo no desenvolvimento da síndrome do desconforto respiratório (odds ratio, 5,1; intervalo de confiança de 95%, 2,2–11,9; p < 0,001).
ConclusõesAs variantes do MBL2 e a deficiência de lectina ligante de manose são importantes fatores de risco para o desenvolvimento da síndrome do desconforto respiratório em neonatos prematuros. Além disso, existe uma associação entre MBL2 do tipo selvagem e a enterocolite necrosante. Mais estudos são necessários sobre esse assunto.
A lectina ligante de manose (MBL, do inglês mannose‐binding lectin) é um reagente de fase aguda que ativa o sistema complemento. Pertence à família das colectinas, que inclui a proteína surfactante pulmonar A (SP‐A) e a SP‐D.1 A MBL desempenha um papel fundamental nas respostas imunes de primeira linha como um componente da imunidade inata.2 Devido ao fato de a imunidade adaptativa ser subdesenvolvida em neonatos prematuros, a imunidade inata ganha maior importância.2,3 O gene MBL2 está localizado no braço longo do cromossomo 10 e os alelos mutantes do MBL2 ocorrem como resultado de três mutações de ponto nesse gene (B, C e D). Embora os níveis funcionais de MBL sejam baixos em polimorfismos heterozigotos, os níveis de MBL em polimorfismos homozigotos são tão baixos que podem não ser determinados.4,5 A MBL ativa o sistema complemento através da ligação à manose ou outros açúcares, encontradas em muitos microrganismos, e desempenha um papel importante na imunidade inata e na inflamação.2,6 Em recém‐nascidos, observa‐se um aumento na frequência de sepse quando os níveis de MBL são baixos.2,3,7
As taxas de mortalidade e morbidade em prematuros são mais altas do que em bebês nascidos a termo. À medida que as semanas gestacionais e o peso ao nascer diminuem, o risco de complicações aumenta. Nos prematuros, as complicações são observadas no período precoce (período neonatal) e tardio (após a alta). Embora a taxa de sobrevivência da maioria dos prematuros tenha melhorado devido aos avanços nos cuidados médicos, a incidência de complicações em curto prazo permanece relativamente estável. Complicações de curto prazo aumentam o risco de sequelas em longo prazo.8,9
Nos últimos anos, muitos estudos foram feitos sobre a importância da MBL durante o período neonatal e a maioria desses associada à sepse. Na sepse, a relação pró‐inflamatória e anti‐inflamatória da citocina é vital na defesa contra agentes infecciosos. O desequilíbrio nessa relação é manifestado pelo aumento da morbidade e mortalidade durante o período neonatal.5,6 O aumento dos níveis de citocinas tem um papel significativo na fisiopatologia das morbidades, como síndrome do desconforto respiratório (SDR), hemorragia intraventricular (HIV), enterocolite necrosante (ECN), displasia broncopulmonar (DBP) e retinopatia da prematuridade (ROP).10 Neste estudo prospectivo, objetivamos investigar a associação do polimorfismo da MBL2 com desfechos em curto prazo em bebês prematuros.
Material e métodosTodos os prematuros com menos de 37 semanas de gestação admitidos na unidade de terapia intensiva neonatal (UTIN) da Uludag University Medical School durante dois anos foram incluídos neste estudo prospectivo. Os neonatos foram categorizados em dois grupos de acordo com os genótipos do MBL2. O genótipo MBL2 normal foi definido como MBL2 do tipo selvagem (genótipo AA), enquanto o genótipo do gene MBL2 mutante foi definido como a variante do MBL2 (genótipo AO ou OO). Os critérios de exclusão incluíram o não consentimento dos pais, bebês com anomalias congênitas maiores e aqueles submetidos a um procedimento cirúrgico mais extenso.
Foram registrados a idade gestacional, peso ao nascer, sexo, tipo de parto, índice de Apgar em 1 e 5min, dados demográficos pré‐natal, administração antenatal de esteroides, ruptura prematura de membranas, histórico de corioamnionite e duração da ventilação mecânica invasiva, oxigênio suplementar total, cateter central e total nutrição parenteral. Também foi registrada a presença de morbidades neonatais, como SDR, sepse tardia (ST), HIV, ECN, DBP, ROP e dados de mortalidade dos prematuros.
A SDR foi diagnosticada com base em achados clínicos (taquipneia, retrações, abertura das narinas e cianose) ou radiológicos (padrão granular reticular ou broncogramas aéreos). Todos os neonatos foram submetidos ao mesmo manejo de acordo com os protocolos da UTIN e conforme recomendado pelas diretrizes do Consenso Europeu sobre o manejo da síndrome do desconforto respiratório neonatal em bebês prematuros.11,12 A sepse neonatal foi definida como a presença de sinais clínicos de sepse com hemocultura positiva. As hemoculturas foram analisadas com o método BACTEC totalmente automatizado, através do dispositivo BACTEC 9240 (Becton Dickinson, Heidelberg, Alemanha). A ST foi determinada pelo tempo em que a sepse ocorreu entre quatro e 30 dias após o nascimento.13 A HIV foi avaliada através de exames de ultrassonografia craniana, feitos pelo mesmo radiologista pediátrico e diagnosticada pelo sistema de classificação Papile.14 A ECN foi diagnosticada de acordo com os achados clínicos e radiográficos, classificados de acordo com os critérios modificados de Bell.15 A DBP foi classificada em três grupos de acordo com a gravidade, dependeu da duração e do nível de oxigênio suplementar e suporte ventilatório mecânico na 36ª semana de idade pós‐menstrual.16 A ROP foi classificada de acordo com Classificação Internacional da Retinopatia da Prematuridade.17
Os níveis de MBL e polimorfismos genéticos foram avaliados em um período de três horas, para a maioria das crianças, e em 24 horas após o nascimento, para todas as crianças. As amostras de sangue para a mensuração dos níveis de MBL foram coletadas em um tubo de ensaio e centrifugadas 30 minutos após a sua coleta. Após o processo de centrifugação, o soro das amostras foi imediatamente armazenado a ‐80°C até as análises.
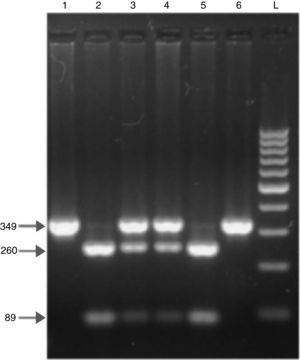
As amostras de sangue foram analisadas através de ensaio imunoenzimático. A PCR e o polimorfismo de comprimento de fragmento de restrição foram usados para a genotipagem do gene MBL2. Os níveis séricos de MBL foram medidos com um kit de imunoensaio (kit Oligomer Elisa, Antibody Shop, Copenhagen, Dinamarca) de acordo com as instruções do fabricante. A menor concentração detectável de MBL foi de 10 ng/mL. Para a definição da deficiência funcional de MBL, usamos dois valores de corte diferentes da concentração de MBL. Um nível de MBL < 700 ng/mL foi estabelecido como deficiência e < 150 ng/mL como deficiência grave.1–3,18 O DNA foi extraído das amostras de sangue com um kit comercialmente disponível (Puregene, Gentra, MN, EUA), e a genotipagem do MBL2 foi feita realizada com essas amostras. As amostras de DNA foram mantidas a ‐20°C até serem usadas. Todos os genótipos foram detectados por PCR e digestão com enzimas de restrição. O exon 1 do gene MBL2 foi amplificado por PCR. As sequências de primer foram 5′‐GTA GGA CAG AGG GCA TGC TC‐3′ e 5′‐CAG GCA GTT TCC TCT GGA AGG‐3′. No total, um produto da PCR de 349 pb foi digerido com BanI e MboII para os códons 54 e 57, respectivamente. O alelo normal (alelo A) foi cortado em dois fragmentos com BanI, 260 e 89 pb. Os alelos B (rs1800450) e D (rs5030737) variantes permaneceram sem cortes. A MboII clivou o alelo C variante (rs1800451) em fragmentos de 270 e 79 pb. Os fragmentos foram visualizados por eletroforese em gel de agarose a 2%. Na eletroforese, a banda dupla no local de restrição foi definida como uma mutação heterozigótica, enquanto a banda única foi definida como uma mutação homozigótica. Como afirmado, o alelo do gene estrutural MBL2 normal foi denominado A, enquanto os alelos B, C e D (mutação nos códons 54, 57 e 52) foram denominados O. Uma eletroforese em gel representativa dos polimorfismos do exon 1 do gene MBL2 no códon 54 é mostrada na figura 1.
Fragmentos de DNA em eletroforese em gel de agarose após digestão com enzima de restrição no exon 1 do códon 54 do gene da lectina ligante de manose (MBL2). No total, o produto de PCR de 349 pb foi digerido com BanI para o polimorfismo do códon 54. O alelo normal (alelo A) é cortado em dois fragmentos com BanI (faixas 2 e 5), de 89 e 260 pb. O alelo variante (alelo O) permanece sem corte (faixas 1 e 6). Ambos os fragmentos não cortados e digeridos são vistos no AO heterozigoto (faixas 3 e 4). L: escada de DNA de 100 pb.
Este estudo foi aprovado pelo Comitê de Ética da Uludag University Medical School e obedeceu os padrões estabelecidos pela Declaração de Helsinque (15/01/2013 ‐ 1/20). Todos os pais forneceram seu consentimento livre e informado antes da inclusão de seus filhos no estudo.
Análise estatísticaA análise estatística foi feita com o software SPSS versão 20.0 (SPSS Inc., Chicago, IL, EUA). Os resultados são apresentados como mediana (intervalo interquartil) para as variáveis com distribuição não Gaussiana e média ± desvio‐padrão para os dados com distribuição normal. O teste t de Student foi usado para comparações de grupos com distribuição normal e o teste U de Mann‐Whitney foi usado para comparações de grupos com distribuição não normal. O teste do qui‐quadrado e o teste exato de Fisher foram usados para a comparação de variáveis categóricas. A análise de regressão logística foi feita para investigar o efeito do genótipo MBL2 na SDR. A análise incluiu fatores que a literatura demonstrou ter algum efeito sobre a SDR: idade gestacional, peso ao nascer, sexo, administração antenatal de esteroides e o genótipo do MBL2. Um valor de p < 0,05 foi considerado estatisticamente significativo.
ResultadosForam incluídos neste estudo 131 prematuros. Dez foram excluídos por insuficiência da amostra de sangue, quatro devido a anomalias congênitas maiores e um devido à grande cirurgia. Na análise final, 116 bebês prematuros foram incluídos: 69 com MBL2 do tipo selvagem (genótipo AA) e 47 com variantes do MBL2 (genótipo AO/OO). No geral, a taxa de variantes do MBL2 em bebês prematuros foi de 41%. Os níveis de MBL foram significativamente menores e a deficiência e deficiência grave de MBL foram maiores nas variantes do MBL2 do que no MBL2 do tipo selvagem (p < 0,001). A tabela 1 mostra as características demográficas da população do estudo. Os polimorfismos dos códons 57 e 52 não foram detectados nos 116 recém‐nascidos prematuros durante a avaliação genética. O genótipo do códon 54 do MBL2 e as frequências alélicas foram de 59% para MBL2 do tipo selvagem (genótipo AA) e 41% para as variantes do MBL2 (genótipo AO e OO).
Características neonatais e maternas da população do estudo
| MBL2 do tipo selvagem(n = 69) | Variante do MBL2(n = 47) | p | |
|---|---|---|---|
| IG ao nascer, semmediana (intervalo) | 30 (29‐33) | 31 (29‐33) | 0,6a |
| Peso ao nascer, g(média ± DP) | 1.539 ± 574 | 1.459 ± 556 | 0,5b |
| Sexo, n (%) | |||
| Masculino | 40 (58) | 29 (62) | 0,7c |
| Feminino | 29 (42) | 18 (38) | |
| PIG, n (%) | 13 (19) | 14 (30) | 0,1c |
| Parto cesário, n (%) | 58 (84) | 36 (77) | 0,3c |
| Índice de APGAR, mediana (intervalo) | |||
| 1° minuto | 7 (5‐8) | 6 (4‐7) | 0,1a |
| 5° minuto | 8 (7‐9) | 8 (7‐9) | 0,1a |
| Esteroides antenatais, n (%) | |||
| Nenhum | 33 (48) | 30 (64) | 0,2c |
| Dose única | 18 (26) | 9 (19) | |
| Dose repetida | 18 (26) | 8 (17) | |
| Pré‐eclâmpsia materna, n (%) | 17 (25) | 15 (32) | 0,4c |
| Infecção materna, n (%) | 3 (4) | 4 (9) | 0,4c |
| RPM, n (%) | 13 (19) | 6 (13) | 0,4c |
| Corioamnionite, n (%) | 4 (6) | 2 (4) | 0,7c |
| Níveis de MBL, (ng/mL)mediana (intervalo) | 993 (257‐1812) | 10 (10‐473) | < 0,001a |
| Deficiência de MBL(nível de MBL < 700 ng/mL), n (%) | 30 (44) | 45 (96) | < 0,001c |
Valores com significância são apresentados em negrito.
IG, idade gestacional; MBL2, gene da lectina ligante de manose; PIG, pequeno para idade gestacional; RPM, Ruptura prematura de membranas.
A avaliação da morbidade em curto prazo com base no genótipo MBL2 revelou que as taxas de SDR e mortalidade foram significativamente maiores no grupo das variantes do MBL2 (p < 0,001, p = 0,03, respectivamente). A ECN foi mais prevalente no grupo MBL2 do tipo selvagem (p = 0,01). Não houve diferença entre os grupos MBL2 do tipo selvagem e das variantes em relação às taxas de HIV, DBP, ROP e ST (tabela 2). A consideração da morbidade em curto prazo com base nos níveis de MBL revelou que a SDR foi significativamente maior tanto no grupo com deficiência de MBL quanto no grupo com deficiência grave de MBL (p < 0,001). Verificou‐se que a ECN foi mais comum com níveis normais de MBL (p = 0,002). Não houve diferença significativa em bebês com ou sem deficiência de MBL em relação a HIV, DBP, ROP, ST e mortalidade (tabela 3). Além disso, como as análises univariadas mostraram que o desenvolvimento de SDR foi mais comum nas variantes do MBL2, o efeito da idade gestacional, peso ao nascer, sexo, uso de esteroides no pré‐natal, genótipo do MBL2 e fatores que podem afetar o desenvolvimento da SDR foram investigados através da análise de regressão logística. As variantes do MBL2 foram consideradas um fator independente para o desenvolvimento de SDR (odds ratio (OR): 5,1, intervalo de confiança de 95% (IC95%): 2,2‐11,9, p < 0,001).
Frequência de desfechos neonatais precoces de acordo com genótipos da lectina ligante de manose
| MBL2 do tipo selvagem(n = 69) | Variante do geneMBL2(n = 47) | pa | |
|---|---|---|---|
| SDR, n (%) | 21 (30) | 31 (66) | < 0,001 |
| HIV, (Grau de Papile 3‐4), n (%) | 3 (4) | 2 (4) | 0,9 |
| ECN, (>grau 1), n (%) | 9 (13) | 0 (0) | 0,01 |
| DBP, (grade 2‐3), n (%) | 16 (23) | 6 (13) | 0,2 |
| ROP, (>estágio 2), n (%) | 10 (15) | 3 (6) | 0,2 |
| ST, n (%) | 18 (26) | 16 (34) | 0,4 |
| Mortalidade, n (%) | 6 (9) | 11 (23) | 0,03 |
Valores com significância são apresentados em negrito.
DBP, displasia broncopulmonar; ECN, enterocolite necrosante; HIV, hemorragia intraventricular; MBL2, gene da lectina ligante de manose; ROP, retinopatia da prematuridade; SDR, síndrome do desconforto respiratório; ST, sepse tardia.
Níveis de lectina ligante de manose em relação aos desfechos neonatais precoces
| Deficiência de MBL | MBL Normal> 700 ng/mL(n = 41) | pa | ||
|---|---|---|---|---|
| < 150 ng/mL(n = 36) | 150‐700 ng/mL(n = 36) | |||
| SDR, n (%) | 28 (72) | 23 (64) | 1 (3) | < 0,001 |
| HIV, (Grau de Papile 3‐4), n (%) | 2 (5) | 1 (3) | 2 (5) | 0,7 |
| ECN, (> grau 1), n (%) | 0 (0) | 1 (3) | 8 (20) | 0,002 |
| DBP, (grade 2‐3), n (%) | 5 (13) | 5 (14) | 12 (29) | 0,1 |
| ROP, (> estágio 2), n (%) | 3 (8) | 4 (11) | 6 (15) | 0,06 |
| ST, n (%) | 14 (36) | 10 (28) | 10 (24) | 0,5 |
| Mortalidade, n (%) | 7 (18) | 7 (19) | 3 (7) | 0,3 |
Valores com significância são apresentados em negrito.
DBP, displasia broncopulmonar; ECN, enterocolite necrosante; HIV, hemorragia intraventricular; MBL, lectina ligante de manose; ROP, retinopatia da prematuridade; SDR, síndrome do desconforto respiratório; ST, sepse tardia.
Observamos que os níveis de MBL foram menores em neonatos prematuros com variantes do MBL2 do que naqueles com MBL2 do tipo selvagem. A SDR foi significativamente mais comum no grupo das variantes do MBL2 e também no grupo com deficiência de MBL. Além disso, as taxas de mortalidade foram maiores em neonatos prematuros com variantes do MBL2. Em nosso modelo de estudo, as variantes do MBL2 foram um fator independente significativo da SDR após ajuste para os efeitos de outros fatores. Além disso, a prevalência de ECN foi maior no grupo com MBL2 do tipo selvagem e com níveis normais de MBL. Acreditamos que nossos achados contribuirão para acumular evidências sobre o efeito da MBL nas morbidades em prematuros.
A família das colectinas e da MBL desempenha um papel importante na eliminação imune primária de microrganismos invasores na resposta imunitária inata, assim como na regulação das respostas imunitárias em curso contra a invasão microbiana. Estudos relataram também uma associação entre deficiência de MBL ou genótipo variante, bem como infecção e patologias pulmonares.19 O comprometimento da função pulmonar já foi relatado em pacientes com deficiência de MBL e fibrose cística. Pacientes com bronquiectasia e deficiência de MBL ou com variantes do MBL2 têm maior taxa de colonização microbiana crônica e recorrência frequente de problemas pulmonares.19,20 Em alguns estudos, com resultados semelhantes aos obtidos em nosso estudo, foi demonstrado que a deficiência de MBL ou a presença das variantes do MBL2 causam morbidade respiratória independente da infecção.1,21 Há uma elevada homologia de sequência entre MBL e SP‐A e SP‐D. Os genes que codificam essas proteínas estão localizados no braço longo do cromossomo 10 e pertencem a uma linhagem semelhante.22 A SP‐A e a SP‐D estão envolvidas na remoção de muitos patógenos nos pulmões e, embora a SP‐A seja particularmente conhecida em relação às suas funções imunológicas, a SDR está associada à diminuição dos níveis de SP‐A.23 A genética mutante do MBL2 está associada à produção insuficiente da proteína surfactante A, o que pode facilitar o desenvolvimento da SDR. Da mesma forma, também encontramos um aumento significativo na prevalência e mortalidade da SDR em pacientes com genética mutante do MBL2. A terapia seletiva precoce com surfactante na SDR reduz a lesão pulmonar e a mortalidade.24 Acreditamos que durante a avaliação do genótipo do MBL2 no momento do parto em prematuros com alto risco de SDR e ≤ 32 semanas de gestação e em casos limítrofes com indicação para o surfactante, a administração precoce de surfactantes a pacientes com genética mutante do MBL2 reduzirá a mortalidade e as morbidades pulmonares.
Nos últimos anos, tem havido um crescente interesse na associação entre MBL e morbidades inflamatórias. Tem sido relatado que a MBL ativa a via da lectina do complemento, resulta em dano por isquemia‐perfusão. Em pacientes com MBL2 do tipo selvagem, níveis mais elevados de MBL foram relatados e associados com ECN, resultaram em lesão de reperfusão após isquemia intestinal.10 De acordo com esses achados, em nosso estudo, a prevalência de ECN foi maior em prematuros com MBL2 do tipo selvagem e níveis normais de MBL. No entanto, alguns estudos relataram que não havia associação entre o genótipo do MBL2 e ECN.5,25 Em nosso estudo, o desenvolvimento de ECN pode ter sido relativamente mais comum devido a taxas de mortalidade significativamente maiores em pacientes com MBL2 do tipo selvagem. Como existem opiniões discutíveis na literatura sobre o genótipo do MBL2 e o desenvolvimento de ECN, estudos adicionais são necessários para esclarecer essa questão.
Neste estudo, de acordo com dados anteriores, não foi encontrada correlação entre o genótipo do MBL2 e os níveis de MBL com patologias associadas à inflamação, DBP, HIV e ROP.5,25 A avaliação da associação entre o genótipo do MBL2 e a morbidade foi o aspecto em comum desses estudos. Acreditamos que seria enganoso avaliar a associação do genótipo do MBL2 e o valor de MBL obtidos no momento do parto somente com as morbidades. Como os níveis de MBL aumentam à medida que a semana gestacional aumenta no grupo com MBL2 do tipo selvagem, a avaliação do desenvolvimento de morbidades com os níveis de MBL obtidos em diferentes semanas pós‐natais pode fornecer resultados mais precisos para demonstrar a associação entre a via da lectina e morbidades inflamatórias.2 Há uma necessidade clara de estudos extensos para investigar a associação entre MBL e morbidades inflamatórias em prematuros.
Embora a associação do genótipo do MBL2 com sepse comprovada por hemocultura não tenha sido relatada na literatura, a associação entre o genótipo do MBL2 e a sepse clínica precoce foi relatada.4,5,25 Em contraste, a associação entre a deficiência de MBL e sepse tem sido relatada em muitos estudos.3,18 No presente estudo, não encontramos associação entre o genótipo do MBL2 e os níveis de MBL com ST. Acreditamos que a resposta imunológica inadequada à infecção é observada devido aos baixos níveis de MBL nas primeiras semanas pós‐natais em bebês prematuros, mesmo que o genótipo do MBL2 seja do tipo selvagem. Portanto, estudos futuros devem avaliar os valores de MBL no momento da sepse juntamente com o genótipo.
Nosso estudo teve algumas limitações. A morbidade foi avaliada com base apenas no genótipo do MBL2 e com os níveis de MBL nas 24 horas após o nascimento, porque os níveis de MBL dos lactentes não foram reavaliados nos dias pós‐natais subsequentes. Além disso, os resultados obtidos com um número limitado de casos podem não refletir os resultados gerais. O ponto forte deste estudo foi a análise da associação do genótipo do MBL2 com o nível de MBL e morbidades em prematuros e a avaliação simultânea do nível de MBL nas primeiras 24 horas de vida.
Em conclusão, a presença de variantes do gene MBL2 e baixos níveis de MBL é importante fator de risco para o desenvolvimento da SDR em prematuros. Além disso, existe uma associação entre o gene MBL2 de tipo selvagem e ECN. Considerando a importância de demonstrar que a variante do gene MBL2 é um preditor independente de SDR, mais estudos prospectivos randomizados sobre esse tópico são claramente necessários.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Dogan P, Ozkan H, Koksal N, Oral HB, Bagci O, Guney Varal I. Mannose‐binding lectin gene polymorphism and its effect on short term outcomes in preterm infants. J Pediatr (Rio J). 2020;96:520–6.