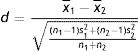Duchenne muscular dystrophy, an X-linked genetic disease, leads to progressive muscle weakness mainly in the lower limbs. Motor function tests help to monitor disease progression. Can low-cost, simple assessments help in the diagnostic suspicion of Duchenne muscular dystrophy? The authors aim to define the sensitivity of time to rise from the floor, time to walk 10meters, and time to run 10meters, evaluating them as eventual diagnostic screening tools.
MethodsThis is an analytical, observational, retrospective (1998–2015), and prospective study (2015–2018). Cases were recruited from the database of the pediatric neurology department and the healthy, from child care consultations, with normal gait development (up to 15 months) and without other comorbidities (neuromuscular, pulmonary, heart diseases) from the same university hospital.
Results128 Duchenne muscular dystrophy patients and 344 healthy children were analyzed, equally distributed in age groups. In Duchenne muscular dystrophy, there is a progressive increase in the means of the times to perform the motor tests according to the age group, which accelerates very abruptly after 7 years of age. Healthy children acquire maximum motor capacity at 6 years and stabilize their times. The time to rise showed a p-value <0.05 and a strong association (effect size [ES] >0.8) in all age groups (except at 12 years), with time to walk 10 meters from 9 years, and with time to run 10 meters, from 5 years. The 100% sensitivity points were defined as follows: time to rise, at 2s; time to walk 10 meters, 5s; time to walk 10 meters, 4s.
ConclusionsTime to rise is a useful and simple tool in the screening of neuromuscular disorders such as Duchenne muscular dystrophy, a previously incurable disease with new perspectives for treatment.
A distrofia muscular de Duchenne, doença genética ligada ao X, determina fraqueza muscular progressiva principalmente em membros inferiores. Os testes de função motora ajudam a monitorar a progressão da doença. Avaliações simples de baixo custo podem ajudar na suspeita diagnóstica da distrofia muscular de Duchenne? Objetivamos definir a sensibilidade do tempo levantar, tempo andar 10 metros e tempo correr 10 metros, avaliando-os como eventuais ferramentas de triagem diagnóstica.
MétodosEstudo analítico, observacional, retrospectivo (1998 até 2015) e prospectivo (2015 até 2018). Os casos foram recrutados do banco de dados do serviço de neurologia infantil e os saudáveis, de consultas de puericultura, com desenvolvimento de marcha normal (até os 15 meses) e sem outras comorbidades (neuromusculares, pneumopatias, cardiopatias), do mesmo hospital universitário.
ResultadosForam analisados 128 pacientes com distrofia muscular de Duchenne e 344 saudáveis, distribuídos igualmente em faixas etárias. Na distrofia muscular de Duchenne ocorre aumento progressivo das médias dos tempos para realizar as provas motoras, de forma acentuada a partir dos 7 anos. Os saudáveis estabilizam os tempos a partir dos 6 anos, adquirindo capacidade motora máxima. O tempo de levantar apresentou p-valor <0,05 e forte associação (TE >0,8) em todas as faixas etárias (exceto aos 12 anos), tempo de andar 10 metros a partir de 9 anos e o tempo de correr 10 metros, dos 5 anos. Os pontos de 100% sensibilidade foram definidos: tempo de levantar aos 2 segundos; tempo de andar, 5 segundos e tempo de correr 10 metros, 4 segundos.
ConclusõesO tempo de levantar é útil e simples na triagem de doenças neuromusculares como a distrofia muscular de Duchenne, doença antes incurável com novas perspectivas de tratamento.
A distrofia muscular de Duchenne (DMD) é a segunda doença genética mais comum1 com incidência de um para cada 3.500-5.000 recém-nascidos do sexo masculino.2 O gene no lócus Xp21.2 codifica a proteína distrofina3 e define sua herança recessiva ligada ao X.
As primeiras manifestações clínicas da DMD são atraso de desenvolvimento neuropsicomotor e/ou dificuldades motoras, após segundo ano de vida (fase 1).4–6 A fraqueza aparece na cintura pélvica entre 2-4 anos com dificuldade de correr, subir escadas, pular, marcha na ponta dos pés e posteriormente quedas frequentes (fase 2). Observa-se, logo no início, o levantar miopático (sinal de Gowers), hipertrofia de panturrilha e marcha digitígrada com báscula da bacia. Na progressão da doença outros grupamentos musculares são gradativamente envolvidos, com aumento das limitações motoras (fase 3 a 5).6
O diagnóstico precoce é fundamental para instituir medidas que atenuem o curso natural da doença e evitar novos casos pelo aconselhamento genético. O diagnóstico precoce só é possível com reconhecimento dos sintomas, solicitação do teste de triagem (dosagem sérica de creatinofosfoquinase, comumente acima de 10.000 UI/l) e encaminhamento para especialistas ao diagnóstico definitivo, por análise molecular e/ou biópsia muscular com imuno-histoquímica.7
Mensurações motoras têm sido usadas para acompanhamento do mesmo indivíduo ao longo do tempo, obtêm-seo parâmetros objetivos evolutivos, que auxiliam na percepção de progressão ou estabilidade de seus problemas, ajudam a reavaliar condutas e servem de medidas de desfecho em ensaios clínicos. Medidas padronizadas de tempo de execução de funções motoras são recomendadas no seguimento desses pacientes nos consensos nacionais e internacionais: teste da caminhada de 6 minutos (TC6M), tempos para andar/correr 10 metros (TA10M e TC10M), tempos para se levantar do chão (TL), se levantar da cadeira e tempo para subir quatro degraus.6–11
Poucos estudos avaliam o TL em separado, mas o seu papel como preditor da progressão da doença tem ganhado destaque.12 O teste TA10M é facilmente executável, por exigir menor distância a ser percorrida e ter menor influência ambiental quando comparado ao TC6M. Além disso, pode ser feito tanto na doença neuromuscular mais avançada, mais próximo da perda da marcha, quanto nas fases mais iniciais de doença, com menor comprometimento motor.13 No entanto, existem poucos dados por faixa etária para o teste TA10M, por vezes, apenas dados do seguimento de estudos longitudinais por 36 meses14 até 48 meses15 ou de medidas individuais por idade.13 O TC10M avalia a capacidade motora máxima dos testes cronometrados e pode ser usado como ferramenta auxiliar.
Objetivamos, com o presente estudo, a partir dos valores dos testes motores padronizados de crianças típicas brasileiras (TL, TA10M e TC10M já publicados16), verificar o desempenho motor das crianças com DMD, estratificadas por idade. Definir sensibilidade e especificidade desses testes, avaliá-los como eventuais ferramentas de triagem diagnóstica da DMD.
MetodologiaFez-se um estudo analítico, observacional, retrospectivo (dados coletados entre 1998-2015) e prospectivo (abril 2015 a 2018), da função motora de crianças com DMD do Serviço de Neurologia Infantil do Instituto de Puericultura e Pediatria Martagão Gesteira (IPPMG) da Universidade Federal do Rio de Janeiro (UFRJ). A função motora foi comparada à de crianças típicas (sem doença neuromuscular), estratificadas por idade, dos dois aos 12 anos. Projeto aprovado pelo Comitê de Ética em Pesquisa (CEP) do IPPMG.
O banco de dados dos pacientes com DMD tinha 137 acompanhados ou em acompanhamento no serviço, até início do estudo prospectivo. Houve inserção de 19 novos com diagnóstico confirmado, total da amostra de 156 pacientes.
Importante destacar que a rotina do serviço de neuropediatria inclui feitura, nas consultas, por equipe treinada e capaz, dos testes motores padronizados na avaliação dos pacientes com doença neuromuscular. Todos os pacientes são orientados a seguir as recomendações vigentes para a DMD (corticoterapia e fisioterapia).
Quando informações eram discordantes, os prontuários eram revistos para ratificação. Não foi feito estudo prospectivo com definição seriada de tempo de acompanhamento. Tratou-se da obtenção de dados motores feitos ao longo das consultas ambulatoriais (seguem o agendamento anual ou semestral). Em caso de consultas extras por intercorrências ou demais demandas, os dados motores também eram inseridos.
A amostra dos típicos foi composta por 345 crianças atendidas no ambulatório de pediatria geral do IPPMG, na faixa de dois a 12 anos, coletadas de julho 2011 até 2012.16
Escolheu-se idade inicial de dois anos para avaliação, razoável e precoce para o diagnóstico de eventual doença neuromuscular e alguns meses após o desenvolvimento desse grande marco motor.17 Delimitou-se a idade limite de 12 anos, máxima de atendimento no IPPMG.
Critérios de inclusão no grupo com DMD: acompanhados e com diagnóstico de DMD (pesquisa molecular ou biópsia muscular e/ou história familiar positiva). No grupo das crianças típicas, aqueles que compareceram à consulta de pediatria geral de julho 2011 a 2012, com idade de 2-12 anos e desenvolvimento de marcha normal (início até 15 meses).
Critérios de exclusão no grupo do DMD englobaram diagnóstico de outras doenças neuromusculares; quadros agudos de pneumopatia ou cardiopatia nos últimos seis meses e não concordância em participar do estudo. No grupo dos típicos, além do atraso da marcha, doenças ortopédicas e reumatológicas; déficit cognitivo moderado/grave; outras doenças crônicas e os já listados acima.
Descrição das variáveis do estudoTempo de Levantar (TL) do solo: cronometrou-se o tempo da criança se levantar, saindo da posição sentada com pernas cruzadas (chinês ou em anel) até colocar-se na posição de ortostase, sem apoio lateral ou qualquer outro auxílio de impulso.
Tempo para Andar 10 Metros (TA10M): cronometrou-se o tempo da criança percorrer, em passos normais, uma distância previamente delimitada de 10 metros, em posição ereta, sem apoio lateral ou qualquer outro auxílio, em terreno plano.
Tempo para Correr 10 Metros (TC10M): cronometrou-se o tempo para correr uma distância previamente delimitada de 10 metros.
As provas motoras eram explicadas e exemplificadas previamente. Feitas com as crianças descalças, vestuário leve, em ambiente tranquilo com temperatura adequada e auxílio de cronômetro. Usaram-se comandos verbais simples estimulantes não padronizados, com intuito de incentivar melhor resposta motora.
Quando ocorria erro no entendimento ou na execução da tarefa, tais valores eram desconsiderados e o teste motor repetido. Por vezes e diversos motivos (dificuldade de colaboração, execução e disposição) os pacientes com DMD não conseguiam fazer todas as provas motoras, porém usávamos dados motores das provas que foram feitas e relatávamos as não executadas. Procuramos considerar todos os dados coletados com intuito de auxiliar na avaliação da progressão da doença.
Análise estatísticaDados foram registrados no Microsoft Office Excel versão 2007. Nos pacientes de DMD, na maioria das vezes, havia registro de mais de um dado motor por faixa etária, de um mesmo teste motor. Optou-se, para comparação com os saudáveis, por fazer a média na faixa etária correspondente. Após finalização dos bancos, os dados foram analisados no programa IBM SPSS Statistics (versão 21), por medidas de tendência central (média, mediana) e dispersão (desvio-padrão e variações mínimo-máximo).
Usou-se teste t não paramétrico – Mann Whitney para comparar médias de subgrupos populacionais distintos (duas amostras independentes com pequeno número amostral). Considerou-se o p valor do teste t<0,05 (5%) como estatisticamente significativo. Com objetivo de agregar informações ao conceito de significância estatística, optou-se por fazer o tamanho do efeito (TE), capaz de quantificar a diferença existente. Fez-se cálculo denominado d de Cohen, conforme equação representada
Usamos esse critério na análise comparativa: valores = 0,20 e <0,50 indicam baixa responsividade; valores = 0,50 e <0,80, moderada responsividade e valores = 0,80, alta responsividade.
Em seguida, consideramos a primeira avaliação de função motora dos pacientes com DMD como casos suspeitos de doença e comparamos com os típicos, estratificados por idade. Construiu-se curva ROC para cada teste motor e faixa etária. Devido à potencial aplicação dos testes de função motora na triagem de doenças neuromusculares, definimos sensibilidade de 100% como ideal e maior especificidade possível correspondente à mesma. Assim, definiram-se os valores de corte para testes motores da DMD e respectivas faixas etárias. Todos os casos suspeitos foram confirmados como casos de pacientes com DMD, exceto quatro pacientes que tiveram outros diagnósticos.
ResultadosResultados geraisDa amostra inicial de 137 fichas de DMD, 20 pacientes já haviam perdido marcha na sua primeira avaliação, quatro não confirmaram a hipótese principal de DMD com diagnóstico de outras doenças neuromusculares (falsos positivos) e dois tinham registros duplicados, ou seja, total de 111 pacientes no estudo prospectivo. Dos 19 pacientes novos, um foi excluído por deficiência intelectual grave e distúrbio comportamental, outro por apresentar idade de primeira avaliação acima de 12 anos. Portanto, 17 pacientes foram incluídos no estudo prospectivo. A amostra final foi de 128 pacientes com DMD.
Além disso, como o mesmo paciente com DMD contribuiu com dados, na maioria das vezes, em mais de uma faixa etária e nos subsequentes testes motores, totalizaram-se 935 testes motores dos pacientes com DMD, distribuídos em 405 de TL, 459 de TA10M e 71 de TC10M. O número amostral dos típicos foi de 344 crianças, fez-se uma única avaliação motora, o número total de 1.026 testes motores foi distribuídos: 339 de TL, 344 de TA10M e 343 de TC10M.
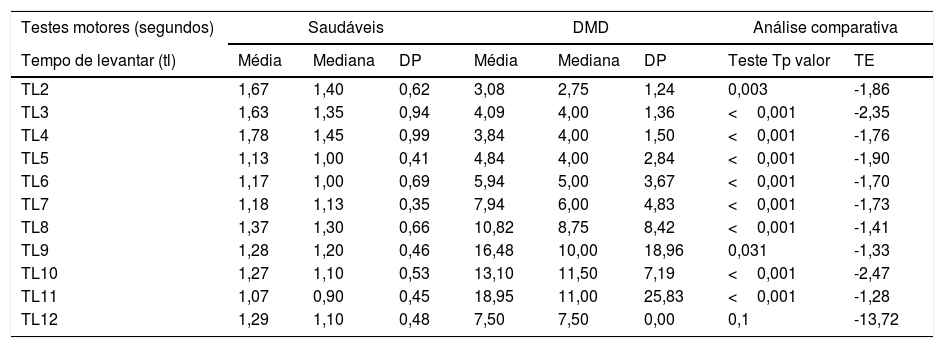
Resultado das provas de função motoraOs valores de média, mediana e DP dos testes motores dos pacientes com DMD e saudáveis, além dos resultados da análise comparativa (p valor e TE), estão na tabela 1.
Análise comparativa do tempo de levantar, tempo de andar 10 metros e tempo de correr 10 metros dos DMD e das crianças saudáveis por faixa etária
| Testes motores (segundos) | Saudáveis | DMD | Análise comparativa | |||||
|---|---|---|---|---|---|---|---|---|
| Tempo de levantar (tl) | Média | Mediana | DP | Média | Mediana | DP | Teste Tp valor | TE |
| TL2 | 1,67 | 1,40 | 0,62 | 3,08 | 2,75 | 1,24 | 0,003 | -1,86 |
| TL3 | 1,63 | 1,35 | 0,94 | 4,09 | 4,00 | 1,36 | <0,001 | -2,35 |
| TL4 | 1,78 | 1,45 | 0,99 | 3,84 | 4,00 | 1,50 | <0,001 | -1,76 |
| TL5 | 1,13 | 1,00 | 0,41 | 4,84 | 4,00 | 2,84 | <0,001 | -1,90 |
| TL6 | 1,17 | 1,00 | 0,69 | 5,94 | 5,00 | 3,67 | <0,001 | -1,70 |
| TL7 | 1,18 | 1,13 | 0,35 | 7,94 | 6,00 | 4,83 | <0,001 | -1,73 |
| TL8 | 1,37 | 1,30 | 0,66 | 10,82 | 8,75 | 8,42 | <0,001 | -1,41 |
| TL9 | 1,28 | 1,20 | 0,46 | 16,48 | 10,00 | 18,96 | 0,031 | -1,33 |
| TL10 | 1,27 | 1,10 | 0,53 | 13,10 | 11,50 | 7,19 | <0,001 | -2,47 |
| TL11 | 1,07 | 0,90 | 0,45 | 18,95 | 11,00 | 25,83 | <0,001 | -1,28 |
| TL12 | 1,29 | 1,10 | 0,48 | 7,50 | 7,50 | 0,00 | 0,1 | -13,72 |
| Tempo de Andar 10 Metros (Ta10m) | Média | Mediana | DP | Média | Mediana | DP | Teste Tp valor | TE |
|---|---|---|---|---|---|---|---|---|
| TA2 | 13,14 | 13,60 | 2,06 | 7,25 | 7,50 | 0,96 | 0,002 | 3,12 |
| TA3 | 12,05 | 12,00 | 1,86 | 7,98 | 7,99 | 1,56 | <0,001 | 2,32 |
| TA4 | 11,07 | 10,70 | 2,39 | 9,46 | 9,43 | 2,48 | 0,016 | 0,68 |
| TA5 | 10,35 | 10,30 | 1,77 | 9,34 | 9,50 | 2,94 | 0,046 | 0,43 |
| TA6 | 10,11 | 9,75 | 2,33 | 10,05 | 9,00 | 3,21 | 0,732 | 0,02 |
| TA7 | 9,85 | 9,95 | 2,05 | 11,61 | 10,00 | 4,94 | 0,776 | -0,42 |
| TA8 | 9,95 | 9,80 | 1,84 | 10,98 | 10,00 | 3,59 | 0,302 | -0,34 |
| TA9 | 9,91 | 9,60 | 2,12 | 13,53 | 12,00 | 5,75 | <0,001 | -0,86 |
| TA10 | 10,49 | 10,30 | 1,86 | 13,68 | 12,00 | 4,64 | 0,001 | -0,86 |
| TA11 | 9,32 | 9,30 | 1,51 | 13,54 | 12,00 | 4,11 | 0,001 | -1,46 |
| TA12 | 9,42 | 9,00 | 1,63 | 16,64 | 13,00 | 8,47 | 0,002 | -1,48 |
| Tempo de Correr 10 Metros (TC10M) | Média | Mediana | DP | Média | Mediana | DP | Teste Tp valor | TE |
|---|---|---|---|---|---|---|---|---|
| TC2 | 7,95 | 7,75 | 1,48 | 5,00 | 5,00 | 0,00 | 0,096 | 1,50 |
| TC3 | 6,89 | 7,00 | 1,10 | 6,25 | 6,25 | 1,06 | 0,313 | -0,61 |
| TC4 | 6,18 | 5,90 | 1,20 | 6,01 | 5,65 | 1,46 | 0,648 | 0,14 |
| TC5 | 5,38 | 5,20 | 0,92 | 8,38 | 8,25 | 3,20 | 0,05 | -2,40 |
| TC6 | 4,99 | 5,00 | 0,63 | 6,92 | 6,34 | 1,60 | <0,001 | -2,09 |
| TC7 | 4,86 | 4,65 | 0,61 | 8,66 | 7,81 | 3,60 | <0,001 | -2,03 |
| TC8 | 4,88 | 4,80 | 0,65 | 7,36 | 6,70 | 2,97 | 0,001 | -1,54 |
| TC9 | 4,78 | 4,70 | 0,70 | 7,63 | 8,70 | 2,75 | 0,031 | -2,80 |
| TC10 | 4,72 | 4,70 | 0,67 | 8,70 | 9,00 | 1,79 | 0,001 | -4,55 |
| TC11 | 4,63 | 4,80 | 0,81 | 8,60 | 10,00 | 2,42 | 0,008 | -3,90 |
| TC12 | 4,89 | 4,90 | 0,71 | 9,67 | 9,67 | 0,00 | 0,099 | -7,14 |
A tabela representa a média dos testes motores (TL – Tempo de Levantar, TA10M – Tempo de Andar 10 Metros e TC10M – Tempo de Correr 10 Metros) dos pacientes com DMD e saudáveis, além da análise comparativa do p valor (p valor <0,05) e tamanho do efeito (TE),
TL2, Tempo de Levantar 2 anos; TL3, Tempo de Levantar 3 anos; TL4, Tempo de Levantar 4 anos; TL5, Tempo de Levantar 5 anos; TL6, Tempo de Levantar 6 anos; TL7, Tempo de Levantar 7 anos; TL8, Tempo de Levantar 8 anos; TL9, Tempo de Levantar 9 anos; TL10, Tempo de Levantar 10 anos; TL11, Tempo de Levantar 11 anos; TL12, Tempo de Levantar 12 anos.
TA2, Tempo de Andar 2 anos; TA3, Tempo de Andar 3 anos; TA4, Tempo de Andar 4 anos; TA5, Tempo de Andar 5 anos; TA6, Tempo de Andar 6 anos; TA7, Tempo de Andar 7 anos; TA8, Tempo de Andar 8 anos; TA9, Tempo de Andar 9 anos; TA10, Tempo de Andar 10 anos; TA11, Tempo de Andar 11 anos; TA12, Tempo de Andar 12 anos.
TC2, Tempo de Correr 2 anos; TC3, Tempo de Correr 3 anos; TC4, Tempo de Correr 4 anos; TC5, Tempo de Correr 5 anos; TC6, Tempo de Correr 6 anos; TC7, Tempo de Correr 7 anos; TC8, Tempo de Correr 8 anos; TC9, Tempo de Correr 9 anos; TC10, Tempo de Correr 10 anos; TC11, Tempo de Correr 11 anos; TC12, Tempo de Correr 12 anos.
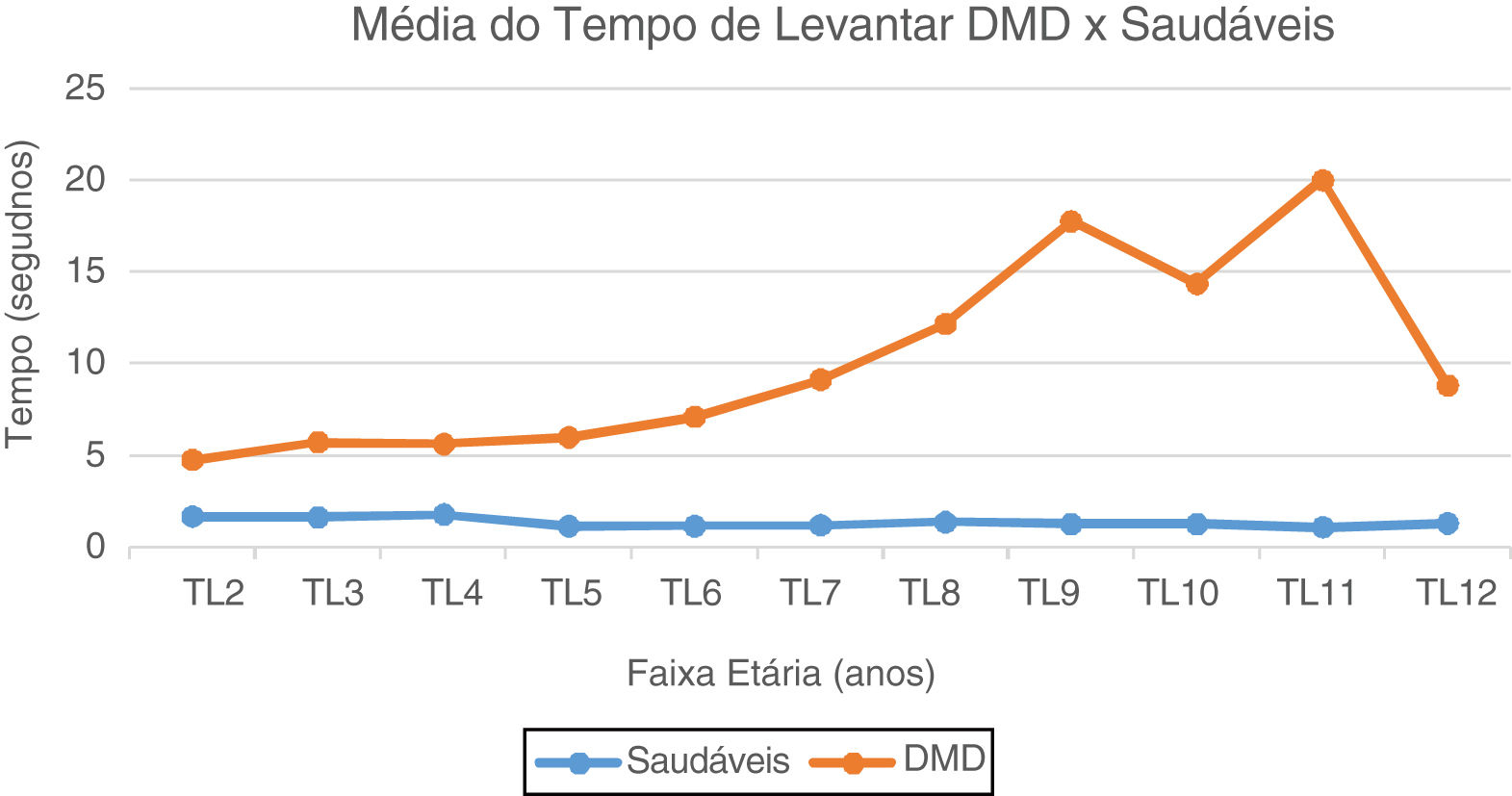
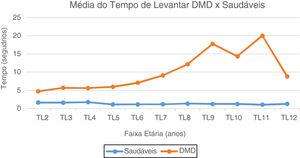
No TL do solo, os valores de média e mediana dos pacientes com DMD são maiores do que dos pacientes saudáveis em todas faixas etárias (de 1,8 vez aos dois anos até 17,7 vezes aos 11 anos). Representação gráfica visualizada na figura 1.
Gráfico da Média do Tempo de Levantar: DMD e Saudáveis. Representação gráfica da média do Tempo de Levantar do solo nos paciente com DMD e Saudáveis. TL2, Tempo Levantar 2 anos; TL3, Tempo Levantar 3 anos; TL4, Tempo Levantar 4 anos; TL5, Tempo de Levantar 5 anos; TL6, Tempo Levantar 6 anos; TL7, Tempo de Levantar 7 anos; TL8, Tempo de Levantar 8 anos; TL9, Tempo de Levantar 9 anos; TL10, Tempo de Levantar 10 anos; TL11, Tempo de Levantar 11 anos; TL12, Tempo de Levantar 12 anos.
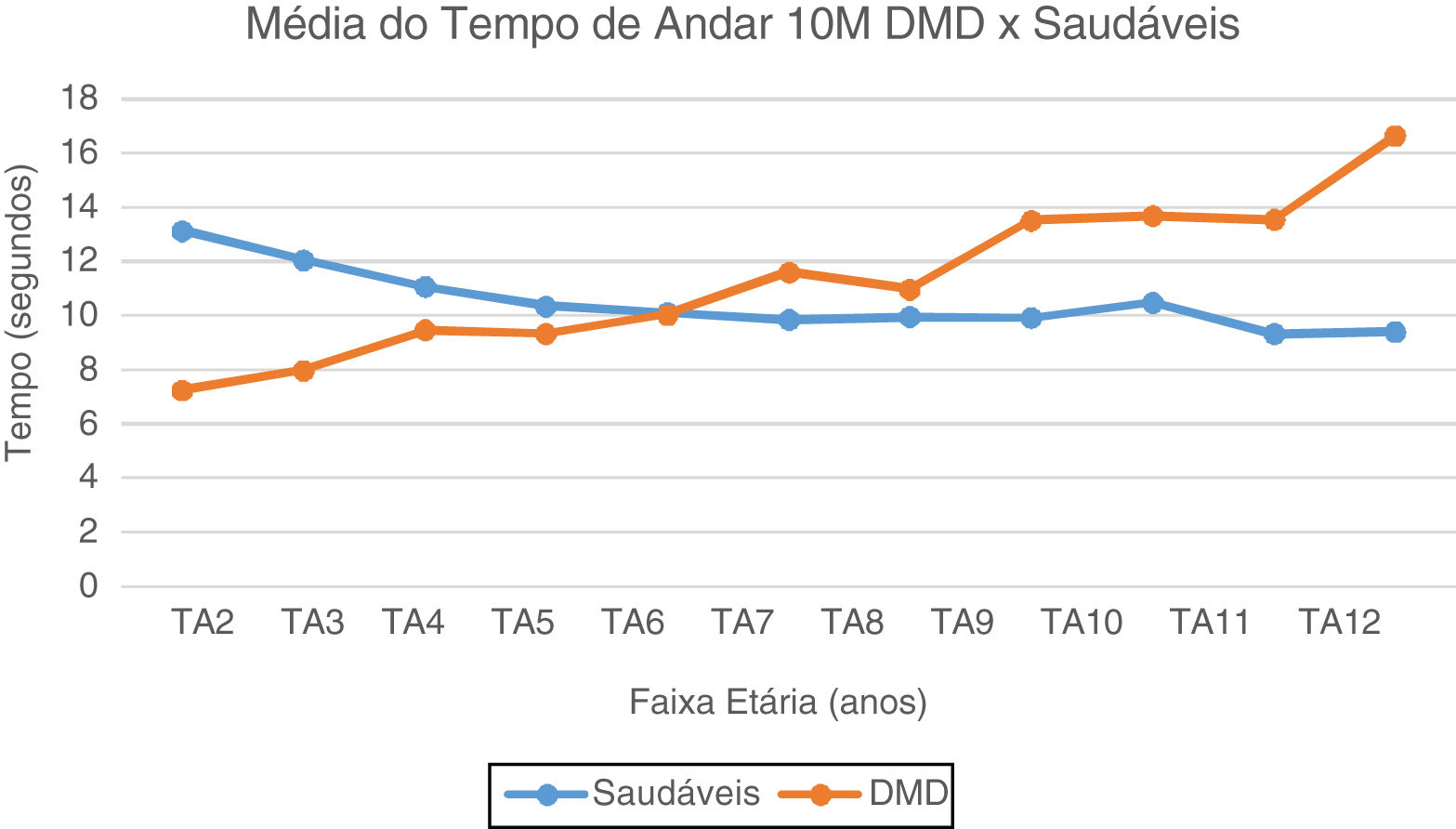
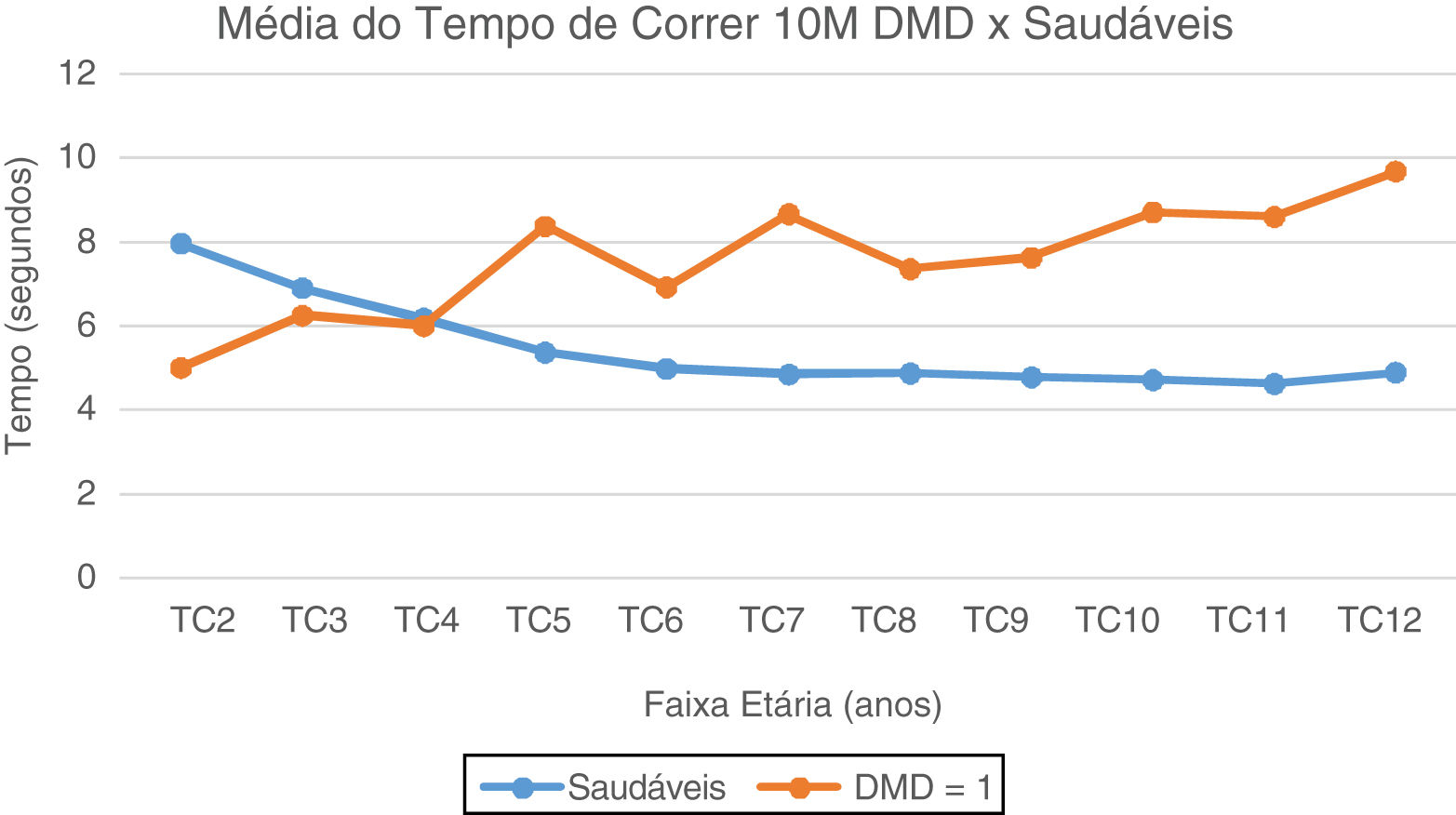
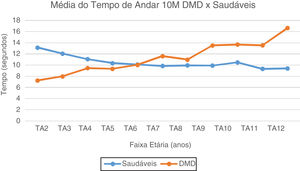
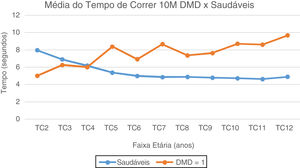
No TA10M, notam-se a partir dos seis anos valores de média e mediana com aumento gradativo e com perda da marcha subsequente, quando comparados aos típicos, que estabilizam valores de média do TA10M em torno de 10 segundos. (fig. 2). No TC10M, notamos padrão progressivo da piora dos tempos na DMD a partir dos quatro anos quando comparado aos típicos (fig. 3).
Média do Tempo de Andar 10 Metros: DMD e Saudáveis. Representação gráfica da média do Tempo de Andar 10 Metros nos paciente com DMD e Saudáveis. TA2, Tempo Andar 2 anos; TA3, Tempo Andar 3 anos; TA4, Tempo Andar 4 anos; TA5, Tempo de Andar 5 anos; TA6, Tempo Andar 6 anos; TA7, Tempo de Andar 7 anos; TA8, Tempo de Andar 8 anos; TA9, Tempo de Andar 9 anos; TA10, Tempo de Andar 10 anos; TA11, Tempo de Andar 11 anos; TA12, Tempo de Andar 12 anos.
Média do Tempo de Correr 10 Metros: DMD e Saudáveis. Representação gráfica da média do Tempo de Correr 10 Metros nos paciente com DMD e Saudáveis. TC2, Tempo Correr 2 anos; TC3, Tempo Correr 3 anos; TC4, Tempo Correr 4 anos; TC5, Tempo de Correr 5 anos; TC6, Tempo Correr 6 anos; TC7, Tempo de Correr 7 anos; TC8, Tempo de Correr 8 anos; TC9, Tempo de Correr 9 anos; TC10, Tempo de Correr 10 anos; TC11, Tempo de Correr 11 anos; TC12, Tempo de Correr 12 anos.
A sensibilidade foi de 100% para todas as provas de função motora avaliadas e em todas as faixas etárias. Enquanto a especificidade variou de 39% até 100% no TL, de 0-3% no TA10M e 0-100% no TC10M.
Quanto ao TL, nos pré-escolares até início da idade escolar, os valores se aproximam dos 2 segundos (para ponto de corte de suspeição da DMD). No TA10M, observaram-se, nos pré-escolares e escolares, pontos de corte de 5 segundos e no TC10M, o valor mínimo de ponto de corte encontrado foi de 4 segundos.
DiscussãoEste estudo demonstra que pacientes com DMD apresentam desempenho pior e progressivo nos TL, TA10M e TC10M; acentuam-se gradativamente no início da idade escolar, culminam com incapacidade de fazê-los no início da adolescência, enquanto as crianças típicas estabilizam seu desempenho aos seis anos, quando adquirem sua função motora máxima.
As provas de função motoras avaliadas discriminaram muito bem as crianças típicas daquelas com DMD, estudo inédito na população brasileira. No TL do solo, nos pré-escolares com DMD, notamos curva retilínea, sem ganhos ou perdas, que correspondeu à fase 1 (pré-sintomática).6 A partir dos cinco anos o aumento do tempo é gradativo, corresponde ao estágio 2da DMD,6 fase em que o sinal de Gowers aparece. Dos seis aos nove anos, uma fase de progressão mais rápida, que coincide com o estágio 3 (transição),6 fase em que se tem perda da capacidade de levantar do solo e de subir escadas. No início da adolescência, a partir dos 11 anos, os pacientes já se encontram no estágio 4,6 no qual pequeno número ainda é capaz de fazer TL (n=10), com tempos cada vez maiores de execução e, aos 12 anos, apenas um paciente foi capaz de fazer.
No TA10M, a partir dos seis anos, piora o desempenho nos pacientes com DMD. A partir dos nove anos, diferenças das médias para feitura do TA10M tornam-se cada vez mais significantes, o que coincide e pode ser justificado pelo fim da fase de deambulação precoce para início da tardia, período de transição para progressão da perda da função dos membros inferiores.6 E estabilização dos valores dos 9-11 anos, o que pode ser devido às evoluções mais lentas e estáveis, mas culminou aos 12 anos com dobro do tempo para fazer o TA10M e já com grande maioria de pacientes não deambulantes. Portanto, no fim da idade escolar e início da adolescência, muitos já perderam a capacidade do TL e uma porcentagem inicia dificuldade ou já é incapaz de andar.
No TC10M, a partir dos quatro anos, pacientes com DMD são mais lentos do que as crianças típicas. Notaram-se dois picos de aumento em faixas etárias bem definidas (5 e 7 anos), compatível com padrão da transição do estágio 2 de deambulação precoce para uma fase de deambulação tardia do estágio 3, e, de acordo com o limite de idade de até os sete anos, ainda podermos observar melhorias de desempenho, como já relatado no TC6M.15 Por tratar-se de um teste que exige maior velocidade e explosão do uso de musculatura, impossibilita menos os mecanismos compensatórios, essa variabilidade de desempenho entre os indivíduos fica mais perceptível, principalmente na faixa dos cinco aos sete anos. A partir de então, progressão de piorai linear, que segue padrão evolutivo de pioria correspondente à perda da capacidade de correr, mesmo antes da capacidade de andar, ou seja, no estágio 4.
Diferenças encontradas nas médias dos TL foram mais substanciais do que as dos demais testes de caminhada (TA10M e TC10M). O TL, de rápida execução e fácil aplicabilidade, é também o mais precoce para nortear triagem dos casos suspeitos de DMD. Além disso, pode ter papel preditor da progressão da doença como já demonstrado em 2016, no estudo italiano.12
A pioria ao longo dos anos dos testes motores (TC6M e TL) já havia sido descrita, assim como observado nos nossos dados, em um estudo longitudinal de 24 meses,18 com valores mais evidentes para os meninos maiores de sete anos. Os mesmos autores demonstraram alta correlação do TL com TC6M (r=0,6, p <0,01), confirmaram que o TL é o fator prognóstico mais precoce para a progressão da DMD e consequentemente perda da marcha.12
Adicionalmente, em estudo longitudinal de 12 meses,19 demonstrou-se pioria progressiva a partir dos seis anos. Nosso estudo também apresenta aumento gradativo dos valores do TA10M, porém com progressão mais rápida dos pacientes brasileiros.
Nos estudos prévios que avaliaram o TC6M e NSAA em pacientes com DMD, descreve-se progressão (12, 24 e 36 meses)14,18,19 em semelhança com o presente estudo.
Um grupo de pesquisadores americanos15 analisou o TC6M e outros testes de função motora cronometrados em estudo multicêntrico de 48 semanas. No TL, apesar de a postura de saída do solo ser diferente, valores ficaram bem próximos aos do presente estudo. Todavia, os TA/TC10M brasileiros do nosso estudo apresentaram pior desempenho do que os americanos.
A velocidade de progressão não é linear. Demonstramos isso nos dados do TA10M, nos quais a maior velocidade de progressão ocorre no início da segunda década de vida. Outros autores, que usaram os dados dos pacientes dos estudos prévios,15,19–21 desenvolveram modelos de evolução da DMD, com potencial melhoria do TC6M até os 10 anos, mas depois com declínio rápido no desempenho.
Existem poucos estudos que descrevem TA10M ou TL por faixa etária. Uma base de dados22 de 240 meninos com DMD, 4-12 anos, descreve que o TL permanece na faixa de 4-6 segundos nos primeiros seis anos e depois atinge 6-8 segundos, o que se assemelha aos nossos dados. Quanto à média do TA/TC10M, o estudo citado revelou valores médios de 6-8 segundos até os sete anos, com poucas oscilações e seguidos com posterior aumento até 8-10 segundos. Encontramos nos nossos pacientes, já a partir dos quatro anos, tempos médios de feitura do TA10M acima de 8 segundos, ou seja, um pior desempenho na fase pré-escolar. Reforçamos o fato de que nosso estudo é o pioneiro no TL na idade pré-escolar.
Poucos foram os estudos comparativos prévios ao nosso e, aqueles existentes, com amostras bem menores. Todavia, sugeriam pior desempenho dos pacientes com DMD quando comparados a crianças típicas, em escolares para TL e TA10,22 assim como para TC6M.23
Uma limitação do nosso estudo foi o número de dados feitos para cada teste motor e menor número de dados de TC10M na DMD. Justifica-se pela maior dificuldade técnica dos pacientes com fraqueza muscular de desempenhar um teste na sua função motora máxima, que exige esforço e predispõe cansaço físico, mas reproduz o que ocorre no acompanhamento desses pacientes. No grupo das crianças típicas, o número de dados ficou mais homogêneo de acordo com as faixas etárias e os testes motores, ocorreu redução nos extremos de idade (2 e 12 anos), o que também acontece até de forma mais ampla da DMD, pela pioria progressiva na adolescência. A divisão por faixa etária forma subgrupos quem apesar de permitir uma melhor análise, reduzem a distribuição do número amostral por faixa etária, contudo satisfatório no presente estudo.
De fato, os tempos absolutos dos pacientes brasileiros com DMD são maiores quando comparados aos estudos americanos e europeus. O início tardio da corticoterapia que estaria diretamente relacionada à fase de progressão da doença e destruição muscular, com substituição do músculo por tecido adiposo e fibrose,24 os fatores de variabilidade inter-individual e modificadores genéticos25 podem justificar este achado.
Para triagem diagnóstica precoce definimos os seguintes pontos de corte para testes de função motora: para TL, 2 segundos; para TA10M, 5 segundos e para TC10M, 4 segundos. Esses parâmetros (ênfase para TL de 2 segundos, por ser o mais precoce discriminador) são testes de fácil execução, factíveis pelo pediatra em ambiente ambulatorial e domiciliar, com baixíssimos custos, podem auxiliar na suspeita de novos casos da DMD em fases iniciais. A recomendação de exames complementares para as famílias que apresentam o caso índice pode ser feita já ao nascimento. O teste do levantar poderia ser inserido na consulta de puericultura a partir dos 2 anos com exame de triagem obrigatório para a pesquisa de doenças neuromusculares.
Só podemos reduzir o tempo até o diagnóstico se aumentarmos a suspeição da DMD, com estratégias que atuem efetivamente nas fases pré-sintomáticas ou na detecção dos sintomas precoces. Infelizmente, a idade média de diagnóstico definitivo no Brasil é de 7,5 anos,4 muito próxima à idade média de perda da marcha, enquanto na maioria dos países no mundo está em torno de 4-5 anos.26 Em suma, a proposta é trazer ferramentas que ajudem a abreviar o diagnóstico e, adicionalmente, melhor acompanhamento dos pacientes com DMD.
Nas crianças normais, há melhoria do desempenho da função motora até os seis anos com subsequente estabilização das provas até adolescência. Nos meninos com DMD, as médias dos tempos dessas provas aumentam, particularmente a partir dos sete anos, culminam com incapacidade de fazer os testes motores no fim da idade escolar e início da adolescência.
A rápida execução, o baixo custo e a técnica simples tornam os testes motores apresentados possíveis de ser usados como ferramenta diagnóstica na triagem para doenças neuromusculares, se usados no acompanhamento do desenvolvimento motor em puericultura. O TL é um ótima ferramenta capaz de abreviar o diagnóstico do DMD, fato de extrema importância atual pelas novas perspectivas de terapias específicas.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Ao estatístico Ronir Raggio Luiz e a sua assistente Jéssica Pronestino. Aos alunos do PINC (Projeto de Iniciação Científica) Bruna Maciel, Luisa Vieira, Monique Minini Lima e Yuri Devaud. A todas as crianças e responsáveis que participaram deste estudo por sua prestatividade e solidariedade, se ofereceram a ajudar esta pesquisa científica ao saberem que seu principal objetivo era abreviar o diagnóstico da distrofia muscular de Duchenne. Aos parentes e às crianças com DMD, exemplo de perseverança e otimismo.
Como citar este artigo: Pereira AC, Araújo AP, Ribeiro MG. Can simple and low-cost motor function assessments help in the diagnostic suspicion of Duchenne muscular dystrophy? J Pediatr (Rio J). 2020;96:503–10.
Study conducted at Universidade Federal do Rio de Janeiro (UFRJ), Instituto de Pediatria e Puericultura Martagão Gesteira (IPPMG),Departamento de Pediatria, Ambulatório de Neurologia Infantil, Rio de Janeiro, RJ, Brazil.