Interleukin 8 protein promotes inflammatory responses, even in airways. The presence of interleukin 8 gene variants causes altered inflammatory responses and possibly varied responses to inhaled bronchodilators. Thus, this study analyzed the interleukin 8 variants (rs4073, rs2227306, and rs2227307) and their association with the response to inhaled bronchodilators in cystic fibrosis patients.
MethodsAnalysis of interleukin 8 gene variants was performed by restriction fragment length polymorphism of polymerase chain reaction. The association between spirometry markers and the response to inhaled bronchodilators was evaluated by Mann‐Whitney and Kruskal‐Wallis tests. The analysis included all cystic fibrosis patients, and subsequently patients with two mutations in the cystic fibrosis transmembrane conductance regulator gene belonging to classes I to III.
ResultsThis study included 186 cystic fibrosis patients. There was no association of the rs2227307 variant with the response to inhaled bronchodilators. The rs2227306 variant was associated with FEF50% in the dominant group and in the group with two identified mutations in the cystic fibrosis transmembrane conductance regulator gene. The rs4073 variant was associated with spirometry markers in four genetic models: co‐dominant (FEF25‐75% and FEF75%), dominant (FEV1, FEF50%, FEF75%, and FEF25‐75%), recessive (FEF75% and FEF25‐75%), and over‐dominant (FEV1/FVC).
ConclusionsThis study highlighted the importance of the rs4073 variant of the interleukin 8 gene, regarding response to inhaled bronchodilators, and of the assessment of mutations in the cystic fibrosis transmembrane conductance regulator gene.
A proteína interleucina 8 promove respostas inflamatórias, o que inclui sua atuação nas vias aéreas. A presença de variantes no gene da interleucina 8 causa respostas inflamatórias alteradas e possivelmente respostas variadas ao uso de broncodilatadores inalatórios. Assim, este estudo analisou as variantes da interleucina 8 (rs4073, rs2227306, rs2227307) e sua associação à resposta a broncodilatadores inalatórios em pacientes com fibrose cística.
MétodosFoi feita análise das variantes genéticas da interleucina 8 por restriction fragment length polymorphism da reação em cadeia da polimerase. A associação entre os marcadores da espirometria e a resposta a broncodilatadores inalatórios foi feita pelos testes de Mann‐Whitney e Kruskal‐Wallis. A análise incluiu todos os pacientes com fibrose cística e posteriormente pacientes com duas mutações no gene cystic fibrosis transmembrane conductance regulator pertencentes às Classes I a II.
ResultadosEste estudo incluiu 186 pacientes com fibrose cística. Não houve associação da variante rs2227307 à resposta a broncodilatadores inalatórios. A variante rs2227306 foi associada a FEF50% no grupo dominante e no grupo com duas mutações identificadas no gene cystic fibrosis transmembrane conductance regulator. A variante rs4073 foi associada a marcadores da espirometria em quatro modelos genéticos: codominante (FEF25‐75% e FEF75%), dominante (VEF1, FEF50%, FEF75% e FEF25‐75%), recessivo (FEF75% e FEF25‐75%) e overdominante (VEF1/CVF).
ConclusõesEste estudo destaca, principalmente, a importância da variante rs4073 do gene da interleucina 8, na resposta a broncodilatadores inalatórios, concomitantemente ao genótipo das mutações no gene cystic fibrosis transmembrane conductance regulator.
A resposta a broncodilatadores inalatórios (BD) na fibrose cística (FC) (OMIM: n° 219700) é muito variável e depende do genótipo do RTFC (Regulador da Condutância Transmembrana da Fibrose Cística), dos sintomas pulmonares e, principalmente, de variantes nos genes modificadores, como o Receptor Adrenérgico Beta 2 (ADRB2).1 Até agora, apenas alguns estudos investigaram essa resposta.
As mutações no gene do RTFC causam FC, devido a deficiência, disfunção ou ausência da proteína do RTFC.2 A FC é caracterizada por um ciclo contínuo de inflamação crônica das vias aéreas, que pode ser exacerbada pela interleucina 8 (IL‐8), um importante mediador pró‐inflamatório. A IL‐8 é responsável por iniciar e aumentar a resposta provocadora na presença de patógenos específicos, causa ativação e migração de neutrófilos do sangue periférico para os tecidos.3 A inflamação crônica das vias aéreas é o caminho comum final de lesão pulmonar. Ela é responsável pelo aumento na permeabilidade vascular, contribui para edema intersticial, alveolar e das vias aéreas.
O tratamento da doença pulmonar na FC inclui anti‐inflamatórios, corticosteroides inalatórios, antibióticos, mucolítico, solução salina hipertônica e fisioterapia. Dentre as possíveis terapias, há pouca comprovação que corrobore um papel dos BD na FC.4,5 Contudo, os BD normalmente são prescritos por um tempo maior devido a episódios de pieira e dispneia na FC.6 Os BD reduzem a liberação de mediadores, responsáveis pelo recrutamento e pela ativação de células inflamatórias, ativam a neurotransmissão colinérgica, e por melhorar a permeabilidade vascular. Eles também aumentam o transporte mucociliar, levam à redução da inflamação pulmonar.7 A resposta a BD depende, em parte, da proteína do RTFC, que interage com a proteína do ADRB2 para promover broncodilatação.8 A espirometria é o principal método de avaliar a função pulmonar, a gravidade e a progressão da doença, bem como a resposta a BD.
Inflamação neutrofílica intensa e baixa hiperreactividade brônquica são características comumente observadas na FC.9 Ademais, a resposta das variantes genéticas aos BD é pouco conhecida.1 Pode‐se destacar o papel da IL‐8 no componente neutrofílico da doença pulmonar na FC. Os genes que podem estar associados à gravidade da FC e possivelmente à resposta a BD foram relatados aqui e na literatura científica de todo o mundo.1,10–12 O gene da IL‐8 deve ser destacado, pois ele tem influência direta sobre a inflamação pulmonar e pode ser eficaz na resposta a BD. Portanto, este estudo comparou as variantes genéticas da IL‐8 rs4073, rs2227306 e rs2227307 com a resposta a BD em pacientes com FC, com o uso da espirometria.
Material e métodosPacientesFoi conduzido um estudo transversal com 186 pacientes com FC, selecionados em dois centros universitários de referência (Faculdade de Medicina de São José do Rio Preto e Universidade de Campinas) para tratamento de FC, de 2013 a 2015. O estudo foi aprovado pelo Comitê de Ética em Pesquisa da Universidade Estadual de Campinas, São Paulo, Brasil (n° 528/2008). Todos os participantes foram informados sobre o estudo e assinaram o Documento de Consentimento Informado. Para os pacientes com menos de 18 anos, o Consentimento Informado foi assinado pelo pai/mãe ou guardião. O estudo seguiu as recomendações da Declaração de Helsinque.
O diagnóstico de FC foi confirmado pela presença de duas concentrações alteradas de sódio e cloreto no suor (nível de cloreto acima de 60 mEq/L). Além disso, nenhum paciente foi submetido a teste inicial de tripsinogênio imunorreativo (IRT). Em um grupo de 91 pacientes, houve duas mutações no gene do RTFC pertencentes às classes I, II e/ou III (associadas à maior gravidade da doença, devido à ausência ou não funcionalidade da proteína do RTFC);13 60 pacientes não apresentaram mutação identificada do gene do RTFC ou apresentaram duas mutações que pertencem às classes IV, V ou VI; e 35 pacientes apresentaram uma mutação no gene do RTFC que pertence às classes I, II ou III e uma mutação não identificada ou pertencente às classes IV, V ou VI (tabela 1).
Distribuição dos pacientes com fibrose cística para genótipo do RTFC e classes de mutações identificadas.a
| Genótipo | N | % | Grupo de pacientes |
|---|---|---|---|
| −/‐ | 55 | 29,6 | Pacientes sem mutação no gene do RTFC ou com uma ou duas mutações pertences às classes IV, V ou VI |
| V562I/‐ | 1 | 0,5 | |
| I507V/‐ | 1 | 0,5 | |
| D110H/V232H | 1 | 0,5 | |
| G576A/R668 C | 1 | 0,5 | |
| p.Glu528G>A/TG11‐5 T | 1 | 0,5 | |
| F508del/‐ | 23 | 12,4 | Pacientes com uma mutação do RTFC pertencentes às classes I, II ou III e uma mutação não identificada ou pertencentes às classes IV, V ou VI |
| G542X/‐ | 4 | 2,2 | |
| F508del/3272‐26A>G | 1 | 0,5 | |
| F508del/P205S | 1 | 0,5 | |
| G542X/P205S | 1 | 0,5 | |
| G542X/R334 W | 1 | 0,5 | |
| 3120+1G>A/L206 W | 1 | 0,5 | |
| 622‐2A>G/711+1G>T | 1 | 0,5 | |
| R1162X/‐ | 1 | 0,5 | |
| G542X/I618 T | 1 | 0,5 | |
| F508del/F508del | 49 | 26,3 | Pacientes com duas mutações do RTFC pertencentes às classes I, II e/ou III −Mutações G2 (grupo CFTR‐B) |
| F508del/G542X | 12 | 6,5 | |
| F508del/N1303 K | 5 | 2,7 | |
| F508del/R1162X | 3 | 1,6 | |
| F508del/R553X | 3 | 1,6 | |
| F508del/1584‐18672pbA>G | 1 | 0,5 | |
| F508del/c.1717‐1G>A | 2 | 1 | |
| 3120+1G>A/R1066 C | 1 | 0,5 | |
| F508del/2183AA>G | 1 | 0,5 | |
| F508del/2184insA | 1 | 0,5 | |
| Duplicação do éxon F508del/6B a 16 | 1 | 0,5 | |
| F508del/G85E | 1 | 0,5 | |
| F508del/S549R (T>G) | 1 | 0,5 | |
| F508del/S4X | 1 | 0,5 | |
| G542X/2183AA>G | 1 | 0,5 | |
| G542X/R1162X | 1 | 0,5 | |
| A561E/A561E | 1 | 0,5 | |
| F508del/R1066 C | 1 | 0,5 | |
| R1070Q; S466X/G542X | 1 | 0,5 | |
| F508del/1812‐1G>A | 2 | 1 | |
| 2183AA>G/2183AA>G | 1 | 0,5 | |
| 3120+1G>A/3120+1G>A | 1 | 0,5 | |
N, tamanho da amostra; RTFC, regulador da condutância transmembrana da fibrose cística.
As seguintes variáveis foram analisadas: escores clínicos (Shwachman‐Kulczycki, Kanga e Bhalla); índice de massa corporal (IMC) de pacientes com mais de 18 anos, com a fórmula IMC=peso/altura;2 a versão 3.0.1 do programa Anthro (Organização Mundial de Saúde [OMS], 2006) foi usada para crianças com menos de cinco anos e a versão 1.0.2 do programa Anthro Plus (Organização Mundial de Saúde [OMS], 2007) foi usada para crianças de cinco anos a adolescentes de 18 anos; idade do paciente e idade na época do diagnóstico; primeiro sintoma clínico (um sintoma geral, sintomas pulmonares e digestivos); período até a primeira colonização por Pseudomonas aeruginosa mucoide (PAM); microrganismos identificados na cultura de escarro de rotina (P. aeruginosa, Achromobacter xylosoxidans, Burkolderia cepacia e Staphylococcus aureus mucoides e não mucoides); saturação de oxigênio no sangue arterial transcutânea (SaO2); espirometria e comorbidades (pólipos nasais, osteoporose, íleo meconial, diabetes mellitus e insuficiência pancreática).
A espirometria foi feita em pacientes com mais de sete anos, com o espirômetro CPFS/D (MedGraphics, Saint Paul, Minnesota, EUA). Os dados foram registrados pela versão 3.8B do software PF BREEZE para Windows 95/98/NT (American Thoracic Society) e avaliados em percentagem de valores preditivos para: capacidade vital forçada (% de CVF), volume expiratório forçado no 1° segundo da CVF (VEF1), proporção VEF1/CVF, fluxo expiratório forçado a 25% da CVF (FEF25%), fluxo expiratório forçado a 50% da CVF (FEF50%), fluxo expiratório forçado a 75% da CVF (FEF75%), fluxo expiratório forçado entre 25% e 75% da CVF (FEF25‐75%), fluxo expiratório forçado máximo (FEFmax) e volume de reserva expiratória (VRE). Os dados da espirometria são mostrados em percentual do valor preditivo de acordo com as equações de Polgar e Promadhat (1971); Pereira et al. (2007) e Duarte et al. (2007).14–16
Todos os pacientes submetidos a espirometria fizeram o teste antes e 15 minutos após administração dos BD [albutrol–C13H21NO3 (400 mg)]. Os pacientes em terapia com BD foram orientados a interromper a medicação oito horas antes da espirometria, caso estivessem em tratamento com BD de curta ação, e 48 horas antes, caso estivessem em tratamento com BD de ação prolongada. A mudança no percentual pós‐BD foi usada na análise estatística. Os critérios de resposta a BD, definidos como aumento de > 12% e 200 mL de VEF1 inicial, foram usados como o segundo modelo para avaliar a associação entre as variantes do gene da IL‐8 e a resposta a BD.
Extração do DNA e genotipagemO DNA genômico foi extraído de amostras de sangue periférico com o método padrão fenol‐clorofórmio e quantificado por espectrofotômetro GE NanoVue™ (GE Healthcare Biosciences, Pittsburgh, EUA). Neste estudo, a concentração final da amostra foi estabelecida em 50 ng/μL.
As mutações do RTFC foram analisadas por reação em cadeia da polimerase (PCR) (F508del) após digestão enzimática (G542X, R1162X, R553X, G551D e N1303 K). Outras mutações no gene do RTFC podem ser identificadas por sequenciamento ou com o uso do método SALSA MPLA (Amplificação de Múltiplas Sondas Dependentes de Ligação) Kit P091‐C1 CFTR‐MRC‐Holland S4X, 2183A > G, 1717‐G > A, I618 T com MegaBace1000® (GE Healthcare Biosciences, Pittsburgh, EUA) e ABI3500 (Biossistemas Aplicados – Thermo Fisher Scientific, São Paulo, Brasil).17
As variantes do gene da IL‐8 foram analisadas por PCR após digestão com enzimas de restrição. Para a variante rs4073, foram usados os iniciadores 5’‐CCA TCA TGA TAG CAT CTG TA‐3′ e 5′‐CCA CAA TTT GGT GAA TTA TTA A‐3′ e a enzima de restrição AseI; para a variante rs2227306, foram usados os iniciadores 5′‐CTC TAA CTC TTT ATA TAG GAA TT‐3′ e 5′‐GAT TGA TTT TAT CAA CAG GCA‐3′, bem como a enzima de restrição EcoRI; e para a variante rs2227307, foram usados os iniciadores 5′‐TAA AGG TTT GAT CAA TAT AGA‐3′ e 5′‐CTT CCT TCT AAT TCCA ATA TG‐3′, bem como a enzima de restrição ScrFI.18,19 Os produtos da restrição enzimática foram submetidos a eletroforese em gel de poliacrilamida a 12%, ou gel de agarose a 4%,18,19 e corados com gel Red®.
Análise estatísticaFoi feita com a versão 22.0 do SPSS (SPSS Inc., Chicago, EUA). Foi usada a versão 3.1.9.220 do software GPower para calcular o poder da amostra, considerou‐se o genótipo das variantes analisadas e adotou‐se o poder para valor acima de 80%. As condições a seguir foram aplicadas para calcular o poder da amostra: (teste de análise da variância no lugar do teste de Kruskal‐Wallis, considerou‐se que a análise de variância é um teste mais forte) tamanho do efeito=0,25, α=0,05, poder=0,80, grau de liberdade do numerador=2, número de grupos=3, n° ideal=158; (teste de Mann‐Whitney–bicaudal) tamanho do efeito=0,5, α=0,05, poder=0,80, proporção de atribuição N2/N1=1, n° ideal–134; (teste χ2) tamanho do efeito=0,3, α=0,05, poder=0,80, grau de liberdade=2, n° ideal=108.
Os testes de Mann‐Whitney e Kruskal‐Wallis foram usados para comparação entre diferentes genótipos e os grupos de variantes do gene da IL‐8 e a resposta a BD. Em caso de diferenças significativas entre os grupos do teste de Kruskal‐Wallis, foram feitas identificação e avaliação adicionais das diferenças entre os genótipos com o software para Windows MedCalc®, versão 16.1 (MedCalc® Software, Ostend, Bélgica).
O teste χ2 e o teste exato de Fisher foram usados para comparação entre os diferentes genótipos e grupos de variantes do gene da IL‐8 e a resposta a BD definidos como um aumento de > 12% e 200 mL de VEF1 inicial.
Para a identificação de mutações no gene do RTFC, os pacientes foram analisados com base em dois contextos: (RTFC‐A) todos os pacientes com FC, independentemente das mutações do gene (n=186 pacientes); (RTFC‐B) pacientes com duas mutações pertencentes às classes I, II e/ou III (n=91 pacientes). Quanto às variantes, foram adotados quatro modelos de análise: (i) codominante (teste de Kruskal‐Wallis); (ii) recessivo (teste de Mann‐Whitney); (iii) dominante (teste de Mann‐Whitney); (iv) superdominante (teste de Mann‐Whitney), aplicados em associação às variáveis clínicas. Para todas as análises, o valor alfa foi estabelecido em 0,05.
Para análise do equilíbrio de Hardy‐Weinberg (HWE) foi usado o software Online Encyclopedia for Genetic Epidemiology Studies (OEGE).
O teste da taxa de falsa descoberta (FDR) foi aplicado para corrigir a comparação múltipla de testes. A FDR é uma abordagem ao problema de múltiplas comparações. Em vez de controlar a chance de qualquer falso, os controles da FDR controlam a proporção esperada de falsos positivos entre os resultados significativos. O limite da FDR é determinado a partir da distribuição do valor de p observado e, assim, é adaptativo ao valor de sinal nos dados.21 O valor de p (p) e o valor de p corrigido (pc) foram mostrados no manuscrito. A análise de desequilíbrio de ligação foi feita na versão 4.2 do software Haploview.
ResultadosOs dados clínicos e laboratoriais dos pacientes com FC são descritos na tabela 2. A descrição do genótipo e da frequência de alelos das variantes do gene da IL‐8 encontra‐se na tabela 3. A figura 1 mostra os dados com valores de p e valor de p corrigido para associação das variantes do gene da IL‐8, consideraram‐se os quatros modelos de análise propostos e o genótipo do gene do RTFC.
Análise descritiva dos marcadores clínicos e laboratoriais de pacientes com fibrose cística
| Variáveis | Distribuiçãoa |
|---|---|
| Sexo (masculino) | 92/186 (49,5%) |
| Etnia (branca) | 169/180 (93,9%) |
| Idade (meses) | 169; 201,41±171,98; 143 (7 a 932) |
| Início dos sintomas (meses) | 159; 38,23±114,03; 3 (0 a 720) |
| Diagnóstico (meses) | 171; 87,90±158,39; 20 (0 a 833) |
| Início dos sintomas digestivos (meses) | 140; 41,2±112,61; 3 (0 a 720) |
| Início dos sintomas pulmonares (meses) | 156; 46,33±123,64; 6 (0 a 720) |
| Índice de massa corporal | 178; 17,28±4,08; 16,28 (6,5 a 35,67) |
| Polipose nasal (presença) | 28/162 (17,3%) |
| Diabetes mellitus (presença) | 32/164 (19,5%) |
| Osteoporose (presença) | 25/162 (15,4%) |
| Insuficiência pancreática (presença) | 130/162 (80,2%) |
| Íleo meconial (presença) | 23/162 (14,2%) |
| 1ª Pseudomonas aeruginosa | 121; 103,03±171,74; 31 (0 a 872)b |
| P. aeruginosa mucoide (presença) | 74/173 (42,8%)c |
| P. aeruginosa não mucoide (presença) | 99/173 (57,2%)c |
| Achromobacter xylosoxidans (presença) | 17/174 (9,8%) |
| Burkolderia cepacia (presença) | 25/174 (14,4%) |
| Staphylococcus aureus (presença) | 131/174 (75,3%) |
| SaO2 | 159; 94,87±4,28; 96 (66 a 99) |
| Escore de Bhalla | 113; 8,9±5,77; 8 (0 a 25) |
| Escore de Kanga | 118; 18,78±5,82; 17,5 (10 a 40) |
| Escore de Shwachman‐Kulczycki | 143; 65,97±16,78; 65 (20 a 95) |
| CVF | 142; 72,13±23,86; 77 (19 a 126) |
| FEV1 | 141; 60,99±25,75; 63 (17 a 116) |
| VEF1/CVF | 144; 79,08±14,99; 81 (39 a 113) |
| FEF25% | 119; 61,28±31,71; 60 (7 a 138) |
| FEF50% | 119; 46,2±31,25; 40 (3 a 126) |
| FEF75% | 116; 36,32±28,77; 27,5 (4 a 142) |
| FEF25‐75% | 140; 47,16±32,51; 39 (5 a 150) |
| FEFMax | 114; 75,54±25,59; 73,5 (25 a 137) |
| VRE | 112; 80,96±52,39; 69 (3 a 248) |
| Resposta a broncodilatador inalatório | |
| CVF | 117; 1,74±8,19; 1 (−17 a 32) |
| FEV1 | 117; 3,51±8,0; 3 (−12 a 48) |
| VEF1/CVF | 111; 2,14±7,43; 2 (−19 a 32) |
| FEF25% | 99; 9,99±24,41; 5 (−45 a 110) |
| FEF50% | 99; 13,08±26,06; 9 (−41 a 114) |
| FEF75% | 99; 20,93±46,47; 16 (−64 a 235) |
| FEF25‐75% | 99; 12,28±27,77; 9,5 (−51 a 117) |
| FEFMax | 116; 2,63±14,48; 3 (−42 a 69) |
| VRE | 100; 23,04±101,08; 0 (−90 a 670) |
CVF, capacidade vital forçada; FEF25%, fluxo expiratório forçado a 25% da CVF; FEF25‐75%, médio do fluxo expiratório forçado entre 25% e 75% da CVF; FEF50%, fluxo expiratório forçado a 50% da CVF; FEF75%, fluxo expiratório forçado a 75% da CVF; FEFmax, fluxo expiratório forçado máximo; SaO2, saturação de oxigênio no sangue arterial; VEF1, volume expiratório forçado no 1° segundo da CVF; VRE, volume de reserva expiratória.
Os dados da espirometria são mostrados em percentual de valor preditivo. Todos os pacientes avaliados são descritos.
Os dados com distribuição categórica são apresentados da seguinte forma: n° de variáveis/n° total (percentual); os dados com distribuição numérica são apresentados da seguinte forma: tamanho da amostra; média±desvio padrão; mediana (mínimo a máximo).
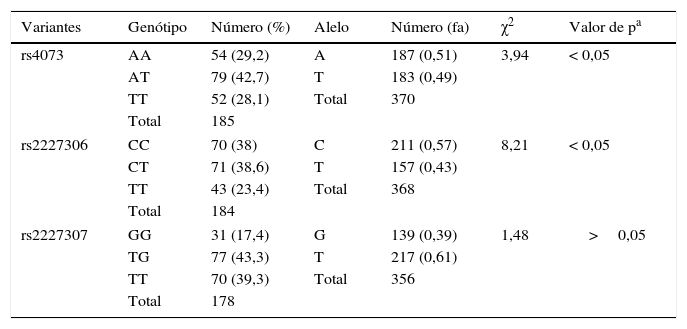
Distribuição de genótipos, alelos e haplótipo das variantes do gene da IL‐8 (rs4073, rs2227306 e rs2227307) em pacientes com fibrose cística
| Variantes | Genótipo | Número (%) | Alelo | Número (fa) | χ2 | Valor de pa |
|---|---|---|---|---|---|---|
| rs4073 | AA | 54 (29,2) | A | 187 (0,51) | 3,94 | < 0,05 |
| AT | 79 (42,7) | T | 183 (0,49) | |||
| TT | 52 (28,1) | Total | 370 | |||
| Total | 185 | |||||
| rs2227306 | CC | 70 (38) | C | 211 (0,57) | 8,21 | < 0,05 |
| CT | 71 (38,6) | T | 157 (0,43) | |||
| TT | 43 (23,4) | Total | 368 | |||
| Total | 184 | |||||
| rs2227307 | GG | 31 (17,4) | G | 139 (0,39) | 1,48 | >0,05 |
| TG | 77 (43,3) | T | 217 (0,61) | |||
| TT | 70 (39,3) | Total | 356 | |||
| Total | 178 | |||||
| rs4073/rs2227306/rs2227307 | Frequência | Percentual (%) |
|---|---|---|
| AA CC GG | 3 | 1,7 |
| AA CC GT | 5 | 2,8 |
| AA CC TT | 24 | 13,6 |
| AA CT GG | 3 | 1,7 |
| AA CT GT | 4 | 2,3 |
| AA CT TT | 7 | 4,0 |
| AA TT GG | 2 | 1,1 |
| AA TT GT | 2 | 1,1 |
| AA TT TT | 3 | 1,7 |
| AT CC GT | 13 | 7,3 |
| AT CC TT | 7 | 4,0 |
| AT CT GT | 30 | 16,9 |
| AT CT TT | 10 | 5,6 |
| AT TT GG | 5 | 2,8 |
| AT TT GT | 6 | 3,4 |
| AT TT TT | 3 | 1,7 |
| TT CC GG | 2 | 1,1 |
| TT CC GT | 5 | 2,8 |
| TT CC TT | 8 | 4,5 |
| TT CT GG | 4 | 2,3 |
| TT CT GT | 6 | 3,4 |
| TT CT TT | 3 | 1,7 |
| TT TT GG | 12 | 6,8 |
| TT TT GT | 5 | 2,8 |
| TT TT TT | 5 | 2,8 |
| Total | 177 | 100 |
fa, frequência absoluta; IL‐8, interleucina 8; %, percentual; χ2, qui‐quadrado.
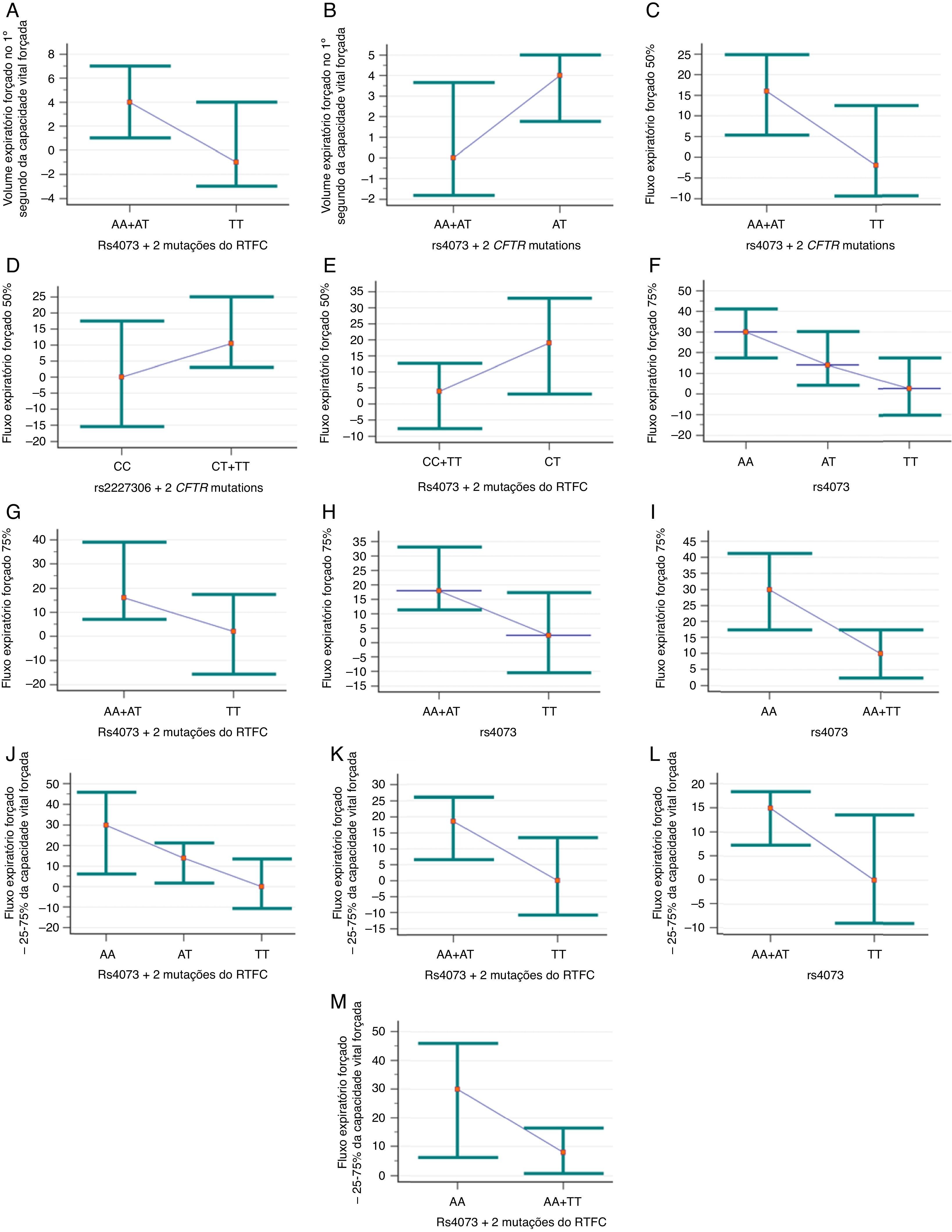
Associação das variantes rs4073 e rs2227306 da IL‐8 (interleucina‐8) à resposta a broncodilatadores inalatórios em pacientes com fibrose cística. A. Associação entre o volume expiratório forçado no 1° segundo (VEF1) da capacidade vital forçada (CVF) e rs4073, modelo dominante e duas mutações identificadas no gene do RTFC (regulador da condutância transmembrana da fibrose cística) pertencente às classes I, II e/ou III (grupo RTFC‐B) (p=0,028; pc–0,112). (AA +AT) n=39; média de 4,77±8,95; mediana de 4 (variação de −9 a 48). (TT) n=21; média de 0,86±5,42; mediana de −1 (variação de −6 a 15). B. Associação da proporção VEF1/CVF à variante rs4073, modelo superdominante e grupo RTFC‐B (p=0,029; pc=0,116). (TT) n=30; média de 0,86±7,36; mediana de 0 (variação de −12 a 23). (AT) n=29; média de 4,76±7,58; mediana de 4 (variação de −9 a 32). C. Associação do fluxo expiratório forçado de 50% (FEF50%) da CVF à variante rs4073, modelo dominante e grupo RTFC‐B (p=0,046; pc=0,184). (AA+AT) n=37; média de 17,38±24,18; mediana de 16 (variação de −20 a 89). (TT) n=21; média de 4,95±20,80; mediana de −2 (variação de −19 a 55). D. Associação do FEF50% à variante rs2227306, modelo dominante e grupo RTFC‐B (p=0,050; pc=0,083). (CC) n=15; média de 1,47±17,22; mediana de 0 (variação de −20 a 29). (CT+TT) n=44; média de 15,84±25,04; mediana de 10,50 (variação de −28 a 89). E. Associação do FEF50% à variante rs2227306, modelo superdominante e grupo RTFC‐B (p=0,033; pc=0,083). (CC+TT) n=33; média de 6,06±20,27; mediana de 4 (variação de −20 a 55). (CT) n=23; média de 19,96±26,43; mediana de 19 (variação de −28 a 89). F. Associação do fluxo expiratório forçado de 75% (FEF75%) da CVF à variante rs4073, modelo codominante independentemente das mutações identificadas no gene do RTFC (grupo RTFC‐A) (p=0,044; pc=0,058). 1 ≠ 3. (AA) n=28; média de 29,93±39,98; mediana de 30 (variação de −47 a 142). (AT) n=42; média de 24,81±53,57; mediana de 14 (variação de −58 a 235). (TT) n=28; média de 9,14±36,95; mediana de 2,5 (variação de −35 a 119). G. Associação do FEF75% à variante rs4073, modelo dominante e grupo RTFC‐B (p=0,024; pc=0,096). (AA+AT) n=38; média de 33±55,23; mediana de (variação de −27 a 235). (TT) n=21; média de 5,43±35,93; mediana de 2 (variação de −35 a 119). H. Associação do FEF75% à variante rs4073, modelo dominante e grupo RTFC‐A (p=0,034; pc=0,058). (AA+AT) (n=70; média de 26,86±48,34; mediana de 18 (variação de −58 a 235). (TT) n=28; média de 9,14±36,95; mediana de 2,5 (variação de −35 a 119). I. Associação do FEF75% à variante rs4073, modelo recessivo e grupo RTFC‐A (p=0,040; pc=0,058). (AA) n=28; média de 29,93±39,98; mediana de 30 (variação de −47 a 142). (AT+TT) n=70; média de 18,54±47,95; mediana de 10 (variação de −58 a 235). J. Associação do FEF entre 25 e 75% (FEF25‐75%) da CVF à variante rs4073, modelo codominante e grupo RTFC‐B (p=0,012; pc=0,024). TT ≠ AA e AT. (AA) n=9; média de 25,78±23,14; mediana de 30 (variação de −21 a 57). (AT) n=29; média de 18,38±29,04; mediana de 14 (variação de −33 a 117). (TT) n=21; média de 2,14±23,74; mediana de 0 (variação de −51 a 65). K. Associação do FEF25‐75% à variante rs4073, modelo dominante e grupo RTFC‐B (p=0,007; pc=0,024). (AA+ATT) n=38; média de 20,13±27,64; mediana de 18,50 (variação de −33 a 117). (TT) n=23; média de 2,14±23,74; mediana de 0 (variação de −51 a 65). L. Associação do FEF25‐75% à variante rs4073, modelo dominante e grupo RTFC‐A (p=0,029; pc=0,100). (AA+AT) n=82; média de 15,48±27,20; mediana de 15 (variação de −40 a 117). (TT) n=33; média de 5,94±27,33; mediana de 0 (variação de −51 a 76). M. Associação do FEF25‐75% à variante rs4073, modelo recessivo e grupo RTFC‐B (p=0,047; pc=0,063). (AA) n=9; média de 25,78±23,14; mediana de 30 (variação de −21 a 57). (AT+TT) n=50; média de 11,56±27,89; mediana de 8 (variação de −51 a 117). O ponto corresponde aos valores medianos e a barra corresponde a intervalo de confiança de 95%.
A variante rs2227307 não foi associada à resposta a BD em nenhum dos modelos estudados; ao passo que a variante rs2227306 foi associada a FEF50% para pacientes com genótipo CC (modelo dominante; p=0,05; pc=0,083) e genótipo CT (modelo superdominante; p=0,033; pc=0,083) no grupo RTFC‐B (fig. 1D e E).
Deve‐se enfatizar de modo especial a variante rs4073, associada às variáveis de espirometria: FEV1, proporção VEF1/CVF, FEF50%, FEF75% e FEF25‐75%. A menor resposta a BD foi observada para genótipo TT (modelo dominante) e pacientes do grupo RTFC‐B a VEF1 (fig. 1A), FEF50% (fig. 1 C), FEF75% (fig. 1G) e FEF25‐75% (fig. 1 K). O mesmo foi observado para o grupo RTFC‐A para FEF75% (fig. 1H) e FEF25‐75% (fig. 1L). Na análise codominante, o genótipo TT apresentou menor resposta a BD para VEF75% (fig. 1F) e FEF25‐75% (fig. 1 J), respectivamente para os grupos RTFC‐A e RTFC‐B. Para o indicador VEF1/CVF, o genótipo AT nos pacientes do grupo RTFC‐B mostrou menor resposta a BD (fig. 1B). Por fim, nos pacientes dos grupos RTFC‐A e RTFC‐B, respectivamente, o genótipo AA (modelo recessivo) para rs4073 mostrou maior resposta a BD para FEF75% (fig. 1I) e FEF25‐75% (fig. 1 M).
A distribuição de haplótipos para as variantes do gene da IL‐8 é apresentada na tabela 3.
Para comparação entre as variantes do gene da IL‐8 e a resposta a BD definida como aumento de > 12% e 200 mL de VEF1 inicial, não foi encontrada associação positiva (p > 0,05).
DiscussãoMostramos anteriormente a influência das diferentes variantes do gene da IL‐8 sobre a gravidade clínica da FC.22 Além disso, este estudo mostra a associação das diferentes variantes do gene da IL‐8 e sua modulação à resposta a BD, avalia o impacto do medicamento sobre a função pulmonar. A variabilidade das respostas aos BD é determinada por vários fatores, como inflamação e obstrução pulmonar,23 bactérias24 e sintomas pulmonares,25 bem como genes modificadores.26 Contudo, até agora, nenhum estudo investigou o papel da IL‐8 como mediador pró‐inflamatório de FC e sua relação aos BD e se as variantes do gene da IL‐8 podem explicar a resposta individual aos BD na FC. Acredita‐se que os beta‐2 agonistas de curta e longa duração podem ser benéficos para pacientes com FC e com hiperresponsividade brônquica positiva.6
Em doenças pulmonares progressivas, foram avaliados diferentes marcadores e o uso dos BD parece fornecer melhor resposta ao FEF25‐75%, em comparação com outros marcadores, o que indica envolvimento de vias aéreas de menor calibre na FC.27 Nosso estudo, em concordância com a literatura de referência, encontrou uma associação da variante rs4073 para o marcador FEF25‐75% nos modelos dominante (para os grupos RTFC‐A e RTFC‐B), codominante (grupo RTFC‐B) e recessivo (grupo RTFC‐B). Houve melhoria em diversos outros marcadores de espirometria para rs4073, como VEF1, VEF1/CVF e FEF50% e FEF75%, o que mostra impacto sobre os padrões de respiração dos pacientes.
O estudo de Hillian et al. encontrou uma associação das variantes rs2227307 e rs4073 do gene da IL‐8 e a gravidade da doença pulmonar.28 Nesse estudo, os pacientes foram divididos em duas coortes: (1) pacientes homozigotos F508del; (2) pacientes com outros genótipos do gene do RTFC. Na coorte 1, as variantes rs4073, rs2227306 e rs2227543 não foram associadas a doença pulmonar e a variante rs22227307 mostrou associação, independentemente do sexo. Na coorte 2, as variantes rs4073 e rs2227306 foram associadas a gravidade da doença pulmonar em homens. Assim, o sexo do paciente, o genótipo do gene do RTFC e os genes modificadores podem modular a gravidade da doença pulmonar.28 Nesse estudo, o genótipo rs2227307 não teve impacto sobre a variabilidade da resposta a BD. Isso sugere que, apesar de esse genótipo estar associado a doença pulmonar em pacientes homozigotos F508del, sua resposta a BD não é relevante.
O alvo dos BD é a proteína ADRB2, expressa no músculo liso das vias aéreas. As variantes de ADRB2 estão associadas à resposta à medicação. Essa proteína foi amplamente estudada em asma e ainda muito raramente em FC. A eficácia da resposta a BD e aos corticosteroides inalatórios no manejo de inflamação das vias aéreas em asma está confirmada e depende das variantes Arg16Gly (rs1042713; c.46A>G) e Glu27Gln (rs1042714; c.79C>G) do gene ADRB2.[29] A variante Gln27Glu concede resistência à proteína ADRB2 na resposta a BD. Os alelos 46*G e 79*G protegem contra asma, reduzem o risco em 27%.29 As variantes do alelo G induzem alterações na regulação do receptor, devido ao aumento da susceptibilidade à degradação de proteínas. Este estudo constatou que as variantes Arg16Gly e Gln27Glu do gene ADRB2 influenciam a respostas aos BD na FC. Na espirometria e em outros marcadores de gravidade, a variante Arg16Gly mostrou associação positiva, ao contrário da variante Gln27Glu. O genótipo Arg/Arg da variante Arg16Gly foi associado a melhores valores de VEF1 e FEF25‐75%. A resposta a BD nas análises de haplótipo foi positiva na ausência dos genótipos Gly16Gly e Glu27Glu para a proporção VEF1/CVF.
As variantes de ADRB2, capacidade de difusão dos pulmões para monóxido de carbono, condutância da membrana capilar alveolar, volume sanguíneo na capilar alveolar e SaO2, foram avaliadas na resposta a BD em 18 pacientes e 20 controles saudáveis, antes e depois da administração de salbutamol (30, 60 e 90 minutos). Os indivíduos saudáveis não apresentaram alterações nos marcadores avaliados para a variante Glu27Glu. Contudo, na FC, essa variante influenciou a resposta a BD: a melhor resposta encontrada na presença de pelo menos um alelo 27Glu. Houve uma diferença de difusão pulmonar e SaO2 periférica de acordo com a variação do gene ADRB2 na posição 27 e a dosagem do medicamento deve ser prescrita de acordo com essa variação.30
A maior parte dos estudos foca nas variantes do gene ADRB2 na resposta a BD. Contudo, este estudo demonstra que, mesmo indiretamente, as variantes do gene da IL‐8 e possivelmente em outros genes, que modulam a resposta pulmonar inflamatória, podem potencializar ou diminuir o efeito dos BD e, ainda, influenciar a resposta ao medicamento.
Com relação ao HWE, conforme discutido anteriormente por nosso grupo,22 duas variantes (rs4073 e rs2227306) não estavam em equilíbrio. Devemos lembrar que o HWE pressupõe uma população ideal, sem a interferência de fatores evolucionários. Contudo, em genes envolvidos em controle de imunidade, inflamação e infecção, o desequilíbrio do HWE parecer estar associado de forma secundária aos mecanismos de seleção que favoreceram um alelo específico que pode trazer uma resposta mais efetiva. O desequilíbrio não invalida o estudo de associação, pois os grupos fazem parte da mesma população.
Limitações do estudo: (i) banco de dados transversal (a resposta a BD foi avaliada em um único momento); (ii) há vários dados ausentes, se levarmos em consideração os problemas para obter as informações nos registros; (iii) caso a resposta a BD seja diferente com base no VEF1 de base, principalmente em indivíduos saudáveis; (iv) possíveis variáveis de confusão com relação aos resultados, como gravidade da doença, terapias atuais, adesão à medicação e esforço adequado no teste de função pulmonar.
As variantes do gene da IL‐8 (rs2227306 e especialmente rs4073) podem estar associadas à resposta a BD durante a espirometria. Esse medicamento pode ser uma opção para o tratamento da doença, na maior parte do tempo em pacientes com vias aéreas de menor calibre. Devem‐se conduzir estudos que envolvam dose e combinações de medicamentos para determinar o melhor tratamento de acordo com o genótipo do paciente com FC, o gene do RTFC, bem como os genes modificadores.
FinanciamentoFALM: Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp), em apoio às pesquisas n° 2011/12939‐4, n° 2011/18845‐1, n° 2015/12183‐8 e n° 2015/12858‐5; Fundo de Apoio à Pesquisa, ao Ensino e à Extensão da Universidade Estadual de Campinas, em apoio à pesquisa n° 0648/2015; JDR: Fapesp, em apoio às pesquisas n° 2011/18845‐1 e n° 2015/12183‐8. LLF: Fapesp, em apoio à pesquisa n° 2013/19052‐0.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Luciana Montes Rezende, Luciana Cardoso Bonadia e Stephanie Villa‐Nova por seu apoio técnico durante a extração do DNA e na identificação de mutações do gene do RTFC. Marcela Augusta de Souza Pinhel, Michele Lima Gregório, Rafael Fernandes Ferreira, Graciele Domitila Tenani e Heloisa Cristina Caldas por seu apoio técnico na padronização da genotipagem da IL‐8. Maria Ângela Gonçalves de Oliveira Ribeiro por fazer os testes de função pulmonar (LAFIP/Ciped/Unicamp). Rafaella Maionchi Pereira Martins por seu apoio técnico na determinação dos escores clínicos. Maria de Fátima Corrêa Pimenta Servidoni por promover um elo entre ambas as universidades.
Como citar este artigo: Furlan LL, Ribeiro JD, Bertuzzo CS, Salomão Junior JB, Souza DR, Marson FA. Variants in the interleukin 8 gene and the response to inhaled bronchodilators in cystic fibrosis. J Pediatr (Rio J). 2017;93:639–48.
Estudo feito na Universidade Estadual de Campinas (Unicamp), Campinas, SP, Brasil.