There is evidence of an important role of immune system changes in the triggering and maintenance of idiopathic nephrotic syndrome (INS). The aim of this study was to investigate the expression of cytokines in lymphocyte populations of patients with INS in comparison to healthy individuals, according to proteinuria.
MethodsThis cross‐sectional study included 44 patients with INS and eight healthy children, matched for age and sex (controls). Patients were subdivided according to proteinuria: persistent proteinuria or partial remission (PP≥300mg/24h, n=17) and low proteinuria or complete remission (LP<300mg/24h, n=27). Ex vivo analysis of peripheral blood leukocytes by flow cytometry was performed using surface markers for T‐lymphocytes, TCD4, TCD8, natural killer (NK) cells, NKT, and B‐lymphocytes. Frequencies of intracellular cytokines were analyzed in these cells.
ResultsThe frequencies of B‐lymphocytes, NK cells, and NKT cells were lower in INS than in controls, whereas INS patients had a higher frequency of CD4+tumor necrosis factor (TNF)‐α+ cells than controls. Cytotoxic‐T‐lymphocytes expressing IFN‐γ were lower in INS than in controls. Patients with PP showed higher frequencies of CD4‐T‐lymphocytes expressing IFN‐γ and TNF‐α than controls. CD8‐lymphocytes expressing TNF‐α were increased in PP group when compared with LP and controls, while CD8+interferon (IFN)‐γ+ cells were lower than in LP and in controls.
ConclusionRegardless the level of proteinuria, INS patients had increased expression of TNF‐α in CD4‐lymphocytes and reduced expression of IFN‐γ in CD8‐lymphocytes. Persistence of proteinuria was associated with higher levels of inflammatory markers.
Há comprovação do importante papel das alterações no sistema imunológico no desencadeamento e na manutenção da síndrome nefrótica idiopática (SNI). O objetivo deste estudo foi investigar a expressão das citocinas em populações de linfócitos de pacientes com SNI em comparação a indivíduos saudáveis e de acordo com a proteinúria.
MétodosEste estudo transversal incluiu 44 pacientes com SNI e oito crianças saudáveis, pareados por idade e sexo (controles). Os pacientes foram subdivididos de acordo com a proteinúria: proteinúria persistente ou remissão parcial (PP≥300mg/24h, n=17) e proteinúria baixa ou remissão completa (PB<300mg/24h, n=27). A análise ex vivo de leucócitos no sangue periférico por citometria de fluxo foi feita utilizando marcadores de superfície para linfócitos T, TCD4, TCD8, células natural killer (NK), linfócitos NKT e B. As frequências das citocinas intracelulares foram analisadas nessas células.
ResultadosA frequência dos linfócitos B, células NK e células NKT foi menor em pacientes com SNI do que nos controles, ao passo que os pacientes com SNI apresentaram maior frequência de células CD4+fator de necrose tumoral (TNF)‐α+ do que nos controles. Os linfócitos T citotóxicos que expressam interferon (IFN)‐γ foram menores nos pacientes com SNI do que nos controles. Os pacientes com PP mostraram maiores frequências de linfócitos T CD4 que expressam IFN‐γ e TNF‐α que os controles. Os linfócitos CD8 que expressam TNF‐α apresentaram aumento no grupo com PP, em comparação aos com PB e os controles, apesar de as células CD8+IFN‐γ+ serem mais baixas nos pacientes com PB e nos controles.
ConclusãoCom relação ao nível de proteinúria, os pacientes com SNI apresentaram aumento na expressão de TNF‐α nos linfócitos CD4 e expressão reduzida de IFN‐γ nos linfócitos CD8. A persistência da proteinúria foi associada a maiores níveis de marcadores inflamatórios.
A síndrome nefrótica (SN) é uma glomerulopatia muito comum em crianças, caracterizada por proteinúria maciça, hipoalbuminemia, edema generalizado e hiperlipidemia. A SN pode ser causada por lesão renal primária, denominada síndrome nefrótica idiopática (SNI), ou estar relacionada a doenças sistêmicas.1
Há comprovação do importante papel das alterações no sistema imunológico no desencadeamento e na manutenção da SNI.2–5 Essas alterações incluem a resposta dos linfócitos T em pacientes com SNI,2 uma possível contribuição das citocinas na fisiopatologia da SNI,3 a possibilidade de um fator de permeabilidade circulante que foi relacionado à recidiva da doença após transplante renal e a melhoria clínica dos pacientes após tratamento com corticosteroides e medicamentos imunossupressores.4 Contudo, além dos avanços em pesquisa sobre a SNI nas últimas décadas, principalmente no campo de imunologia, sua fisiopatologia continua a ser totalmente abordada.5
Várias alterações imunológicas foram detectadas em pacientes com SNI.5 Há relatos de expressão alterada de citocina/quimiocina que incluem interleucina (IL)‐2, IL‐10, IL‐4 e IL‐8, bem como alterações nas células TCD8+ e TCD4+ de pacientes com SNI.2,6–10 A IL‐2 e o fator de necrose tumoral alfa (TNF‐α) são considerados possíveis fatores patogênicos subjacentes aos mecanismos de lesão renal em pacientes com SNI.11,12 Por exemplo, a infusão de TNF‐α em ratos com SN causou aumento da proteinúria, dependente da dose, paralelamente ao comprometimento do estado clínico.13 É importante destacar que o aumento dos níveis plasmáticos de TNF‐α em pacientes com SNI associado ao aumento nos níveis plasmáticos de IL‐2 e a seu receptor solúvel (sIL‐2R) e IFN‐γ durante as recaídas da SN em pacientes sensíveis a esteroides, sugere um padrão pró‐inflamatório ou de resposta imune das células T auxiliares 1.14 Por outro lado, um desequilíbrio entre os padrões de resposta imune Th1 e Th2 foi relatado na SNI, com uma tendência de alteração no perfil Th2.3,15
Com base no conceito de que a SNI e sua progressão podem estar associados ao desequilíbrio da resposta imune, neste estudo investigamos a expressão das citocinas pró e anti‐inflamatórias em diferentes subpopulações leucocitárias do sangue periférico de pacientes com SNI. Avaliamos também se essas alterações no perfil das células imunes estiveram relacionadas à persistência da proteinúria.
Pacientes e métodosModelo do estudoEste estudo transversal usou uma amostra de conveniência de 44 pacientes pediátricos com SNI e oito crianças saudáveis pareadas por sexo e idade como um grupo de controle. Os pacientes com SNI foram regularmente acompanhados na Unidade de Nefrologia Pediátrica de nossa instituição de 2014 a 2016. Os critérios de diagnóstico da SNI tiveram como base as Orientações de Prática Clínica para Glomerulonefrite do KDIGO.16 Nossa Unidade de Nefrologia Pediátrica foi estabelecida em 1980 e acompanhou aproximadamente 300 crianças com síndrome nefrótica, de acordo com um protocolo sistemático que inclui definição da etiologia da doença, avaliação do curso clínico e alterações laboratoriais, instituição de tratamento e indicação de biópsia renal com base nos achados clínicos (sem resposta ao corticosteroide) e laboratoriais.
Pacientes com SNIOs critérios de inclusão incluíram crianças e adolescentes com SNI bem estabelecida com função renal ainda preservada, acompanhadas de 2014 a 2016, cujos pais forneceram seu consentimento para participar do protocolo do estudo. As crianças e os adolescentes com formas congênitas ou secundárias de síndrome nefrótica e pacientes com SNI em estágios 2‐5 de doença renal crônica foram automaticamente excluídos do estudo.
Grupo de controleO grupo de controle consistiu de indivíduos saudáveis pareados por sexo e idade de nosso Centro Pediátrico de Atenção Primária. O status saudável foi determinado por meio do histórico de saúde dos indivíduos e relato dos pais ou autorrelato para descartar a presença de doenças crônicas ou agudas.
Aspectos éticosO Comitê de Ética de nossa instituição aprovou o estudo. O consentimento informado foi obtido dos pais de todos os indivíduos incluídos. O protocolo de pesquisa não interferiu em qualquer recomendação ou prescrição médica. As amostras de sangue no grupo de controle foram coletadas simultaneamente a outros exames de sangue de rotina. O acompanhamento dos pacientes com SNI e controles saudáveis foi garantido mesmo em caso de recusa a participar do estudo.
Protocolo do estudoCom base nos níveis de proteinúria no momento da coleta de sangue, os pacientes com SNI foram subdivididos em dois grupos. Os pacientes com excreção de proteína na urina de 24 horas igual ou superior a 300mg/24h foram considerados em remissão parcial e alocados ao grupo chamado proteinúria persistente (PP, n=17) e os com proteinúria inferior a 300mg/24h considerados em remissão completa e classificados como proteinúria baixa (PB, n=27). Esse ponto de corte para proteinúria teve como base as Orientações de Prática Clínica para Glomerulonefrite do KDIGO.16
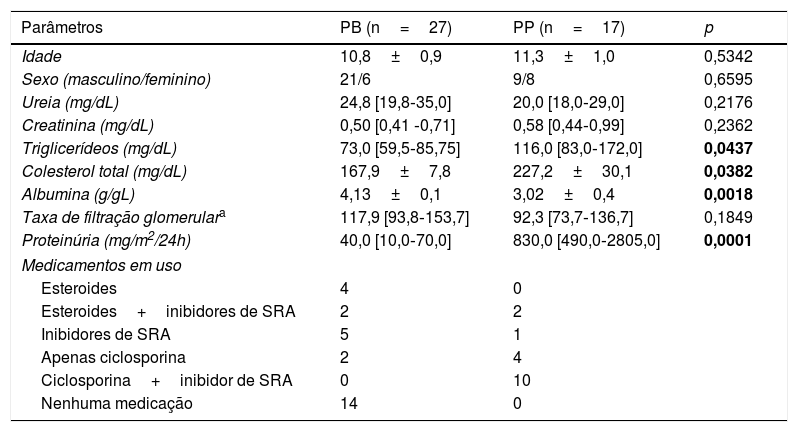
As características clínicas e medições casuais foram obtidas ao mesmo tempo da coleta de sangue e urina de 24 horas. As variáveis clínicas analisadas foram idade, sexo, estatura, peso, índice de massa corporal e pressão arterial sistólica e diastólica. Em pacientes com SNI, os níveis séricos de ureia, creatinina, albumina, colesterol, triglicerídeos e ácido úrico foram avaliados com a mesma amostra de sangue coletada para as medições de células do sistema imunológico. A determinação da excreção de proteína de 24 horas também foi feita simultaneamente às medições sanguíneas. A Taxa de Filtração Glomerular (TFG) foi estimada com a fórmula convencional de Schwartz et al.17 em pacientes com SNI e controles saudáveis. Os resultados da biópsia renal e das medicações usadas no momento da amostragem de sangue também foram informados (tabela 1).
Características clínicas e laboratoriais dos pacientes com síndrome nefrótica idiopática divididas em dois grupos de acordo com a excreção de proteína na urina de 24 horas: proteinúria persistente (PP) quando a proteinúria ≥ 300mg/24h e proteinúria baixa (PB) quando proteinúria <300mg/24h
| Parâmetros | PB (n=27) | PP (n=17) | p |
|---|---|---|---|
| Idade | 10,8±0,9 | 11,3±1,0 | 0,5342 |
| Sexo (masculino/feminino) | 21/6 | 9/8 | 0,6595 |
| Ureia (mg/dL) | 24,8 [19,8‐35,0] | 20,0 [18,0‐29,0] | 0,2176 |
| Creatinina (mg/dL) | 0,50 [0,41 ‐0,71] | 0,58 [0,44‐0,99] | 0,2362 |
| Triglicerídeos (mg/dL) | 73,0 [59,5‐85,75] | 116,0 [83,0‐172,0] | 0,0437 |
| Colesterol total (mg/dL) | 167,9±7,8 | 227,2±30,1 | 0,0382 |
| Albumina (g/gL) | 4,13±0,1 | 3,02±0,4 | 0,0018 |
| Taxa de filtração glomerulara | 117,9 [93,8‐153,7] | 92,3 [73,7‐136,7] | 0,1849 |
| Proteinúria (mg/m2/24h) | 40,0 [10,0‐70,0] | 830,0 [490,0‐2805,0] | 0,0001 |
| Medicamentos em uso | |||
| Esteroides | 4 | 0 | |
| Esteroides+inibidores de SRA | 2 | 2 | |
| Inibidores de SRA | 5 | 1 | |
| Apenas ciclosporina | 2 | 4 | |
| Ciclosporina+inibidor de SRA | 0 | 10 | |
| Nenhuma medicação | 14 | 0 | |
SRA, sistema renina‐angiotensina.
Os valores são expressos como erro padrão da média de ou mediana e intervalos interquartis de acordo com a distribuição variável. Sexo e as medicações em uso são expressos como valores absolutos.
As amostras de sangue foram coletadas em tubos estéreis que contêm ácido etilenodiamino tetra‐acético (EDTA) e heparina. As amostras de sangue coletadas em tubos com EDTA foram usadas imediatamente na análise ex vivo de populações e subpopulações de leucócitos por citometria de fluxo.
As amostras de sangue coletadas em tubos que contêm heparina foram imediatamente usadas para cultura de células e análise subsequente de citocinas intracelulares.
Contagem de leucócitos do sangue periféricoOs leucócitos no sangue foram contados com um contador de células CC‐550 CELM (CELM, Barueri, SP, Brasil). As contagens de leucócitos diferenciais foram feitas em esfregaços de sangue com um microscópio óptico (Olympus‐BX41 TF, Japão) após coloração May‐Grunwald‐Giemsa.
Coloração da superfície celular e análise de citometria de fluxoAs amostras de sangue periférico (50μL/amostra) foram incubadas com anticorpo monoclonal para os seguintes marcadores de superfície: anti‐CD3, anti‐CD4, anti‐CD8 (Becton & Dickinson, San Jose, CA, EUA), anti‐CD80 e anti‐CD18 (Caltag‐Medsystems Limited, Buckingham, Inglaterra) conjugado com fluoresceína fico eritrina (PE), isotiocianato (FITC) ou biotina no escuro por 30 minutos em temperatura ambiente. Após incubação, os eritrócitos foram lisados com solução Optilyse‐B (Immunotec, EUA). As células foram lavadas duas vezes em 1mL e solução salina tamponada com fosfato fria (PBS, pH 7,4). Os anticorpos biotinilados foram revelados com estreptavidina‐FITC (Becton & Dickinson, San Jose, CA, EUA). Foram usados os seguintes anticorpos contra proteínas humanas: anti‐CD3 FITC (clone: UCHT1) e anti‐CD8 FITC (clone: HIT8a) (Bio‐Legend, CA, EUA); anti‐CD4 FITC (clone: RPA‐T4) e anti‐CD19 FITC (clone: HIB19) da BD Pharmigen; anti‐CD56 PE (clone: B159), anti‐CD19 PE (clone: HIB19), anti‐CD4 PE (clone: L120) e anti‐CD8 PE (clone: HIT8a) fornecidos pela BD Biosciences (Becton & Dickinson, San Diego, CA, EUA). A coleta de dados foi feita com FACScan (Becton & Dickinson, San Diego, CA, EUA). A coleta de células foi processada e analisada com o software Cell Quest (Becton & Dickinson, San Jose, CA, EUA). O total de linfócitos T (CD3+), os linfócitos T auxiliares (CD3+CD4+), os linfócitos T citotóxico (CD3+CD8+), os linfócitos B (CD3+CD19+), as células com fenótipo de Exterminadoras Naturais (NK, CD3‐CD56+) e as células com fenótipo de Exterminadoras Naturais T (NKT, CD3+CD56+) foram analisados com modelos de fluorescência de pontos após a seleção da população de células de interesse com base no tamanho e na granulosidade de células (gráfico de SSC em comparação com FSC). Essas células foram então analisadas por sua expressão [frequência e intensidade média de fluorescência (IMF)] de determinado marcador com histogramas com marcadores estabelecidos com base em controles de isotipo negativo.
Análise da citocina intracelular em leucócitosPara fazer a análise de perfil da citocina em diferentes populações de leucócitos, 500μL de sangue periférico foram acrescentados a 500μL de meio de cultura de RPMI‐1640 (Sigma‐Aldrich®, EUA) em dois tubos separados. O primeiro tubo continha cultura não estimulada chamada de cultura controle e o segundo tubo continha cultura não especificamente estimulada com acetato de miristato de forbol (AMF) e 25 ng/mL e 1,0μL de ionomicina a 1 ng/mL. Nos dois tubos, 10μL de Brefeldin‐A em 1mg/mL foram adicionados para manter as citocinas no compartimento intracelular. As amostras foram então incubadas por quatro horas a 37°C em uma incubadora umidificada com 5% de CO2. Após incubação, foi adicionado EDTA (20nM) seguido de nova incubação por 15 minutos. As amostras foram lavadas com PBS (0,015M PBS, pH 7,4 com 0,5% de albumina sérica bovina e 0,1% de azida de sódio) e incubadas por 30 minutos, longe da luz, em temperatura ambiente, com anticorpos monoclonais específicos para marcadores de superfície celular: FITC‐anti‐CD4, FITC anti‐CD8 e FITC anti‐CD19.
Após essa etapa, os eritrócitos foram lisados com 2mL de solução Optilyse‐B (Immunotec, EUA) por 10 minutos. Então, as amostras foram centrifugadas em temperatura ambiente e, posteriormente, os leucócitos foram permeabilizados com solução de PBS (0,015M PBS, pH 7,4 com 0,5% de albumina sérica bovina, 0,1% de azida de sódio e 0,5% de saponina). Após permebialização, essas células foram incubadas por 30 minutos em temperatura ambiente no escuro, com anticorpos monoclonais específicos contra citocinas: TNF‐α anti‐PE (clone: MAb11), anti‐IL10 PE (clone: JES3‐9D7), anti‐IFN‐γ PE (clone: 4S.B3) e anti‐IL13 PE (clone: JES10‐5A2) (BioLegend, CA, EUA); anti‐IL17 PE (clone: eBio64DEC17) Biosciences; anti‐IL6 PE (clone: 1936) (R&D Systems, MN, EUA) e anti‐IL4 PE (clone: 8D4‐8 BD) (BD Pharmingen, CA, EUA). As amostras foram avaliadas para os parâmetros de produção celular de fenótipo e citocina pela aquisição de 30.000 eventos. As análises foram feitas com o software Cell Quest (Becton & Dickinson, San Jose, CA, EUA). O perfil de citocina foi expresso como a diferença (delta) entre o percentual de células manchadas para citocinas intracelulares obtido em culturas não estimuladas e culturas estimuladas com AMF.
Análise de dados e avaliação estatísticaOs resultados obtidos foram apresentados como média±erro‐padrão da média (EPM) ou mediana e intervalos interquartis. Todos os dados foram testados para normalidade pelo teste de Shapiro‐Wilk. Para variáveis normalmente distribuídas, as diferenças foram comparadas pelo teste t de Student não pareado ou análise de variância (Anova). O pós‐teste de Bonferroni foi usado para comparações múltiplas. Em caso de variáveis com distribuição não gaussiana, as diferenças foram analisadas pelo teste U de Mann‐Whitney ou teste não paramétrico de Kruskal‐Wallis. Todos os testes estatísticos foram bicaudais, com um nível de significância de α=0,05. As análises estatísticas foram feitas com o software SPSS (IBM SPSS Statistics for Windows, Version 22.0. NY, EUA) e a versão GraphPad Prism 5.0 (GraphPad Software, Inc., La Jolla, CA, EUA).
ResultadosCaracterísticas e medições casuais dos indivíduosO grupo de controle (n=8) incluiu cinco meninos e três meninas entre 6,1 e 13,5 anos. Os valores médios de peso, estatura, índice de massa corporal, pressões sistólicas e diastólicas e parâmetros da função renal estavam dentro do normal (dados não mostrados).
Os pacientes com SNI foram divididos de acordo com o nível de proteinúria no momento da amostragem sanguínea (PP ou PB). As características clínicas e laboratoriais de cada subgrupo no momento da amostragem sanguínea são mostradas na tabela 1. Nenhuma diferença foi detectada na idade, na distribuição por sexo e nos níveis de azoto (ureia e creatinina). Contudo, o grupo de PP apresentou aumento nos níveis séricos de colesterol e triglicerídeos e redução significativa de albumina sérica em comparação com o grupo de PB (p<0,05). Conforme esperado, o grupo de PP apresentou proteinúria significativamente maior e 15 dos 17 pacientes no grupo de PP (88,2%) mostraram valores de proteinúria acima de 600mg/24h. Conforme mencionado anteriormente, a doença ficou em remissão em todos os pacientes do grupo de PB. Por outro lado, todos os pacientes do grupo de PP tiveram recaída (88,2%) ou doença parcialmente remitida (11,8%), pois os níveis de proteinúria sempre estiveram acima de 300mg/24h em todos eles.
Com relação ao tratamento, 14 dos 27 pacientes (51,8%) do grupo de PB não receberam qualquer tipo de medicação, ao passo que todos os pacientes do grupo de PP precisaram de pelo menos uma medicação como tentativa de controle da proteinúria. Além disso, 25 dos 27 pacientes do grupo de PB (88,2%) se mostraram sensíveis a esteroides. Apenas dois pacientes com PB foram tratados com ciclosporina devido à dependência a esteroides. Em contraste acentuado, 14 dos 17 pacientes (82,3%) no grupo de PP recebiam ciclosporina, de forma isolada ou em associação com inibidores do Sistema Renina‐Angiotensina (SRA), devido à resistência a esteroides. Apenas três pacientes do grupo de PP mostraram resposta parcial à administração de esteroides. Conforme esperado, todos os pacientes do grupo de PP foram submetidos a biópsias renais, que mostraram esclerose segmentar focal em 13 pacientes (76,5%) e proliferação mesangial difusa nos quatro restantes (23,5%). No grupo de PB, apenas dois pacientes foram submetidos a biópsia, devido à dependência aos esteroides e ao padrão histológico comprovado em alteração mínima na síndrome nefrótica em um e proliferação mesangial difusa em outro.
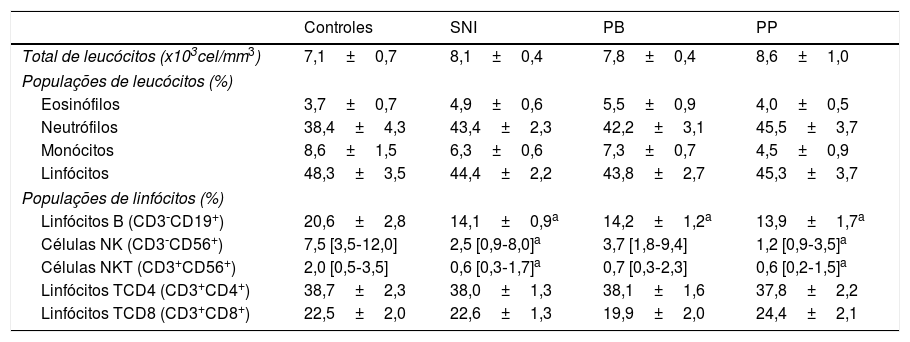
Contagem de leucócitos do sangue periféricoConforme mostrado na tabela 2, nenhuma diferença significativa foi encontrada nas contagens totais de leucócitos ou nas populações específicas de leucócitos (monócitos, neutrófilos e linfócitos) de pacientes com SNI em comparação com o grupo de controle. Nenhuma diferença foi detectada na comparação entre os grupos de PP e PB. Resultados semelhantes foram obtidos para as comparações entre os percentuais de linfócitos T‐CD4+e T‐CD8+nesses grupos (tabela 2). Por outro lado, os pacientes com SNI apresentaram menores frequências de linfócitos B, células NK e células NKT em comparação com os controles. Além disso, os pacientes com SNI com PP apresentaram menores frequências de linfócitos B em células NK e NKT em comparação com o grupo de controle, ao passo que nos pacientes com PB apenas os linfócitos B se mostraram significativamente reduzidos em comparação com os controles (tabela 2).
As populações e subpopulações de leucócitos em indivíduos saudáveis (controles), em todo o grupo de pacientes com síndrome nefrótica idiopática (SNI) e em pacientes com SNI, foram divididas em dois grupos de acordo com a excreção de proteína na urina de 24 horas: proteinúria persistente (PP) quando a proteinúria ≥ 300 24h e proteinúria baixa (PB) quando proteinúria <300mg/24h
| Controles | SNI | PB | PP | |
|---|---|---|---|---|
| Total de leucócitos (x103cel/mm3) | 7,1±0,7 | 8,1±0,4 | 7,8±0,4 | 8,6±1,0 |
| Populações de leucócitos (%) | ||||
| Eosinófilos | 3,7±0,7 | 4,9±0,6 | 5,5±0,9 | 4,0±0,5 |
| Neutrófilos | 38,4±4,3 | 43,4±2,3 | 42,2±3,1 | 45,5±3,7 |
| Monócitos | 8,6±1,5 | 6,3±0,6 | 7,3±0,7 | 4,5±0,9 |
| Linfócitos | 48,3±3,5 | 44,4±2,2 | 43,8±2,7 | 45,3±3,7 |
| Populações de linfócitos (%) | ||||
| Linfócitos B (CD3‐CD19+) | 20,6±2,8 | 14,1±0,9a | 14,2±1,2a | 13,9±1,7a |
| Células NK (CD3‐CD56+) | 7,5 [3,5‐12,0] | 2,5 [0,9‐8,0]a | 3,7 [1,8‐9,4] | 1,2 [0,9‐3,5]a |
| Células NKT (CD3+CD56+) | 2,0 [0,5‐3,5] | 0,6 [0,3‐1,7]a | 0,7 [0,3‐2,3] | 0,6 [0,2‐1,5]a |
| Linfócitos TCD4 (CD3+CD4+) | 38,7±2,3 | 38,0±1,3 | 38,1±1,6 | 37,8±2,2 |
| Linfócitos TCD8 (CD3+CD8+) | 22,5±2,0 | 22,6±1,3 | 19,9±2,0 | 24,4±2,1 |
Resultados expressos como média±erro‐padrão da média ou mediana e intervalos interquartis, quando adequado.
Os percentuais de TCD4+, TCD8+e linfócitos B que expressam citocinas após estimulação com AMF foram comparados em pacientes com SNI e no grupo de controle. A análise de citocina em linfócitos T‐CD4+ revelou que os pacientes com SNI apresentaram aumento significativo na frequência de células que expressam TNF‐α em comparação com os controles (SNI: 13,94±1,06 em comparação com os controles: 8,74±1,92%, p <0,05). Os pacientes com SNI também mostraram uma redução no percentual de linfócitos TCD8+ que expressam IFN‐γ em comparação com os controles (SNI: 5,61±0,83% em comparação com os controles: 19,46±3,91%, p <0,05). Não foi detectada outra diferença.
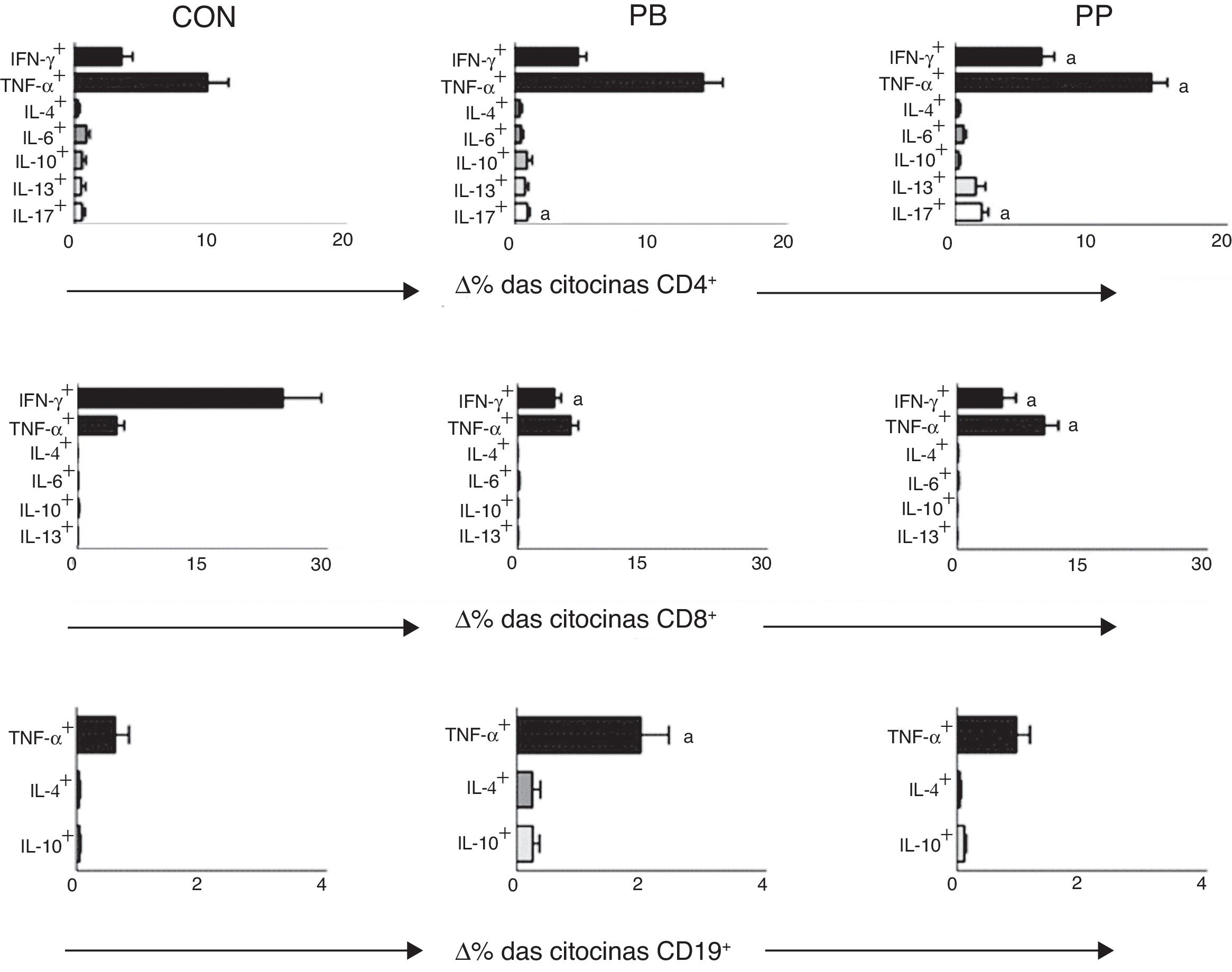
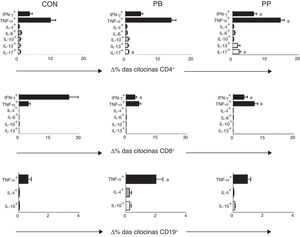
As comparações entre o percentual de TCD4+, TCD8+e linfócitos B que expressam citocinas após estimulação com AMF no grupo de controle e em pacientes com SNI com PP e com PB estão na fig. 1. Em pacientes com SNI com PP que apresentaram percentuais significativamente maiores de células TCD4+ que expressam IFN‐γ (6,58±0,89%), TNF‐α (14,43±1,18%) e IL‐17 (1,58±0,32%) em comparação com o grupo de controle (3,47±0,82, 8,74±1,92% e 0,55±0,18, respectivamente, fig. 1). Os pacientes do grupo PP também apresentaram aumento significativo no percentual de células TCD8+que expressam TNF‐α (10,37±1,75%) em comparação com os pacientes do grupo de PB (6,43±0,91%) e controles (4,72±0,90%) (fig. 1). Por outro lado, o percentual de células TCD8+ que expressam IFN‐γ foi significativamente menor nos grupos de PB (4,75±0,78%) e PP (7,12%±1,8%) em comparação com os controles (19,46±3,91%) (fig. 1).
Análise do percentual de variação (Δ%) das células que expressam citocinas pró e anti‐inflamatórias após estímulo in vitro não específico com AMF em pacientes com síndrome nefrótica idiopática que mostram proteinúria baixa (PB), proteinúria persistente (PP) e controles saudáveis (CON). Resultados expressos como gráficos de barras com valores médios e desvio padrão.
Δ, diferença entre as culturas com e sem estímulo por AMF.
a p <0,05.
Os mecanismos moleculares e celulares subjacentes à SNI continuam incertos. Contudo, uma comprovação emergente foi destacada como um papel no sistema imunológico na patogênese dessa doença.5 No estudo atual, os pacientes com SNI apresentaram uma redução significativa de linfócitos B, células NK e NKT no sangue periférico, caso comparados com controles saudáveis pareados por idade e sexo. Nossos resultados estão em linha com estudos anteriores que mostram o envolvimento nessas células imunes na SNI.18–20 Para comparar a doença recidivada ou a falta de resposta à medicação com a doença em remissão, os pacientes com SNI foram divididos nos grupos de PP ou PB com base nos níveis de proteinúria no momento da amostragem de sangue. É importante destacar que, neste trabalho, pela primeira vez, a diminuição de linfócitos B depende dos níveis de proteinúria, ao passo que a redução das frequências de células NK e NKT foi associada a recaída na SNI ou recaída parcial. Nossos achados indicam que essa população de células pode ser marcadora da atividade da doença.
Foi relatado que os mediadores inflamatórios, inclusive as citocinas, desempenham um papel na fisiopatologia da SNI e podem contribuir para a proteinúria e o dano glomerular.3,13 Há comprovação de que as células T mediaram o dano renal por meio da liberação desses mediadores inflamatórios.3,21 Dessa forma, descobrimos que os pacientes com SNI apresentaram maiores frequências de células TCD4+ que expressam a citocina inflamatória TNF‐α, em comparação com crianças saudáveis. Curiosamente, eles também apresentaram menores linfócitos TCD8+ que expressam IFN‐γ. Nos últimos anos, a comprovação emergente corroborou um papel de desequilíbrio nas respostas inflamatórias Th1/Th2 na fisiopatologia da SNI, com alteração com relação ao perfil Th2. Por exemplo, a aumento da expressão de citocinas Th2, como IL‐4, IL‐10 e IL‐13, antecedeu a ocorrência da doença em estudos clínicos e experimentais.15,22,23 Contudo, é importante observar que as citocinas Th1, inclusive IL‐2, IFN‐γ e TNF‐α, também foram associadas à SN, o que corroborou nossos achados.12,14,24 As diferenças metodológicas, inclusive a população de pacientes e as técnicas usadas para medir os níveis de citocina, poderão representar resultados conflitantes.3
Também mostramos que um estímulo não específico com AMF das células imunes de pacientes com PP revelaram um aumento significativo das células TCD4+ que expressam as citocinas inflamatórias IL‐17, IFN‐γ e TNF‐α, bem como os linfócitos TCD8+ que expressam TNF‐α. Corroborando nossos achados, o aumento na expressão de mRNA para IL‐17 nas células mononucleares do sangue periférico e rim, bem como maiores níveis séricos de citocinas inflamatórias, IL1‐ß e IL‐6, foi anteriormente relatado em pacientes pediátricos com SNI.25 Contudo, os autores não avaliaram a influência das citocinas medidas nos níveis de proteinúria.26 Sabe‐se que os mediadores inflamatórios, principalmente TNF‐α, aumentam a excreção de proteína na urina em modelos de roedores.27,28 Contudo, ainda faltam dados sobre os pacientes. No melhor de nosso conhecimento, nosso estudo é o primeiro a fornecer comprovação de que o aumento na expressão de citocinas inflamatórias em células do sistema imunológico pode estar associado à melhoria na proteinúria em pacientes com SNI, que, por sua vez, pode influenciar a atividade da doença e o prognóstico.
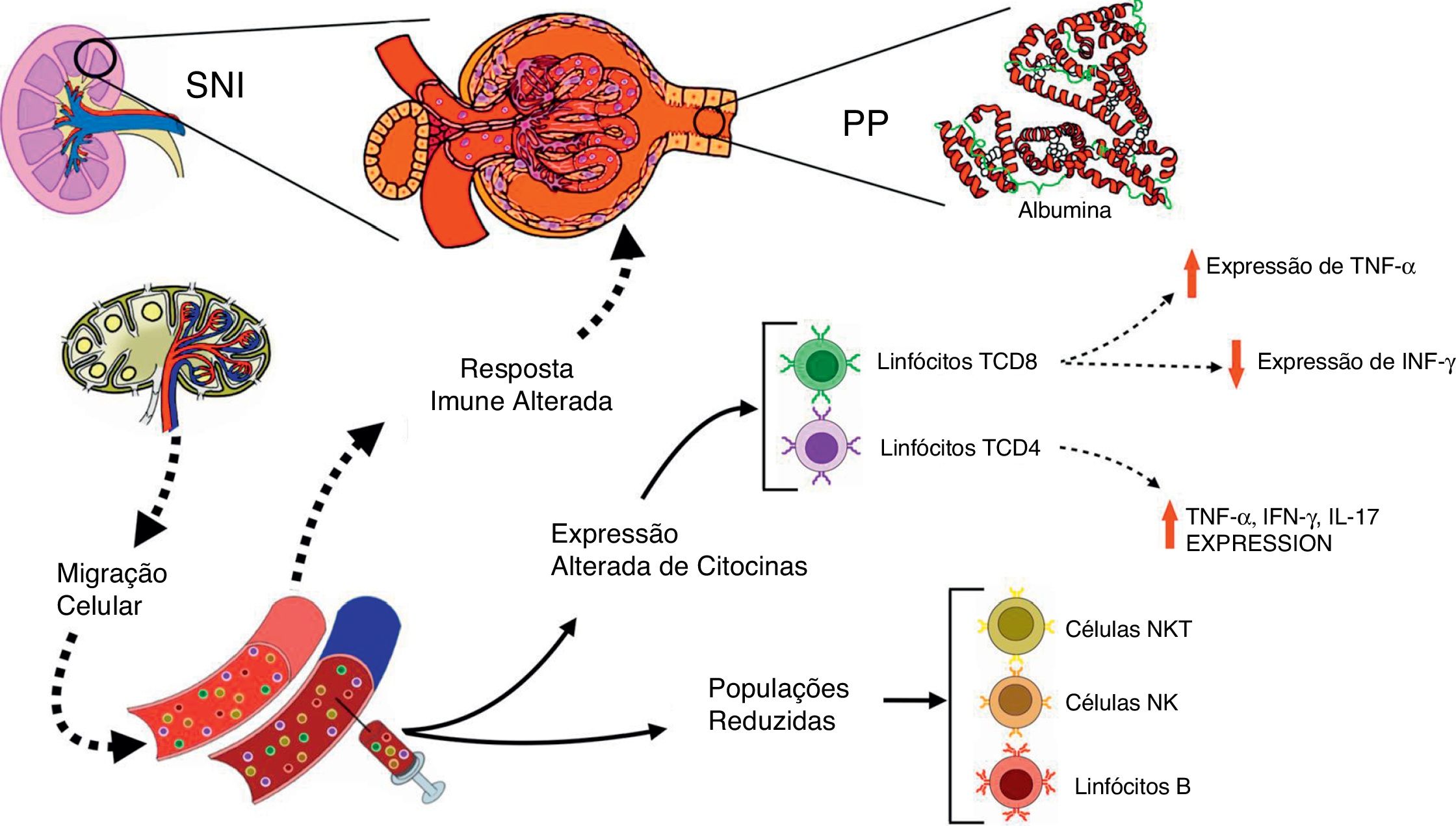
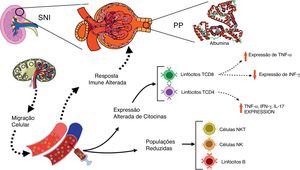
Os corticosteroides são a primeira linha de medicamentos imunossupressores para o tratamento de SNI.28 Os pacientes pediátricos com SNI tratados com corticoides apresentaram uma supressão precoce e reversível na população de células T, seguida por uma depressão persistente nos números de células B mesmo com interrupção do medicamento.29 Também foi relatado que as terapias imunossupressoras melhoraram a função renal e a redução na proteinúria em pacientes com glomeruloesclerose segmentar focal.30 Curiosamente, neste estudo, os corticosteroides e a ciclosporina não conseguiram suprimir completamente a expressão de citocinas inflamatórias por linfócitos T, principalmente em pacientes com PP. O perfil inflamatório de células imunes de pacientes com SNI pode contribuir, pelo menos em parte, para a persistência e/ou recidiva de proteinúria e, por fim, para a resposta inadequada a esteroides, conforme hipotetizado na fig. 2.
Visão esquemática das interações entre as alterações imunológicas na corrente sanguínea e as alterações renais em pacientes com síndrome nefrótica idiopática (SNI). A figura enfatiza as principais alterações nas populações de leucócitos no sangue periférico e a expressão de citocinas após estímulo in vitro com AMF em pacientes com SNI com proteinúria persistente (PP), em comparação com controles saudáveis.
Estamos cientes das limitações associadas ao modelo transversal de nosso estudo. A possível principal fraqueza foi o uso de uma amostra de conveniência, que torna a homogeneidade entre os grupos selecionados muito difícil de atingir, pois a presença e o uso anterior de medicamentos imunossupressores podem interferir nas medições de citocina e quimiocina. Além disso, o tamanho de nosso grupo de controle foi reduzido devido à dificuldade de recrutamento de pacientes saudáveis para amostragem de sangue simultaneamente às coletas de sangue dos pacientes. Contudo, alguns aspectos do estudo podem aumentar a força de nossos achados, inclusive o uso de critérios de inclusão e exclusão estritamente definidos e do protocolo bem estabelecido para medições de citometria de fluxo.
Fornecemos a primeira comprovação de que os pacientes pediátricos com SNI apresentaram um perfil inflamatório, apesar do uso de terapia com esteroides ou ciclosporina, que foram associados a aumento nos níveis de proteinúria. Por fim, identificamos células imunes que expressam citocinas inflamatórias, principalmente TNF‐α, como possíveis marcadores de atividade da doença, pavimentamos uma estrada para o desenvolvimento de novos alvos terapêuticos.
FinanciamentoEste estudo foi parcialmente financiado pela Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes),pelo Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), Brasil - número de concessão470472/2014-6 e número de concessão 460334/2014-0) - e Fundação de Amparo à Pesquisa do Estado de Minas Gerais (Fapemig), Brasil - número de concessão PPM-00555-15.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
AgradecimentosEste trabalho foi financiado por FAPEMIG (Fundação de Amparo à Pesquisa do Estado de Minas Gerais, Brasil),CAPES (Coordenação de Aperfeiçoamento de Pessoal de Nível Superior), CNPq (Conselho Nacional de Desenvolvimento Científico e Tecnológico, Brasil).
Como citar este artigo: Guimarães FT, Melo GE, Cordeiro TM, Feracin V, Vieira ER, Pereira WF, et al. T‐lymphocyte‐expressing inflammatory cytokines underlie persistence of proteinuria in children with idiopathic nephrotic syndrome. J Pediatr (Rio J). 2018;94:546–53.