Characterize the role of human parainfluenza virus and its clinical features in Brazilian children under 2 years of age presenting with acute lower respiratory tract infections.
MethodsReal‐time assays were used to identify strains of human parainfluenza virus and other common respiratory viruses in nasopharyngeal aspirates. One thousand and two children presenting with acute lower respiratory tract illnesses were enrolled from February 2008 to August 2010.
ResultsOne hundred and four (10.4%) patients were human parainfluenza virus positive, of whom 60 (57.7%) were positive for human parainfluenza virus‐3, 30 (28.8%) for human parainfluenza virus‐4, 12 (11.5%) for human parainfluenza virus‐1, and two (1.9%) for human parainfluenza virus‐2. Seven (6.7%) patients had more than one strain of human parainfluenza virus detected. The most frequent symptoms were tachypnea and cough, similar to other viral respiratory infections. Clinical manifestations did not differ significantly between human parainfluenza virus‐1, ‐2, ‐3, and ‐4 infections. Human parainfluenza virus‐1, ‐3, and ‐4 were present in the population studied throughout the three years of surveillance, with human parainfluenza virus‐3 being the predominant type identified in the first two years.
ConclusionHuman parainfluenza viruses contribute substantially to pediatric acute respiratory illness (ARI) in Brazil, with nearly 30% of this contribution attributable to human parainfluenza virus‐4.
Caracterizar o papel do VPH‐4 e suas características clínicas em crianças brasileiras com menos de dois anos de idade com infecções agudas do trato respiratório inferior.
MétodosEnsaios em tempo real foram utilizados para identificar tipos de VPH e outros vírus respiratórios comuns em aspirados nasofaríngeos. Mil e duas crianças com doença aguda do trato respiratório inferior foram inscritas para participar de fevereiro de 2008 a agosto de 2010.
Resultados104 (10,4%) pacientes eram VPH positivos, dos quais 60 (57,7%) eram positivos para VPH‐3, 30 (28,8%) para VPH‐4, 12 (11,5%) para VPH‐1 e dois (1,9%) para VPH‐2. Sete (6,7%) apresentaram mais de um tipo de VPH detectado. Os sintomas mais frequentes foram tosse e taquipneia, semelhantes a outras infecções respiratórias virais. As manifestações clínicas não diferiram de forma significativa entre as infecções por VPH‐1, ‐2, ‐3 e ‐4. Os VPH‐1, ‐3 e ‐4 estavam presentes na população estudada ao longo dos três anos de vigilância, e o VPH‐3 foi o tipo predominante identificado nos primeiros dois anos.
ConclusãoOs VPHs contribuem substancialmente para a DRA pediátrica no Brasil com quase 30% dessa contribuição atribuível ao VPH‐4.
Os vírus são a causa predominante da doença respiratória aguda (DRA) em todo o mundo e são responsáveis por taxas de morbidez e mortalidade substanciais em crianças entre um e cinco anos. Os vírus da parainfluenza humana (VPHs) representam uma proporção significativa da DRA viral em crianças, são a segunda causa mais comum de infecções do trato respiratório superior e inferior, logo depois do vírus sincicial respiratório humano (VSR).1 Estima‐se que os quatro sorotipos do VPH, VPH‐1, ‐2, ‐3 e ‐4, e dois subtipos, ‐4a e ‐4b, causam até 10% das DRAs da infância.2 O PIV1 e o PIV2 são a principal causa de crupe em crianças entre seis e 48 meses; o PIV3 e, em menor grau, o PIV1 são associados com mais frequência a bronquiolite e pneumonia em crianças com menos de um ano. Os VPHs também causam doenças graves, inclusive pneumonia e óbito em receptores de transplantes, bem como infecções nosocomiais e eclosões, semelhantemente ao VSR e ao vírus da gripe.3
Pouco se sabe sobre a epidemiologia e carga de doença de VPHs na população pediátrica na América Latina e principalmente no Brasil.1,4–6 Há ainda menos estudos com relação à infecção por VPH‐4 na América, pois poucos laboratórios fornecem diagnósticos específicos de VPH‐4 devido à sua aparentemente baixa frequência e dificuldade de crescimento em cultura de células.7
Para melhor esclarecimento do papel do VPH‐4 e de suas características clínicas em crianças com menos de dois anos com DRA, foram usadas análises de transcriptase reversa seguida de reação em cadeia da polimerase (RT‐PCR) em tempo real (rRT‐PCR) para identificar quatro tipos de VPH e outros vírus respiratórios comuns em aspirados nasofaríngeos.
MétodosO comitê de ética em pesquisa do Instituto de Ciências Biomédicas da Universidade de São Paulo aprovou o estudo. De março de 2008 a agosto de 2010, foram coletadas amostras de aspirados nasofaríngeos de pacientes com menos de dois anos com DRA atendidos ou internados no Hospital Santa Casa de Misericórdia (São Paulo, Brasil), após obter o consentimento por escrito dos pais das crianças. As amostras foram colocadas em um tubo de transporte viral e mantidas por até 48 horas a 4°C. As amostras foram processadas em um laboratório com nível de biossegurança 2 no Instituto de Ciências Biomédicas, Universidade de São Paulo. Todos os ácidos nucleicos foram extraídos automaticamente de 300μL de amostras frescas e eluídos em 110μL do tubo de eluição livre de RNase com o NucliSENS easyMAG (bioMérieux, Brasil) de acordo com as instruções do fabricante. Os ácidos nucleicos foram mantidos congelados a ‐70°C até serem usados. Foi usado um painel de ensaios múltiplos singleplex de transcriptase reversa seguida de reação em cadeia da polimerase em tempo real para detectar e identificar VPHs (tipos 1, 2, 3 e 4)8 e outros vírus respiratórios humanos, inclusive vírus sincicial respiratório, metapneumovírus humano, adenovírus e vírus da gripe A e B.9–11 As análises estatísticas foram feitas com o software Statgraphics Centurion XV, o teste qui‐quadrado para comparação de proporções foi usado em cada sintoma para verificar a proporção de pacientes que apresentam o sintoma nos sorotipos analisados. Também foi gerado um gráfico de análise de significados (ANOM) para determinar quais amostras apresentaram diferença significativa da média geral. Como o valor de p foi superior ou igual a 0,05, não existem diferenças significativas entre as amostras no nível de confiança de 95% ou mais.
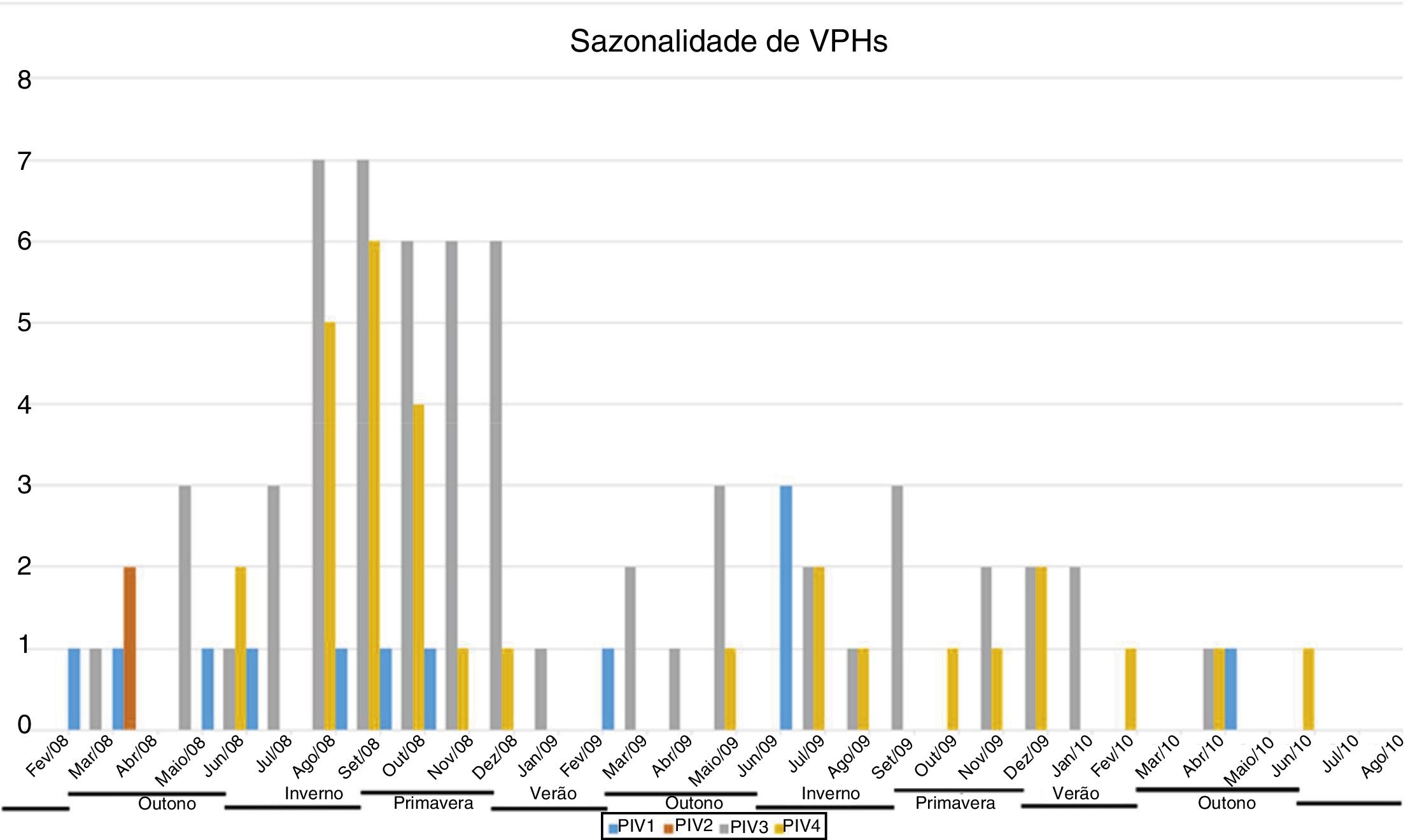
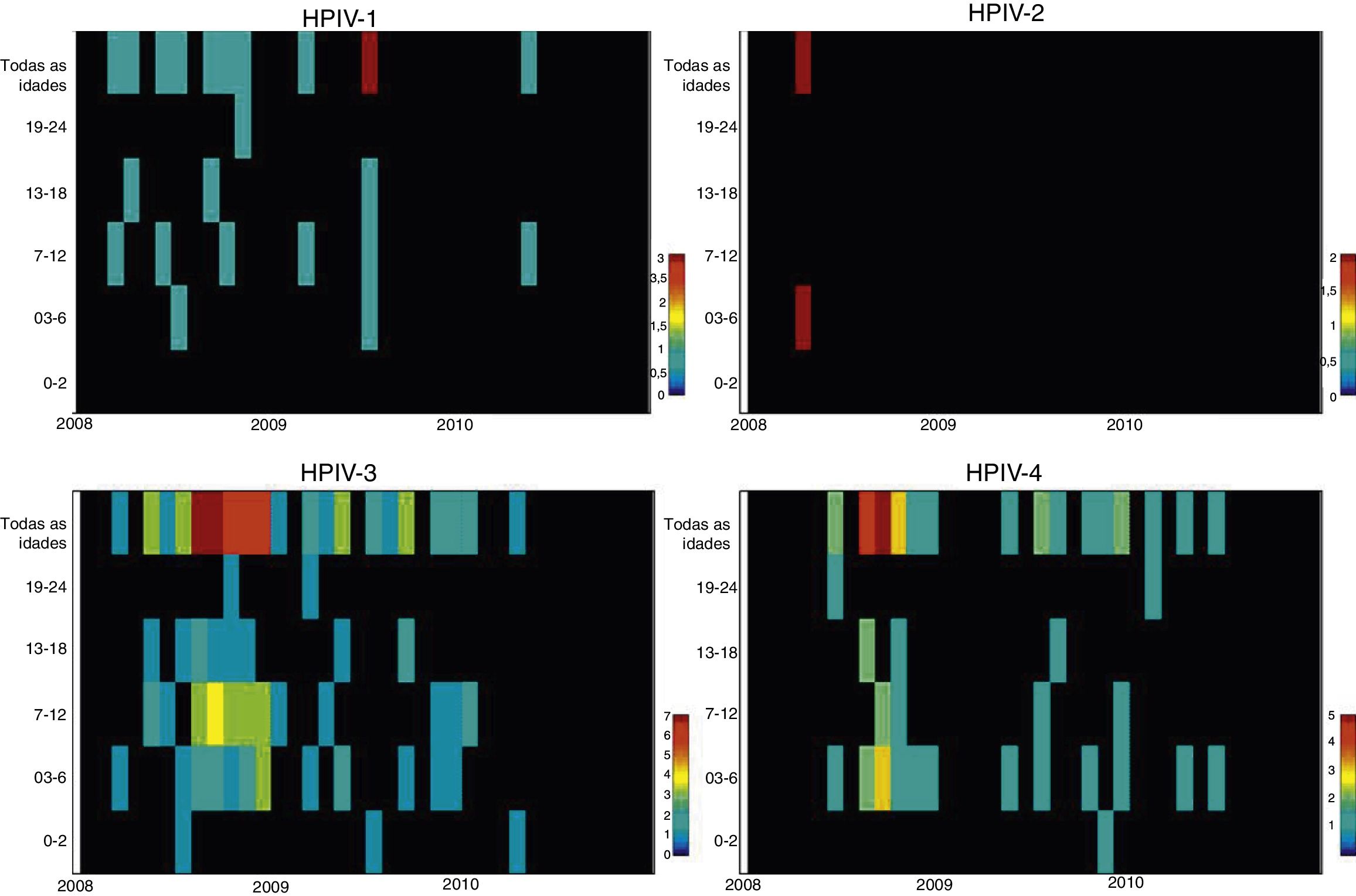
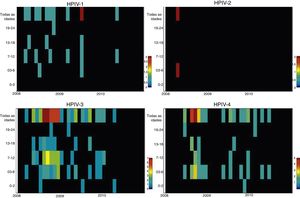
ResultadosAmostras nasofaríngeas foram coletadas de 1.002 pacientes com DRA. A infecção por vírus parainfluenza foi confirmada por laboratório em 104 (10,4%) amostras, das quais 60 (57,7%) foram positivas para VPH‐3, 30 (28,8%) para VPH‐4, 12 (11,5%) para VPH‐1 e duas (1,9%) para VPH‐2. A maioria das amostras de VPH‐4 confirmadas por laboratório foi coletada de agosto de 2008 a dezembro de 2008, porém poucos casos foram coletados em 2009 e 2010, como mostra a figura 1. A idade média de pacientes infectados por VPH‐4 foi de sete meses (0‐24), oito (1‐24) para VPH‐3, cinco (3‐6) para VPH‐2 e 11 (6‐22) para VPH‐1. Em contrapartida, a frequência de VPH‐4 foi maior na faixa de 3‐6 meses. De certa forma, menor do que a detecção de VPH‐3 e VPH‐1, com maior número de casos entre 7‐12 meses (fig. 2). Os prontuários médicos de 87 pacientes infectados por VPH foram examinados e os dados clínicos estão resumidos na tabela 1. Os sintomas clínicos proeminentes incluíam taquipneia (97,7%), tosse (94,3%), dispneia (94,3%), pieira (87,4%), coriza (71,3%) e febre (67,8%). Treze (15%) dos pacientes infectados precisaram de internação hospitalar (terapia intensiva). Em 23 casos, o VPH‐4 foi o único tipo de VPH detectado. Contudo, em outros sete casos, também foram detectados o VPH‐1 (um caso) e o VPH‐três (seis casos).
Sintomas clínicos de pacientes com VPH positivo (%)
| Sintomas clínicos | VPHs | |||||
|---|---|---|---|---|---|---|
| VPH‐1 (n = 11) | VPH‐2 (n = 2) | VPH‐3 (n = 50) | VPH‐4 (n = 24) | Todos (n = 87) | pa | |
| Óbito | 18,20 | 0,00 | 4,00 | 0,00 | 4,60 | 0,058 |
| Tosse | 90,90 | 100,00 | 96,00 | 91,70 | 94,30 | 0,677 |
| Paroxismo | 9,10 | 0,00 | 6,10 | 0,00 | 4,60 | 0,396 |
| Coqueluche | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | ‐ |
| Pieira | 81,80 | 100,00 | 88,00 | 87,50 | 87,40 | 0,855 |
| Taquipneia | 90,9b | 100,00 | 100,00 | 100,00 | 97,70 | 0,033 |
| Dispneia | 100,00 | 100,00 | 95,90 | 91,70 | 94,30 | 0,532 |
| Cianose | 9,10 | 0,00 | 20,00 | 8,30 | 14,90 | 0,352 |
| Apneia/Pausa | 0,00 | 0,00 | 4,00 | 8,30 | 4,60 | 0,524 |
| Febre | 90,00 | 100,00 | 60,00 | 78,30 | 67,80 | 0,077 |
| ≥ 39°C | 40,00 | 0,00 | 16,70 | 13,00 | 17,20 | 0,140 |
| Coriza | 81,80 | 100,00 | 72,00 | 62,50 | 71,30 | 0,480 |
| Hialina | 72,70 | 100,00 | 63,30 | 54,20 | 62,10 | 0,552 |
| Purulência | 18,20 | 0,00 | 10,40 | 8,30 | 10,30 | 0,674 |
| Conjuntivite | 18,20 | 0,00 | 12,50 | 4,20 | 10,30 | 0,397 |
| Diarreia | 9,10 | 0,00 | 12,00 | 0,00 | 8,00 | 0,212 |
| Fornecimento de O2 | 72,70 | 100,00 | 84,00 | 79,20 | 81,60 | 0,657 |
| Terapia intensiva | 18,20 | 0,00 | 18,00 | 8,30 | 14,90 | 0,532 |
| Ventilação mecânica | 18,20 | 0,00 | 16,00 | 8,30 | 13,80 | 0,616 |
Houve seis codetecções de VPH‐3 e ‐4 e uma codetecção de VPH‐1 e ‐4.
n = Número de pacientes positivos com informações clínicas disponíveis.
Foram detectados outros vírus respiratórios em 473 (47,2%) das 1.002 amostras de pacientes. Os vírus detectados com mais frequência foram VSR em 244 casos (24,3% do total de amostras), adenovírus em 121 (12,1%), gripe em 58 (5,8%) e metapneumovírus humano (HMPV) em 50 (5%). Coinfecções com dois ou mais vírus foram detectadas em 11,7% das amostras estudadas.
DiscussãoApesar de as associações entre infecção por VPH‐4 e DRA serem propostas há mais de meio século,12 elas normalmente não são incluídas no teste molecular disponível no Brasil porque não são consideradas um vírus causador de doenças importante.13 Até onde sabemos, este é o primeiro relatório de infecção por VPH‐4 em crianças com DRA no Brasil. Esse vírus circulou entre pacientes pediátricos com DRAs durante todo o período de testes juntamente com outros vírus respiratórios, inclusive outros VPHs. Esses resultados corroboram estudos de outros países nos quais o VPH‐4 foi identificado como causador de doenças respiratórias em crianças institucionalizadas, bem como adquirido na comunidade, como pneumonia e bronquiolite.14–16 O VPH‐4 foi o terceiro vírus mais prevalente (5,8%) em casos de doença do tipo gripe em adultos em duas estações consecutivas nos EUA de 1998 a 2000.3 Neste estudo, a prevalência de VPH‐4 ficou atrás de patógenos respiratórios mais comuns (VSR, adenovírus, gripe e HMPV), porém foi o segundo VPH mais prevalente depois do VPH‐3. No geral, os VPHs foram o terceiro patógeno viral respiratório mais comum detectado.
A análise de distribuição de idade de acordo com a infecção viral mostra que o maior número de casos positivos de todos os VPHs, como outros vírus respiratórios, ocorre em crianças com menos de um ano, o que vai de encontro com a literatura internacional.8,9,17
Ao comparar sintomas físicos e diagnósticos clínicos com etiologia, nenhuma associação pôde ser encontrada, então é impossível identificar o tipo de VPH apenas com base em sinais clínicos; contudo, foi encontrada uma taxa relativamente maior de necessidade de ventilação mecânica e terapia intensiva em pacientes com VPH‐1 e 3, bem como uma taxa maior de cianose em pacientes com VPH‐3. Entre os VPHs, foi observada uma taxa maior de óbitos em pacientes portadores do VPH‐1 (18,2%).
A limitação deste estudo foi o término da coleta de amostras antes do término do último ano estudado exatamente no período de maior incidência esperada, afetou possíveis inferências na sazonalidade de VPHs. Ademais, a falta de controles assintomáticos para ajudar a determinar a prevalência de infecções subclínicas por VPH‐4 e apenas um hospital amostrado. A população restrita complica a generalização de dados para a comunidade em geral. Estudos longitudinais devem ser feitos para confirmar os resultados obtidos neste estudo.
Não existem dados que descrevam a circulação do VPH‐4 no Brasil. Encontramos evidência de uma frequência moderada de detecção de VPH‐4 (28,8% de VPHs; 3% de todas as amostras de vírus positivas) em jovens crianças com DRA, igual ou superior a outros VPHs. São necessários estudos adicionais para confirmar esses achados. O VPH‐4 deve ser incluído em outros patógenos respiratórios testados rotineiramente em países em desenvolvimento, principalmente no grupo de neonatos de alto risco, como prematuridade, cardiopatias congênitas, doenças pulmonares crônicas, imunodeficiências e coinfecções (crianças com vários vírus), que poderão desenvolver doenças mais graves. Além disso, outros fatores de risco associados a doenças graves são internações mais longas, maior frequência de necessidade de oxigênio complementar, ventilação mecânica e terapia intensiva.
Isenção de responsabilidadeOs achados e conclusões neste relatório são os achados e conclusões dos autores e não representam necessariamente a posição oficial do Centro de Controle e Prevenção de Doenças.
FinanciamentoConselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Os autores agradecem à Fapesp e o CNPq (Y0204004040131) por seu apoio financeiro. A Wladimir Jimenez Alonso e à equipe NIH por seu apoio no uso do software EPIPOI no MISMS (Multinational Influenza Seasonal Mortality Study) 2015 (Taipei, Taiwan) e a Rosana Prisco pelo apoio estatístico.
Como citar este artigo: Thomazelli LM, Oliveira DB, Durigon GS, Whitaker B, Kamili S, Berezin EN, et al. Human parainfluenza virus surveillance in pediatric patients with lower respiratory tract infections: a special view of parainfluenza type 4. J Pediatr (Rio J). 2018;94:554–8.