Obesity is a late effect in survivors of childhood cancer and correlates with chronic complications. Survivors of leukemia, brain tumors, and hematopoietic stem cell transplantation are more likely to develop obesity resulting from treatment modalities such as radiotherapy and glucocorticoids. This paper analyzes and integrates the current data available to health professionals in order to clarify strategies that can be used to treat and prevent obesity in childhood cancer survivors.
SourcesThis is a literature review from on scientifically reliable electronic databases. We selected articles published in the last five years and earlier articles of great scientific importance.
Data synthesisThe mechanisms involved in the pathophysiology of obesity in cancer survivors are not completely understood, but it is believed that damage to the hypothalamus and endocrine disorders such as insulin resistance, leptin resistance, and hormone deficiency may be involved. The body composition of this group includes a predominance of adipose tissue, especially in those undergoing hematopoietic stem cell transplant and total body irradiation. The use of body mass index in these patients may lead to an underestimation of individuals risk for metabolic complications.
ConclusionEarly identification of groups using accurate anthropometric assessments, interventional treatment, and/or preventative measures and counseling is essential to minimize the adverse effects of treatment. Physical activity and healthy eating to promote weight loss in the whole population should be encouraged.
A obesidade é um efeito tardio em sobreviventes do câncer na infância e está correlacionada com complicações crônicas. Os sobreviventes da leucemia, tumores cerebrais e transplante de células‐tronco hematopoiéticas têm maior probabilidade de desenvolver obesidade como resultado das modalidades de tratamento, como radioterapia e glicocorticoides. Este artigo analisa e integra os dados atuais disponíveis a profissionais da saúde para esclarecer as estratégias que podem ser usadas para tratar e prevenir a obesidade em sobreviventes do câncer na infância.
FontesEsta é uma análise da literatura de bases de dados eletrônicas cientificamente confiáveis. Selecionamos artigos publicados nos últimos cinco anos e artigos mais antigos de grande importância científica.
Resumo dos dadosOs mecanismos envolvidos na fisiopatologia da obesidade em sobreviventes do câncer não são completamente entendidos, porém acredita‐se que o dano no hipotálamo e disfunções endócrinas, como resistência à insulina, resistência à leptina e deficiência hormonal, possam estar envolvidos. A composição corporal desse grupo inclui uma predominância de tecido adiposo, principalmente em pacientes submetidos a transplante de células‐tronco hematopoiéticas e irradiação de todo o corpo. O uso do índice de massa corporal nesses pacientes poderá levar a uma subestimação do risco de complicações metabólicas nessas pessoas.
ConclusãoA identificação precoce de grupos por meio de avaliações antropométricas precisas, o tratamento intervencional e/ou medidas preventivas e aconselhamento são fundamentais para minimizar os efeitos colaterais do tratamento. A atividade física e alimentação saudável devem ser incentivadas para promover a perda de peso na população em geral.
A obesidade é um efeito tardio reconhecido em sobreviventes do câncer na infância observado principalmente em alguns grupos, como sobreviventes de tumores cerebrais ou de leucemia, pois esses tipos de câncer são associados a outras doenças crônicas, incluindo diabetes, hipertensão, depressão, doença cardiovascular e dislipidemia.1,2 A obesidade nesses grupos de pessoas é bem descrita na literatura; entre todos os sobreviventes, foi comprovado que radioterapia craniana (CRT), quimioterapia e esteroides contribuem para uma alteração na composição corporal de pacientes já liberados do tratamento oncológico.3
Alterações endócrinas e metabólicas foram registradas como altamente prevalentes em sobreviventes de câncer que receberam transplante de células‐tronco hematopoiéticas (TCTH). Os fatores de contribuição podem incluir tratamento imunossupressor intensivo ou prolongado, disfunção endócrina pós‐transplante e resistência à insulina ou leptina. Embora não haja estudos que sugiram que o TCTH seja a causa, a prevenção e o tratamento precoce de riscos cardiovasculares nesses pacientes pode diminuir a incidência de complicações tardias após o transplante.4
A identificação precoce de grupos de alto risco, seguida de um plano de tratamento com base em avaliações metabólicas e nutricionais que inclua o aumento de atividade física, é um componente essencial na prevenção da obesidade.5 Com esse conhecimento, é importante estudar as causas da obesidade em todos os sobreviventes do câncer na infância, abordar não apenas causas bem documentadas na literatura como influentes, mas também fatores causais pouco explorados nesse grupo. Também questionamos a eficácia do índice de massa corporal (IMC) como indicador para identificar pacientes acima do peso, pois esses indivíduos passam por alterações na composição corporal e, portanto, os pacientes com risco de complicações metabólicas poderão ser ignorados. Portanto, nosso objetivo é promover a discussão sobre o assunto por meio de compilação de dados e do entendimento das possíveis causas e alertar profissionais da saúde sobre a importância desse assunto. A promoção do debate na comunidade acadêmica é essencial para incentivar a implantação de futuras políticas públicas de saúde para impedir a obesidade em crianças e adolescentes com câncer e futuros sobreviventes.
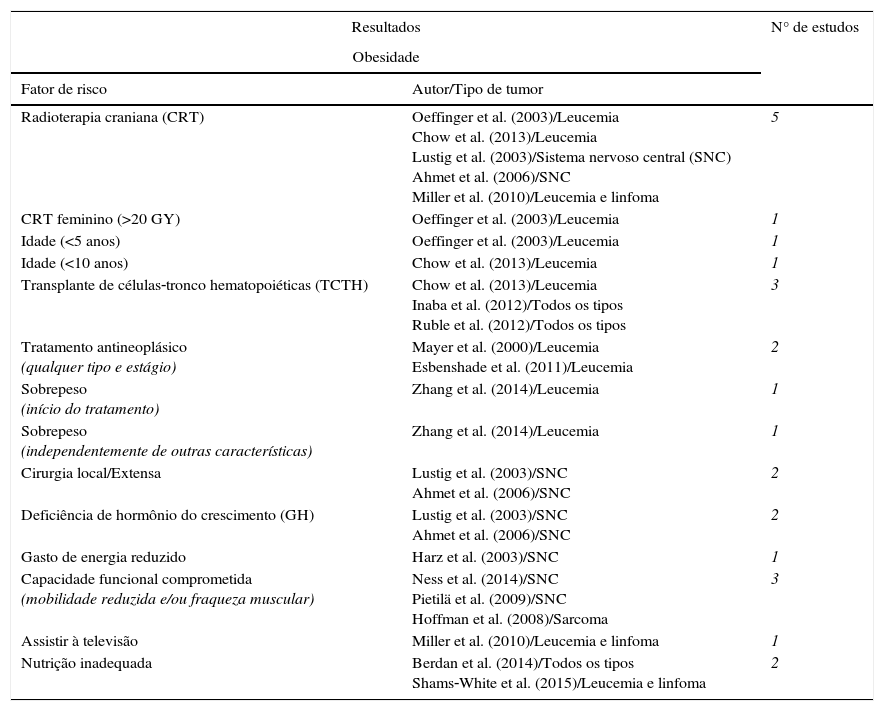
MétodosEsta é uma análise de literatura a partir de bases de dados eletrônicos científicos, feita no segundo semestre de 2014 e no primeiro semestre de 2015 com os seguintes termos descritivos relacionados ao tema: “Obesidade”; “Sobrevivente”; “Agentes antineoplásicos/efeitos colaterais”; “Neoplasias”; “Infância”. Selecionamos artigos publicados nos últimos cinco anos e artigos anteriores de grande importância científica, com exclusão daqueles que não se adequam ao trabalho proposto, e estratificamos segundo o modelo do estudo, número de participantes, tipo de tumor, objetivo do estudo e os resultados obtidos. Segue um resumo dos principais estudos que serão abordados e descritos nesta análise (tabela 1).
Resumo dos estudos sobre os principais fatores de risco relacionados a obesidade e síndrome metabólica em sobreviventes do câncer na infância
| Resultados | N° de estudos | |
|---|---|---|
| Obesidade | ||
| Fator de risco | Autor/Tipo de tumor | |
| Radioterapia craniana (CRT) | Oeffinger et al. (2003)/Leucemia Chow et al. (2013)/Leucemia Lustig et al. (2003)/Sistema nervoso central (SNC) Ahmet et al. (2006)/SNC Miller et al. (2010)/Leucemia e linfoma | 5 |
| CRT feminino (>20 GY) | Oeffinger et al. (2003)/Leucemia | 1 |
| Idade (<5 anos) | Oeffinger et al. (2003)/Leucemia | 1 |
| Idade (<10 anos) | Chow et al. (2013)/Leucemia | 1 |
| Transplante de células‐tronco hematopoiéticas (TCTH) | Chow et al. (2013)/Leucemia Inaba et al. (2012)/Todos os tipos Ruble et al. (2012)/Todos os tipos | 3 |
| Tratamento antineoplásico (qualquer tipo e estágio) | Mayer et al. (2000)/Leucemia Esbenshade et al. (2011)/Leucemia | 2 |
| Sobrepeso (início do tratamento) | Zhang et al. (2014)/Leucemia | 1 |
| Sobrepeso (independentemente de outras características) | Zhang et al. (2014)/Leucemia | 1 |
| Cirurgia local/Extensa | Lustig et al. (2003)/SNC Ahmet et al. (2006)/SNC | 2 |
| Deficiência de hormônio do crescimento (GH) | Lustig et al. (2003)/SNC Ahmet et al. (2006)/SNC | 2 |
| Gasto de energia reduzido | Harz et al. (2003)/SNC | 1 |
| Capacidade funcional comprometida (mobilidade reduzida e/ou fraqueza muscular) | Ness et al. (2014)/SNC Pietilä et al. (2009)/SNC Hoffman et al. (2008)/Sarcoma | 3 |
| Assistir à televisão | Miller et al. (2010)/Leucemia e linfoma | 1 |
| Nutrição inadequada | Berdan et al. (2014)/Todos os tipos Shams‐White et al. (2015)/Leucemia e linfoma | 2 |
| Síndrome metabólica | N° de estudos | |
|---|---|---|
| Fator de risco | Autor/Tipo de tumor | |
| TCTH (incluindo irradiação de todo o corpo [TBI]) | Van Waas et al. (2010)/Leucemia e SNC Oudin et al. (2011)/Leucemia Taskinen et al. (2000)/Todos os tipos Frisk et al. (2011)/Todos os tipos Scott Baker et al. (2007)/Todos os tipos | 5 |
Optamos por dividir os tópicos de discussão de acordo com o tumor e o tratamento por serem os principais tipos descritos na literatura correlacionada à obesidade.
Resultados e discussãoLeucemia linfoblástica aguda (LLA)A leucemia linfoblástica aguda (LLA) é o câncer infantil maligno mais comum e tem sido considerado um importante modelo para o estudo de distúrbios metabólicos e sua correlação com acontecimentos cardiovasculares, como derrames e doenças crônicas entre sobreviventes da LLA.6
O ganho de peso excessivo durante o tratamento da LLA normalmente está relacionado ao uso de esteroides, aos transtornos alimentares, à radioterapia do sistema nervoso central (SNC) e ao gasto reduzido de energia devido à inatividade física.3 O ganho de peso posterior ao tratamento também foi associado à CRT e as mulheres são mais afetadas do que os homens de acordo com uma análise de 1.765 adultos sobreviventes de câncer na infância inscritos no Estudo de Sobreviventes de Câncer na Infância (CCSS). Entre eles, as sobreviventes do sexo feminino tratadas com 20Gy apresentaram uma probabilidade duas a três vezes maior de ser obesas em comparação com seus irmãos do sexo masculino. Aqueles tratados antes dos 5 anos apresentaram uma probabilidade quase quatro vezes maior de ser obesos do que seus irmãos. Além disso, meninos tratados com 20Gy apresentaram uma chance quase duas vezes maior de ser obesos em comparação com seus irmãos do sexo masculino.7,8
De acordo com essa influência da radioterapia observada com base no peso, Mayer et al. relataram que a prevalência da obesidade foi significativamente maior após a terapia de LLA quando os fatores de obesidade após a terapia de LLA foram avaliados durante um estudo transversal com 39 sobreviventes da doença. Em comparação com os pacientes não irradiados, aqueles submetidos à terapia apresentaram taxas de metabolismo basal (TMB) altamente reduzidas, bem como uma redução em seus níveis de atividade física e concentrações menores de proteína 3 de ligação ao fator de crescimento semelhante à insulina e de tiroxina livre.9
Em sua análise dos efeitos diferenciais de CRT, radioterapia espinhal e irradiação de todo o corpo (TBI) sobre o crescimento e a função endócrina de 3.467 sobreviventes de LLA, o CCSS constatou que os pacientes tratados com TBI apresentavam, de forma significativa, maior probabilidade de ter peso abaixo da média do que aqueles que não receberam dose de radioterapia. Também foi constatado que aqueles tratados com CRT apresentavam, de forma significativa, maior probabilidade de estar acima do peso ou obesos. O estudo mostrou que a idade inferior a 10 anos no diagnóstico e o TCTH são características independentes associadas a alterações no IMC e a um maior risco de sobrepeso ou obesidade. Outros achados do estudo incluem o seguinte: a suplementação com hormônio do crescimento (GH) foi associada ao peso abaixo da média e as sobreviventes do sexo feminino, ao contrário de estudos anteriores, apresentaram menor probabilidade de estar acima do peso ou obesas do que os sobreviventes do sexo masculino. Os autores concluíram que pacientes tratados com quaisquer das terapias mencionadas apresentaram maior risco de alterações na composição corporal.10
Apesar de diversas evidências da associação entre obesidade e radioterapia (RT), os estudos também têm mostrado que os pacientes apresentam risco de sobrepeso em todas as fases de tratamento, independentemente da modalidade. Ao avaliar o IMC de 183 pacientes com LLA durante todas as fases de tratamento (diagnóstico, indução, consolidação e manutenção), observamos que, no diagnóstico, 36% dos pacientes estavam acima do peso e 19% estavam obesos. O escore z de IMC médio aumentou durante a fase de indução e, posteriormente, retornou à linha de base; entretanto, aumentou novamente ao longo dos primeiros 22 meses de manutenção. Ao término do tratamento, 49% dos pacientes estavam acima do peso e 21% estavam obesos. O aumento no escore z de IMC durante o diagnóstico foi associado ao aumento do escore z durante a fase de manutenção. O estudo concluiu que os pacientes correm risco de aumento do IMC em todas as fases de tratamento, o que implica um risco maior com relação a condições de saúde adversas no futuro.11
Outro estudo semelhante examinou o IMC de 83 sobreviventes pediátricos de LLA e foi observado que o peso no diagnóstico e o escore z de IMC são dois importantes preditores de sobrepeso e obesidade no fim do tratamento. Os pacientes que estavam acima do peso ou obesos no diagnóstico apresentaram probabilidade 11,9 maior de estar acima do peso ou ser obesos no fim de seu tratamento do que aqueles que estavam com peso abaixo da média ou com peso normal no diagnóstico. Um aumento de uma unidade no escore z de IMC no diagnóstico foi associado à triplicação do risco de estar acima do peso ou obeso no fim do tratamento. O estudo finalmente conclui que sobreviventes de LLA têm risco de ficar acima do peso no início do tratamento e que seu aumento de peso é mantido durante todo o tratamento, o que torna necessária uma intervenção precoce.12 Em reafirmação desses achados, o mesmo autor descobriu em uma metanálise dos sobreviventes de LLA que a obesidade é prevalente nesse grupo e não depende das características dos pacientes, como sexo ou idade no diagnóstico, e dos tratamentos, como irradiação craniana. Assim, profissionais da área da saúde poderão precisar prestar atenção especial a esses sobreviventes.13
Além de obesidade, a síndrome metabólica (SM) também é vivenciada por sobreviventes de câncer na infância como consequência de tratamentos antineoplásicos. A SM pode ser definida como um grupo de fatores de risco inter‐relacionados de origem metabólica que contribuem diretamente para o desenvolvimento de doença cardiovascular (DCV) e/ou diabetes mellitus tipo 2. Os fatores de risco bem conhecidos da SM incluem dislipidemia aterogênica, pressão arterial elevada e níveis elevados de glicose plasmática. Pessoas com essas características normalmente apresentam estado pró‐trombótico e pró‐inflamatório. A dislipidemia aterogênica inclui várias alterações nos níveis de lipoproteínas, incluindo um aumento no triacilglicerol, na apolipoproteína B (apo B) e na lipoproteína de baixa densidade (LDL) e uma redução na lipoproteína de alta densidade (HDL). Obesidade abdominal, resistência à insulina (RI), sedentarismo, envelhecimento e desequilíbrio hormonal podem promover fatores de risco metabólicos.14
Os sobreviventes do câncer na infância, principalmente os tratados com irradiação craniana, enfrentam maior risco de desenvolver SM quando adultos,15 principalmente os que tiveram LLA e cânceres no SNC e apresentaram fatores de risco como adiposidade visceral, dislipidemia, RI e hipertensão.16,17 Os autores de um estudo determinaram que a prevalência de SM em sobreviventes franceses de LLA foi de 9,2%, o dobro da taxa na população geral de jovens adultos franceses. Não houve associação entre a prevalência de SM e sexo, idade no diagnóstico, subtipo de leucemia ou tratamento com esteroides ou irradiação do SNC.18
As doenças endócrinas observadas em sobreviventes que receberam um TCTH são multifatoriais e correlacionadas à idade do paciente, doença base e tipo de transplante (autólogo ou alógeno). O regime de condicionamento do TCTH que usa doses elevadas de agentes quimioterápicos sozinhos ou combinados com radioterapia, destinado a eliminar células malignas ativas e residuais, poderá ser um fator de contribuição para o desenvolvimento de doenças endócrinas. Outro fator de contribuição pode ser a administração de agentes imunossupressores, destinados a produzir toxicidade hematopoiética precoce ou tardia, como profilaxia contra a doença do enxerto contra o hospedeiro (DECH).19,20
Sistema nervoso centralDeficiências hormonais e obesidade são complicações comuns após o tratamento de tumores do SNC. Atualmente, os principais fatores de risco que parecem prever o desenvolvimento de obesidade em sobreviventes de tumores do SNC são idade no diagnóstico, irradiação do hipotálamo maior do que 51Gy, localização do tumor, extensão da cirurgia, histologia do tumor e presença de doenças endócrinas, principalmente a deficiência de GH.21,22
Os craniofaringiomas são tumores raros que representam 2% a 5% dos tumores do SNC e se originam de resquícios do epitélio escamoso da bolsa de Rathke.23 Os sobreviventes de craniofaringioma apresentam risco substancialmente elevado de obesidade extrema devido à localização de seu tumor cerebral e a lesões do hipotálamo resultantes de ressecção cirúrgica. Essas pessoas vivenciam um estado de obesidade hipotalâmica, definida como qualquer lesão nos centros de controle de energia do hipotálamo, responsável pela regulação de peso corporal por meio do equilíbrio entre ingestão de alimentos, gasto de energia e quantidade de tecido adiposo.24 Essas lesões, que podem aparecer no hipotálamo ventromedial, no núcleo paraventricular, no núcleo arqueado e no hipotálamo lateral, podem resultar de procedimentos cirúrgicos, tratamentos antineoplásicos ou do próprio tumor. A lesão pode ser de natureza estrutural, funcional ou genética e comprometer, em última instância, as funções do hipotálamo e levar a um estado de obesidade severa.25
A consequente morbidez da ressecção radical do tumor feita para reduzir as chances de recidiva é explicada pela relação anatômica íntima dos craniofaringiomas com a neuro‐hipófise e principalmente com o hipotálamo. O transtorno hipotalâmico‐hipofisário –caracterizado por pan‐hipopituitarismo, obesidade, hiperfagia, obsessão com a busca de comida e distúrbios neuropsicológicos – afeta drasticamente a qualidade de vida das crianças afetadas e de suas famílias.26
Embora a dosagem e a duração do tratamento com dexametasona pericirúrgica tenha uma influência de curto prazo sobre o ganho de peso pós‐cirúrgico em pacientes com craniofaringioma, não é possível afirmar que afetem a obesidade mórbida de longo prazo. Outros fatores podem estar correlacionados com o ganho de peso nesse grupo, conforme observado por Harz et al., que descobriram que seus pacientes obesos com craniofaringioma apresentaram uma ingestão calórica próxima do normal, porém um gasto de energia reduzido em comparação com o grupo de controle com IMC semelhante. Os autores trabalham com a hipótese de que esse fenômeno possa estar relacionado a déficits neurológicos e visuais, bem como a uma produção não controlada de melatonina, e levar a um aumento da sonolência diurna.27
Os tratamentos foram propostos de forma a minimizar a obesidade hipotalâmica presente nesse grupo de pacientes. Em um estudo randomizado duplo‐cego que usa terapia com octreotida para obesidade hipotalâmica pediátrica, foi observado que, de forma análoga à somatostatina, resultou na estabilização do peso e do IMC. Adicionalmente, o tratamento com placebo não resultou em alteração no índice de ganho de peso, o que sugere efeitos benéficos da octreotida nesse grupo.28 Outro estudo avaliou o efeito da terapia combinada com diazóxido e metformina para a obesidade hipotalâmica e observou uma redução no IMC e na área abaixo da curva de insulina, o que é uma variável preditora da eficácia do tratamento.29
Além das terapias medicinais, a gastroplastia redutora foi proposta como um método eficiente e seguro para tratar a obesidade hipotalâmica, conforme descrito em um estudo de caso de um homem adulto submetido à ressecção do craniofaringioma aos 8 anos. Após 18 meses da gastroplastia redutora, houve uma redução no IMC de 52kg/m para 31,9kg/m, bem como remissão total da diabetes tipo 2 e melhoria expressa de sua apneia.30
Outros tipos de tumores no SNC também podem afetar o metabolismo de forma importante. Heikens et al. investigaram fatores de risco de DCV em um grupo misto de sobreviventes de longo prazo de tumores no SNC e descrevem um perfil de risco alterado para esse grupo de pacientes devido a dislipidemia, obesidade abdominal e pressão arterial sistólica elevada, principalmente para os que sofrem de uma deficiência de GH.31 Mecanismos adicionais contribuem para o excesso de peso nesse grupo, incluindo mobilidade reduzida, fraqueza nos músculos e tolerância reduzida a atividade física, o que compromete sua capacidade de participar completamente de uma rotina diária normal.32,33
Outros tipos de câncerO excesso de peso não foi demonstrado apenas em sobreviventes de LLA ou de tumores do SNC. Outros estudos que exploram grupos isolados de tipos de tumores, além de estudos agrupados sobre sobreviventes do câncer na infância, mostraram alterações nos padrões de IMC dos sobreviventes.
Ao analisar os sobreviventes do sarcoma na infância−predominantemente o sarcoma de Ewing – nos Estados Unidos, os sobreviventes apresentaram maior probabilidade de ter dois ou mais critérios para SM em comparação com seus controles. Uma análise dos critérios individuais de SM revelou uma prevalência maior de hipertensão e hipertrigliceridemia. No que diz respeito à situação nutricional com base no IMC, 22% dos sobreviventes eram obesos e 28% estavam acima do peso. Os sobreviventes tanto do sexo masculino quanto do feminino apresentaram um aumento da gordura corporal total conforme medida por absorciometria de dupla energia de raios X (Dexa). Outros parâmetros, como níveis de testosterona e atividade física, também foram avaliados e revelaram que, entre os sobreviventes do sexo masculino, o nível total de testosterona foi reduzido. Além disso, a testosterona livre e os escores z de atividade médios apresentavam forte tendência de diminuição conforme o número de indicadores de SM aumentava. Os autores chegaram à conclusão de que esse grupo de pacientes apresentou um aumento na prevalência de SM, principalmente entre os mais novos do que 40 anos. O desenvolvimento de SM nessa população foi associado aos níveis reduzidos de testosterona e capacidade funcional.34
Foram descritas as alterações na composição corporal dos sobreviventes e os problemas relacionados ao uso do IMC. Um estudo com 170 sobreviventes de LLA e linfoma buscou comparar indicadores de gordura corporal e fatores metabólicos relacionados à gordura corporal e determinar o risco de adiposidade em sobreviventes do câncer na infância que receberam uma ampla gama de tratamentos. Os autores concluíram que as taxas de gordura total do corpo e abdominal são maiores em sobreviventes de câncer na infância do sexo masculino do que em controles irmãos e o IMC não é um indicador sensível de adiposidade. Para sobreviventes tanto do sexo masculino como do feminino, a CRT ou assistir à televisão foram associados à adiposidade.35
Os tratamentos do câncer podem ter impacto sobre a região cerebral do hipotálamo‐hipófise e causar mudanças de longo prazo no consumo e na compulsão alimentar, como sugerido por autores que usaram um “inventário de desejo alimentar” modificado em 22 sobreviventes de leucemia e linfoma na infância. Comparados com sobreviventes diagnosticados mais cedo (< 4,5 anos), aqueles diagnosticados mais tarde tiveram significativamente mais desejos no total e desejo por fast food, doces, carboidratos e gordura; portanto, a idade de diagnóstico possivelmente afeta desejos alimentares em sobreviventes de câncer na infância.36
Hábitos mais saudáveis, como nutrição adequada, fator modificável e preventivo de doenças crônicas, não foram demonstrados em sobreviventes, como foi indicado em um estudo por Berdan et al. em 2014 que pretendeu avaliar a adesão de sobreviventes de câncer na infância às diretrizes da Sociedade Americana contra o Câncer (ACS) em comparação com um grupo de controle. Apenas 35,8% dos pacientes sobreviventes se encaixaram em uma faixa saudável de IMC, ao passo que 2,9% estavam abaixo do peso, 28,9% estavam acima do peso e 32,4% foram classificados como obesos. Os sobreviventes hispânicos apresentaram um IMC maior do que os brancos. A respeito do consumo de alimentos, apenas 4,8% dos sobreviventes aderiram totalmente às recomendações da ACS. Apenas 10,2% seguiram a ingestão recomendada de fibra alimentar e 17,7% consumiam cinco frutas e verduras por dia, ao passo que 46,2% seguiram a recomendação para carne vermelha processada.37
Transplante de células‐tronco hematopoiéticas (TCTH)Os TCTHs, incluindo transplantes de células‐tronco autólogas ou alógenas da medula óssea, do sangue periférico e do sangue do cordão umbilical, aumentaram consideravelmente nos últimos anos. O TCTH é aplicável principalmente no tratamento de leucemia e tumores sólidos, mas também é efetivo no tratamento de doenças hematológicas, imunológicas e genéticas e na cura de doenças metabólicas não hematológicas. Avanços na tecnologia de transplante e práticas de apoio ao tratamento levaram a melhorias progressivas na sobrevida de receptores de TCTH; contudo, em virtude de os pacientes viverem mais após o transplante, o risco de desenvolver complicações tardias relacionadas a exposições pré, peri e pós‐transplante aumentou. Essas complicações podem causar morbidez substancial, pioria na qualidade de vida dos pacientes e contribuir para a mortalidade tardia nessas pessoas. Os efeitos colaterais mais comuns, que normalmente resultam de regimes de condicionamento pré‐transplante, incluem distúrbios de crescimento e da tireoide, alterações metabólicas, insuficiência gonadal e osteoporose.4,38
Quando a frequência de efeitos tardios sobre a glicose e o metabolismo lipídico após o transplante na infância foi avaliada, 52% dos pacientes com transplantes apresentaram RI. Os principais indicadores de SM (hiperinsulinemia e hipertrigliceridemia combinadas) foram encontrados em 39% dos pacientes de transplante, em comparação com 8% em um grupo de controle de sobreviventes de LLA tratados apenas com quimioterapia (sem TCTH) e 0% nos controles saudáveis. A frequência de RI aumentou com o tempo depois que o TCTH foi feito. A obesidade abdominal era comum entre pacientes com RI. Os autores chegaram à conclusão de que os sobreviventes de longo prazo submetidos ao TCTH apresentam risco substancial de RI, intolerância a glicose e diabetes mellitus tipo 2 mesmo com peso normal e em uma idade jovem.39 Os autores sugerem que a redução na sensibilidade à insulina pode ser explicada por composição corporal adversa após TCTH, conforme avaliado em um estudo transversal com 18 sobreviventes do câncer do sangue (leucemia e linfoma) na infância que foram submetidos ao transplante e completaram dez anos sem tratamento. Com o uso da Dexa, foi mostrado que a massa gorda era significativamente maior e a massa corporal magra era significativamente menor nos sobreviventes do que nos pacientes do grupo de controle e esses parâmetros se correlacionam inversamente com sensibilidade à insulina. O IMC mediano do sobrevivente foi de 21,6kg/m2. O IMC tendeu a ser menor no grupo de sobreviventes devido à massa corporal magra reduzida, porém seus percentuais maiores de massa gorda foram associados a uma redução na sensibilidade à insulina.40
Além do próprio TCTH, a TBI como terapia preparatória para TCTH foi descrita por desempenhar um papel essencial na gênese da RI, conforme indicado por um grande estudo multicêntrico que incluiu sobreviventes adultos e pediátricos de transplantes. O risco de desenvolver diabetes mellitus tipo 2 era três vezes maior em pacientes que foram submetidos a TCTH e esse risco foi associado à TBI.41
Embora as complicações endócrinas em pacientes que receberam um TCTH tenham sido bem descritas na literatura, as causas do excesso de peso nesse grupo continuaram controversas. Essa controvérsia existe possivelmente devido à especificidade comprometida do uso do IMC como indicador de SM em sobreviventes do câncer na infância, principalmente nos que foram submetidos a transplante. Um estudo mediu as alterações do peso longitudinal e da composição corporal em sobreviventes de doenças hematológicas malignas na infância e observou uma redução significativa no IMC de sobreviventes após o TCTH, devido principalmente a uma redução na massa corporal magra. De acordo com os autores, os achados do estudo poderão ser atribuíveis à TBI e/ou ao grau da DECH crônica. Adicionalmente, eles sugerem que profissionais da saúde devem estar alertas para perdas não apenas no IMC, mas também na massa magra desses sobreviventes, para garantir intervenção precoce e adequada com base em educação nutricional e atividade física.42
Rubles et al. corroboraram esses achados e observaram que 54% dos sobreviventes apresentavam percentuais de gordura corporal (medidos pela Dexa) que ultrapassaram as recomendações para uma composição corporal saudável e 31% apresentavam obesidade abdominal. O tratamento anterior com TBI foi associado ao percentual de gordura corporal maior e à obesidade abdominal e a DECH ao percentual de gordura corporal menor. Os critérios de IMC não identificaram corretamente os sobreviventes do TCTH com um percentual de gordura corporal elevado. O estudo concluiu que os sobreviventes que receberam um TCTH na infância correm risco de desenvolver obesidade e obesidade abdominal, o que não é facilmente identificado pelos critérios de IMC padrão.43
ConclusãoOs sobreviventes de LLA e tumores do SNC são mais propensos a desenvolver obesidade devido às modalidades de tratamento empregadas, porém tratamentos antineoplásicos influenciam a aparência de excesso de peso em todos os sobreviventes do câncer na infância, independentemente do tipo de tumor. Como na população em geral, outros fatores contribuem para o ganho de peso nos sobreviventes, considerando que a obesidade é uma doença multifatorial; esses fatores incluem má nutrição, sedentarismo e características genéticas individuais. Além disso, a administração de TCTH e TBI afeta a composição corporal ao aumentar a adiposidade, reduzir a massa corporal magra e aumentar complicações metabólicas. A necessidade de assistência nesse grupo é clara. Estratégias para identificação precoce de pacientes de alto risco e desenvolvimento de modelos intervencionistas, incluindo aconselhamento nutricional, devem ser oferecidos por profissionais da saúde para minimizar e/ou prevenir essa complicação crônica de terapia antineoplásica.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes). O papel da fonte de financiamento é incentivar a educação e o desenvolvimento de pesquisas no país.
Como citar este artigo: Teixeira JF, Maia‐Lemos PS, Cypriano MS, Pisani LP. The influence of antineoplastic treatment on the weight of survivors of childhood cancer. J Pediatr (Rio J). 2016;92:559–66.