To review the literature on sialorrhea in children with cerebral palsy.
Source of dataNon‐systematic review using the keywords “sialorrhea” and “child” carried out in the PubMed®, LILACS®, and SciELO® databases during July 2015. A total of 458 articles were obtained, of which 158 were analyzed as they were associated with sialorrhea in children; 70 had content related to sialorrhea in cerebral palsy or the assessment and treatment of sialorrhea in other neurological disorders, which were also assessed.
Data synthesisThe prevalence of sialorrhea is between 10% and 58% in cerebral palsy and has clinical and social consequences. It is caused by oral motor dysfunction, dysphagia, and intraoral sensitivity disorder. The severity and impact of sialorrhea are assessed through objective or subjective methods. Several types of therapeutic management are described: training of sensory awareness and oral motor skills, drug therapy, botulinum toxin injection, and surgical treatment.
ConclusionsThe most effective treatment that addresses the cause of sialorrhea in children with cerebral palsy is training of sensory awareness and oral motor skills, performed by a speech therapist. Botulinum toxin injection and the use of anticholinergics have a transient effect and are adjuvant to speech therapy; they should be considered in cases of moderate to severe sialorrhea or respiratory complications. Atropine sulfate is inexpensive and appears to have good clinical response combined with good safety profile. The use of trihexyphenidyl for the treatment of sialorrhea can be considered in dyskinetic forms of cerebral palsy or in selected cases.
Revisar a literatura referente à sialorreia em crianças com paralisia cerebral.
Fonte de dadosRevisão não sistemática com as palavras‐chave “sialorreia”; e “criança” feita nas bases de dados Pubmed®, Lilacs® e Scielo® em julho de 2015. Foram recuperados 458 artigos, 158 foram analisados por terem relação com sialorreia em crianças, foram aproveitados 70 com conteúdo relativo à sialorreia na paralisia cerebral ou à avaliação e ao tratamento da sialorreia em outros distúrbios neurológicos.
Síntese dos dadosA sialorreia tem prevalência entre 10% e 58% na paralisia cerebral e implica consequências clínicas e sociais. É causada por disfunção motora oral, disfagia e distúrbio da sensibilidade intraoral. A gravidade e o impacto da sialorreia são avaliados por meio de métodos objetivos ou subjetivos. Estão descritas diversas formas de manejo terapêutico: treino para consciência sensorial e habilidades motoras orais, terapia farmacológica, injeção de toxina botulínica e tratamento cirúrgico.
ConclusõesO tratamento mais eficaz e que aborda a causa da sialorreia nas crianças com paralisia cerebral é o treino para consciência sensorial e habilidades motoras orais, feito por um fonoaudiólogo. Injeção de toxina botulínica e o uso de anticolinérgicos têm efeito transitório e são auxiliares ao tratamento fonoaudiológico ou devem ser considerados nos casos de sialorreia moderada a grave ou com complicações respiratórias. O sulfato de atropina tem baixo custo e parece ter boa resposta clínica com bom perfil de segurança. O uso de triexifenidil para o tratamento da sialorreia pode ser considerado nas formas discinéticas de paralisia cerebral ou em casos selecionados.
Sialorreia é a perda involuntária de saliva e conteúdo da boca,1,2 pode ocorrer normalmente em lactentes, porém aos 24 meses crianças com desenvolvimento típico devem ter a capacidade de fazer a maioria das atividades sem perda de saliva.3 Após os quatro anos, a sialorreia é anormal e frequentemente persiste em crianças com doenças neurológicas que incluam incoordenação neuromuscular da deglutição e deficiência intelectual.1 O termo paralisia cerebral (PC) descreve um grupo de transtornos do desenvolvimento do movimento e da postura, com restrições de atividade ou deficiência motora que são causadas por malformações ou insultos que ocorrem no cérebro em desenvolvimento, fetal ou infantil.4,5 Mundialmente, a prevalência de PC é de um a cinco para 1.000 nascidos vivos e é a causa mais comum de deficiência motora em crianças.6 A prevalência da sialorreia na PC é infrequentemente estudada e os resultados não podem ser comparados devido à variação nos desenhos de pesquisa e na seleção de pacientes.1 Alguns autores reportaram prevalência entre 10% e 58%,7–10 é razoável aceitar que um em cada três pacientes com PC tem sialorreia em algum grau.1
Apesar de pouco valorizada, a sialorreia implica consequências clínicas e sociais e tem diversos impactos relacionados a saúde geral da criança com PC, no que diz respeito à disfagia e à saúde respiratória, ao seu desenvolvimento socioafetivo e à sobrecarga emocional e de trabalho para as famílias e os cuidadores.
Esta revisão não sistemática tem por objetivo atualizar os profissionais envolvidos nos cuidados com crianças com PC em relação à literatura referente à sialorreia nesses pacientes e foi feita com as palavras‐chave “sialorreia” e “criança” nas bases de dados Pubmed®, Lilacs® e Scielo® em julho de 2015. Foram recuperados 458 artigos, 158 foram analisados por terem relação com sialorreia em crianças e foram aproveitados 70 com conteúdo relativo a sialorreia na paralisia cerebral ou a avaliação e tratamento da sialorreia em outros distúrbios neurológicos.
Fisiologia da salivaçãoAs parótidas produzem saliva mais serosa e aquosa como resultado da estimulação durante as refeições. As glândulas submandibulares e sublinguais produzem saliva mais viscosa e de uma forma mais constante ao longo do dia.11,12 Em média, um indivíduo deglute aproximadamente 600ml de saliva a cada dia. Entretanto, em alguns esse volume pode chegar a 1.000ml/dia.11 Aferências do quinto, sétimo, nono e décimo nervos cranianos chegam ao tractus solitarius e aos núcleos salivatórios no bulbo. O estímulo parassimpático chega às glândulas salivares submandibulares através do sétimo nervo craniano e às parótidas pelo nono nervo. As fibras simpáticas pré‐ganglionares se originam na coluna intermédia lateral do primeiro e do segundo segmento torácico e se conectam com fibras pós‐ganglionares no gânglio simpático cervical superior. Essas fibras simpáticas pós‐ganglionares percorrem o trecho ao longo da artéria carótida externa e atingem as glândulas salivares. A secreção da saliva é regulada indiretamente pelo circuito hipotalâmico‐solitário e por reflexos diretos modulados por estímulos táteis, mecânicos e gustatórios. É questionável se na PC pode ocorrer uma interrupção nesse mecanismo regulatório como parte da encefalopatia.11 A sialorreia pode variar de minuto a minuto, depende de fatores como fome, sede, cansaço, ansiedade e estado emocional e do ritmo circadiano de produção da saliva.1
Fatores predisponentes, fisiopatologia e etiologiaReid et al. analisaram os fatores predisponentes de sialorreia em crianças com PC (385 indivíduos) de 7 a 14 anos. São eles: os tipos não espásticos, o padrão topográfico tetraplégico, a ausência de controle cervical, as dificuldades graves na coordenação/função motora grossa, a epilepsia, a deficiência intelectual, a ausência de fala, a mordida anterior aberta e a disfagia.13
Atualmente, é amplamente aceito que a sialorreia na criança com PC não é causada por hipersalivação, mas sim por disfunção motora oral, por disfagia e/ou por distúrbio da sensibilidade intraoral.1,3,9,11,12 Senner et al. publicaram estudo em que compararam grupos de crianças com PC com sialorreia (n=14), crianças com PC sem sialorreia (n=14) e crianças com neurodesenvolvimento normal (n=14) por quantificação da produção de saliva por meio do teste Saxon, descrito por Kohler et al.14 Os resultados demonstraram piores escores na função motora oral sem produção de saliva em excesso no grupo PC com sialorreia e sugerem que a hipersalivação não é um dos fatores responsáveis pela sialorreia na PC.3 Erasmus et al. estudaram grupos de crianças com PC (n=100) e de crianças saudáveis (n=61) por meio de coleta de saliva por método descrito por Rottevel et al.15 e concluíram que não houve diferenças entre as taxas de fluxo salivar nos dois grupos de pacientes.11 Um reflexo de deglutição correto é essencial para a deglutição de saliva. Essa função básica complexa é mediada por sistemas neuromusculares orofaciais e envolve uma série de reflexos sequenciais, movimentos coordenados dos músculos da mandíbula, dos lábios, da língua, da faringe, da laringe e do esôfago.12 Vários estudos demonstraram correlação positiva entre a sialorreia nas crianças com PC e os seguintes fatores: dificuldades na formação do bolo alimentar,3,7 vedamento labial ineficiente, distúrbio de sucção, resíduo alimentar aumentado,3,16 dificuldades para controle dos lábios, da língua e da mandíbula,3,8 sensibilidade intraoral reduzida,3,17 frequência reduzida de deglutição espontânea,18 disfagia de fase esofagiana3,7 e má oclusão dentária.3,19 Significativas correlações negativas foram encontradas entre sialorreia e capacidade de mastigação e outras habilidades de deglutição em geral.3 Outros fatores, todos comuns na PC, influenciam na presença e na gravidade da sialorreia: posição de boca aberta, postura corporal inadequada particularmente da cabeça, deficiência intelectual, estado emocional e grau de concentração.1,12,20
Relação entre sialorreia e doença do refluxo gastroesofágico (DRGE)A saliva tem um importante papel na defesa contra lesão de mucosa esofagiana induzida por DRGE. Em crianças com sialorreia, a perda constante de saliva pode prejudicar a remoção do ácido gástrico refluído no esôfago, o que pode perpetuar dismotilidade esofagiana e esofagite.3,21 Heine et al., em estudo feito em 1996, demonstraram que 1/3 das 24 crianças portadoras de sialorreia tinham evidências de DRGE na phmetria de 24 horas ou na esofagoscopia. Nesse estudo o tratamento medicamentoso com cisaprida e ranitidina para DRGE não reduziu a gravidade e a frequência da sialorreia na maioria das crianças e na opinião dos autores a secreção de saliva estimulada por DRGE deve ter importância clínica apenas naqueles pacientes portadores de esofagite substancial.21 Para Erasmus et al., a irritação química causada por DRGE pode levar a aumento na produção de saliva graças à mediação do sistema nervoso parassimpático e do reflexo vagovagal, com o objetivo de proteger as mucosas orofaríngea e esofagiana. Nas crianças com disfunção motora oral, esse aumento na produção de saliva poderia se acumular na faringe e/ou no esôfago e aumentar o risco de aspiração. Na opinião dos autores, ainda são matérias de debate se a DRGE pode por si só causar sialorreia grave e se o tratamento para DRGE pode reduzir a sua intensidade em crianças com PC.10
Classificação, implicações clínicas, sociais e familiaresDo ponto de vista clínico, pode‐se classificar a sialorreia em anterior e posterior, ambas podem ocorrer isoladamente ou simultaneamente. Sialorreia anterior é a perda não intencional de saliva a partir da boca. Sialorreia posterior é o deslizamento de saliva a partir da língua para a faringe.1,10,22
A sialorreia anterior pode levar a consequências psicossociais, físicas e educacionais. Uma delas é o isolamento social, que pode ter efeitos negativos sobre a autoestima. As crianças mais gravemente afetadas podem ter um odor desagradável e podem ser rejeitadas por seus pares e até mesmo por seus cuidadores. Os indivíduos podem ser percebidos negativamente com subestima da sua capacidade intelectual. A extensão desse impacto varia de acordo com características socioculturais, em função da idade e da capacidade cognitiva. A sialorreia anterior grave requer mudanças frequentes de roupas e pode causar danos aos livros, computadores e teclados e ameaçar ferramentas essenciais para a educação e a comunicação. Podem também ocorrer infecções periorais e prejuízo para a dentição.1,3,10,23–28 Essas consequências atingem a vida dos pacientes e também têm impacto na qualidade de vida dos parentes e cuidadores. Um grupo holandês demonstrou as enormes demandas para os cuidadores em termos de sobrecarga de trabalho, tais como ter de lembrar frequentemente o indivíduo para deglutir a saliva, limpar o excesso de saliva da boca, no queixo e em outras áreas, mudar e lavar toalhas e roupas.27,28
A sialorreia posterior ocorre nas crianças com disfagia de fase faríngea mais grave. Essas crianças estão em risco para aspiração de saliva, que pode causar pneumonias de repetição ou até não ser diagnosticada antes do desenvolvimento de lesão pulmonar significativa.10 Park et al. descreveram dois casos nos quais foi documentada com sucesso aspiração de saliva para a árvore traqueobrônquica por meio de um exame com radionucleotídeo denominado salivograma. Esse mesmo método foi usado e evidenciou a redução total da aspiração de saliva após aplicação de toxina botulínica em glândulas salivares dos pacientes.29 Vijayasekaran et al. estudaram um grupo de 62 crianças submetidas a tratamento cirúrgico para sialorreia e evidenciaram elevação da saturação média de oxigênio e redução da frequência de pneumonias. Assim, intervenções terapêuticas podem efetivamente melhorar a saúde respiratória nesses pacientes.30
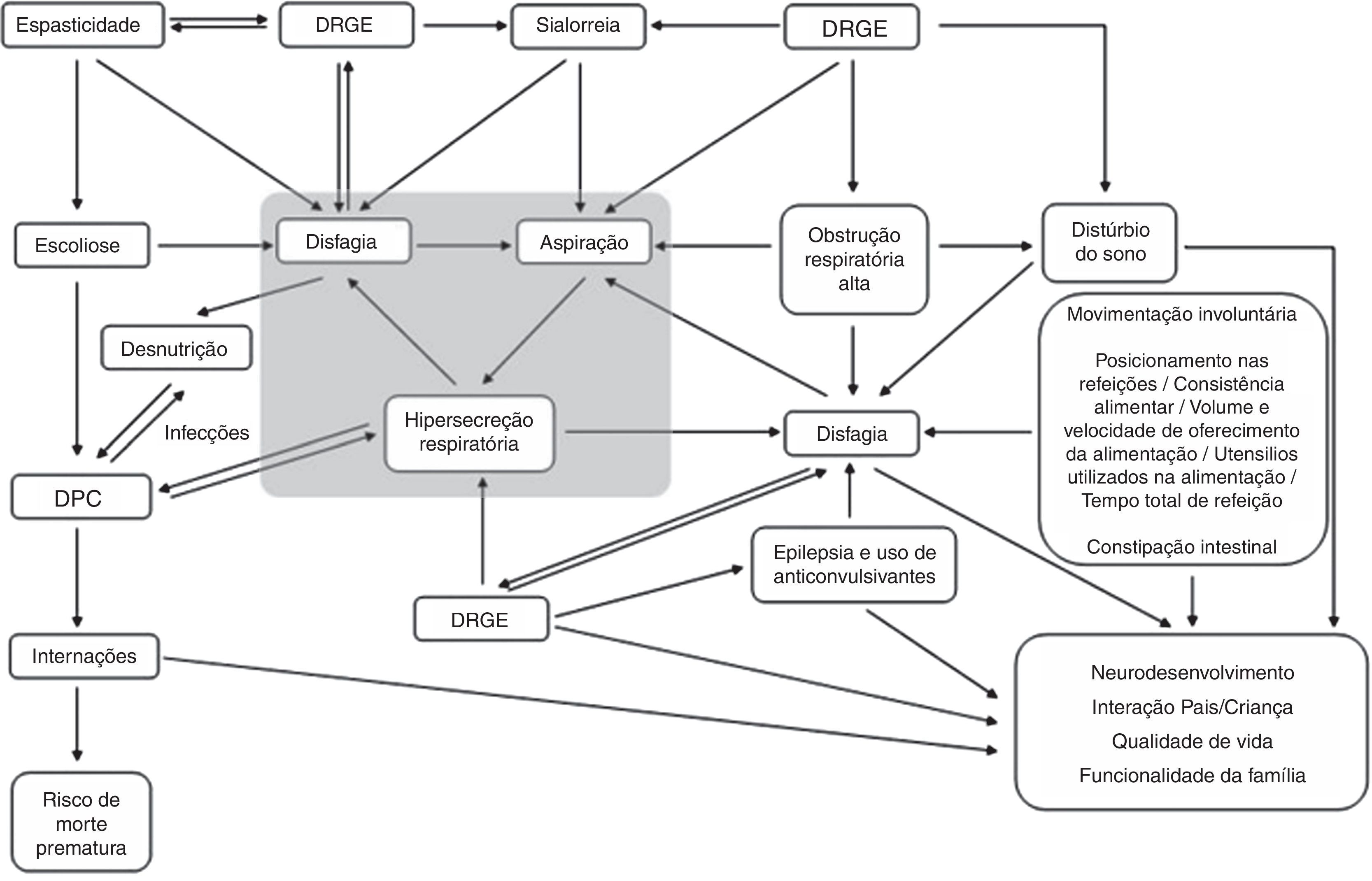
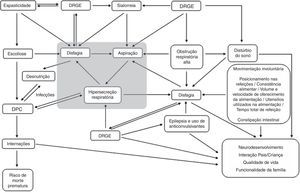
Avaliação da sialorreiaAvaliação clínicaOs variados aspectos clínicos envolvidos na saúde das crianças com PC podem influenciar na ocorrência e na gravidade da sialorreia e de modo reverso, podem ser influenciados na sua gravidade pela sua presença (fig. 1). Por isso, na avaliação clínica da sialorreia, esses diversos fatores (tabela 1) devem ser pesquisados ativamente por meio da anamnese e observação da criança.1
Fatores clínicos a serem pesquisados
| Histórico clínico e socioemocional Motivação, capacidade física e cognitiva para tentar reduzir a sialorreia Uso de medicações (anticonvulsivantes, benzodiazepínicos, neurolépticos) Exame neurológico (incluindo estado de alerta, pares cranianos, capacidade motora geral, postura e tônus) Avaliação orofacial (sinais de obstrução respiratória alta) Higiene oral, oclusão e saúde dentária, vedamento labial Linguagem (disartria, dispraxia) e capacidade de comunicação em geral Cognição Saúde respiratória (hipersecreção, broncoespasmo e infecções recorrentes)/atopia Presença de DRGE Presença e avaliação de disfagia Nutrição |
DRGE, doença do refluxo gastroesofágico.
Existe grande dificuldade para a mensuração da sialorreia. A criança não deve perceber que é observada e deve ser estudada em situações do seu cotidiano. Apesar disso, existe a necessidade da quantificação da frequência e gravidade da sialorreia e do seu impacto na qualidade de vida da criança e dos seus cuidadores. A gravidade e o impacto da sialorreia podem ser avaliados por meio de métodos objetivos ou subjetivos.31
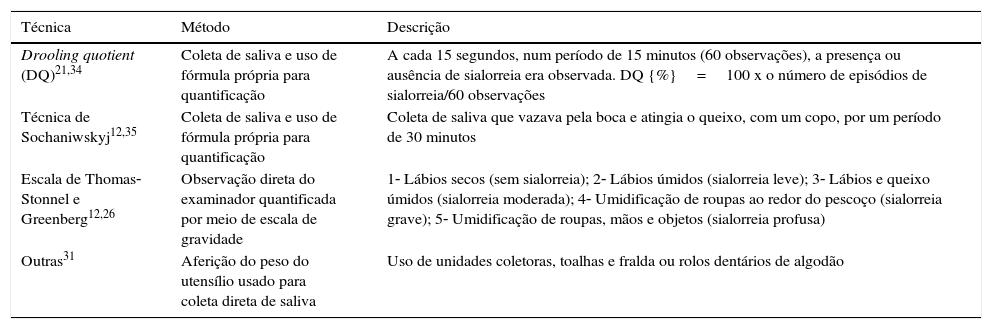
Métodos objetivos incluem mensuração do fluxo salivar e observação direta da perda de saliva. Algumas dessas técnicas estão descritas na tabela 2.12,21,25,26,31–35 O desenvolvimento de métodos de mensuração diretos (objetivos) da sialorreia anterior, que sejam validados e realmente factíveis, ainda é um desafio, tanto do campo de pesquisa quanto na prática clínica.31
Métodos objetivos para mensuração da sialorreia
| Técnica | Método | Descrição |
|---|---|---|
| Drooling quotient (DQ)21,34 | Coleta de saliva e uso de fórmula própria para quantificação | A cada 15 segundos, num período de 15 minutos (60 observações), a presença ou ausência de sialorreia era observada. DQ {%}=100 x o número de episódios de sialorreia/60 observações |
| Técnica de Sochaniwskyj12,35 | Coleta de saliva e uso de fórmula própria para quantificação | Coleta de saliva que vazava pela boca e atingia o queixo, com um copo, por um período de 30 minutos |
| Escala de Thomas‐Stonnel e Greenberg12,26 | Observação direta do examinador quantificada por meio de escala de gravidade | 1‐ Lábios secos (sem sialorreia); 2‐ Lábios úmidos (sialorreia leve); 3‐ Lábios e queixo úmidos (sialorreia moderada); 4‐ Umidificação de roupas ao redor do pescoço (sialorreia grave); 5‐ Umidificação de roupas, mãos e objetos (sialorreia profusa) |
| Outras31 | Aferição do peso do utensílio usado para coleta direta de saliva | Uso de unidades coletoras, toalhas e fralda ou rolos dentários de algodão |
Escalas subjetivas são métodos úteis e apropriados para mensurar mudanças na sialorreia, pois o impacto nas famílias, nos cuidadores e nos próprios indivíduos é de primeira importância quando pesquisamos a satisfação com a eficácia de qualquer tratamento. Na opinião de alguns pesquisadores, o método definitivo para a avaliar a eficácia de qualquer tratamento para a sialorreia é aquele que afere em quanto a vida do cuidador foi facilitada e que quantifica a melhoria na qualidade de vida da criança.33,36 Escalas subjetivas, como Drooling Rating Scale, Drooling Frequency and Severity Scale, Visual Analogue Scale e a Drooling Impact Scale,31,33,36 são preenchidas por pacientes ou por seus cuidadores, que expressam suas impressões qualitativa e quantitativa da gravidade e do impacto da sialorreia.31
TratamentoObjetivosOs objetivos principais no tratamento da sialorreia são: redução dos impactos socioafetivos e de saúde provocados pela sialorreia anterior; redução dos impactos de saúde provocados pela sialorreia posterior; melhoria da qualidade de vida de pacientes e cuidadores; redução na sobrecarga vivida pelos cuidadores.
Qualidade de vida e sobrecarga para parentes/cuidadores, autoestima e saúde da criançaEm geral, após as diversas modalidades de tratamento, as demandas com os cuidados com essas crianças são reduzidas, particularmente na frequência de necessidade de limpar boca, lábios e queixos, no número de trocas de toalhas e roupas e no dano a livros, material escolar, brinquedos e equipamentos eletrônicos.36,37 Adicionalmente, a redução da sialorreia melhora o contato social da criança com seus pares. Mesmo naquelas crianças com deficiência intelectual, um estudo alemão mostrou que a percepção dos pais em relação à satisfação da criança com respeito à relação a sua aparência física e à sua vida em geral pode melhorar após intervenções terapêuticas.36,38 Van der Burg et al. (2006) publicaram estudo no qual avaliaram mudanças na qualidade de vida e na necessidade de cuidados como resultado do tratamento para sialorreia. O impacto da sialorreia foi investigado antes e após tratamento, por meio de questionário elaborado especificamente para esse estudo. Os resultados demonstraram que a redução no fluxo salivar teve efeitos significativamente positivos na necessidade de cuidados diários. Os autores concluem que redução do fluxo salivar não deve ser o único objetivo no tratamento da sialorreia. É recomendável que as diversas modalidades terapêuticas também sejam avaliadas em relação ao impacto que trazem para a vida diária do paciente.38
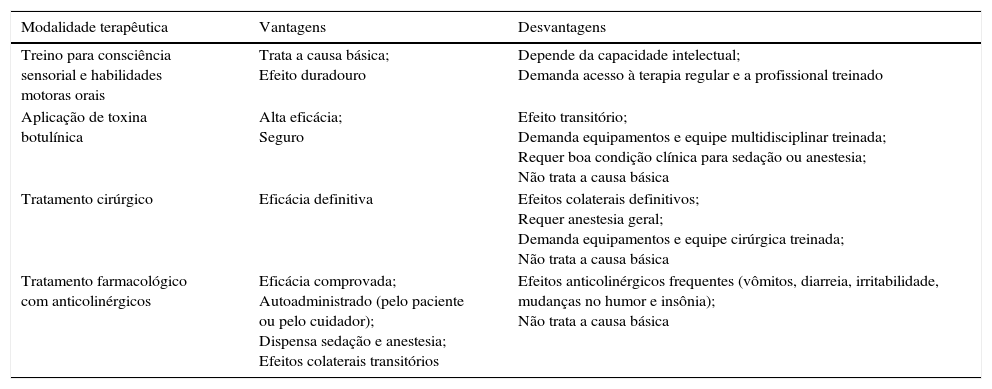
Modalidades terapêuticasNa literatura estão descritas diversas formas de manejo terapêutico. As vantagens e desvantagens das principais modalidades terapêuticas estão resumidas na tabela 3.
Vantagens e desvantagens das principais modalidades terapêuticas
| Modalidade terapêutica | Vantagens | Desvantagens |
|---|---|---|
| Treino para consciência sensorial e habilidades motoras orais | Trata a causa básica; Efeito duradouro | Depende da capacidade intelectual; Demanda acesso à terapia regular e a profissional treinado |
| Aplicação de toxina botulínica | Alta eficácia; Seguro | Efeito transitório; Demanda equipamentos e equipe multidisciplinar treinada; Requer boa condição clínica para sedação ou anestesia; Não trata a causa básica |
| Tratamento cirúrgico | Eficácia definitiva | Efeitos colaterais definitivos; Requer anestesia geral; Demanda equipamentos e equipe cirúrgica treinada; Não trata a causa básica |
| Tratamento farmacológico com anticolinérgicos | Eficácia comprovada; Autoadministrado (pelo paciente ou pelo cuidador); Dispensa sedação e anestesia; Efeitos colaterais transitórios | Efeitos anticolinérgicos frequentes (vômitos, diarreia, irritabilidade, mudanças no humor e insônia); Não trata a causa básica |
Para as crianças capazes de obedecer aos comandos e de cooperar com o treino, essa é a pedra fundamental de intervenção e deve ser testada antes das outras opções de tratamento. Manobras iniciais incluem melhorias da posição sentada, nos movimentos labiais e no fechamento da mandíbula e da língua. Em sua forma mais simples, consiste em exercícios que são apresentados de forma lúdica, como uso de texturas diferentes ao redor da boca (cubos de gelo, escova de dentes elétrica etc.) para estimular a consciência sensorial e exercícios para melhorar a vedação dos lábios e o movimento da língua (uso de canudo, beijos de batom no papel, encher bexigas de festa etc.). É necessária a orientação constante do fonoaudiólogo. Ao contrário das crianças com sintomas neurológicos mais graves e com menor capacidade de cooperação e de compreensão, aquelas com sialorreia leve podem conseguir benefícios significativos por meio de tal programa.39
Modificação corporal via biofeedbackA modificação corporal via biofeedback é baseada na monitoração do grupamento muscular alvo para estimulação com o uso de eletromiografia. Quando o músculo contrai, a eletromiografia informa a mudança na atividade muscular por meio de sinais acústicos ou luminosos. Assim, o paciente pode conscientemente “corrigir” ou melhorar certos componentes da deglutição. A técnica pode ter um impacto positivo no treinamento do paciente e na melhoria da função oromotora.12,20
Terapia ortodônticaDeve ser usada como complementar a qualquer outro tratamento e tem por objetivos prevenir ou corrigir a mordida anterior aberta e outras anormalidades na oclusão dentária vertical.12
Terapias farmacológicas e cirúrgicasApesar das indicações de que a hipersalivação não é um dos fatores responsáveis pela sialorreia em crianças com PC, a maioria dos tratamentos disponíveis, incluindo uso de medicações por via oral (VO), transdérmica (TD) ou sublingual (SL), aplicação de toxina botulínica ou manejo cirúrgico, tem por objetivo a redução na produção da saliva.3 Existem vantagens e desvantagens no uso dessas técnicas (tabela 3), comparativamente com aquelas não farmacológicas e não cirúrgicas. Em geral, as opções que visam à redução na produção da saliva levam mais rapidamente a uma efetiva redução da sialorreia, porém com o perfil de efeitos colaterais próprios de cada modalidade de tratamento. Outro aspecto importante tem relação com a possível exacerbação de DGRE e esofagite.3 Dessa forma, naqueles que se encontram em um tratamento cujo mecanismo de ação é a redução da produção de saliva, a abordagem precoce e efetiva para DRGE torna‐se imprescindível. Nesse grupo de tratamentos, cada modalidade tem suas peculiaridades descritas a seguir.
Toxina botulínicaA injeção intraglandular de toxina botulínica inibe a liberação de acetilcolina das terminações nervosas colinérgicas e consequentemente reduz a secreção de saliva e a sialorreia. Alguns estudos prospectivos, controlados, investigaram o uso de toxina botulínica tipo A (BoNT‐A) para tratamento de sialorreia. Uma significativa redução na sialorreia foi notada nestes estudos com o uso de escalas objetivas (Classe I) e subjetivas de controle. Os sítios de injeção são as glândulas parótidas e submandibulares. Crianças maiores (colaborativas) e adultos podem ser submetidos a anestesia local.1,40,41 Algumas desvantagens (tabela 3) dificultam o acesso dos pacientes ao procedimento: os sítios de injeção devem ser acessados, de forma ideal, por meio de ultrassonografia; a técnica exige a presença de equipes médica e de enfermagem com experiência; deve‐se avaliar se o paciente tem condições clínicas para ser submetido a sedação ou anestesia.
Tratamento cirúrgicoO primeiro tratamento cirúrgico para sialorreia foi a realocação de ductos da parótida,42 seguido por remoção adicional das glândulas submandibulares.43,44 Procedimentos radicais, como divisão bilateral dos ductos das parótidas com remoção das submandibulares e neurectomias, foram propostos, porém com resultados imprevisíveis.43–48 As cirurgias foram feitas na maioria em adultos e sua eficácia era questionável, pois havia retorno dos sintomas algum tempo depois.43,44 Em 1974, Ekedahl descreveu a realocação dos ductos das submandibulares para a fossa tonsilar.49 As glândulas mantinham o funcionamento com passagem normal de saliva para a orofaringe, o que evita o acúmulo de saliva no andar anterior da boca, garante a presença de saliva na cavidade oral e mantém sua contribuição no processo de deglutição. Ao longo dos anos subsequentes sofreu poucas modificações (associadamente é feita a remoção das sublinguais) e se tornou a técnica cirúrgica de escolha para sialorreia grave.44,49 Pelo risco de consequências definitivas (principalmente a xerostomia), é indicada apenas nos casos mais graves, não responsivos às terapêuticas não cirúrgicas e em que a sialorreia repercute com grande impacto sobre a saúde e a qualidade de vida das crianças e dos parentes/cuidadores.1
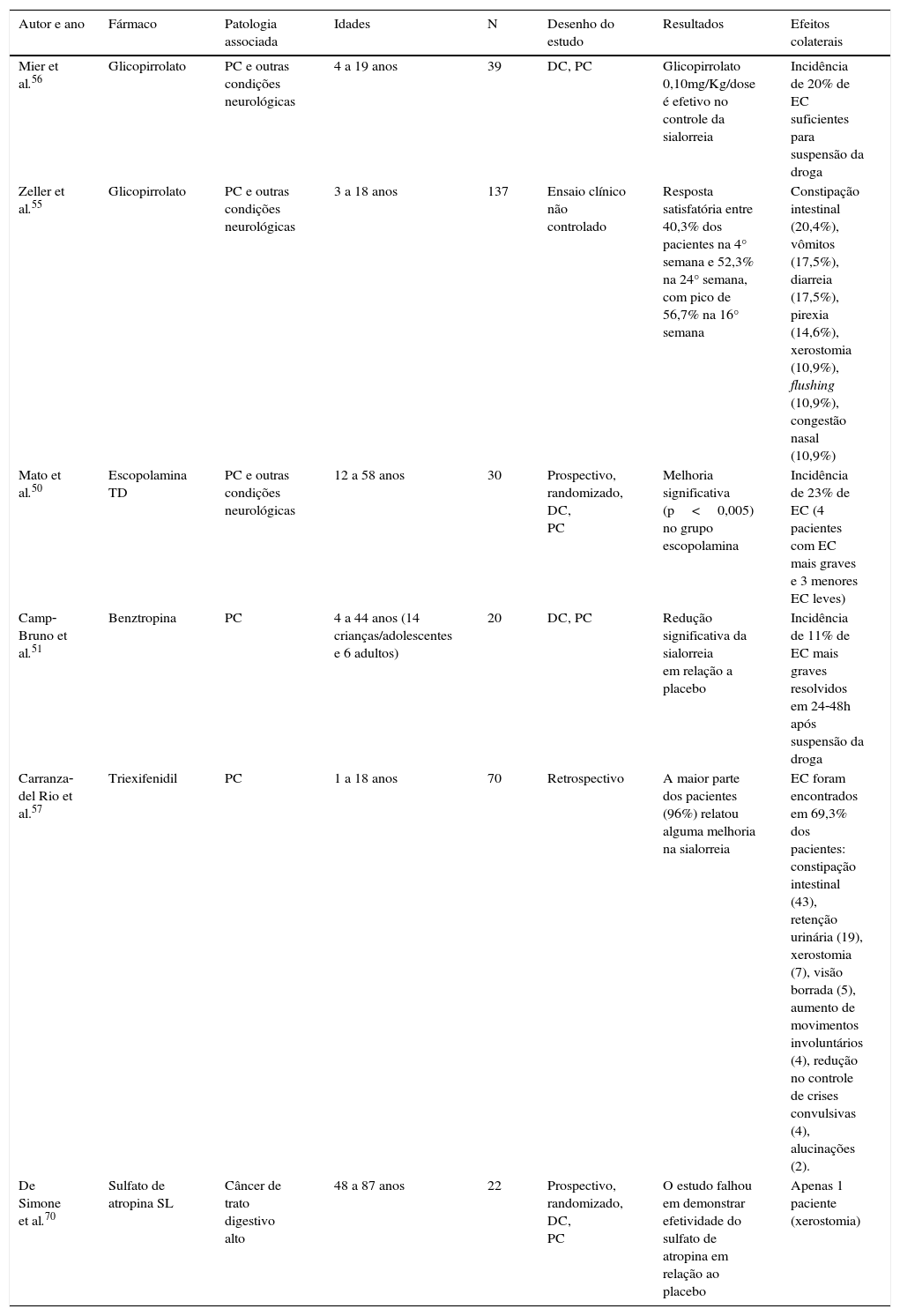
Tratamento farmacológico via oral (VO), transdérmica (TD) ou sublingual (SL)As glândulas salivares são controladas pelo sistema nervoso autônomo parassimpático e, por isso, as drogas anticolinérgicas induzem uma importante redução no fluxo de saliva e são os medicamentos mais usados. As vantagens e desvantagens do uso de anticolinérgicos por VO, TD ou SL estão resumidas na tabela 3.12,50–57 Os anticolinérgicos sistêmicos mais usados são glicopirrolato, benztropina, escopolamina, triexifenidil e sulfato de atropina, porém apenas o triexifenidil e o sulfato de atropina estão disponíveis no Brasil. Os resultados de alguns estudos com essas drogas estão resumidos na tabela 4.
Tratamento farmacológico
| Autor e ano | Fármaco | Patologia associada | Idades | N | Desenho do estudo | Resultados | Efeitos colaterais |
|---|---|---|---|---|---|---|---|
| Mier et al.56 | Glicopirrolato | PC e outras condições neurológicas | 4 a 19 anos | 39 | DC, PC | Glicopirrolato 0,10mg/Kg/dose é efetivo no controle da sialorreia | Incidência de 20% de EC suficientes para suspensão da droga |
| Zeller et al.55 | Glicopirrolato | PC e outras condições neurológicas | 3 a 18 anos | 137 | Ensaio clínico não controlado | Resposta satisfatória entre 40,3% dos pacientes na 4° semana e 52,3% na 24° semana, com pico de 56,7% na 16° semana | Constipação intestinal (20,4%), vômitos (17,5%), diarreia (17,5%), pirexia (14,6%), xerostomia (10,9%), flushing (10,9%), congestão nasal (10,9%) |
| Mato et al.50 | Escopolamina TD | PC e outras condições neurológicas | 12 a 58 anos | 30 | Prospectivo, randomizado, DC, PC | Melhoria significativa (p<0,005) no grupo escopolamina | Incidência de 23% de EC (4 pacientes com EC mais graves e 3 menores EC leves) |
| Camp‐Bruno et al.51 | Benztropina | PC | 4 a 44 anos (14 crianças/adolescentes e 6 adultos) | 20 | DC, PC | Redução significativa da sialorreia em relação a placebo | Incidência de 11% de EC mais graves resolvidos em 24‐48h após suspensão da droga |
| Carranza‐del Rio et al.57 | Triexifenidil | PC | 1 a 18 anos | 70 | Retrospectivo | A maior parte dos pacientes (96%) relatou alguma melhoria na sialorreia | EC foram encontrados em 69,3% dos pacientes: constipação intestinal (43), retenção urinária (19), xerostomia (7), visão borrada (5), aumento de movimentos involuntários (4), redução no controle de crises convulsivas (4), alucinações (2). |
| De Simone et al.70 | Sulfato de atropina SL | Câncer de trato digestivo alto | 48 a 87 anos | 22 | Prospectivo, randomizado, DC, PC | O estudo falhou em demonstrar efetividade do sulfato de atropina em relação ao placebo | Apenas 1 paciente (xerostomia) |
DC, Duplo cego; EC, efeitos colaterais; PC, Placebo controlado.
A solução oral de glicopirrolato é, atualmente, a única formulação de qualquer anticolinérgico liberada pela Food and Drug Administration (FDA) americana para tratamento da sialorreia em crianças entre 3‐16 anos. Glicopirrolato não está disponível no Brasil.
EscopolaminaVários estudos demonstraram a redução na secreção de saliva com uso de escopolamina. A via transdérmica efetivamente reduz a secreção salivar em 67% dos pacientes e sua ação pode ser evidenciada após 15 minutos da aplicação. Os principais efeitos colaterais são dilatação pupilar e retenção urinária.53 Lewis et al. observaram que 66% dos pacientes apresentaram dilatação pupilar, que ocorreu poucos dias após o início do tratamento.52
BenztropinaExiste apenas um estudo com benztropina que envolve crianças. A droga foi considerada efetiva em um ensaio clínico controlado e randomizado publicado por Camp‐Bruno et al. (1989).51
TriexifenidilNo maior estudo em crianças com o triexifenidil, uma medicação usada habitualmente no tratamento de síndromes extrapiramidais, como a distonia, as indicações para uso foram distonia (28,7%), sialorreia (5,9%) e distonia e sialorreia (65,4%). A dose média inicial foi de 0,095mg/Kg/dia e a dose média máxima de 0,55mg/Kg/dia, duas a três vezes ao dia. Efeitos colaterais foram encontrados em 69,3% dos pacientes. A maior parte dos pacientes relatou alguma melhoria na distonia, na sialorreia e na linguagem específica. Os autores concluem que o triexifenidil foi mais bem tolerado nessa população de crianças e adolescentes (com PC e síndrome extrapiramidal) em relação à população adulta e que a melhoria na sialorreia pode ter ocorrido pelo efeito anticolinérgico do medicamento, mas também por ação central que produz maior controle motor dos músculos envolvidos na deglutição.57 Outros estudos relatam o uso do triexifenidil com sucesso em adultos para tratamento da sialorreia induzida por clozapina.58–60
Sulfato de atropinaApesar de há muitos anos ser reconhecida como eficaz, a atropina nunca teve ampla aceitação para tratamento da sialorreia crônica.54 A primeira menção ao seu uso para tratamento de sialorreia foi feita em artigo publicado em outubro de 1970 por Smith et al. no New England Journal of Medicine.61 Posteriormente alguns estudos relataram o seu uso para tratamento de sialorreia induzida por drogas62–68 e em pacientes com doença de Parkinson.69 De Simone et al. (2006) publicaram o único estudo prospectivo, randomizado, controlado com placebo, duplo cego com uso de atropina SL que falhou em demonstrar efetividade da atropina em relação ao placebo.70 Em 2010 Rapoport relatou o caso de um menino de 14 anos, portador de leucodistrofia metacromática com excesso de secreção oral e necessidade de aspirações frequentes que determinavam quedas recorrentes na saturação de oxigênio por aspiração de saliva. tratado com sucesso com sulfato de atropina SL. Esse é o único caso descrito na literatura de uso do sulfato de atropina SL em crianças ou adolescentes.54 Não há estudos específicos publicados em crianças com PC, porém há pesquisas em andamento com o sulfato de atropina 0,5% (forma colírio – gotas oftalmológicas) por via SL em crianças com PC, que sugerem boa eficácia com baixa incidência de efeitos colaterais. Tais dados estarão disponíveis para publicação em breve.
Considerações finaisEm nossa prática, para indicação de qualquer tipo de tratamento para sialorreia em crianças com PC devemos levar em consideração a oportunidade de acesso dos nossos pacientes ao tratamento proposto, as características socioeconômicas e culturais de cada família na escolha individual de métodos que sejam eficientes, mais específicos e que tragam uma menor sobrecarga para cada paciente/família. Concluímos que o tratamento mais eficaz e que aborda efetivamente a causa da sialorreia nas crianças com PC é o treino para consciência sensorial e habilidades motoras orais, feito ou supervisionado por um fonoaudiólogo devidamente treinado e qualificado. As terapias farmacológicas, tais como a toxina botulínica e o uso de anticolinérgicos, têm efeito transitório e idealmente devem ser auxiliares ao tratamento fonoaudiológico ou, então, devem ser consideradas em casos específicos de pacientes com sialorreia moderada a grave ou com complicações respiratórias. Entre o universo de fármacos disponíveis, o sulfato de atropina tem baixo custo, fácil acesso e parece ter boa resposta clínica com bom perfil de segurança. O uso de triexifenidil para o tratamento da sialorreia pode ser considerado em crianças com formas discinéticas de PC ou em alguns casos selecionados.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.