To evaluate the association between intra‐ventricular hemorrhage and habituation responses to external stimuli in preterm infants at 36–38 weeks post‐conceptual age.
MethodsCross‐sectional study of infants with gestational age <32 weeks. Intra‐ventricular hemorrhage was identified by cranial ultrasonography and classified according to Papile et al. (1978). The luminous (flashlight), sound (rattle, bell), and tactile stimuli were presented, and the responses were scored according to Lester and Tronik (2004). Habituation response scores were compared between groups by Student's t‐test. The association between IVH and habituation scores was evaluated by linear regression adjusted for GA, clinical severity score, post‐conceptual age at habituation assessment, sepsis, and bronchopulmonary dysplasia.
ResultsSixty‐five infants were studied, 20 with intra‐ventricular hemorrhage (16 grades I/II; four grades III/IV) and 45 without intra‐ventricular hemorrhage. Infants with intra‐ventricular hemorrhage had lower gestational age (28.2±2.2 vs. 29.7±1.7 weeks) and birth weight (990±305 vs. 1275±360g). Infants with intra‐ventricular hemorrhage at 36–38 weeks post‐conceptual age had lower habituation scores to light (4.21±2.23 vs. 6.09±2.44), rattle (3.84±2.12 vs. 6.18±2.27), and bell (3.58±1.74 vs. 5.20±2.47) after controlling for confounders. No differences were found for tactile stimulus.
ConclusionInfants with gestational age <32 weeks and intra‐ventricular hemorrhage had poorer habituation responses to external stimuli than those without intra‐ventricular hemorrhage at 36–38 weeks post‐conceptual age.
Avaliar a associação entre hemorragia intraventricular e as respostas de habituação a estímulos externos em neonatos prematuros com idade pós‐conceptual de 36‐38 semanas.
MétodosEstudo transversal com neonatos com idade gestacional < 32 semanas. A hemorragia intraventricular foi identificada por ultrassonografia craniana e classificada de acordo com Papile et al. (1978). Os estímulos luminosos (lanterna), sonoros (chocalho, sino) e táteis foram apresentados e as respostas foram pontuadas de acordo com Lester & Tronik (2004). Os escores das respostas de habituação foram comparadas entre os grupos pelo teste t de Student. A associação entre a hemorragia intraventricular e os escores de habituação foi avaliada por regressão linear ajustada para a idade gestacional, escore de gravidade clínica, idade pós-conceptual na avaliação da habituação, sepse e displasia broncopulmonar.
Resultados65 neonatos foram estudados, 20 com hemorragia intraventricular (16 graus I/II;4 graus III/IV) e 45 sem hemorragia intraventricular. Os neonatos com hemorragia intraventricular apresentaram menor idade gestacional (28,2 ± 2,2 vs. 29,7 ± 1,7 semanas) e peso ao nascer (990 ± 305 vs. 1275 ± 360 g). Os neonatos com hemorragia intraventricular na idade pós-conceptual de 36-38 semanas apresentaram escores de habituação menores a luz (4,21 ± 2,23 vs. 6,09 ± 2,44), chocalho (3,84 ± 2,12 vs. 6,18 ± 2,27) e campainha (3,58 ± 1,74 vs. 5,20 ± 2,47) após controle para variáveis de confusão. Nenhuma diferença foi encontrada para os estímulos táteis.
ConclusãoNeonatos com idade gestacional < 32 semanas e hemorragia intraventricular apresentaram respostas de habituação piores a estímulos externos que os sem hemorragia intraventricular, na idade pós-conceptual de 36-38 semanas.
A taxa de sobrevida de neonatos extremamente prematuros aumentou, porém a incidência de hemorragia intraventricular (IVH) continua alta.1 Em uma coorte francesa de 3.495 neonatos com idade gestacional <32 semanas, a frequência de IVH classificada de acordo com Papile et al.2 foi: Grau I – 17,0% (intervalo de confiança de 95% 15,7‐18,4), Grau II – 12,1% (IC de 95% 11,0‐13,3), Grau III – 3,3% (IC de 95% 2,7‐3,9) e Grau IV – 3,8% (IC de 95% 3,2‐4,5).3 Em um estudo prospectivo multicêntrico de neonatos prematuros <32 semanas de idade gestacional nascidos em 10 hospitais americanos, os graus III/IV de IVH estiveram presentes em 5% deles.4
A associação de IVH e comprometimento moderado ou grave do desenvolvimento neurológico (NDI: paralisia cerebral moderada ou grave, atraso cognitivo moderado ou grave, comprometimento visual grave e/ou comprometimento grave da audição) aos 18‐24 meses corrigida dos neonatos com idade gestacional <34 semanas foi avaliada por metanálise. Entre os sobreviventes e o ajuste para as variáveis de confusão, o NDI foi maior em neonatos prematuros com IVH leve (Graus I/II) em comparação com os sem IVH (RC 1,34; IC de 95% 1,09‐1,77, nos com IVH grave (Graus III/IV) em comparação com os sem IVH (RC 2,44; IC de 95% 1,73‐3,42) e nos com IVH grave em comparação com leve (RC 2,16; IC de 95% 2,36‐3,45).5
Recentemente, alguns estudos mostraram uma associação entre o neurocomportamento menos ideal em neonatos prematuros avaliados a termo, com idade corrigida pela Escala Neurocomportamental da Rede de Unidades de Terapia Intensiva Neonatal (UTIN) (NNNS),6 e o atraso no desenvolvimento na infância.7,8 Ela considera não somente o estado organizacional do pacientes, mas também os limites dessa organização, que podem ser testados por meio de situações de estresse. A integridade dos sistemas de modulação permite a organização de respostas comportamentais a situações de estresse.9 Um dos domínios da avaliação neurocomportamental é a resposta de habituação, que testa as competências perceptivas e cognitivas no período neonatal.10 As pontuações de habituação avaliam a capacidade de o neonato diminuir ou abolir a resposta a um estímulo quando presente por um longo período ou por vários curtos períodos repetidos; contudo, quando um estímulo novo é mostrado, a atenção do neonato ao estímulo aumentará posteriormente. Esse padrão de resposta reflete a capacidade de processamento de informações. O atraso na resposta de habituação a estímulos externos significa uma menor capacidade de modular a resposta comportamental a um estímulo de estresse.11
Poucos estudos examinaram as respostas de habituação em neonatos prematuros a termo e os resultados são contraditórios. Castillo et al. avaliaram neonatos prematuros <32 semanas de gestação prospectivamente e, a termo, eles apresentaram respostas de habituação semelhantes em comparação com os nascidos a termo avaliados nos primeiros dias de vida.12 Pineda et al. constataram que os neonatos prematuros, a termo, apresentaram respostas de habituação piores em comparação com os neonatos a termo.13 A literatura sobre a associação entre o dano cerebral e o neurocomportamento de neonatos prematuros a termo com idade corrigida com o uso da NNNS é escassa. Nos estudos existentes, a IVH grave foi associada a menos atenção, mais excitabilidade e maior número de respostas não ideais quando os reflexos são testados.13,14 Somente Pineda et al. avaliaram a associação entre o dano cerebral e as respostas de habituação e não encontraram associação.
Nesse contexto, o objetivo deste estudo é avaliar a associação entre a IVH e as respostas de habituação a estímulos externos em neonatos prematuros <32 semanas de idade gestacional, às 36‐38 semanas de idade gestacional corrigida.
Material e métodosEste é um estudo transversal com neonatos prematuros nascidos em um hospital universitário público terciário em São Paulo, Brasil, entre junho de 2015 e março de 2017. O estudo foi aprovado pelo Comitê de Ética da instituição (CAAE 44415915.0.0000.5505). Os neonatos recém‐nascidos foram inscritos para participar após seus pais assinarem o formulário de consentimento informado. Incluímos consecutivamente neonatos prematuros com idade gestacional abaixo <32 semanas, de acordo com a melhor estimativa obstétrica. Os neonatos com malformações congênitas, síndromes genéticas, infecções congênitas, distúrbios musculares ou outros distúrbios neurológicos ou aqueles que morreram durante a internação foram excluídos.
Foram feitas ultrassonografias da cabeça na unidade pelo menos três vezes no primeiro mês após o nascimento: nos dias de vida 3‐4, 7‐10 e 28‐30 com o Sistema de Ultrassom Acuson X300 (Siemens Healthineers, Erlangen, Alemanha) e um transdutor 3,5MHz. Foi usada a fontanela anterior (janela) com incidências axiais, coronais e sagitais. Os exames foram feitos por radiologistas do Departamento de Diagnóstico por Imagem da Escola Paulista de Medicina, Universidade Federal de São Paulo, cegos para a avaliação comportamental dos neonatos. Os exames sempre foram revisados pelo radiologista pediátrico sênior. A hemorragia, se presente em um ou mais exames, foi classificada de acordo com Papile et al.2 O grau mais elevado de hemorragia observado nos exames foi considerado para cada recém‐nascido, quando presente.
As respostas de habituação foram avaliadas com o neonato vestido em uma sala aquecida e calma, com baixa luminosidade, em um berço normal, antes da alta hospitalar, às 36‐38 semanas de idade gestacional corrigida. No momento do exame, os neonatos estavam no ar ambiente, sem acesso venoso e recebiam alimentação oral. Todos os exames foram feitos pelo primeiro autor, treinado por um pesquisador certificado para fazer a NNNS no Hospital da Ilha de Rodes, Brown University, RI, de acordo com o Estudo de Estilo de Vida Materno.15 O exame neurocomportamental teve início com a observação do estado de sono‐vigília e a avaliação das respostas de habituação a estímulos externos teve início somente quando o paciente estava no estado de sono‐vigília exigido para cada teste.6
Os estímulos externos foram apresentados sempre na mesma ordem: estímulo luminoso (uma lanterna padrão de oito polegadas foi aluminada 30cm do neonato, diretamente nos olhos por dois segundos); estímulo auditivo – chocalho e campainha (o chocalho foi agitado duas vezes a 30cm do neonato e, após isso, a mesma ação foi feita com a campainha); estímulos táteis (o calcanhar foi pressionado de forma suave, porém firme, com um bastão plástico). Os estímulos luminosos e auditivos foram apresentados até dez vezes e os estímulos táteis foram apresentados até cinco vezes. O próximo estímulo foi apresentado cinco segundos após o neonato cessar a resposta. Para pontuar a resposta, o estímulo ao qual o neonato respondeu primeiro foi considerado a apresentação inicial. Caso, após duas tentativas, ainda não tivesse havido resposta ou caso a resposta do neonato ao estímulo tivesse durado mais de 45 segundos, foi aplicado o próximo item de habituação.
A resposta de habituação foi avaliada com base na capacidade de o neonato cessar, diminuir ou atrasar suas respostas à apresentação repetida de um estímulo. A resposta foi considerada presente se o neonato mostrou movimentação de todo o corpo ou do membro, movimentos de contorção ou piscar de olhos com caretas faciais. As respostas foram pontuadas como segue: 1 – nenhum decréscimo nas respostas nos 10 estímulos; 2 – nenhum decréscimo nas respostas, porém algum atraso nas repostas nas 10 tentativas; 3 – algum decréscimo nas respostas nas 10 tentativas, porém não cessou completamente; 4 – algum decréscimo nas respostas e atraso nas respostas nas 10 tentativas, porém não cessou completamente; 5 – cessou as respostas após nove estímulos; 6 – cessou as respostas após 7‐8 estímulos; 7 – cessou as respostas após 5‐6 estímulos; 8 – cessou as respostas após 3‐4 estímulos; 9 – cessou as respostas após 1‐2 estímulos. As pontuações 5‐9 indicam habituação bem‐sucedida e as pontuações 4 ou menores foram consideradas decréscimo nas respostas incompletas.6
Para estímulos táteis, as respostas de habituação foram pontuadas como segue: 1 – resposta generalizada em todo o corpo e aumentou com as tentativas; 2 – os dois pés foram retirados sem decréscimo na resposta; 3 – resposta variável aos estímulos com decréscimo nas respostas; 4 – decréscimo nas respostas após 5 tentativas localizadas a estímulos nas pernas e nenhuma mudança no estado de alerta; 5 – decréscimo nas respostas após 5 tentativas localizadas a estímulos nos pés e nenhuma mudança no estado de alerta; 6 – resposta limitada a estímulos nos pés após 3‐4 tentativas e nenhuma mudança no estado de alerta; 7 – resposta limitada a estímulos nos pés ou decréscimo total na resposta após 1‐2 tentativas e nenhuma mudança no estado de alerta; 8 – resposta localizada e mínima após duas tentativas e mudança no estado de alerta; 9 – decréscimo total nas respostas e mudança no estado de alerta. Para habituação a estímulos táteis, não há definição da pontuação acima na qual a habituação é considerada presente.6
Os seguintes dados foram coletados: características maternas, características demográficas neonatais, ao Escore para Fisiologia Neonatal Aguda – Extensão Perinatal (Snappe‐II)16 e morbidez durante o tempo de internação. As intervenções terapêuticas, como ventilação mecânica (presença e número de dias), surfactante exógeno, ibuprofeno, analgésicos, sedativos e uso pós‐natal de esteroides, também foram coletadas. Na alta, os dados estudados incluíram: idade cronológica, idade pós‐conceptual, peso e perímetro cefálico.
O tamanho da amostra necessário para detectar uma diferença média de 1 ponto nas pontuações de habituação entre os neonatos prematuros com e sem IVH, com desvio padrão de 1, erro alfa de 5% e poder de 80%, foi de 16 recém‐nascidos em cada grupo.
As pontuações das respostas de habituação foram comparadas entre os grupos pelo teste t de Student. Quatro modelos de regressão linear múltipla foram criados com pontuações de habituação para os estímulos de luz, chocalho, campainha e táteis como as variáveis dependentes e IVH como uma variável independente e ajustados para os seguintes variáveis de confusão: idade gestacional, idade na avaliação da habituação, sepse clínica, displasia broncopulmonar (dependência de oxigênio com 28 dias) e escore Snappe‐II > 15 (pontuação média da população estudada), presumiu‐se o número mínimo de 10 pacientes para cada fator incluído na análise. A análise foi feita com o SPSS (Pacote SPSS Statistics para Windows, versão 20.0, IBM, Somers, NY, EUA).
ResultadosDe junho de 2015 a março de 2017, 130 neonatos prematuros com idade gestacional <32 semanas nasceram no hospital do estudo. Entre esses, 65 atenderam a um ou mais critérios de exclusão: malformações congênitas (27), infecções congênitas (5), óbito durante a internação (23), recusa a participar do estudo (6) e não avaliado (4). Portanto, 65 bebês foram estudados.
Os neonatos prematuros fizeram uma média de 3,1 ± 1,5 (variação: 1‐9) ultrassonografias de cabeça durante o tempo de internação. O primeiro exame foi feito em todos os 65 neonatos, com mediana de 5 (1‐17) dias após o nascimento; 59 (91%) fizeram dois exames com 13 (6‐39) dias de vida; 38 (58%) fizeram três exames com 26 (12‐52) dias; 21 (32%) fizeram quatro exames com 32 (17‐69) dias de vida; 9 (14%) fizeram cinco exames com 41 (30‐58) dias de vida; e 8 (12%) neonatos fizeram mais de cinco exames durante o tempo de internação.
IVH foi identificada em 20 (30,8%) neonatos, grau I em 12 (60,0%), grau II em 4 (20,0%), grau III em 2 (10,0%) e grau IV em 2 (10,0%). Em 11 neonatos (55%), o diagnóstico de IVH foi feito nos primeiros 10 dias de vida.
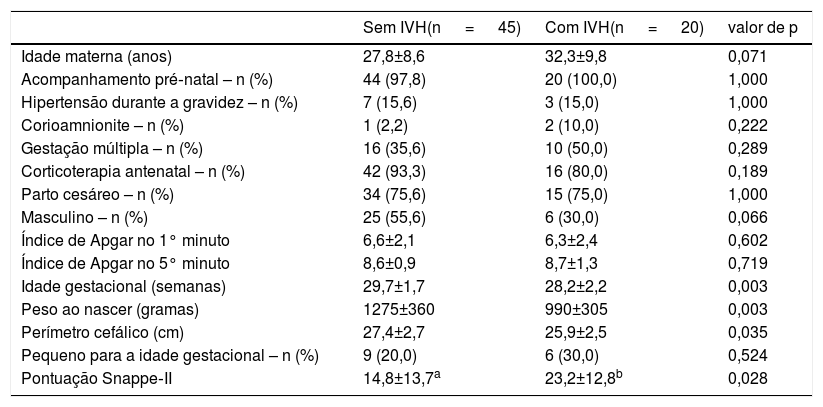
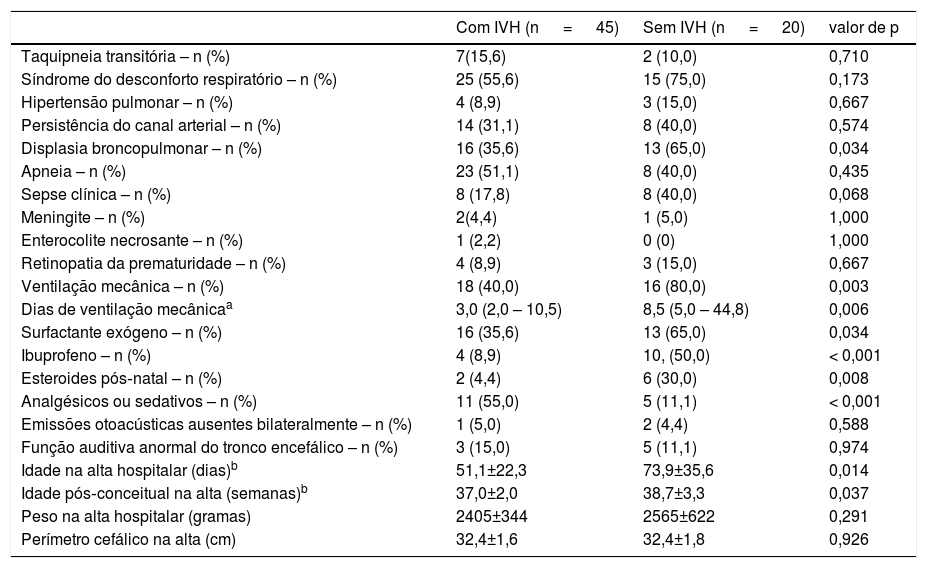
As características demográficas e clínicas das mães e dos neonatos com e sem IVH foram semelhantes, exceto que os neonatos prematuros com IVH, em comparação com os sem IVH, apresentaram menor idade gestacional, peso ao nascer e perímetro cefálico no nascimento e um escore Snappe‐II maior (tabela 1). Somente uma mãe em cada grupo fez uso de maconha durante a gestação. A tabela 2 mostra a morbidez e as intervenções terapêuticas recebidas durante o tempo de internação. Os neonatos com IVH usaram ibuprofeno e sedativos e/ou analgésicos com mais frequência do que os sem IVH; contudo, eles não usaram qualquer desses medicamentos no momento do exame neurocomportamental. Apesar de três neonatos não terem apresentado emissões otoacústicas bilaterais e de oito terem apresentado função auditiva anormal do tronco encefálico auditivo, seu limiar tonal foi entre 40‐50dB. Como a intensidade do som do chocalho e da campainha é de 90‐100dB, os neonatos conseguiram escutar o chocalho e a campainha.
Características maternas e neonatais, de acordo com a presença de IVH
| Sem IVH(n = 45) | Com IVH(n = 20) | valor de p | |
|---|---|---|---|
| Idade materna (anos) | 27,8±8,6 | 32,3±9,8 | 0,071 |
| Acompanhamento pré‐natal – n (%) | 44 (97,8) | 20 (100,0) | 1,000 |
| Hipertensão durante a gravidez – n (%) | 7 (15,6) | 3 (15,0) | 1,000 |
| Corioamnionite – n (%) | 1 (2,2) | 2 (10,0) | 0,222 |
| Gestação múltipla – n (%) | 16 (35,6) | 10 (50,0) | 0,289 |
| Corticoterapia antenatal – n (%) | 42 (93,3) | 16 (80,0) | 0,189 |
| Parto cesáreo – n (%) | 34 (75,6) | 15 (75,0) | 1,000 |
| Masculino – n (%) | 25 (55,6) | 6 (30,0) | 0,066 |
| Índice de Apgar no 1° minuto | 6,6±2,1 | 6,3±2,4 | 0,602 |
| Índice de Apgar no 5° minuto | 8,6±0,9 | 8,7±1,3 | 0,719 |
| Idade gestacional (semanas) | 29,7±1,7 | 28,2±2,2 | 0,003 |
| Peso ao nascer (gramas) | 1275±360 | 990±305 | 0,003 |
| Perímetro cefálico (cm) | 27,4±2,7 | 25,9±2,5 | 0,035 |
| Pequeno para a idade gestacional – n (%) | 9 (20,0) | 6 (30,0) | 0,524 |
| Pontuação Snappe‐II | 14,8±13,7a | 23,2±12,8b | 0,028 |
cm, centímetro; IVH, hemorragia peri‐intraventricular; Snappe‐II, Escore para Fisiologia Neonatal Aguda – Extensão Perinatal, Versão II.
Morbidez neonatal e intervenções terapêuticas, de acordo com IVH
| Com IVH (n = 45) | Sem IVH (n = 20) | valor de p | |
|---|---|---|---|
| Taquipneia transitória – n (%) | 7(15,6) | 2 (10,0) | 0,710 |
| Síndrome do desconforto respiratório – n (%) | 25 (55,6) | 15 (75,0) | 0,173 |
| Hipertensão pulmonar – n (%) | 4 (8,9) | 3 (15,0) | 0,667 |
| Persistência do canal arterial – n (%) | 14 (31,1) | 8 (40,0) | 0,574 |
| Displasia broncopulmonar – n (%) | 16 (35,6) | 13 (65,0) | 0,034 |
| Apneia – n (%) | 23 (51,1) | 8 (40,0) | 0,435 |
| Sepse clínica – n (%) | 8 (17,8) | 8 (40,0) | 0,068 |
| Meningite – n (%) | 2(4,4) | 1 (5,0) | 1,000 |
| Enterocolite necrosante – n (%) | 1 (2,2) | 0 (0) | 1,000 |
| Retinopatia da prematuridade – n (%) | 4 (8,9) | 3 (15,0) | 0,667 |
| Ventilação mecânica – n (%) | 18 (40,0) | 16 (80,0) | 0,003 |
| Dias de ventilação mecânicaa | 3,0 (2,0 – 10,5) | 8,5 (5,0 – 44,8) | 0,006 |
| Surfactante exógeno – n (%) | 16 (35,6) | 13 (65,0) | 0,034 |
| Ibuprofeno – n (%) | 4 (8,9) | 10, (50,0) | < 0,001 |
| Esteroides pós‐natal – n (%) | 2 (4,4) | 6 (30,0) | 0,008 |
| Analgésicos ou sedativos – n (%) | 11 (55,0) | 5 (11,1) | < 0,001 |
| Emissões otoacústicas ausentes bilateralmente – n (%) | 1 (5,0) | 2 (4,4) | 0,588 |
| Função auditiva anormal do tronco encefálico – n (%) | 3 (15,0) | 5 (11,1) | 0,974 |
| Idade na alta hospitalar (dias)b | 51,1±22,3 | 73,9±35,6 | 0,014 |
| Idade pós‐conceitual na alta (semanas)b | 37,0±2,0 | 38,7±3,3 | 0,037 |
| Peso na alta hospitalar (gramas) | 2405±344 | 2565±622 | 0,291 |
| Perímetro cefálico na alta (cm) | 32,4±1,6 | 32,4±1,8 | 0,926 |
IVH, hemorragia peri‐intraventricular.
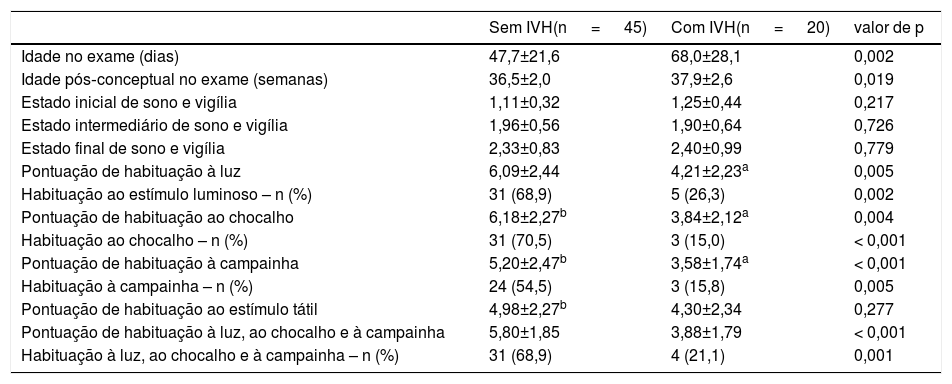
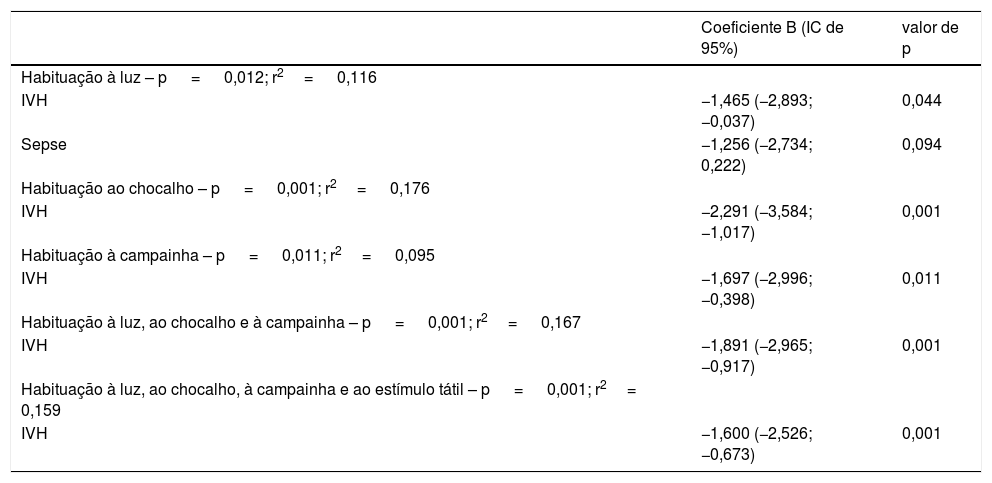
A tabela 3 mostra as respostas de habituação dos neonatos a estímulos externos. A avaliação foi feita em uma idade pós‐natal e pós‐conceptual mais avançada em neonatos prematuros com IVH. Não foi encontrada diferença entre os neonatos com e sem IVH com relação ao tempo após a última alimentação na avaliação (66 ± 21 em comparação com 69 ± 46 minutos; p=0,701) ou a duração do exame (13 ± 4 em comparação com 13 ± 5 minutos; p=0.812). Os neonatos prematuros com IVH apresentaram menores pontuações de habituação a luz e som, porém nenhuma diferença nos estímulos táteis. Os neonatos prematuros sem IVH apresentaram uma resposta de habituação completa a luz e som após 7‐8 estímulos, ao passo que os com IVH mostraram uma redução e atraso na reposta ao estímulo, porém habituação incompleta. Ao comparar a frequência de sucesso na resposta de habituação a luz e som, isso foi menos frequente em neonatos com IVH, em comparação com os sem IVH. A associação entre a presença de IVH e a variação das respostas de habituação aos diferentes estímulos mostrou que a IVH foi associada à redução nas pontuações de habituação a luz e som, mesmo após controlar a idade gestacional no nascimento, idade na avaliação comportamental, sepse clínica, displasia broncopulmonar e o escore de gravidade Snappe‐II (tabela 4). A IVH não foi associada à pontuação de habituação aos estímulos táteis.
Avaliação das respostas de habituação dos neonatos estudados, de acordo com a presença de IVH
| Sem IVH(n = 45) | Com IVH(n = 20) | valor de p | |
|---|---|---|---|
| Idade no exame (dias) | 47,7±21,6 | 68,0±28,1 | 0,002 |
| Idade pós‐conceptual no exame (semanas) | 36,5±2,0 | 37,9±2,6 | 0,019 |
| Estado inicial de sono e vigília | 1,11±0,32 | 1,25±0,44 | 0,217 |
| Estado intermediário de sono e vigília | 1,96±0,56 | 1,90±0,64 | 0,726 |
| Estado final de sono e vigília | 2,33±0,83 | 2,40±0,99 | 0,779 |
| Pontuação de habituação à luz | 6,09±2,44 | 4,21±2,23a | 0,005 |
| Habituação ao estímulo luminoso – n (%) | 31 (68,9) | 5 (26,3) | 0,002 |
| Pontuação de habituação ao chocalho | 6,18±2,27b | 3,84±2,12a | 0,004 |
| Habituação ao chocalho – n (%) | 31 (70,5) | 3 (15,0) | < 0,001 |
| Pontuação de habituação à campainha | 5,20±2,47b | 3,58±1,74a | < 0,001 |
| Habituação à campainha – n (%) | 24 (54,5) | 3 (15,8) | 0,005 |
| Pontuação de habituação ao estímulo tátil | 4,98±2,27b | 4,30±2,34 | 0,277 |
| Pontuação de habituação à luz, ao chocalho e à campainha | 5,80±1,85 | 3,88±1,79 | < 0,001 |
| Habituação à luz, ao chocalho e à campainha – n (%) | 31 (68,9) | 4 (21,1) | 0,001 |
IVH, hemorragia peri‐intraventricular.
Associação entre as pontuações de IVH e habituação por meio da análise de regressão linear múltipla
| Coeficiente B (IC de 95%) | valor de p | |
|---|---|---|
| Habituação à luz – p = 0,012; r2= 0,116 | ||
| IVH | −1,465 (−2,893; −0,037) | 0,044 |
| Sepse | −1,256 (−2,734; 0,222) | 0,094 |
| Habituação ao chocalho – p = 0,001; r2= 0,176 | ||
| IVH | −2,291 (−3,584; −1,017) | 0,001 |
| Habituação à campainha – p = 0,011; r2= 0,095 | ||
| IVH | −1,697 (−2,996; −0,398) | 0,011 |
| Habituação à luz, ao chocalho e à campainha – p = 0,001; r2= 0,167 | ||
| IVH | −1,891 (−2,965; −0,917) | 0,001 |
| Habituação à luz, ao chocalho, à campainha e ao estímulo tátil – p = 0,001; r2= 0,159 | ||
| IVH | −1,600 (−2,526; −0,673) | 0,001 |
IVH, hemorragia peri‐intraventricular.
Os neonatos prematuros <32 semanas de gestação com IVH, quando examinados antes da alta hospitalar, apresentaram menos respostas de habituação a estímulos luminosos e sonoros externos, em comparação com os sem IVH. Deve‐se notar que os neonatos com IVH foram avaliados em uma idade corrigida de 37,9 semanas e aqueles sem IVH às 36,5 semanas. Isso aconteceu porque os neonatos com IVH foram internados por períodos mais longos, pois eles eram mais imaturos e mais doentes, e os dois grupos foram avaliados próximo à alta hospitalar. Portanto, a análise múltipla foi ajustada para essas possíveis variáveis de confusão.
IVH foi identificada em 30,8% dos neonatos prematuros, 80% leve e 20% grave. O Projeto de Base de Dados da Vermont Oxford Trial Network relatou uma frequência de IVH de 26% entre neonatos prematuros com muito baixo peso ao nascer internados em 38 unidades neonatais da América do Norte.17 Mais recentemente, o Instituto Nacional de Saúde Infantil e Desenvolvimento Humano Rede de Pesquisa Neonatal Eunice Kennedy Shriver mostrou uma incidência de IVH grave de 5% em neonatos com <28 semanas de idade gestacional.1 Em 20 hospitais universitários públicos brasileiros, identificamos IVH grave em 10% dos neonatos prematuros com idade gestacional de 23 a 33 semanas.18 Uso mais frequente de corticoterapia antenatal e melhores práticas no cuidado neonatal no Brasil ainda são necessários para reduzir a frequência da IVH em neonatos prematuros.18
Estudos mostraram que a IVH está associada a um pior desenvolvimento global na infância.7,8 Em neonatos extremamente prematuros, aqueles com hemorragia intraventricular grau III‐IV, em comparação com aqueles sem IVH, apresentam maiores taxas de atraso no desenvolvimento (43,0% em comparação com 12,1%), paralisia cerebral (30,1% em comparação com 6,5%), surdez (8,6% em comparação com 2,3%) e cegueira (2,2% em comparação com 0,2%). A alta frequência de comprometimento do desenvolvimento também foi encontrada em neonatos com IVH graus I‐II, em comparação com aqueles sem IVH: (22,0% em comparação com 12,1%), paralisia cerebral (10,4% em comparação com 6,5%) e surdez (6,0% em comparação com 2,3%). Mesmos após a exclusão de outras anomalias no ultrassom, inclusive leucomalácia, porencefalia e aumento ventricular, a IVH graus I‐II isolada foi associada ao aumento nas taxas de comprometimento neurossensorial moderado‐grave (18,6% em comparação com 12,1%).19 Em outro estudo, os neonatos com peso ao nascer <1.000g e IVH graus I/II apresentaram uma maior frequência de MDI <70 e anormalidades motoras e neurossensoriais em comparação com aqueles sem IVH.20 Outro estudo também mostrou que, mesmo quando a ressonância magnética cerebral foi normal, neonatos extremamente prematuros apresentam desempenho cognitivo e motor mais baixo aos 30 meses de idade corrigida em comparação com os neonatos nascidos a termo.21 Como as mudanças comportamentais nos neonatos prematuros avaliados em idade pós‐conceptual a termo também são associadas a um desenvolvimento mais baixo na infância,7,8,22,23 é interessante identificar as características neurocomportamentais dos neonatos prematuros com lesões cerebrais. As respostas de habituação são um domínio importante do neurocomportamento neonatal, pois elas avaliam as competências de percepção e cognitivas10 e refletem a capacidade de processamento das informações.11 Somente um estudo avaliou a associação entre a IVH e as respostas de habituação a estímulos externos em neonatos prematuros e os autores não encontraram associação entre lesão cerebral e as respostas de habituação, apesar de terem encontrado uma associação entre as lesões cereberais (hemorragia cerebelar, IVH grave ou leucomalácia periventricular) e menor autorregulação e maior excitabilidade.13 A diferença com relação a nossos resultados pode ser devida a uma maior imaturidade e maior frequência de morbidades neonatais nos pacientes inscritos no primeiro estudo.
O sistema nervoso central tem um desenvolvimento complexo e cada função depende da maturação do substrato neural anatômico correspondente, que envolve proliferação, migração, organização e mielinização dos neurônios.24 Em neonatos prematuros entre 23 e 32 semanas de idade gestacional, a organização e a mielinização se desenvolvem rapidamente e qualquer lesão cerebral nesse estágio pode levar a mudanças nas respostas de desenvolvimento e comportamentais.25 Além disso, a experiência ambiental, como a natureza nociva da unidade de terapia intensiva neonatal, pode contribuir para os transtornos comportamentais.26 No desenvolvimento da resposta de habituação, a atenção é reduzida, pois o recém‐nascido elabora uma representação mental dos estímulos e eles se tornam menos interessantes.27 A atenção do neonato a um estímulo a princípio aumenta, conforme as informações sobre o estímulo são processadas, e então apresenta queda, conforme o processamento do estímulo é progressivamente concluído.28 Quando um novo estímulo é apresentado, o neonato o compara com a representação mental (memória), consegue discriminar os novos estímulos.27 Os neonatos prematuros com IVH podem ter uma fraca organização e mielinização dos neurônios, interferir no processo de representação mental e, talvez, resultar em menor habituação a estímulos externos.
Não foi encontrada diferença entre os neonatos prematuros com e sem IVH com relação às respostas de habituação a estímulos táteis. Os estímulos táteis e de dor estimulam os receptores mecânicos da pele e as vias aferentes comuns para o sistema nervoso central e os neonatos prematuros podem ter uma capacidade limitada de se habituar a estímulos de dor repetitiva.29 Como esses neonatos são expostos a procedimentos de dor repetitiva durante seu tempo de internação, essas experiências aversivas podem interferir em sua capacidade de se habituar a estímulos táteis mostrados no presente estudo.
A principal limitação de nosso estudo é o tamanho da amostra, que pode ter reduzido o poder de detectar as diferenças na resposta de habituação a estímulos táteis entre os grupos e limitado a capacidade de controlar outras possíveis variáveis de confusão. Além disso, não foi possível avaliar as respostas de habituação de neonatos prematuros com hemorragia na matriz germinativa, hemorragia intraventricular, hidrocefalia pós‐hemorragia ou infarto parenquimatoso hemorrágico separadamente. A associação entre outras lesões cerebrais, como leucomalácia periventricular, porencefalia, aumento ventricular ou hemorragia cerebelar,13 e o comportamento dos neonatos não foi avaliada, pois o diagnóstico por imagem da ressonância magnética não foi obtido.
Em conclusão, os neonatos prematuros com IVH mostraram uma menor capacidade de se habituar a estímulos luminosos e sonoros externos às 36‐38 semanas de idade pós‐conceptual, em comparação com aqueles sem IVH, ajustada para as variáveis de confusão. São necessários estudos adicionais para avaliar se os neonatos prematuros com menor capacidade de respostas de habituação a estímulos externos terão neurodesenvolvimento mais fraco durante a infância.
FinanciamentoO principal pesquisador foi financiado pelo Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq): 128349/2015‐8 e 119032/2016‐3.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Bueno GG, Barros MC, Guinsburg R. Preterm infants with peri/intraventricular hemorrhage have poorer habituation responses to external stimuli. J Pediatr (Rio J). 2019;95:728–35.