To evaluate the prevalence and risk factors associated with progression to recurrent wheezing in preterm infants.
MethodsThe cross‐sectional study was carried out in 2014 and 2015 and analyzed preterm infants born between 2011 and 2012. The search for these children was performed in a university maternity hospital and a Special Immunobiological Reference Center. The evaluation was performed through a questionnaire applied during a telephone interview.
ResultsThe study included 445 children aged 39 (18–54) months. In the univariate analysis, the risk factors with the greatest chance of recurrent wheezing were birth weight <1000g, gestational age <28 weeks, living with two or more siblings, food allergy, and atopic dermatitis in the child, as well as food allergy and asthma in the parents. In the multivariate analysis, there was a significant association between recurrent wheezing and gestational age at birth <28 weeks, food allergy and atopic dermatitis in the child, and living with two or more children. Of the 445 analyzed subjects, 194 received passive immunization against the respiratory syncytial virus, and 251 preterm infants were not immunized. There was a difference between the gestational age of these subgroups (p<0.001). The overall prevalence of recurrent wheezing was 27.4% (95% CI: 23.42–31.70), whereas in the children who received passive immunization it was 36.1% (95% CI: 29.55–43.03).
ConclusionsPersonal history of atopy, lower gestational age, and living with two or more children had a significant association with recurrent wheezing. Children with lower gestational age who received passive immunization against the respiratory syncytial virus had a higher prevalence of recurrent wheezing than the group with higher gestational age.
Avaliar a prevalência e os fatores de risco associados à evolução para sibilância recorrente em prematuros.
MétodosO estudo transversal foi feito em 2014 e 2015 e analisou crianças prematuras nascidas entre 2011 e 2012. A busca dessas crianças foi feita em maternidade de hospital universitário e em um Centro de Referência para Imunobiológicos Especiais. A avaliação foi feita por questionário dirigido em entrevista telefônica.
ResultadosO estudo incluiu 445 crianças com 39 (18–54) meses de vida. Na análise univariada, os fatores de risco com maior chance de sibilância recorrente foram peso de nascimento menor do que 1.000g, idade gestacional menor do que 28 semanas, convivência com dois ou mais irmãos, alergia alimentar e dermatite atópica na criança e alergia alimentar e asma nos pais. Na análise multivariada houve associação significativa entre sibilância recorrente e idade gestacional ao nascer menor do que 28 semanas, alergia alimentar e dermatite atópica na criança e a convivência com duas ou mais crianças. Dos 445 sujeitos analisados, 194 receberam imunização passiva contra vírus sincicial respiratório e 251 eram prematuros não imunizados. Houve diferença entre a idade gestacional desses subgrupos (p<0,001). A prevalência geral de sibilância recorrente foi 27,4% (IC 95%: 23,42–31,70) e nas crianças que receberam a imunização passiva foi 36,1% (IC 95%: 29,55–43,03).
ConclusõesHistória pessoal de atopia, menor idade gestacional e convivência com duas ou mais crianças apresentaram associação significativa com sibilância recorrente. As crianças com menor idade gestacional, que receberam a imunização passiva contra o vírus sincicial respiratório, apresentaram maior prevalência de sibilância recorrente que o grupo de maior idade gestacional.
A sibilância recorrente (SR) é importante causa de morbidade e apresenta alta prevalência nos primeiros anos de vida.1 O Estudo Internacional de Sibilância em Lactentes (EISL), que padroniza sua investigação, define SR como a ocorrência de três ou mais episódios de crises de sibilos em um ano.1 O sibilo ou chiado representa fluxo aéreo turbulento por redução do calibre de vias aéreas inferiores, causado por obstrução ou constrição.2 Cerca de 90% dos quadros de sibilância em crianças até o terceiro ano de vida são causados por infecções respiratórias virais, principalmente pelo VSR.3 A SR do lactente está associada a infecções virais e a asma, além de outras doenças pulmonares e extrapulmonares.4 Estudos de coorte permitiram a identificação dos fenótipos de SR, com o objetivo de diagnosticar asma e estabelecer estratégias de prevenção e terapêutica.5
Na literatura, os fatores de risco associados à SR estão relacionados a características genéticas, ao menor calibre de vias aéreas e à exposição a agentes ambientais.5
Os avanços tecnológicos proporcionam um aumento na população de prematuros e esses apresentam maior risco de desenvolver sibilância recorrente, o que interfere em taxas de morbidade e aumento de custos para a saúde pública.6
A infecção grave pelo Vírus Sincicial Respiratório (VSR) é um importante fator de risco associado à SR.7 Ainda não está definido se a infecção por esse vírus promove SR ou se a infecção grave e a sibilância são marcadores de uma vulnerabilidade subjacente, como a atopia.8 Esse vírus ativa a resposta imunológica de padrão T‐helper tipo 2 (Th‐2).3,8 Alguns autores argumentam que ocorrência de infecção em fases precoces da vida pode alterar permanentemente a resposta imunológica, promover SR e asma.9 Por outro lado, infecção grave pelo VSR pode ser um marcador de predisposição genética para asma.10
Desde o fim dos anos 1990, o anticorpo monoclonal Palivizumabe é usado como imunização passiva para reduzir os índices de infecção grave pelo VSR em indivíduos com maior risco, ou seja, as crianças prematuras, com broncodisplasia pulmonar ou cardiopatia congênita com repercussão hemodinâmica.11 De acordo com as diretrizes da Academia Americana de Pediatria, o Palivizumabe tem efeito limitado sobre infecções respiratórias em crianças sem fatores de risco para doença grave e mínimos efeitos sobre sibilância subsequente, não é recomendado o uso para prevenção de asma ou para reduzir episódios de sibilância.11
Alguns estudos demonstraram evidências de efeito causal do uso de Palivizumabe sobre redução de índices de sibilância em prematuros.12–14 Porém, Simões et al.15 verificaram que o uso da imunização passiva conferiu proteção para SR apenas nas crianças sem história familiar de atopia. No grupo das crianças atópicas esse efeito protetor não foi observado.15 Numa coorte de prematuros previamente saudáveis, a proteção contra VSR não alterou o risco de asma ou resultados de testes de função pulmonar aos seis anos de vida.16
Os objetivos deste trabalho foram avaliar a prevalência de SR em um grupo de crianças prematuras e analisar os fatores de risco associados a esta. Entre eles, verificar se o menor risco de infecção grave pelo VSR conferido pela imunização passiva contra o VSR ou a maior idade gestacional protegeu os prematuros da evolução para SR subsequente.
MétodosO estudo de corte transversal foi feito entre junho de 2014 e agosto de 2015.
O grupo de estudo incluiu os prematuros nascidos em 2011 e 2012, com IG menor de 37 semanas, definida por ultrassom gestacional ou por método de Capurro, no Centro de Atendimento Integral a Saúde da Mulher (CAISM) – Unicamp; e as crianças nascidas prematuramente entre 2010 e 2012 na região da Divisão Regional de Saúde – DIR VII – Secretaria de Saúde do Estado de São Paulo, que foram encaminhadas para uso de imunização passiva contra o VSR (Palivizumabe) em 2012, no Centro de Referência de Imunobiológicos Especiais (CRIE) da Unicamp.
O instrumento de pesquisa usado foi um questionário dirigido sobre fatores de risco associado à versão reduzida do questionário EISL17 que investigou dados demográficos e fatores de risco para SR, como sexo, etnia, escolaridade materna, peso de nascimento, IG ao nascer, aleitamento materno, frequência a creche, exposição a animais domésticos, número de crianças no mesmo lar, tabagismo materno, cuidador tabagista, história pessoal de alergia alimentar e dermatite atópica, história parental de alergia alimentar ou asma e proteção contra infecção grave pelo VSR pelo uso de Palivizumabe. Esse questionário foi aplicado aos responsáveis por entrevista telefônica.
Foram excluídas as crianças cujos pais ou responsáveis não foram localizados e aquelas que evoluíram para óbito.
A definição de SR foi três ou mais crises de sibilância em um ano no primeiro ano de vida ou no último ano antes da entrevista.
Os dados foram processados com o programa SPSS 16.0 (SPSS Inc., Chicago, IL, USA). As variáveis qualitativas foram apresentadas como frequências absolutas e relativas e sua associação foi avaliada com o teste do qui‐quadrado. Determinou‐se média, desvio‐padrão, mediana, mínimo e máximo das variáveis quantitativas e a comparação de sua distribuição foi determinada pelo teste de Mann‐Whitney. O nível de significância adotado foi 5%. Determinaram‐se os valores de odds ratio não ajustados, IC 95% e o p‐valor de SR em relação a cada variável preditora por Regressão Logística Univariada (método Enter). Posteriormente, foram selecionadas as variáveis preditoras com p‐valor<0,200 na análise univariada, para compor o modelo logístico multivariado. Empregou‐se o método Forward Stepwise (Wald), com p‐valor de inclusão de 0,05 e p‐valor de exclusão de 0,10. A prevalência de SR e seu intervalo de confiança foram definidos com o software OpenEpi, versão 3.03a.
O Projeto de Pesquisa foi aprovado pela Comissão de Pesquisa do CAISM (CP 019/2014) e pela Comissão de Ética em Pesquisa da Unicamp (Parecer 142.928/2012 e Parecer 1.030.707/2015). Houve dispensa do TCLE por inviabilidade de se fazer entrevista presencial.
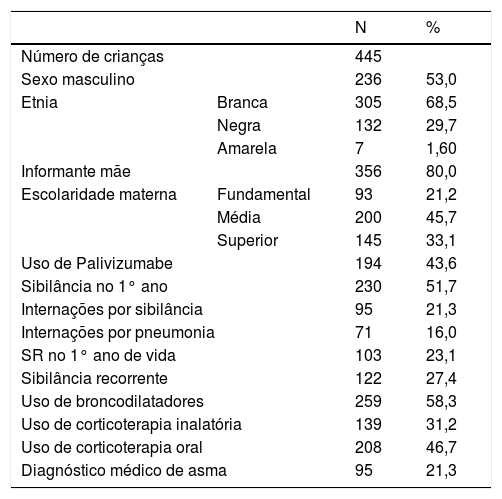
ResultadosNo grupo de prematuros nascidos no CAISM em 2011 e 2012 havia 825 crianças. Foram feitas ligações para todos os telefones de contato e 261 crianças foram localizadas. Entre as dez excluídas, cinco haviam evoluído para óbito e cinco pertenciam ao grupo que usara Palivizumabe. Os responsáveis por 251 crianças foram entrevistados. No grupo que recebeu Palivizumabe em 2012, havia 425 crianças. Foram localizadas 282, foram excluídas 84 que não eram prematuras e quatro casos por óbito. Foram entrevistados os pais ou responsáveis por 194 crianças. Não houve recusa para a entrevista. Foram avaliados 445 prematuros, na idade de 39 meses (mínimo: 18, máximo: 54, intervalo interquartil: 8) e com idade gestacional de 32 semanas (mínimo: 24; máximo: 36; intervalo interquartílico: 6). As características demográficas e clínicas desse grupo estão expostas na tabela 1.
Características demográficas e clínicas do grupo de estudo
| N | % | ||
|---|---|---|---|
| Número de crianças | 445 | ||
| Sexo masculino | 236 | 53,0 | |
| Etnia | Branca | 305 | 68,5 |
| Negra | 132 | 29,7 | |
| Amarela | 7 | 1,60 | |
| Informante mãe | 356 | 80,0 | |
| Escolaridade materna | Fundamental | 93 | 21,2 |
| Média | 200 | 45,7 | |
| Superior | 145 | 33,1 | |
| Uso de Palivizumabe | 194 | 43,6 | |
| Sibilância no 1° ano | 230 | 51,7 | |
| Internações por sibilância | 95 | 21,3 | |
| Internações por pneumonia | 71 | 16,0 | |
| SR no 1° ano de vida | 103 | 23,1 | |
| Sibilância recorrente | 122 | 27,4 | |
| Uso de broncodilatadores | 259 | 58,3 | |
| Uso de corticoterapia inalatória | 139 | 31,2 | |
| Uso de corticoterapia oral | 208 | 46,7 | |
| Diagnóstico médico de asma | 95 | 21,3 | |
| Mediana | IntervaloIQ | |
|---|---|---|
| Idade na entrevista (meses) | 39 | 8 |
| Idade gestacional (semanas) | 32 | 6 |
| Peso de nascimento (g) | 1690 | 1217 |
| Aleitamento materno (meses) | 3,0 | 8 |
| Idade 1ª crise sibilos (meses) | 6,0 | 9 |
%, porcentagem; Intervalo IQ, intervalo interquartílico; N, número total; SR, sibilância recorrente.
No momento da aplicação do questionário, a idade das crianças com SR foi de 39 meses (mínimo: 18, máximo: 50, intervalo interquartil: 7). Entre as crianças sem SR, a idade foi de 40 meses (mínimo: 22, máximo: 54, intervalo interquartil: 9). A análise estatística das idades cronológicas não apresentou diferença significativa (p=0,142).
A IG do grupo que recebeu Palivizumabe foi de 28 semanas (mínimo: 24, máximo: 36, intervalo interquartil: 3,25). A IG do grupo não imunizado foi de 34 semanas (mínimo: 28, máximo: 36, intervalo interquartil: 3). A avaliação de associação da IG entre as crianças que usaram e não usaram Palivizumabe apresentou diferença significativa (p<0,001), o grupo que recebeu Palivizumabe apresentou menor IG.
A prevalência geral de SR foi 27,4% (IC 95%: 23,42‐31,70). No grupo que recebeu Palivizumabe, a prevalência de SR foi 36,1% (IC 95%: 29,55‐43,03) e no grupo sem profilaxia foi 20,7% (IC 95%: 16,04–26,06). O grupo que recebeu a imunização passiva apresentou maior prevalência de SR (p<0,001).
A internação por crise de sibilância foi mais frequente em crianças com sibilância recorrente (p<0,001).
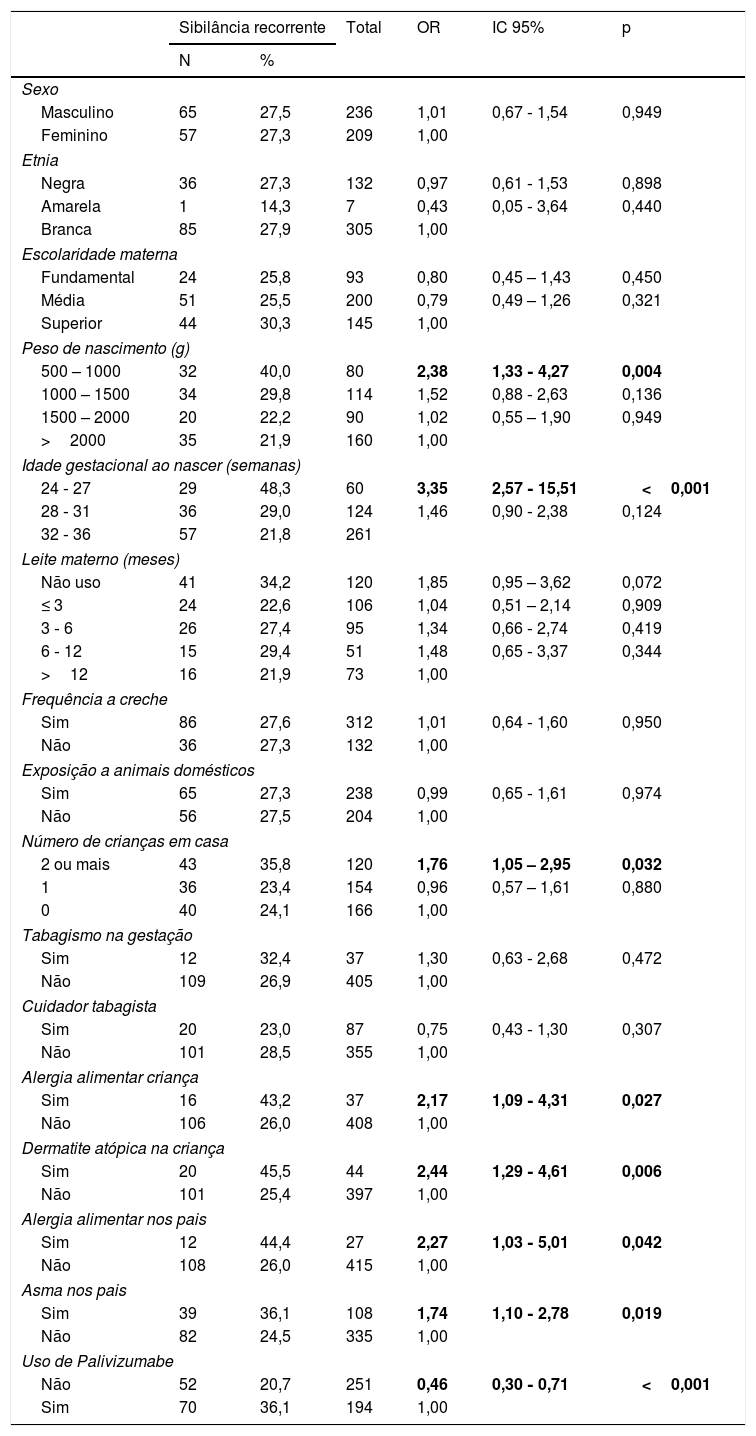
A análise dos fatores de risco para SR, por Regressão Logística Univariada, não encontrou diferença estatística significativa em relação aos seguintes fatores: sexo, etnia, escolaridade materna, peso de nascimento maior do que 1.000g, idade gestacional maior do que 28 semanas, aleitamento materno, frequência a creche, exposição a animais domésticos, número de crianças em casa menor do que dois; tabagismo materno e cuidador tabagista (tabela 2).
Fatores de risco para sibilância recorrente
| Sibilância recorrente | Total | OR | IC 95% | p | ||
|---|---|---|---|---|---|---|
| N | % | |||||
| Sexo | ||||||
| Masculino | 65 | 27,5 | 236 | 1,01 | 0,67 ‐ 1,54 | 0,949 |
| Feminino | 57 | 27,3 | 209 | 1,00 | ||
| Etnia | ||||||
| Negra | 36 | 27,3 | 132 | 0,97 | 0,61 ‐ 1,53 | 0,898 |
| Amarela | 1 | 14,3 | 7 | 0,43 | 0,05 ‐ 3,64 | 0,440 |
| Branca | 85 | 27,9 | 305 | 1,00 | ||
| Escolaridade materna | ||||||
| Fundamental | 24 | 25,8 | 93 | 0,80 | 0,45 – 1,43 | 0,450 |
| Média | 51 | 25,5 | 200 | 0,79 | 0,49 – 1,26 | 0,321 |
| Superior | 44 | 30,3 | 145 | 1,00 | ||
| Peso de nascimento (g) | ||||||
| 500 – 1000 | 32 | 40,0 | 80 | 2,38 | 1,33 ‐ 4,27 | 0,004 |
| 1000 – 1500 | 34 | 29,8 | 114 | 1,52 | 0,88 ‐ 2,63 | 0,136 |
| 1500 – 2000 | 20 | 22,2 | 90 | 1,02 | 0,55 – 1,90 | 0,949 |
| >2000 | 35 | 21,9 | 160 | 1,00 | ||
| Idade gestacional ao nascer (semanas) | ||||||
| 24 ‐ 27 | 29 | 48,3 | 60 | 3,35 | 2,57 ‐ 15,51 | <0,001 |
| 28 ‐ 31 | 36 | 29,0 | 124 | 1,46 | 0,90 ‐ 2,38 | 0,124 |
| 32 ‐ 36 | 57 | 21,8 | 261 | |||
| Leite materno (meses) | ||||||
| Não uso | 41 | 34,2 | 120 | 1,85 | 0,95 – 3,62 | 0,072 |
| ≤ 3 | 24 | 22,6 | 106 | 1,04 | 0,51 – 2,14 | 0,909 |
| 3 ‐ 6 | 26 | 27,4 | 95 | 1,34 | 0,66 ‐ 2,74 | 0,419 |
| 6 ‐ 12 | 15 | 29,4 | 51 | 1,48 | 0,65 ‐ 3,37 | 0,344 |
| >12 | 16 | 21,9 | 73 | 1,00 | ||
| Frequência a creche | ||||||
| Sim | 86 | 27,6 | 312 | 1,01 | 0,64 ‐ 1,60 | 0,950 |
| Não | 36 | 27,3 | 132 | 1,00 | ||
| Exposição a animais domésticos | ||||||
| Sim | 65 | 27,3 | 238 | 0,99 | 0,65 ‐ 1,61 | 0,974 |
| Não | 56 | 27,5 | 204 | 1,00 | ||
| Número de crianças em casa | ||||||
| 2 ou mais | 43 | 35,8 | 120 | 1,76 | 1,05 – 2,95 | 0,032 |
| 1 | 36 | 23,4 | 154 | 0,96 | 0,57 – 1,61 | 0,880 |
| 0 | 40 | 24,1 | 166 | 1,00 | ||
| Tabagismo na gestação | ||||||
| Sim | 12 | 32,4 | 37 | 1,30 | 0,63 ‐ 2,68 | 0,472 |
| Não | 109 | 26,9 | 405 | 1,00 | ||
| Cuidador tabagista | ||||||
| Sim | 20 | 23,0 | 87 | 0,75 | 0,43 ‐ 1,30 | 0,307 |
| Não | 101 | 28,5 | 355 | 1,00 | ||
| Alergia alimentar criança | ||||||
| Sim | 16 | 43,2 | 37 | 2,17 | 1,09 ‐ 4,31 | 0,027 |
| Não | 106 | 26,0 | 408 | 1,00 | ||
| Dermatite atópica na criança | ||||||
| Sim | 20 | 45,5 | 44 | 2,44 | 1,29 ‐ 4,61 | 0,006 |
| Não | 101 | 25,4 | 397 | 1,00 | ||
| Alergia alimentar nos pais | ||||||
| Sim | 12 | 44,4 | 27 | 2,27 | 1,03 ‐ 5,01 | 0,042 |
| Não | 108 | 26,0 | 415 | 1,00 | ||
| Asma nos pais | ||||||
| Sim | 39 | 36,1 | 108 | 1,74 | 1,10 ‐ 2,78 | 0,019 |
| Não | 82 | 24,5 | 335 | 1,00 | ||
| Uso de Palivizumabe | ||||||
| Não | 52 | 20,7 | 251 | 0,46 | 0,30 ‐ 0,71 | <0,001 |
| Sim | 70 | 36,1 | 194 | 1,00 | ||
%, frequência relativa; N, frequência absoluta; p, probabilidade do teste de Wald.
Em relação ao peso de nascimento, a chance de a criança apresentar SR foi 2,38 vezes maior se estivesse no grupo entre 500 e 1.000g (OR: 2,38; IC 95%: 1,33‐4,27; p=0,004) em relação ao grupo com peso maior de 2.000g. A idade gestacional de 24 a 27 semanas significou chance 3,35 vezes maior de pertencer ao grupo com SR (OR: 3,35; IC 95%: 1,86–6,01; p<0,001) em relação ao grupo com idade gestacional ao nascer maior do que 37 semanas (tabela 2).
A chance de SR foi 76% maior no caso de convívio com duas ou mais crianças na mesma casa (OR: 1,76; IC 95%: 1,05–2,95; p=0,032) (tabela 2).
Houve associação de SR e antecedente de atopia na criança e seus parentes. A alergia alimentar na criança aumentou a chance de sibilância recorrente em 2,17 vezes (OR: 2,17; IC 95%: 1,09–4,31; p=0,027), a dermatite atópica na criança em 2,44 vezes (OR: 2,44; IC 95%: 1,29–4,61; p=0,006), a alergia alimentar nos pais em 2,27 vezes (OR: 2,27; IC 95%: 1,03–5,01; p=0,042) e a asma nos pais em 74% (OR: 1,74 (IC 95%: 1,10–2,78; p=0,019) (tabela 2).
O grupo que não recebeu a imunização passiva, com maior idade gestacional, apresentou menor chance de sibilância recorrente (OR: 0,46; IC 95%: 0,30‐0,71; p<0,001) (tabela 2).
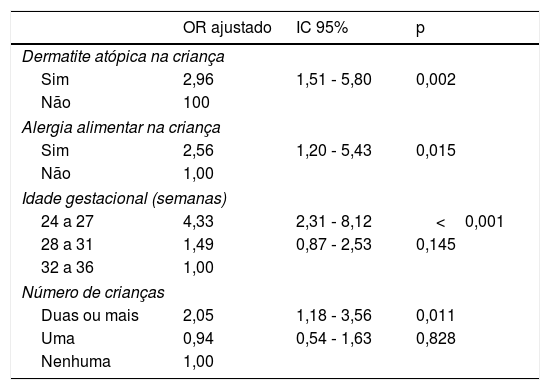
Para a análise por Regressão Logística Multivariada, o “fator de risco” peso de nascimento não foi incluído devido à forte associação com a idade gestacional. Após ajustes finais, permaneceram no modelo as variáveis idade gestacional entre 24 a 27 semanas, na qual a chance de ser SR é 4,33 vezes maior do que no grupo 32‐36 semanas de IG (OR ajustado=4,33, IC 95%: 2,31–8,12; p<0,001); a convivência com número de crianças maior do que dois com chance de 2,05 vezes maior do que famílias sem outras crianças (OR ajustado=2,05; IC 95%: 1,18‐3,56; p=0,011); dermatite atópica na criança, grupo em que a chance é 2,96 vezes maior (OR ajustado=2,96; IC 95%: 1,51–5,8; p=0,002); e alergia alimentar na criança com chance 2,56 vezes maior (OR ajustado=2,56; IC 95%: 1,20‐5,43; p=0,015) (tabela 3).
Análise multivariada
| OR ajustado | IC 95% | p | |
|---|---|---|---|
| Dermatite atópica na criança | |||
| Sim | 2,96 | 1,51 ‐ 5,80 | 0,002 |
| Não | 100 | ||
| Alergia alimentar na criança | |||
| Sim | 2,56 | 1,20 ‐ 5,43 | 0,015 |
| Não | 1,00 | ||
| Idade gestacional (semanas) | |||
| 24 a 27 | 4,33 | 2,31 ‐ 8,12 | <0,001 |
| 28 a 31 | 1,49 | 0,87 ‐ 2,53 | 0,145 |
| 32 a 36 | 1,00 | ||
| Número de crianças | |||
| Duas ou mais | 2,05 | 1,18 ‐ 3,56 | 0,011 |
| Uma | 0,94 | 0,54 ‐ 1,63 | 0,828 |
| Nenhuma | 1,00 | ||
IC 95%, intervalo de confiança de 95% do odds ratio ajustado; OR ajustado, odds ratio ajustado; p, probabilidade do teste de Wald.
A decisão de avaliar SR num grupo de crianças prematuras foi motivada pela necessidade de entender os fatores de risco associados a SR nessa população específica.
A prevalência de SR encontrada neste estudo foi de 27,4%, avaliada numa população de crianças prematuras, heterogênea em relação à presença de comorbidades, com alto risco de infecção grave pelo VSR. No estudo de Mallol et al.,1 publicado em 2016, verificou‐se prevalência de 21,7% na cidade de São Paulo, em crianças da população geral, não se observou a característica prematuridade e suas comorbidades, porém com características demográficas semelhantes aos indivíduos deste estudo.1 Um artigo de revisão sistemática sobre risco de sibilância em prematuros mostra a prevalência de 31,6% de SR em prematuros aos quatro anos de vida.18 Outro estudo de revisão sistemática e metanálise mostrou maior chance de SR em pacientes prematuros, principalmente em crianças nascidas com IG menor do que 32 semanas.19 Não encontramos artigos que discutam prevalência de SR em indivíduos com características semelhantes aos avaliados neste trabalho.
Neste grupo de estudo não houve associação de SR com os fatores de risco sexo, etnia, escolaridade materna, aleitamento materno, frequência a creche, exposição a animais domésticos, tabagismo materno, cuidador tabagista e imunização com Palivizumabe. Porém foi demonstrada a associação de SR com peso de nascimento menor do que 1.000g, idade gestacional menor do que 28 semanas, convivência com duas ou mais crianças em casa, história de atopia pessoal e nos pais. A internação por crise de sibilância foi mais frequente no grupo com sibilância recorrente, achado semelhante a estudo do grupo EISL.1 Essa característica não foi estudada como fator de risco, somente foi avaliada sua associação.
Um trabalho feito com prematuros mostra que o sexo masculino é fator de risco independente associado a SR.20 Estudos do grupo EISL também demonstram sexo masculino associado a SR,21,22 porém há estudos que não encontraram diferença entre os sexos.23
Trabalhos do EISL não definem etnia como fator associado à SR,22,23 mas um estudo americano considerou ascendência africana como fator independente associado a SR.24
O nível de escolaridade materna também não foi fator associado a maior chance de SR em alguns trabalhos do EISL.22,23 Outros autores que analisaram esse fator de risco mostraram que o nível superior era uma condição protetora.21
Os resultados dos efeitos de aleitamento materno sobre SR são controversos na literatura, em parte devido ao fato de que muitos estudos são apenas observacionais.6 Há associação entre SR e a falta do aleitamento materno em pesquisas do EISL.25 Uma publicação que avaliou esse fator de risco em prematuros não encontrou associação entre aleitamento materno e SR,20 assim como neste trabalho.
Ao contrário deste estudo, vários autores de trabalhos com questionário EISL demonstram associação entre SR e frequência à creche.1,21–23,25
Este trabalho determinou ser significativo o fato de o paciente conviver com mais de duas crianças no mesmo domicílio, não é importante o número menor de irmãos. Outros estudos EISL documentaram não haver diferenças entre a chance de SR e a convivência com qualquer número de irmãos na mesma casa.22,23 Um estudo conduzido na Espanha com prematuros define a presença de irmãos em idade escolar como fator de risco independente associado a SR.26
A exposição a animais domésticos não é significante para SR nos achados do EISL.22,23 Porém, já foi publicada a associação entre convívio com animais e SR.25
Sobre o fator de risco tabagismo, uma revisão sistemática que estudou a relação entre sibilância, tabagismo materno na gestação e exposição pós‐natal ao cigarro encontrou associação entre a exposição pré‐natal ao tabagismo e a ocorrência de SR na idade entre três e quatro anos.27 Outro trabalho mostrou que a prematuridade associada a tabagismo materno determina chance de SR 3,8 vezes maior do que crianças nascidas a termo.28 Já um estudo feito com prematuros menores de 28 semanas de IG não encontrou relação entre tabagismo e SR e sua justificativa foi a possibilidade de esse fator ser superado pela morbidade própria da prematuridade extrema.29
Quanto à avaliação do peso de nascimento, este estudo mostrou que é maior a chance de SR quanto menor o peso ao nascer, achado semelhante ao de um trabalho francês feito com prematuros20 e um grande estudo do EISL.30 Há relação de baixo peso de nascimento com prematuridade e restrição de crescimento intrauterino, fatores ligados a prejuízos ao desenvolvimento pulmonar e redução de função pulmonar.30 Revisões sistemáticas também associam prematuridade à SR.18,19 Simões et al. demonstraram variação inversamente proporcional entre SR e IG e peso ao nascer.12
A atopia é importante fator de risco associado à SR neste trabalho, visto que a história pessoal de alergia alimentar e dermatite atópica foi confirmada como aumento significativo de chance de SR na população do estudo. Estudos relatam associação de alergia alimentar com SR e asma.15 A dermatite atópica é fator associado a SR em muitos estudos do EISL,21,23 assim como asma nos pais.1,15,21–23,25
Há uma relação complexa entre infecção grave pelo VSR e desenvolvimento de SR. Este trabalho avaliou diversos fatores de risco para SR em prematuros, como discutido anteriormente. A prevalência de SR foi maior no grupo de crianças que recebeu a imunização passiva contra VSR, o que pode ser explicado por sua menor IG e menor peso.
Na literatura, alguns artigos relacionam uso de imunização passiva contra VSR e índices de SR. Simões et al.12 descrevem que o uso de Palivizumabe reduziu incidência de SR em uma coorte não randomizada de prematuros com IG menor de 36 semanas sem doença pulmonar crônica. Porém, quando se avaliou a informação de atopia na família, em outro artigo15 do mesmo grupo de estudo, os autores verificaram redução dos índices de SR somente nas crianças sem história familiar de atopia. Yoshihara et al.14 também mostraram menores índices de SR num estudo observacional com prematuros de 33‐35 semanas de gestação, cujo desfecho era a SR avaliada em consultas médicas. Blanken et al.13 conduziram um estudo randomizado no qual houve redução de dias de sibilância no primeiro ano de vida de prematuros que receberam imunização passiva, sem comorbidades, porém Scheltema et al.16 reavaliaram essa mesma coorte e mostraram não haver alteração sobre o risco de asma ou função pulmonar aos seis anos de vida em relação ao uso de Palivizumabe. A Academia Americana de Pediatria, em suas diretrizes para uso do Palivizumabe, ressalta seu importante papel na redução de infecção grave pelo VSR, porém, com base nos artigos descritos acima, recomenda que a profilaxia não seja usada com o objetivo de reduzir episódios de SR subsequente nem para prevenção de asma.11
A análise multivariada definiu que dermatite atópica, alergia alimentar na criança, IG menor do que 28 semanas e convivência com mais que duas crianças foram fatores de risco para SR. Este trabalho confirmou que a atopia é fator de risco associado a SR.
O menor calibre de vias aéreas relacionado à IG também é um dos principais fatores de risco associados a SR, como demonstrado por outros autores.15,18,19 Isso é confirmado pela maior prevalência de SR nas crianças com menor idade gestacional, mesmo protegidas da infecção grave por VSR, pelo uso da imunização passiva contra o VSR.
A prevalência e os fatores de risco associados a SR podem variar, apesar do uso de instrumentos padronizados em populações semelhantes, demonstram que existe interferência de genética, fatores ambientais e culturais de cada população estudada.
Como limitação do estudo, não foi analisada a relação entre gravidade das crises de sibilância e evolução com SR, por não haver documentação da presença do VSR como agente causal nesses eventos.
O número de crianças cujos responsáveis não foram entrevistados ocorreu por haver grande dificuldade de localizá‐las a partir dos telefones de contato registrados no CAISM e no CRIE, cadastros efetuados dois a três anos antes das entrevistas.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
À equipe do Centro de Referências em Imunobiológicos Especiais do Hospital das Clínicas da Unicamp pelo apoio e colaboração na coleta de dados.
Como citar este artigo: Simões MC, Inoue Y, Matsunaga NY, Carvalho MR, Ribeiro GL, Morais EO, et al. Recurrent wheezing in preterm infants: Prevalence and risk factors. J Pediatr (Rio J). 2019;95:720–7.
Estudo vinculado ao Centro de Investigações em Pediatria (CIPED), Faculdade de Ciências Médicas (FCM), Universidade Estadual de Campinas (Unicamp), Campinas, SP, Brasil.