To describe the main predictors for excess birth weight in Brazilian children.
Data sourcesSystematic review carried out in the bibliographic databases: PubMed/Medline, Cochrane, Scopus, Web of Science, and LILACS. The research in the gray literature was performed using the Google Scholar database. The bias risk analysis was adapted from the Downs and Black scale, used to evaluate the methodology of the included studies.
Data synthesisUsing the classifications of fetal macrosomia (>4.000g or ≥4.000g) and large for gestational age (above the 90th percentile), 64 risk factors for excess birth weight were found in 33 scientific articles in the five regions of the country. Of the 64 risk factors, 31 were significantly associated with excess birth weight, with excess gestational weight gain, pre‐gestational body mass index ≥25kg/m2, and gestational diabetes mellitus being the most prevalent.
ConclusionThe main predictors for excess birth weight in Brazil are modifiable risk factors. The implementation of adequate nutritional status in the gestational period and even after childbirth appears to be due to the quality and frequency of the follow‐up of the mothers and their children by public health agencies.
Descrever os principais preditores para o excesso de peso ao nascer em crianças brasileiras.
Fontes dos dadosRevisão sistemática feita nos bancos de dados bibliográficos: PubMed/Medline, Cochrane, Scopus, Web of Science e Lilacs. A pesquisa na literatura cinzenta foi feita na base de dados Google Acadêmico. A análise do risco de viés foi adaptada da escala de Downs e Black, usada para avaliar a metodologia dos estudos incluídos.
Síntese dos dadosCom o uso das classificações macrossomia fetal (> 4.000g ou ≥ 4.000g) e grande para idade gestacional acima do percentil 90, foram encontrados 64 fatores de risco para excesso de peso ao nascer em 33 artigos científicos nas cinco regiões do país. Dos 64 fatores de risco, 31 foram significativamente associados a excesso de peso ao nascer, os mais prevalentes foram ganho de peso gestacional excessivo, índice de massa corporal pré‐gestacional ≥25kg/m2 e diabetes mellitus gestacional.
ConclusãoOs principais preditores para o excesso de peso ao nascer no Brasil são fatores de risco modificáveis. O estabelecimento de um estado nutricional adequado no período gestacional e mesmo após o parto parece ser a qualidade e a frequência do acompanhamento dos órgãos de saúde junto às mães e seus filhos.
O peso ao nascer tem sido intensamente investigado desde a década de 401 do século passado em função, principalmente, de sua intrínseca relação com a saúde da criança e da mãe.2 Diretamente relacionado às condições nutricionais do recém‐nascido e da mãe,3 o peso ao nascer também está associado às condições socioeconômicas e à qualidade da atenção recebida durante o período pré‐natal, além de influenciar no crescimento e no desenvolvimento do indivíduo ao longo de toda a sua vida.4 Adicionalmente, o fato de a mãe estar intimamente conectada à criança através da placenta e do cordão umbilical ao longo da gestação faz com que o estado nutricional do par mãe‐criança seja potencialmente influenciado por fatores semelhantes.5
Durante muito tempo, diversos estudos consideraram o baixo peso ao nascer como a principal alteração do estado nutricional da criança devido a sua forte relação com a mortalidade infantil.6 O baixo peso ao nascer é até uma característica considerada na avaliação do índice de desenvolvimento humano (IDH) para classificar os países quanto ao tipo de desenvolvimento.7 Países em desenvolvimento comumente apresentam elevadas taxas de baixo peso ao nascer e, consequentemente, baixo IDH.8,9 No entanto, com a rápida alteração no estilo de vida da população mundial, sobretudo dieta e atividade física,10 muitos estudos têm revelado que o excesso de peso ao nascer também está associado a grande parte dos mesmos fatores de risco para baixo peso ao nascer.11
Nos últimos anos, estudos conduzidos tanto em países desenvolvidos como em desenvolvimento têm revelado elevadas taxas de excesso de peso ao nascer em suas populações.12–15 Na Noruega, um país com mais de cinco milhões de habitantes16 e IDH de 0,944,17 o excesso de peso ao nascer em 2006 foi de 20,5%.18 Nos Estados Unidos, que têm IDH de 0,91517 e 326.425 milhões de habitantes,19 o excesso de peso ao nascer em 2016 foi de 13,2%.20 Estudos conduzidos na França, no Canadá e na Espanha revelaram valores de excesso de peso corporal de 15,3%, 25,8% e 16,7%, respectivamente.21 Esses mesmos países apresentaram IDHA de 0,888, 0,913 e 0,876 em 2015,17 respectivamente.
No Brasil, um país em desenvolvimento com 200 milhões de habitantes e IDH de 0,755,17 as taxas de excesso de peso ao nascer variam entre 4,1 e 30,1%, dependem do critério de classificação usado,14,22–29 e diferem consideravelmente segundo a região em que o estudo foi conduzido.
Atualmente, o excesso de peso ao nascer atingiu valores alarmantes. A prevalência mundial de excesso de peso ao nascer está entre 0,5% na Índia a 14,5% na Argélia.12 A estimativa para 2025 é a de que o mundo tenha 70 milhões de crianças nascidas com excesso de peso ao nascer, desfecho que já é considerado por muitos autores um grave problema de saúde pública.30
As diferentes prevalências de excesso de peso ao nascer, comumente encontradas em países com grande diversidade socioeconômica, demográfica, cultural, entre outras, como é o caso do Brasil, realçam a importância de cada país identificar os principais fatores associados a essa condição clínica.31 Ainda que diversos fatores associados ao excesso de peso ao nascer sejam também encontrados em diferentes países, alguns fatores podem estar associados a características do próprio país e dessa forma não podem ser usados para explicar a mesma condição clínica de outros países.31
Alguns estudos demonstraram que o excesso de peso ao nascer está associado principalmente ao excesso de peso materno pré‐gestacional, ao ganho de peso excessivo durante a gestação, ao diabetes mellitus, à hipercolesterolemia, à idade avançada e à multiparidade.4,32–34 Entretanto, não existe um consenso entre quais são os principais preditores para o excesso de peso ao nascer especificamente de crianças brasileiras.
É fundamental que cada país desenhe seu modelo de gestão pública com base nos dados de pesquisas desenvolvidos com sua própria população. Nesse sentido, este estudo tem como objetivo identificar os principais preditores do excesso de peso ao nascer oriundos especificamente de estudos desenvolvidos com a população brasileira.
MétodosEsta revisão sistemática seguiu os critérios do Preferred Reporting Items for Systematic Reviews and Meta‐Analyses Checklist (Prisma).35 O protocolo foi registrado no CRD's International Prospective Register of Systematic Reviews (Prospero) sob o número CRD42017070505.
Critérios de elegibilidadeForam considerados elegíveis os estudos que avaliaram os fatores de risco para excesso de peso ao nascer no Brasil, sem restrição ou delimitação de ano de publicação e idioma. Os critérios de classificação para excesso de peso ao nascer adotados foram: grande para idade gestacional (GIG) ou maior do que o percentil 90,36 macrossomia fetal (> 4.000g ou ≥ 4.000g),37 independentemente de se havia referência quanto à classificação.
Em relação aos tipos, foram incluídos estudos de coorte, transversais e casos‐controle, com dados de fontes primárias ou secundárias. Foram excluídos os artigos que: 1) não levaram em consideração excesso de peso ao nascer, 2) não apresentaram dados para classificação de MF e GIG, 3) apresentaram dados insuficientes para avaliar os fatores de risco associados ao excesso de peso ao nascer, 4) não avaliaram associação e 5) o artigo completo não estava disponível. Artigos de revisão, editoriais, cartas, capítulos de livros, opiniões pessoais, comentários, resumos de congressos ou conferências não foram considerados.
Fontes de informação e estratégias de pesquisaAs estratégias de busca detalhadas e individualizadas foram feitas nas seguintes bases de dados: PubMed/Medline, Cochrane, Scopus, Web of Science e Lilacs (Apêndice 1). Para a pesquisa dos 100 primeiros artigos na literatura cinzenta usou‐se a base de dados Google Acadêmico. A lista de referências dos estudos incluídos foi revisada manualmente para avaliar a necessidade de incluir referências adicionais. A busca pelos descritores foi feita em 28 de junho de 2017. Referências duplicadas foram removidas e o referencial completo foi feito com o software EndNote versão X7.5.1.1 (Thomson Reuters, Filadélfia, PA, Estados Unidos da América).
Seleção dos estudosA triagem dos artigos seguiu duas etapas. Na primeira foi feita a seleção dos artigos condizentes com os critérios de inclusão de acordo com títulos e resumos de todas as referências, individualmente por três pesquisadores (S.A.C., L.F.S., J.M.). Uma revisora (C.K.) concomitantemente analisou e conferiu os critérios necessários para eleger os estudos.
Na segunda etapa, os mesmos autores leram os artigos completos e excluíram aqueles que não se enquadraram nos critérios de inclusão. Dois outros autores (M.F.M., S.S.B.S.M.) participaram da seleção quando surgiam divergências entre os quatro revisores.
Processo de coleta dos dadosTrês autores (S.A.C., L.F.S., J.M.) coletaram informações referentes aos artigos selecionados, tais como autor e ano, local da coleta dos dados, tipo de instituição, objetivo do estudo, tipo de estudo, número de participantes, fatores de risco materno e fetal, critério para classificação de excesso de peso ao nascer, prevalência de excesso de peso em recém‐nascidos e resultados principais do estudo (tabela 1). Após a compilação dos dados e das informações dos estudos, esses foram checados por um quarto autor (C.K.), de forma a organizar as informações dos artigos selecionados. Ainda, para eliminar dúvidas, um quinto revisor (M.F.M.) contribuiu para definir eventuais discordâncias.
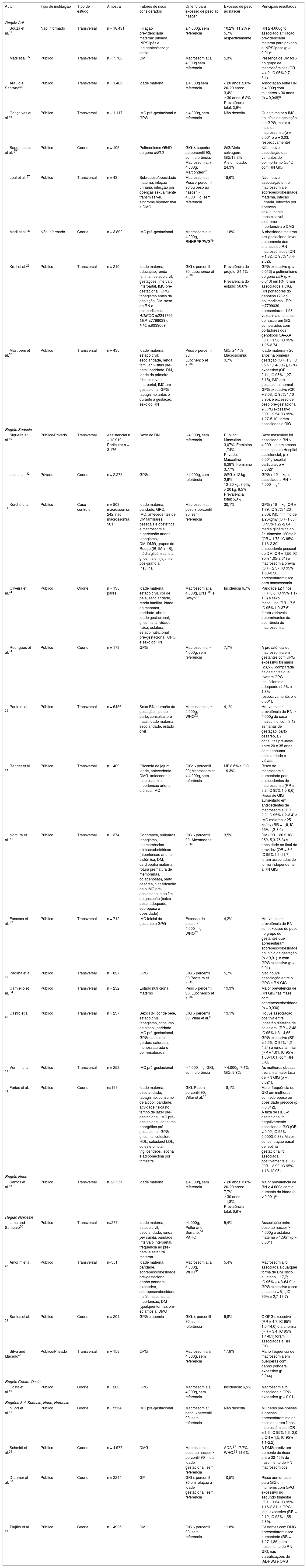
Características dos estudos incluídos nesta revisão sistemática, segundo a região do país
| Autor | Tipo de instituição | Tipo de estudo | Amostra | Fatores de risco considerados | Critério para excesso de peso ao nascer | Excesso de peso ao nascer | Principais resultados |
|---|---|---|---|---|---|---|---|
| Região Sul | |||||||
| Souza et al.61 | Não informado | Transversal | n = 18.491 | Filiação previdenciária materna: privada, INPS/Ipês e indigentes/serviço social | ≥ 4.000g, sem referência | 10,2%, 11,2% e 5,7%, respectivamente | RN ≥ 4.000g foi associado a filiação previdenciária materna para privado e INPS/Ipesc (p < 0,01)a |
| Madi et al.55 | Público | Transversal | n = 7.760 | DM | Macrossomia; ≥ 4.000g sem referência | 5,3% | Presença de DM foi > no grupo de macrossômicos (OR = 4,2, IC 95% 2,7‐6,4) |
| Araujo e Sant́Ana59 | Público | Transversal | n = 1.406 | Idade materna | ≥ 4.000g sem referência | < 20 anos: 2,8% 20‐29 anos: 3,4% ≥ 30 anos: 6,2% Prevalência total: 3,9% | Associação entre RN ≥ 4.000g com mulheres > 30 anos (p = 0,048)a |
| Gonçalves et al.45 | Público | Transversal | n = 1.117 | IMC pré‐gestacional e GPG | ≥ 4.000g, sem referência | Não descrita | Quanto maior o IMC no início da gestação e o GPG, maior o risco de macrossomia (p = 0,001 e p = 0,03, respectivamente) |
| Baggenstoss et al. 27 | Público | Coorte | n = 105 | Polimorfismo G54D do gene MBL2 | GIG: > superior ao percentil 90, sem referência. Macrossomia: > 4.000g, Marcondes78 | GIG/Alelo selvagem: GIG/13,2% Alelo mutado: 24,3% | Não houve associação das variantes do polimorfismo G54D com RN GIG |
| Leal et al. 57 | Público | Transversal | n = 43 | Sobrepeso/obesidade materna, infeção urinária, infecção por doenças sexualmente transmissível, síndrome hipertensiva e DMG | Macrossomia: Peso > percentil 90 ou peso ao nascer > 4.000g, sem referência | 18,6% | Não houve associação entre macrossomia e sobrepeso/obesidade materna, infeção urinária, infecção por doenças sexualmente transmissível, síndrome hipertensiva e DMG |
| Madi et al.25 | Não informado | Coorte | n = 3.892 | IMC pré‐gestacional | Macrossomia ≥ 4.000g, RNHBPEPWG79 | 11,8% | A obesidade materna pré‐gestacional levou ao aumento das chances de RN macrossômicos (OR = 1,82, IC 95% 1,44‐2,32). |
| Kroll et al.28 | Público | Transversal | n = 210 | Idade materna, educação, renda familiar, estado civil, gestações, intervalo interpartal, IMC pré‐gestacional, GPG, tabagismo antes da gestação, DM, sexo do RN e polimorfismos ADIPOQ rs2241766, LEP rs7799039 e FTO rs9939609 | GIG > percentil 90, Lubchenco et al.36 | Prevalência do projeto: 24,4% Prevalência do estudo: 50,0% | GPG excessivo (p = 0,013) e polimorfismo do gene LEP (p = 0,043) em RN foram associados a GIG. RN portadores do genótipo GG do polimorfismo LEP‐rs7799039 apresentaram 1,98 vezes maior chance de nascerem GIG comparados com portadores dos genótipos GA+AA (OR = 1,98, IC 95% 1,05‐3,74). |
| Mastroeni et al.13 | Público | Transversal | n = 435 | Idade materna, estado civil, escolaridade, renda familiar, visitas pré‐natal, paridade, DM, idade do primeiro filho, intervalo interpartal, IMC pré‐gestacional, GPG, tabagismo antes e durante a gestação, sexo do RN | Peso > percentil 90, Lubchenco et al.36 | GIG: 24,4% Macrossomia: 9,7% | Idade materna < 20 anos na primeira gestação (OR=1,9, IC 95% 1,14‐3,17), GPG excessivo (OR = 2,11, IC 95% 1,27‐3,15), IMC pré‐gestacional normal + GPG excessivo (OR = 2,08, IC 95% 1,10‐3,95), e excesso de peso pré‐gestacional + GPG excessivo (OR = 2,54, IC 95% 1,27‐5,10) foram associados a GIG. |
| Região Sudeste | |||||||
| Siqueira et al.39 | Público/Privado | Transversal | Assistencial n = 12.919 Particular n = 3.176 | Sexo do RN | > 4.000g, sem referência | Público: Masculino 3,07%; Feminino 1,74%. Privado: Masculino 6,28%; Feminino 3,77% | Sexo masculino foi associado a RN > 4.000g em ambos os hospitais (Hospital assistencial, p < 0,001; hospital particular, p = 0,002)a |
| Lizo et al. 32 | Privado | Coorte | n = 2.275 | GPG | ≥ 4.000g, sem referência | GPG < 12 kg: 2,6%; 12‐20 kg: 7,0%; > 20 kg: 8,5% Prevalência total: 5,3% | GPG > 12kg foi associado a RN ≥ 4.000ga |
| Kerche et al. 42 | Público | Caso‐controle | n = 803, macrossomia: 242; não macrossomia: 561 | Idade materna, paridade, GPG, IMC, antecedentes de DM familiares, pessoais e obstétrica e macrossomia, hipertensão arterial, tabagismo, DM, DMG, grupos de Rudge (IB, IIA + IIB), média glicêmica total, glicemia em jejum e pós‐prandial, insulina. | Macrossomia: peso > percentil 90, sem referência | 30,1% | GPG >16kg (OR = 1,79, IC 95% 1,23‐2,60), IMC mínimo de ≥ 25kgmy (OR=1,83, IC 95% 1,27‐2,64), média glicêmica do 3° trimestre 120mg/dl (OR = 1,78, IC 95% 1,13‐2,80), antecedente pessoal de DM (OR = 1,56, IC 95% 1,05‐2,31) e macrossomia prévia (OR = 2,37, IC 95% 1,60‐3,50) apresentaram risco para macrossomia |
| Oliveira et al.24 | Público | Coorte | n = 195 pares | Idade materna, estado civil, cor de pele, escolaridade, renda familiar, idade da menarca, paridade, aborto, idade gestacional, glicemia, atividade física, estatura, estado nutricional pré‐gestacional, GPG e sexo do RN | Macrossomia; ≥ 4.000g, Brasil80 e Sysyn81 | Incidência 6,7% | Paridade ≥2 filhos (RR=3,8, IC 95% 1,1‐1,9) e sexo masculino (RR = 7,5, IC 95% 1,0‐37,6) foram variáveis determinantes da ocorrência de macrossomia |
| Rodrigues et al.44 | Público | Coorte | n = 173 | GPG | Macrossomia ≥ 4.000g, sem referência | 7,7% | A prevalência de macrossomia em gestantes com GPG excessivo foi maior (23,5%) comparada às gestantes que tiveram GPG insuficiente ou adequado (4,5% e 1,8% respectivamente, p < 0,001). |
| Paula et al. 23 | Público | Transversal | n = 6456 | Sexo RN, duração da gestação, tipo de parto, consultas pré‐natal, idade materna, escolaridade, estado civil | Macrossomia; ≥ 4.000g, WHO82 | 4,1% | Houve maior prevalência de RN ≥ 4.000g do sexo masculino, com ≥ 42 semanas de gestação, parto cesáreo, ≥ 7 consultas pré‐natal, entre 20 e 35 anos, com nenhuma escolaridade e viúvas. |
| Rehder et al. 53 | Público | Transversal | n = 409 | Glicemia de jejum, idade, antecedente DMG, antecedente macrossomia, hipertensão arterial crônica, IMC | GIG: > percentil 90; Macrossomia: > 4.000g, sem referência | MF 8,6% e GIG 19,3% | Risco de macrossomia aumentado para antecedentes de macrossomia (RR = 3,2, IC 95% 1,5‐6,6). Risco de GIG aumentado em antecedentes de macrossomia (RR = 2,0, IC 95% 1,2‐3,4) e IMC materno ≥ 25 kg/my (RR = 1,9, IC 95% 1,2‐3,0) |
| Nomura et al. 41 | Público | Transversal | n = 374 | Cor branca, nulíparas, tabagismo, intercorrências clínicas/obstétricas (hipertensão arterial sistêmica, DM, cardiopatia materna, rotura prematura de membranas, colagenosas), parto cesárea, classificação pelo IMC pré‐gestacional e no fim da gestação (baixo peso, adequado, sobrepeso e obesidade) | GIG > percentil 90, Alexander et al.83 | 3,5% | DM (OR = 20,2, IC 95% 5,3‐76,8) e obesidade no final da gravidez (OR = 3,6, IC 95% 1,1‐11,7), foram associadas de forma independente a RN GIG |
| Fonseca et al. 47 | Público | Transversal | n = 712 | IMC inicial da gestante e GPG | Excesso de peso: ≥ 4.000g, WHO82 | 4,2% | Houve maior prevalência de RN com excesso de peso no grupo de gestantes que apresentaram sobrepeso/obesidade no início da gestação (p < 0,01), e com GPG excessivo (p < 0,01) |
| Padilha et al. 50 | Público | Transversal | n = 827 | GPG | GIG > percentil 90 Pedreira et al.84 | 5,7% | Não houve associação entre o GPG e RN GIG |
| Carniello et al. 54 | Público | Transversal | n = 232 | Estado nutricional materno | Peso > percentil 90, Lubchenco et al.36 | 19,3% | Maior prevalência de RN GIG nas mães com sobrepeso/obesidade (p = 0,030) |
| Castro et al. 49 | Público | Transversal | n = 297 | Sexo RN, cor de pele, estado civil, tabagismo, consumo de álcool, paridade, IMC pré‐gestacional, GPG, colesterol, gordura saturada, monossaturada e poli‐insaturada | GIG > percentil 90, Villar et al.85 | 13,1% | Houve associação positiva entre ingestão dietética de colesterol (RP = 2,48, IC 95% 1,31‐4,66), GPG excessivo (RP = 2,26, IC 95% 1,21‐4,24) e renda familiar (RP = 1,01, IC 95% 1,00‐1,01) com RN GIG. |
| Vernini et al. 52 | Público | Transversal | n = 258 | IMC pré‐gestacional | ≥ 4.000g, GIG, sem referência | ≥ 4.000g: 7,4% GIG: 8,9% | As mulheres obesas tiveram a maior taxa de RN GIG (p = 0,021). |
| Farias et al. 14 | Público | Coorte | n=199 | Idade materna, escolaridade, tabagismo, consumo de álcool, paridade, atividade física no tempo de lazer pré‐gestacional, IMC pré‐gestacional, consumo energético pré‐gestacional, GPG, glicemia, colesterol HDL, colesterol LDL, colesterol total, triglicerídeos, leptina e adiponectina por trimestre | GIG: Peso > percentil 90, Villar et al.85 | 18,1% | Maior frequência de GIG em mulheres com sobrepeso ou obesidade precoce (p = 0,042). A taxa de HDL‐c gestacional foi negativamente associada a GIG (OR = 0,02, IC 95% 0,0003‐0,88). Maior concentração basal de leptina gestacional foi associada positivamente a GIG (OR = 3,92, IC 95% 1,18‐12,95) |
| Região Norte | |||||||
| Santos et al.58 | Público | Transversal | n=23.961 | Idade materna | ≥ 4.000g, sem referência | < 20 anos: 3,8% 20‐29 anos: 7,7% ≥ 30 anos: 11,8% Prevalência total: 6,8% | Maior prevalência de RN ≥ 4.000g com o aumento da idade (p < 0,001)a |
| Região Nordeste | |||||||
| Lima and Sampaio60 | Público | Transversal | n=277 | Idade materna, estado civil, escolaridade, renda per capita, paridade, intervalo interpartal, frequência ao pré‐natal e estatura materna. | ≥4.000g, Puffer and Serrano,86 PAHO | 5,4% | Associação entre peso ao nascer ≥ 4.000g e estatura materna > 1,50m (p = 0,001) |
| Amorim et al. 43 | Público | Transversal | n=551 | Idade materna, paridade, sobrepeso/obesidade pré‐gestacional, ganho ponderal excessivo, sobrepeso/obesidade na última consulta, hipertensão, DM (qualquer forma), pré‐eclâmpsia, DMG | Macrossomia; ≥ 4.000g, WHO82 | 5,4% | Macrossomia foi associada a qualquer forma de DM (risco ajustado = 17,7; IC 95% = 4,8‐64,9) e GPG excessivo (risco ajustado = 6,1; IC 95% = 2,7‐13,7) |
| Santos et al. 34 | Público | Coorte | n = 204 | GPG e anemia | GIG: > percentil 90, sem referência | 9,8% | O GPG excessivo (RR = 4,7, IC 95% 1,6‐14,0) e a anemia (RR = 3,4, IC 95% 1,4‐8,1) foram associados a RN GIG |
| Silva and Macedo40 | Público/Privado | Transversal | n = 158 | GPG | Macrossomia ≥ 4.000g, sem referência | 17,8% | Mario frequência de macrossomia em puérperas com ganho ponderal excessivo (p = 0,044) |
| Região Centro‐Oeste | |||||||
| Costa et al.46 | Público | Coorte | n = 200 | GPG | Macrossomia ≥ 4.000g, sem referência | Incidência: 6,5% | Macrossomia foi associada a GPG excessivo (p < 0,01). |
| Regiões Sul, Sudeste, Norte, Nordeste | |||||||
| Nucci et al.51 | Público | Coorte | n = 5564 | IMC pré‐gestacional | Macrossomia: peso > percentil 90, sem referência | Não descrita | Mulheres pré‐obesas e obesas apresentaram maior risco de terem filhos macrossômicos (OR = 1,6, IC 95% 1,3‐ 2,0 e OR = 1,5, IC 95% 1,1‐2,2) |
| Schmidt et al.26 | Público | Coorte | n = 4.977 | DMG | Macrossomia: peso ao nascer ≥ percentil 90da idade gestacional, sem referência | ADA.87 17,7%; WHO.82 14,6% | A DMG prediz um aumento do risco entre 30‐45% do nascimento de RN macrossômicos |
| Drehmer et al. 48 | Público | Coorte | n = 2244 | GP | GIG > percentil 90 em relação à idade gestacional, sem referência | 10,5% | Risco aumentado para GIG em mulheres com GPG excessivo no segundo trimestre (RR = 1,64, IC 95% 1,16‐2,31) e GPG total excessivo (RR = 2,12, IC 95% 1,55‐2,89). |
| Trujillo et al. 56 | Público | Coorte | n = 4926 | DM | GIG > percentil 90, sem referência | 11,8% | Gestantes com DMG apresentaram risco aumentado (RR = 1,27‐1,86) para nascimento de RN GIG, nas classificações de IADPSG e OMS |
ADA, American Diabetes Association; AIG, Adequado para idade gestacional; DM, Diabetes mellitus; DMG, Diabetes mellitus gestacional; GIG, Grande para idade gestacional; IADPSG, The International Association of Diabetes and Pregnancy Study Groups; IB, hiperglicemia diária‐teste de tolerância à glicose (TTG) 100g alterado e perfil glicêmico alterado (PG); IIA, TTG 100g alterado e PG normal; IIB, TTG 100g e PG alterado; IMC, Índice de Massa Corporal; IOM/NRC, Institute of Medicine/National Researche Council; OMS, Organização Mundial da Saúde; PAHO, Pan American Health Organization; Unesp, Universidade Estadual Paulista; PIG, Pequeno para idade gestacional; RNHBPEPWG, Report of the National High Blood Pressure Education Program Working Group on High Blood Pressure in Pregnancy; Sinasc, Sistema Nacional de Nascidos Vivos; SUS, Sistema Único de Saúde; TOTG, Teste Oral de Tolerância à Glicose; WHO, World Health Organization.
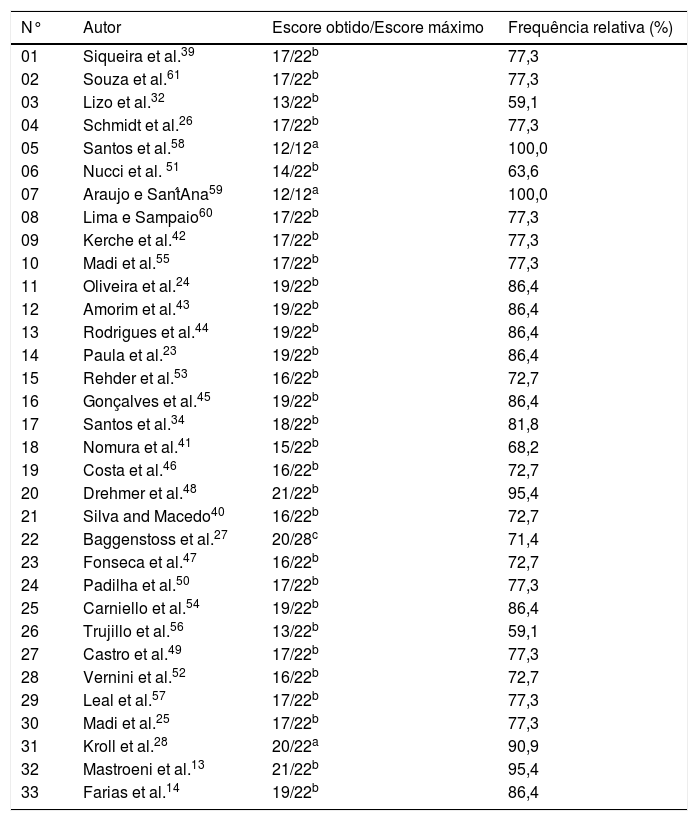
Dois autores (L.F.S., J.M.) se encarregaram de revisar a qualidade metodológica e os riscos de viés de acordo com a escala adaptada de Downs e Black38 (tabela 2), consideraram somente os estudos que se enquadraram nos critérios de inclusão. Um terceiro autor (C.K) avaliou e definiu qualquer discordância. A escala Downs e Black objetiva avaliar estudos não relacionados a ensaios clínicos aleatórios e compreende 27 perguntas/itens aplicáveis para avaliação da qualidade e do viés dos artigos.38 Tais critérios avaliam a qualidade da informação, a validade interna (vieses e fatores de confusão), a validade externa e a capacidade de detecção de efeito significativo do estudo.
Avaliação de risco de viés adaptado de Downs e Black.38
| N° | Autor | Escore obtido/Escore máximo | Frequência relativa (%) |
|---|---|---|---|
| 01 | Siqueira et al.39 | 17/22b | 77,3 |
| 02 | Souza et al.61 | 17/22b | 77,3 |
| 03 | Lizo et al.32 | 13/22b | 59,1 |
| 04 | Schmidt et al.26 | 17/22b | 77,3 |
| 05 | Santos et al.58 | 12/12a | 100,0 |
| 06 | Nucci et al. 51 | 14/22b | 63,6 |
| 07 | Araujo e Sant́Ana59 | 12/12a | 100,0 |
| 08 | Lima e Sampaio60 | 17/22b | 77,3 |
| 09 | Kerche et al.42 | 17/22b | 77,3 |
| 10 | Madi et al.55 | 17/22b | 77,3 |
| 11 | Oliveira et al.24 | 19/22b | 86,4 |
| 12 | Amorim et al.43 | 19/22b | 86,4 |
| 13 | Rodrigues et al.44 | 19/22b | 86,4 |
| 14 | Paula et al.23 | 19/22b | 86,4 |
| 15 | Rehder et al.53 | 16/22b | 72,7 |
| 16 | Gonçalves et al.45 | 19/22b | 86,4 |
| 17 | Santos et al.34 | 18/22b | 81,8 |
| 18 | Nomura et al.41 | 15/22b | 68,2 |
| 19 | Costa et al.46 | 16/22b | 72,7 |
| 20 | Drehmer et al.48 | 21/22b | 95,4 |
| 21 | Silva and Macedo40 | 16/22b | 72,7 |
| 22 | Baggenstoss et al.27 | 20/28c | 71,4 |
| 23 | Fonseca et al.47 | 16/22b | 72,7 |
| 24 | Padilha et al.50 | 17/22b | 77,3 |
| 25 | Carniello et al.54 | 19/22b | 86,4 |
| 26 | Trujillo et al.56 | 13/22b | 59,1 |
| 27 | Castro et al.49 | 17/22b | 77,3 |
| 28 | Vernini et al.52 | 16/22b | 72,7 |
| 29 | Leal et al.57 | 17/22b | 77,3 |
| 30 | Madi et al.25 | 17/22b | 77,3 |
| 31 | Kroll et al.28 | 20/22a | 90,9 |
| 32 | Mastroeni et al.13 | 21/22b | 95,4 |
| 33 | Farias et al.14 | 19/22b | 86,4 |
Para avaliar o risco de viés com os critérios de Downs e Black,38 os artigos foram agrupados em três categorias, cada uma com um escore específico: a) Primeira: estudos transversais do tipo prevalência, com escore máximo de 12; b) Segunda: artigos com delineamento metodológico do tipo transversal e de coorte, com escore máximo de 22; c) Terceira: estudos caso‐controle com intervenção e escore máximo de 28. De forma a garantir a proporção dos resultados entre as categorias, o escore obtido de cada artigo foi dividido pelo escore máximo possível para cada uma das três categorias estabelecidas (tabela 2).
Medidas de associação usadasForam considerados somente artigos que fizeram o teste de proporcionalidade qui‐quadrado ou exato de Fischer para determinar a associação entre excesso de peso ao nascer e os fatores de risco. Quando houve dúvida em relação à análise usada no estudo, os autores foram contatados por e‐mail para que conferissem se os dados estavam corretos. Adicionalmente, também foram consideradas as medidas de odds ratio, risco relativo e razão de prevalência (RP) para avaliar o efeito entre fatores de risco e excesso de peso ao nascer. Quando o estudo não relatou o valor de p referente às análises desenvolvidas, foram usados os intervalos de confiança para descrever se houve significância estatística. Somente variáveis categóricas foram consideradas.
Síntese dos resultadosOptou‐se em não incluir metanálise na revisão sistemática em virtude da heterogeneidade dos dados entre os estudos considerados e dos diferentes métodos estatísticos usados para avaliar risco entre os estudos.
Risco de viés de publicaçãoPara diminuir o risco de viés, a avaliação dos artigos selecionados levou em conta cada fator de risco individualmente segundo a categoria de referência de excesso de peso ao nascer (> 4.000g, ≥ 4.000g, > 90 percentil ou ≥ 90 percentil).
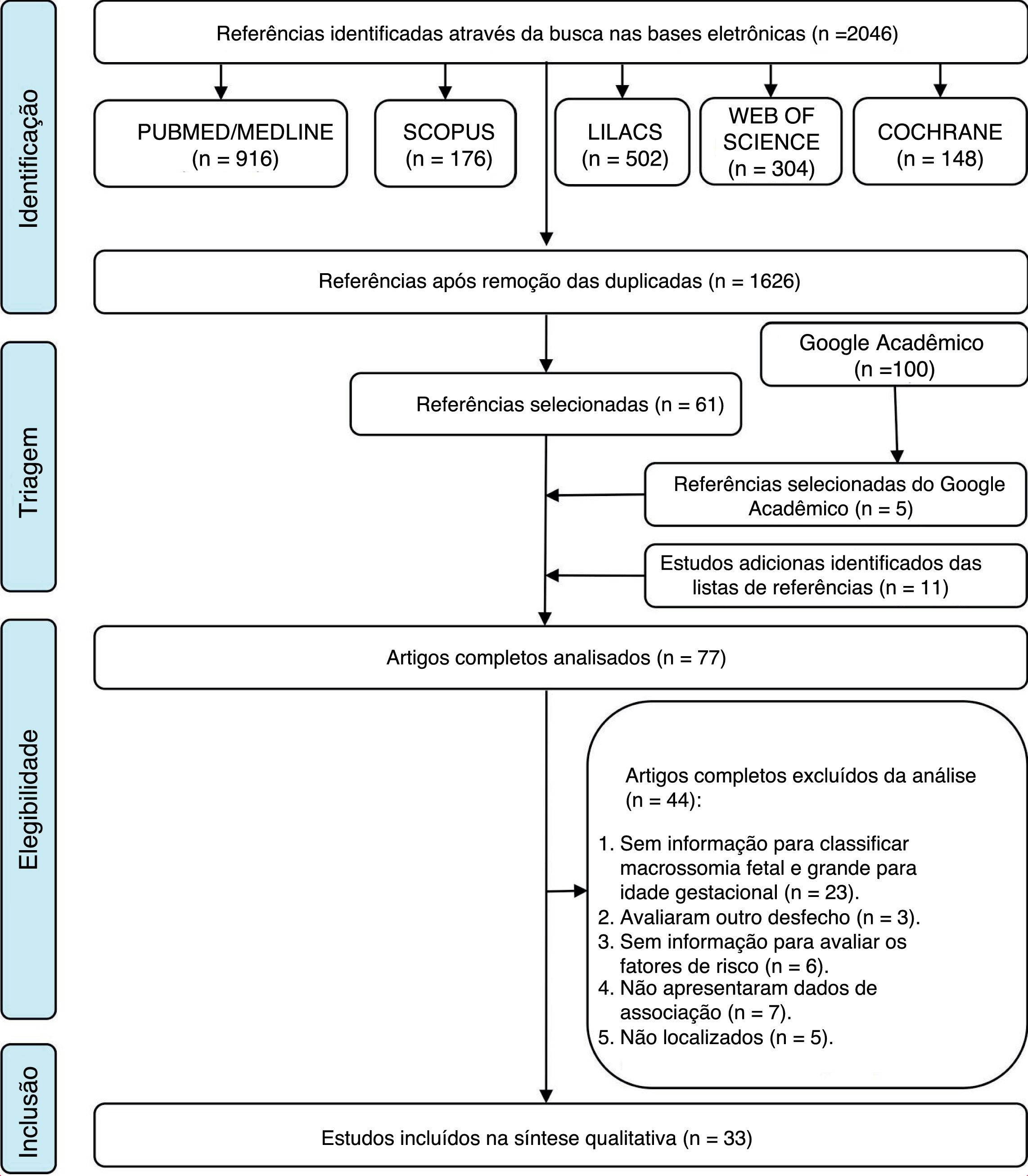
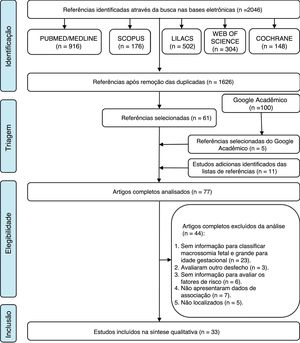
ResultadosSeleção dos estudosForam identificados 2.046 artigos sobre o tema de interesse. Após a remoção de 420 artigos duplicados, restaram 1.626 nos idiomas inglês, português e espanhol. Uma análise abrangente de título e resumo desconsiderou 1.565 artigos, resultou‐se em 61 na primeira etapa do estudo. A partir de uma análise dos 100 primeiros resultados do Google Scholar, foram adicionados cinco artigos e 11 foram adicionados a partir das referências dos artigos previamente selecionados, total de 77 artigos elegíveis para a segunda etapa da revisão.
Na etapa 2 todos os 77 artigos foram lidos por completo e 44 foram excluídos, 23 devido à ausência de dados para a classificação do estado nutricional, três por terem avaliado outro desfecho, seis por não fornecerem dados suficientes para avaliar os fatores de risco, sete por não terem avaliado associação entre o desfecho e os preditores e cinco devido a o artigo completo não ter sido localizado (Apêndice 2). Um fluxograma do processo de identificação, inclusão e exclusão dos estudos é mostrado na figura 1.
Características dos estudosOs estudos usados nesta revisão foram publicados nas quatro últimas décadas (1981‐2017) e conduzidos nas cinco regiões do Brasil. Predominaram estudos conduzidos nas regiões Sudeste (55,0%) e Sul (39,0%). A amostra total incluiu 105.826 recém‐nascidos, a maioria (60,6%) proveniente de estudos de delineamento transversal e 36,4% de estudos de coorte. Grande parte dos estudos usou as classificações de MF ≥ 4.000g (42,5%) ou GIG > 90 percentil (42,5%) para avaliar o estado nutricional do recém‐nascido. A prevalência de macrossomia fetal variou entre 1,74%39 e 17,8%40 e para GIG entre 3,5%41 e 30,1%.42 As características dos estudos incluídos nesta revisão estão demonstradas na tabela 1.
Risco de viés entre os estudosA avaliação da qualidade metodológica e do risco de viés é apresentada na tabela 2. Dos 33 artigos avaliados, obteve‐se um escore médio de 79,6% com escore máximo de 100,0% e mínimo de 59,1%. Vinte artigos apresentaram valores abaixo do escore médio e, portanto, foram considerados com risco de viés e qualidade metodológica reduzida.
Síntese dos resultadosNa tabela 3 estão apresentados os fatores de risco e sua relação com o desfecho avaliado. Foram encontrados 67 fatores de risco para excesso de peso ao nascer nas cinco regiões do país. Desses, 31 foram significativamente associados ao desfecho (tabela 3). Os fatores de risco foram agrupados segundo cinco principais características: a) Biológicas, b) Socioeconômicas, c) Outros fatores de risco, d) Fatores de risco não associados ao excesso de peso ao nascer e e) Região do país (Sul, Sudeste, Norte, Nordeste e Centro‐Oeste).
Fatores de risco associados ao excesso de peso ao nascer no Brasil
| Variáveis | Desfecho | OR, RR ou RP (IC95%) | Variáveis de ajuste | p‐valora | Região | Autor |
|---|---|---|---|---|---|---|
| Ganho de peso gestacional | ||||||
| >12 Kg | ≥ 4.000 g | < 0,001 | SE | Lizo et al.32 | ||
| Excessivo | ≥ 4.000 g | RR=2,80 (0,80‐7,70) | 0,070 | SE | Oliveira et al.24 | |
| Excessivo | ≥ 4.000 g | RP=6,90 (2,90‐16,90) | NE | Amorim et al.43 | ||
| Excessivo | ≥ 4.000 g | <0,001 | NE | Rodrigues et al.44 | ||
| 9‐12 Kg | ≥ 4.000 g | OR=1,30 (0,70‐2,40) | 0,030 | S | Gonçalves et al.45 | |
| 13‐16 Kg | ≥ 4.000 g | OR=1,10 (0,60‐2,30) | 0,030 | S | Gonçalves et al.45 | |
| ≥17 Kg | ≥ 4.000 g | OR=1,70 (0,80‐3,40) | 0,030 | S | Gonçalves et al.45 | |
| Excessivo | ≥ 4.000 g | 0,010 | CE | Costa et al.46 | ||
| Excessivo | ≥ 4.000 g | 0,044 | NE | Silva and Macedo40 | ||
| Excessivo | ≥ 4.000 g | OR=1,75 (0,76‐4,04) | 0,260 | SE | Fonseca et al.47 | |
| >16 Kg | > 90 percentil | OR=1,79 (1,23‐2,60) | 0,020 | SE | Kerche et al.42 | |
| Excessivo | > 90 percentil | RR=4,70 (1,60‐14,00) | 0,009 | NE | Santos et al.34 | |
| Excessivo 2o trimestre | > 90 percentil | RR=1,64 (1,16‐2,31) | S, SE, N, NE | Drehmer et al.48 | ||
| Excessivo | > 90 percentil | RR=2,12 (1,55‐2,89) | S, SE, N, NE | Drehmer et al.48 | ||
| Excessivo | > 90 percentil | OR=0,95 (0,48‐1,86) | Tabagismo, paridade, número de consulta pré‐natal, assistência nutricional | 0,891 | SE | Padilha et al.50 |
| Excessivo | > 90 percentil | RP=2,26 (1,21‐4,24) | Idade materna, renda familiar, IMC pré‐gestacional, GPG, colesterol | 0,011 | SE | Castro et al.49 |
| Excessivo | > 90 percentil | 0,013 | S | Kroll et al.28 | ||
| Excessivo | > 90 percentil | OR=2,11 (1,27‐3,15) | Escolaridade renda familiar, tabagismo durante a gestação, idade do primeiro filho, IMC pré‐gestacional, hemoglobina glicada | S | Mastroeni et al.13 | |
| IMC pré‐gestacional | ||||||
| Pré‐obeso | > 90 percentil | OR=1,61 (1,30‐2,00) | S, SE, N, NE | Nucci et al.51 | ||
| Obeso | > 90 percentil | OR=1,53 (1,08‐2,17) | S, SE, N, NE | Nucci et al.51 | ||
| ≥25 kg/my | >90 percentil | OR=1,83 (1,27‐2,64) | 0,003 | SE | Kerche et al.42 | |
| Sobrepeso/Obesidade | >90 percentil | 0,020 | SE | Nomura et al.41 | ||
| ≥25 kg/m2 | >90 percentil | RP=1,88 (1,05‐3,36) | 0,033 | SE | Castro et al.49 | |
| Obesidade | >90 percentil | 0,021 | SE | Vernini et al.52 | ||
| <25 kg/m2 | >90 percentil | 0,677 | S | Kroll et al.28 | ||
| Sobrepeso | >90 percentil | OR=1,00 (0,54‐1,79) | Escolaridade, renda familiar, tabagismo durante a gestação, idade do primeiro filho, GPG, hemoglobina glicada | S | Mastroeni et al.13 | |
| Obesidade | >90 percentil | OR=1,15 (0,56‐2,36) | Escolaridade, renda familiar, tabagismo durante a gestação, idade do primeiro filho, GPG, hemoglobina glicada | S | Mastroeni et al.13 | |
| ≥25 kg/m2 | >90 percentil | 0,042 | SE | Farias et al.14 | ||
| Sobrepeso/obesidade | ≥ 4.000 g | RR=3,70 (1,80‐9,20) | 0,010 | SE | Oliveira et al.24 | |
| Sobrepeso/obesidade | ≥ 4.000 g | RP=2,80 (1,00‐7,80) | NE | Amorim et al.43 | ||
| Sobrepeso | ≥ 4.000 g | OR= 3,40 (0,40‐26,10) | 0,001 | S | Gonçalves et al.45 | |
| Obesidade | ≥ 4.000 g | OR= 6,70 (0,90‐52,50) | 0,001 | S | Gonçalves et al.45 | |
| Obesidade | ≥ 4.000 g | 0,037 | SE | Vernini et al.52 | ||
| 0Obesidade | ≥ 4.000 g | OR=1,20 (1,44‐2,32) | Desordem hiperglicêmica | <0,010 | S | Madi et al.25 |
| IMC ≥25 Kg/m2na última consulta | ≥ 4.000 g | RP=4,90 (2,00‐12,50) | NE | Amorim et al.43 | ||
| IMC durante a gestação | ||||||
| ≥25 Kg/m2 | >90 percentil | RR=1,90 (1,20‐3,00) | SE | Rehder et al.53 | ||
| Sobrepeso/obesidade | >90 percentil | 0,030 | SE | Carniello et al.54 | ||
| Sobrepeso/obesidade | >90 percentil | 0,340 | S | Leal et al.57 | ||
| ≥25 Kg/m2 | >4.000 g | RR=2,00 (0,90‐4,00) | SE | Rehder et al.53 | ||
| Obesidade no momento do parto | >90 percentil | OR=3,60 (1,10‐11,70) | Tabagismo, diagnóstico de hipertensão arterial, DM, GPG, IMC pré‐gestacional, IMC no fim da gestação, classificação do estado nutricional materno pelo IMC pré‐gestacional e fim da gestação | 0,040 | SE | Nomura et al.41 |
| IMC ≥25 Kg/myno início da gestação | ≥4.000 g | <0,010 | SE | Fonseca et al.47 | ||
| Relação IMC pré‐gestacional e GPG | ||||||
| Baixo peso/normal e GPG excessivo | >90 percentil | OR=2,08 (1,10‐3,95) | Escolaridade, renda familiar, tabagismo durante a gestação, idade do primeiro filho, hemoglobina glicada | S | Mastroeni et al.13 | |
| Sobrepeso e GPG adequado | >90 percentil | OR=0,46 (0,13‐1,64) | Escolaridade, renda familiar, tabagismo durante a gestação, idade do primeiro filho, hemoglobina glicada | S | Mastroeni et al.13 | |
| Sobrepeso e GPG excessivo | >90 percentil | OR=2,54 (1,27‐5,10) | Escolaridade, renda familiar, tabagismo durante a gestação, idade do primeiro filho, hemoglobina glicada | S | Mastroeni et al.13 | |
| Obesidade e GPG adequado | >90 percentil | OR=1,94 (0,72‐5,25) | Escolaridade, renda familiar, tabagismo durante a gestação, idade do primeiro filho, hemoglobina glicada | S | Mastroeni et al.13 | |
| Obesidade e GPG excessivo | >90 percentil | OR=1,54 (0,58‐4,08) | Escolaridade, renda familiar, tabagismo durante a gestação, idade do primeiro filho, hemoglobina glicada | S | Mastroeni et al.13 | |
| Diabetes mellitus | ||||||
| Presente | >90 percentil | 0,050 | SE | Kerche et al.42 | ||
| Presente | >90 percentil | OR=20,2 (5,30‐76,80) | Tabagismo, diagnóstico de hipertensão arterial, DM, GPG, IMC pré‐gestacional, IMC no fim da gestação, classificação do estado nutricional materno pelo IMC pré‐gestacional e fim da gestação | <0,001 | SE | Nomura et al.41 |
| Presente | >90 percentil | 0,580 | S | Kroll et al.28 | ||
| Presente | >90 percentil | OR=1,08 (0,47‐2,51) | S | Mastroeni et al.13 | ||
| Presente | ≥ 4.000 g | OR=4,20 (2,70‐6,40) | <0,050 | S | Madi et al.25 | |
| Presente | ≥ 4.000 g | RP=8,90 (4,10‐19,40) | SE | Amorim et al.43 | ||
| Presença de DMG | ||||||
| ≥90 percentil | ADA, RR=1,29 (0,73‐2,18) | Centro, etnicidade, altura materna, IMC pré‐gestacional, GPG e sexo do RN. | S, SE, N, NE | Schmidt et al.26 | ||
| ≥90 percentil | WHO, RR=1,45 (1,06‐1,95) | Centro, etnicidade, altura materna, IMC pré‐gestacional, GPG e sexo do RN. | S, SE, N, NE | Schmidt et al.26 | ||
| ≥90 percentil | 0,100 | S | Leal et al.57 | |||
| >90 percentil | 0,050 | SE | Kerche et al.42 | |||
| ≥90 percentil | IADPSG, RR=1,40 (1,15‐1,70) | S, SE, N, NE | Trujillo et al.56 | |||
| ≥90 percentil | WHO, RR=1,67 (1,30‐2,15) | S, SE, N, NE | Trujillo et al.56 | |||
| ≥90 percentil | ADA, RR=1,50 (0,95‐2,34) | S, SE, N, NE | Trujillo et al.56 | |||
| ≥ 4.000 g | RP=12,0 (6,0‐24,2) | NE | Amorim et al.43 | |||
| Antecedente de DM | ||||||
| Qualquer | >90 percentil | 0,262 | SE | Kerche et al.42 | ||
| Familiar | >90 percentil | 0,073 | SE | Kerche et al.42 | ||
| Pessoal | >90 percentil | OR=1,56 (1,05‐2,31) | 0,003 | SE | Kerche et al.42 | |
| Obstétrico | >90 percentil | <0,001 | SE | Kerche et al.42 | ||
| Antecedente de DMG | ||||||
| >90 percentil | RR=0,40 (0,10‐2,60) | SE | Rehder et al.53 | |||
| >4.000 g | RR=0,90 (0,10‐6,60) | SE | Rehder et al.53 | |||
| Grupos de Rudge IB, IIA+IIB | >90 percentil | 0,030 | SE | Kerche et al.42 | ||
| Média glicêmica total ≥120 mg/dL | >90 percentil | OR=1,78 (1,13‐2,80) | 0,000 | SE | Kerche et al.42 | |
| Glicemia em jejum (mg/dL) | ||||||
| ≥90 | >90 percentil | 0,069 | SE | Kerche et al.42 | ||
| ≥90 | >90 percentil | RR=1,10 (0,70‐1,70) | SE | Rehder et al.53 | ||
| 80,0‐175,0 | ≥ 4.000 g | RR=1,70 (0,50‐4,80) | 0,380 | SE | Oliveira et al.24 | |
| ≥90 | >4.000 g | RR=0,90 (0,40‐2,00) | SE | Rehder et al.53 | ||
| Glicemia pós‐prandial ≥130 mg/dL | >90 percentil | 0,012 | SE | Kerche et al.42 | ||
| Grupo etário materno (anos) | ||||||
| >35 | >4.000 g | RR=1,00 (0,50‐2,20) | SE | Rehder et al.53 | ||
| 20‐30 | ≥ 4.000 g | <0,001 | NE | Santos et al.58 | ||
| >30 | ≥ 4.000 g | <0,001 | NE | Santos et al.58 | ||
| >30 | ≥ 4.000 g | 0,048 | S | Araujo and Sant́Ana.59 | ||
| 25‐29 | >4.000 g | 0,420 | NE | Lima and Sampaio.60 | ||
| 30‐39 | ≥ 4.000 g | RR=2,40 (0,90‐4,80) | 0,050 | SE | Oliveira et al.24 | |
| ≥25 | ≥ 4.000 g | RP=1,20 (0,60‐2,40) | NE | Amorim et al.43 | ||
| ≥20 | ≥ 4.000 g | <0,001 | SE | Paula et al.23 | ||
| ≥25 | >90 percentil | 0,086 | SE | Kerche et al.42 | ||
| >35 | >90 percentil | RR=1,10 (0,70‐1,80) | SE | Rehder et al.53 | ||
| <20 | >90 percentil | 0,496 | S | Kroll et al.28 | ||
| 20‐30 | >90 percentil | OR=0,73 (0,39‐1,35) | S | Mastroeni et al.13 | ||
| ≥30 | >90 percentil | OR=0,94 (0,47‐1,85) | S | Mastroeni et al.13 | ||
| ≤30 | >90 percentil | 0,545 | SE | Farias et al.14 | ||
| Idade materna | >90 percentil | RP=1,04 (1,0‐1,09) | 0,073 | SE | Castro et al.49 | |
| Paridade (número de filhos) | ||||||
| ≥2 | ≥ 4.000 g | 0,700 | NE | Lima and Sampaio60 | ||
| ≥2 | ≥ 4.000 g | RR=3,80 (1,10‐9,90) | Idade, estado civil, paridade, sexo do RN, IMC pré‐gestacional, GPG | 0,030 | SE | Oliveira et al.24 |
| ≥2 | ≥ 4.000 g | RP=1,00 (0,50‐2,00) | NE | Amorim et al.43 | ||
| ≥3 | >90 percentil | 0,136 | SE | Kerche et al.42 | ||
| 0 | >90 percentil | 0,400 | SE | Nomura et al.41 | ||
| ≥2 | >90 percentil | RP=1,41 (0,72‐2,78) | 0,317 | SE | Castro et al.49 | |
| ≥3 | >90 percentil | OR=1,30 (0,77‐2,19) | S | Mastroeni et al.13 | ||
| ≥1 | >90 percentil | 0,137 | SE | Farias et al.14 | ||
| Sexo da criança | ||||||
| Masculino | >4.000 g | <0,001 | SE | Siqueira et al.39 | ||
| Masculino | ≥ 4.000 g | RR=7,50 (1,00‐37,60) | Idade, estado civil, paridade, sexo do RN, IMC pré‐gestacional, GPG | 0,050 | SE | Oliveira et al.24 |
| Masculino | ≥ 4.000 g | 0,014 | SE | Paula et al.23 | ||
| Feminino | >90 percentil | 0,674 | SE | Castro et al.49 | ||
| Masculino | >90 percentil | 0,269 | S | Kroll et al.28 | ||
| Feminino | >90 percentil | OR=0,93 (0,60‐1,44) | S | Mastroeni et al.13 | ||
| Estatura materna (m) | ||||||
| >1,5 | ≥ 4.000 g | 0,001 | NE | Lima and Sampaio60 | ||
| 1,6‐1,8 | ≥ 4.000 g | RR=1,80 (0,60‐4,80) | 0,280 | SE | Oliveira et al.24 | |
| Macrossomia prévia | ||||||
| >90 percentil | OR=2,37 (1,60‐3,50) | <0,001 | SE | Kerche et al.42 | ||
| >90 percentil | RR=2,00 (1,20‐3,40) | SE | Rehder et al.53 | |||
| >4.000 g | RR=3,20 (1,50‐6,60) | SE | Rehder et al.53 | |||
| Hipertensão arterial | ||||||
| >90 percentil | 0,126 | SE | Kerche et al.42 | |||
| >90 percentil | RR=0,80 (0,50‐1,30) | SE | Rehder et al.53 | |||
| >90 percentil | 0,100 | SE | Nomura et al.41 | |||
| >90 percentil | 0,800 | S | Leal et al.57 | |||
| ≥ 4.000 g | RP=2,90 (1,10‐7,90) | NE | Amorim et al.43 | |||
| >4.000 g | RR=1,60 (0,60‐3,00) | SE | Rehder et al.53 | |||
| Parto cesárea | ||||||
| >90 percentil | 0,100 | SE | Nomura et al.41 | |||
| >90 percentil | 0,023 | S | Kroll et al.28 | |||
| ≥ 4.000 g | <0,001 | SE | Paula et al.23 | |||
| Estado civil | ||||||
| União consensual | ≥ 4.000 g | 0,980 | NE | Lima and Sampaio60 | ||
| Casada | ≥ 4.000 g | RR=3,00 | 0,030 | SE | Oliveira et al.24 | |
| Solteira/outros | ≥ 4.000 g | 0,004 | SE | Paula et al.23 | ||
| Solteira/outros | >90 percentil | RP=0,87 (0,40‐1,87) | 0,717 | SE | Castro et al.49 | |
| Casada | >90 percentil | 0,173 | S | Kroll et al.28 | ||
| Solteira/outros | >90 percentil | OR=0,61 (0,32‐1,16) | S | Mastroeni et al.13 | ||
| Renda per capita <1 SM | ≥ 4.000 g | 0,350 | NE | Lima and Sampaio60 | ||
| Renda familiar total (SM) | ||||||
| ≥1 | ≥ 4.000 g | RR=1,50 (0,50‐4,20) | 0,450 | SE | Oliveira et al.24 | |
| ≥3 | ≥ 4.000 g | 0,447 | S | Kroll et al.28 | ||
| <3 | ≥ 4.000 g | OR=0,73 (0,44‐1,23) | Escolaridade, tabagismo durante a gestação, idade do primeiro filho, hemoglobina glicada | S | Mastroeni et al.13 | |
| Renda familiar total | >90 percentil | RP=1,01 (1,00‐1,01) | Escolaridade, idade materna, IMC pré‐gestacional, GPG, colesterol total | 0,014 | SE | Castro et al.49 |
| Consultas pré‐natal | ||||||
| ≥6 | ≥ 4.000 g | 0,970 | NE | Lima and Sampaio60 | ||
| ≥7 | ≥ 4.000 g | 0,001 | SE | Paula et al.23 | ||
| <6 | >90 percentil | OR=0,69 (0,39‐1,20) | S | Mastroeni et al.13 | ||
| Filiação previdenciária INPS/IPESC | ≥ 4.000 g | <0,01 | S | Souza et al.61 | ||
| Idade do primeiro parto <20 anos | >90 percentil | OR=1,90 (1,14‐3,17) | Escolaridade, renda familiar, tabagismo durante a gestação, hemoglobina glicada | S | Mastroeni et al.13 | |
| Anemia | >90 percentil | RR=3,40 (1,40‐8,10) | 0,040 | S | Gonçalves et al.45 | |
| Escolaridade | ||||||
| <4 anos | ≥ 4.000 g | 0,570 | NE | Lima and Sampaio60 | ||
| ≤4 anos | ≥ 4.000 g | RR=1,80 (0,50‐5,30) | 0,360 | SE | Oliveira et al.24 | |
| Nenhuma | ≥ 4.000 g | 0,661 | SE | Paula et al.23 | ||
| 9‐12 anos | >90 percentil | 0,285 | S | Kroll et al.28 | ||
| <8 anos | >90 percentil | OR=0,62 (0,32‐1,20) | Renda familiar, tabagismo durante a gestação, idade do primeiro filho, hemoglobina glicada | S | Mastroeni et al.13 | |
| >8 anos | >90 percentil | 0,519 | SE | Farias et al.14 | ||
| Intervalo interpartal (anos) | ||||||
| ≥5 | ≥ 4.000 g | 0,660 | NE | Lima and Sampaio60 | ||
| ≥2 | >90 percentil | 0,459 | S | Kroll et al.28 | ||
| Antecedente familiar de macrossomia | ||||||
| >90 percentil | RR=1,50 (0,90‐2,30) | SE | Rehder et al.53 | |||
| >4.000 g | RR=1,00 (0,50‐2,20) | SE | Rehder et al.53 | |||
| Tabagismo | ||||||
| Não | >90 percentil | 0,278 | SE | Kerche et al.42 | ||
| Não | >90 percentil | 0,060 | SE | Nomura et al.41 | ||
| Sim | >90 percentil | RP=0,53 (0,17‐1,66) | Escolaridade, renda familiar, idade do primeiro filho, hemoglobina glicada | S | Mastroeni et al.13 | |
| Sim | >90 percentil | OR=0,64 (0,18‐2,28) | ||||
| Não | >90 percentil | 0,093 | SE | Farias et al.14 | ||
| Tabagismo antes da gestação | ||||||
| Não | >90 percentil | 0,079 | S | Kroll et al.28 | ||
| Sim | >90 percentil | OR=0,58 (0,23‐1,43) | Escolaridade, renda familiar, idade do primeiro filho, hemoglobina glicada | S | Mastroeni et al.13 | |
| Consumo de álcool | ||||||
| Sim | >90 percentil | RP=0,62 (0,23‐1,16) | 0,348 | SE | Castro et al.49 | |
| Não | >90 percentil | 0,806 | SE | Farias et al.14 | ||
| Uso de insulina | >90 percentil | 0,085 | SE | Kerche et al.42 | ||
| Aborto prévio | ≥ 4.000 g | RR=1,02 (0,30‐3,10) | 0,980 | SE | Oliveira et al.24 | |
| Idade gestacional (semanas) | ||||||
| 35‐40 | ≥ 4.000 g | RR=0,90 (0,20‐3,70) | 0,920 | SE | Oliveira et al.24 | |
| ≥42 | ≥ 4.000 g | 0,565 | SE | Paula et al.23 | ||
| Cor da pele branca | ||||||
| ≥ 4.000 g | RR=1,90 (0,60‐5,00) | 0,230 | SE | Oliveira et al.24 | ||
| >90 percentil | 0,500 | SE | Nomura et al.41 | |||
| >90 percentil | RP=1,38 (0,56‐3,35) | 0,481 | SE | Castro et al.49 | ||
| Idade da menarca < 13 anos | ≥ 4.000 g | RR=1,10 (0,40‐3,30) | 0,810 | SE | Oliveira et al.24 | |
| Sedentarismo | ≥ 4.000 g | RR=1,20 (0,20‐3,10) | 0,740 | SE | Oliveira et al.24 | |
| Atividade física pré‐gestacional | >90 percentil | 0,102 | SE | Farias et al.14 | ||
| Pré‐eclâmpsia | ≥ 4.000 g | RP=1,70 (0,60‐4,70) | NE | Amorim et al.43 | ||
| Número de gestações ≥ 3 | ||||||
| >90 percentil | 0,642 | S | Kroll et al.28 | |||
| >90 percentil | OR=1,45 (0,86‐2,43) | S | Mastroeni et al.13 | |||
| Cardiopatia materna | >90 percentil | 0,600 | SE | Nomura et al.41 | ||
| Rotura prematura de membranas | >90 percentil | 0,100 | SE | Nomura et al.41 | ||
| Colagenoses | >90 percentil | 0,700 | SE | Nomura et al.41 | ||
| Consumo energético materno (Kcal) | >90 percentil | RP=1,00 (1,00‐1,00) | 0,842 | SE | Castro et al.49 | |
| Consumo de gordura (mg/1.000 kcal) | ||||||
| Saturada: 4o quartil (11,4‐18,3) | >90 percentil | RP=1,34 (0,71‐2,51) | 0,362 | SE | Castro et al.49 | |
| Monossaturada: 4o quartil (7,7‐20,0) | >90 percentil | RP=1,34 (0,71‐2,51) | 0,362 | SE | Castro et al.49 | |
| Poli‐insaturada: 4o quartil (4,2‐6,8) | >90 percentil | RP=1,48 (0,80‐2,73) | 0,210 | SE | Castro et al.49 | |
| Polimorfismos (Alelo) | ||||||
| Mutante G54D (materno) | >90 percentil | 0,149 | S | Baggenstoss et al.27 | ||
| Mutante ADIPOQ rs2241766 (RN) | >90 percentil | OR=2,01 (0,90‐4,47) | Idade materna, escolaridade, renda familiar, estado civil, GPG, tabagismo antes da gestação, DM, sexo do RN, ADIPOQ rs2241766, LEP rs7799039, FTO rs9939609 | 0,087 | S | Kroll et al.28 |
| Selvagem LEP rs7799039 (RN) | >90 percentil | OR=1,98 (1,05‐3,74) | Idade materna, escolaridade, renda familiar, estado civil, GPG, tabagismo antes da gestação, DM, sexo do RN, ADIPOQ rs2241766, LEP rs7799039, FTO rs9939609 | 0,036 | S | Kroll et al.28 |
| Mutante FTO rs9939609 (RN) | >90 percentil | OR=1,11 (0,59‐2,11) | Idade materna, escolaridade, renda familiar, estado civil, GPG, tabagismo antes da gestação, DM, sexo do RN, ADIPOQ rs2241766, LEP rs7799039, FTO rs9939609 | 0,744 | S | Kroll et al.28 |
| Concentração de colesterol total: mg/1.000kcal. 4o quartil (183,5‐466,7) | >90 percentil | RP=2,48 (1,31‐4,66) | Idade materna, renda familiar, IMC pré‐gestacional, GPG, colesterol total | 0,005 | SE | Castro et al.49 |
| Concentração de colesterol HDL‐c segundo a idade gestacional | >90 percentil | OR=0,02 (0,00‐0,88) | Log de triglicerídeos, leptina e adiponectina, idade materna, educação, paridade, atividade física pré‐gestacional, glicemia, GPG e IMC no início da gestação | 0,043 | SE | Farias et al.14 |
| Concentração de colesterol LDL‐c segundo a idade gestacional | >90 percentil | OR=1,52 (0,80‐2,88) | Log de triglicerídeos, leptina e adiponectina, idade materna, educação, paridade, atividade física pré‐gestacional, glicemia, GPG e IMC no início da gestação | 0,203 | SE | Farias et al.14 |
| Concentração de triglicerídeos segundo a idade gestacional | >90 percentil | OR=1,0e+43 (0,00‐9,5e+88) | Log de triglicerídeos, leptina e adiponectina, idade materna, educação, paridade, atividade física pré‐gestacional, glicemia, GPG e IMC no início da gestação | 0,067 | SE | Farias et al.14 |
| Log da concentração de leptina no primeiro trimestre da gestação | >90 percentil | OR=3,92 (1,18‐12,95) | Log de triglicerídeos, leptina e adiponectina, idade materna, educação, paridade, atividade física pré‐gestacional, glicemia, GPG e IMC no início da gestação | 0,025 | SE | Farias et al.14 |
| Log da concentração de adiponectina no primeiro trimestre da gestação | >90 percentil | OR=0,54 (0,16‐1,83) | Log de triglicerídeos, leptina e adiponectina, idade materna, educação, paridade, atividade física pré‐gestacional, glicemia, GPG e IMC no início da gestação | 0,321 | SE | Farias et al.14 |
| Presença de infecção urinária | >90 percentil | 0,220 | S | Leal et al.57 | ||
| Presença de infecção por doença sexualmente transmissível | >90 percentil | 0,370 | S | Leal et al.57 | ||
Valor de p proveniente do teste de qui‐quadrado. Quando presente valor de p para OR, RR ou RP, o mesmo foi adicionado.
ADA, American Diabetes Association; CE, Centro‐Oeste; DM, diabetes mellitus; DMG, diabetes mellitus gestacional; GPG, ganho de peso gestacional; HDL, High Density Lipoprotein cholesterol; IADPSG, Association of Diabetes in Pregnancy Study Groups; IB, hiperglicemia diária TTG 100g normal e perfil glicêmico alterado; IIA, TTG 100g alterado e PG normal; IIB, TTG 100g e PG alterados; IMC, índice de massa corporal; LDL, Low Density Lipoprotein cholesterol; N, Norte; NE, Nordeste; OR, odds ratio; PG, perfil glicêmico; RN, recém‐nascido; RP, razão de prevalência; RR, risco relativo; S, Sul; SE, Sudeste; TTG, teste de tolerância à glicose; WHO, World and Health Organization.
Dos 15 estudos que avaliaram o GPG excessivo como fator de risco para excesso de peso ao nascer,13,24,28,32,34,40,42–50 apenas três demonstraram que o GPG excessivo não foi associado ao excesso de peso ao nascer.24,47,50
IMC pré‐gestacionalDoze estudos investigaram IMC pré‐gestacional como fator de risco para o excesso de peso ao nascer.13,14,24,25,28,41–43,45,49,51,52 Desses, dois não encontraram relação significativa com o desfecho avaliado.13,28 Adicionalmente, excesso de peso na última consulta,43 excesso de peso durante a gestação,53,54 obesidade no momento do parto,41 excesso de peso no início da gestação47 e relação entre sobrepeso pré‐gestacional e GPG excessivo13 também demonstraram estar associados com o excesso de peso ao nascer.
Diabetes mellitusDos seis estudos13,28,41–43,55 que investigaram a associação de DM no estado nutricional de recém‐nascidos, três revelaram associação significativa entre a presença de DM e excesso de peso ao nascer.41,43,55 Em relação à DM gestacional (DMG), três26,43,56 de cinco estudos26,42,43,56,57 mostraram associação significativa entre a presença de DMG e excesso de peso ao nascer. Somente um estudo demonstrou haver associação significativa entre os fatores de risco: 1) histórico familiar e obstétrico de DM, 2) índice glicêmico (média glicêmica total ≥ 120mg/dL e glicemia pós‐prandial ≥ 130mg/dL) e 3) classificação de Rudge (IB ou IIA+IIB) com excesso de peso ao nascer.42
Idade maternaTreze estudos avaliaram a relação entre idade materna e estado nutricional ao nascer.13,14,23,24,28,42,43,49,53,58–60 Desses, três revelaram que a idade materna foi significativamente associada ao excesso de peso ao nascer: ≥ 20 anos,23 20‐30 anos58 e > 30 anos.58,59
ParidadeOito estudos investigaram a relação entre paridade e estado nutricional13,14,24,41–43,49,60 e somente um estudo mostrou que mães com dois filhos ou mais foram significativamente associadas ao excesso de peso ao nascer.24
Sexo da criançaSeis estudos13,23,24,28,39,49 investigaram a relação entre sexo e estado nutricional ao nascer. Desses, dois mostraram que sexo masculino e excesso de peso ao nascer foram significativamente associados.24,39
Estatura maternaApenas um60 dos dois estudos24,60 que investigaram estatura materna e estado nutricional mostrou que mulheres com estatura > 1,5 m foram significativamente associadas ao excesso de peso ao nascer.
Histórico de macrossomia fetalDois estudos mostraram associação significativa entre histórico de macrossomia fetal e excesso de peso ao nascer.42,53
Hipertensão arterial (HA)Cinco estudos avaliaram a relação entre HA e estado nutricional42,43,53,57 e apenas um revelou existir associação significativa entre a presença de HA e excesso de peso ao nascer.43
Tipo de partoTrês estudos23,28,41 investigaram a associação entre tipo de parto e estado nutricional ao nascer e dois mostraram que o tipo de parto cesárea e excesso de peso ao nascer foram significativamente associados.23,28
Características socioeconômicasEstado civilSeis estudos13,23,24,28,49,60 avaliaram a relação entre estado civil e estado nutricional ao nascer. Dois revelaram que o excesso de peso ao nascer foi significativamente associado ao estado civil casada24 e solteira/viúva/divorciada.23
Renda familiarSomente um49 dos quatro estudos13,24,28,49 revelou que aumento da renda familiar foi significativamente associado ao excesso de peso ao nascer.
Consultas pré‐natalDe três estudos13,23,60 que envolveram o número de consultas pré‐natal, apenas um23 mostrou que sete ou mais consultas pré‐natais foram significativamente associadas ao excesso de peso ao nascer.
Outras características associadas ao excesso de peso ao nascerAs características segunda classe de filiação previdenciária (INPS/Ipesc),61 idade do primeiro parto < 20 anos,13 presença de anemia durante a gestação,45 recém‐nascidos que apresentaram o genótipo selvagem (“GG”) do polimorfismo do gene LEP‐rs7799039,28 concentrações de colesterol total entre 183,5 e 466,7mg/1,000kcal49 e baixos níveis de HDL‐c elevados níveis de leptina maternos14 foram significativamente associados ao excesso de peso ao nascer.
Características não associadas ao excesso de peso ao nascerAs características a seguir não se mostraram significativamente associadas ao excesso de peso ao nascer: escolaridade materna,13,14,23,24,28,60 renda per capita,60 intervalo interpartal,28,60 histórico familiar de DM,42 histórico pessoal de DMG,53 histórico familiar de macrossomia fetal,53 tabagismo antes e durante a gestação,13,14,28,41,42 consumo de bebida alcoólica,14,49 glicemia em jejum,24,42,53 uso de insulina,42 aborto prévio,24 idade gestacional,23,24 cor da pele,24,41,49 idade da menarca,24 atividade física durante e antes da gestação,14,24 pré‐eclâmpsia,43 número de gestações,13,28 cardiopatia materna, rotura prematura de membranas e colagenoses,41 consumo energético (Kcal), consumo de gordura saturada, monossaturada e poli‐insaturada maternos,49 polimorfismos G54D materno, ADIPOQ rs2241766 e FTO rs9939609 no recém‐nascido,27,28 níveis de LDL‐c, triglicerídeos e adiponectina maternos14 e infecção urinária/infecção por doença sexualmente transmissível.57
Região do país (Sul, Sudeste, Norte, Nordeste e Centro‐Oeste)Os 67 fatores de risco descritos foram relatados por estudos desenvolvidos nas cinco regiões do país. No entanto, as regiões Sul e Sudeste foram as que apresentaram maior número de estudos (n = 23; 69,7%) e, consequentemente, maior número de fatores de risco associados ao excesso de peso ao nascer. Na Região Centro‐Oeste, somente um estudo foi desenvolvido (3,0%) e cinco (15,2%) foram desenvolvidos nas regiões Norte/Nordeste. Finalmente, quatro (12,1%) dos 33 estudos foram desenvolvidos com bases de dados de quatro regiões: Sul, Sudeste, Norte e Nordeste.
DiscussãoNeste estudo pioneiro de revisão sistemática que envolveu somente artigos desenvolvidos com a população brasileira foram investigados 33 estudos e encontrados 67 fatores de risco para excesso de peso ao nascer, dos quais 31 mostraram‐se significativamente associados ao desfecho. Os 33 estudos foram encontrados nas cinco regiões do Brasil. Entre os fatores de risco biológicos, o GPG, o IMC pré‐gestacional e o DM revelaram‐se os principais preditores do excesso de peso ao nascer, corroboram o encontrado em estudos de outros países.62–64
O Brasil é um país de dimensões continentais, tem mais de 200 milhões de habitantes distribuídos desigualmente em cinco regiões geográficas. Acreditamos que essas características influenciem os diferentes fatores de risco para o nascimento de crianças com excesso de peso corporal. Tais fatores incluem características culturais, distribuição de recursos do governo federal/estadual, disponibilidade de alimentos mais saudáveis, acesso ao sistema de saúde (público/privado), renda e educação. Notoriamente, todos esses fatores têm sido mais proeminentes nas regiões Sul e Sudeste, as duas mais ricas do país.65,66 Ainda que neste estudo não seja possível determinar o efeito da região no desenvolvimento do excesso de peso ao nascer, o GPG foi o único fator de risco identificado nas cinco regiões do país. Em relação ao IMC pré‐gestacional e ao DM, os mesmos foram identificados em todas as regiões, exceto a Centro‐Oeste.
No que tange ao tipo de sistema de saúde descrito nos estudos investigados, público ou privado, a grande maioria (90,9%) foi feita no sistema público. Entretanto, em virtude da desigualdade regional dos estudos trabalhados nesta revisão, não é possível fazer qualquer análise sobre o sistema de saúde usado pela população.
Descrever e avaliar o efeito de fatores que levam ao excesso de peso ao nascer em diferentes culturas e populações é fundamental para prevenir o potencial estabelecimento de doenças não transmissíveis na criança ao longo da vida. Alguns estudos têm demonstrado que os efeitos negativos do excesso de peso ao nascer, tanto na fase infantil como na adolescência e na vida adulta, têm contribuído de forma significativa para o desenvolvimento de diversas comorbidades crônicas não transmissíveis, como obesidade mórbida, DM, neoplasias e doenças cardiovasculares.67,68 Esses resultados evidenciam que o acompanhamento da mãe no período gestacional é uma estratégia obrigatória para evitar o desenvolvimento dessas doenças.
O estabelecimento de um quadro onde a mãe apresenta excesso de peso pré‐gestacional, GPG excessivo e DM parece estar relacionado a dificuldades na implantação das políticas públicas de saúde direcionadas ao monitoramento da mulher antes e durante a gestação. O interessante é que esses fatores podem ser modificados antes e ao longo do período gestacional,69,70 e refletem a complexa condição sociodemográfica, econômica, política e cultural característica de cada país e entre as diferentes regiões de um país.33,65,71
Desde a década de 90 do século passado o Brasil tem atravessado um período de intensa transição nutricional, caracterizado pela redução da prevalência de desnutrição infantil e aumento da prevalência de obesidade em diferentes faixas etárias.10,72 Entre os principais fatores propulsores da transição nutricional destaca‐se o padrão nutricional da população, resultado de mudanças na dieta dos indivíduos.24,73 Essa mudança no hábito alimentar dos brasileiros inclui a adoção de uma dieta rica em gorduras, açúcar e alimentos refinados e redução no consumo de carboidratos complexos e de fibras.24,74 Junto ao declínio progressivo da atividade física e incentivado principalmente pelo uso excessivo de equipamentos eletrônicos, o predomínio de um estilo de vida sedentário tem contribuído substancialmente para o aumento da obesidade no país.24,73 Adicionalmente, a redução do tamanho da família, o aumento da disponibilidade de alimentos, a maior concentração de pessoas na área urbana, onde gastam menos energia e têm acesso a variados tipos de alimentos industrializados,24,75 e o incremento de benefícios sociais são aspectos que influenciam o processo de transição nutricional no Brasil.
Estudos desenvolvidos no Brasil e em outros países têm revelado que o constante e adequado monitoramento/intervenção multidisciplinar da gestante e de mulheres em idade reprodutiva com excesso de peso corporal é uma medida preventiva simples, específica de atenção primária à saúde e fundamental para minimizar os efeitos negativos do excesso de peso ao nascer no par mãe‐criança.69,76 Além de prevenir o nascimento de crianças macrossômicas, favorecer o parto natural e evitar diversos outros problemas oriundos de uma criança GIG no parto, a prática monitorada de atividade física e/ou dieta são intervenções possíveis de ser adotadas para evitar o ganho excessivo durante a gestação.69 No entanto, o Brasil parece não conseguir evitar o avanço do sobrepeso/obesidade no país. Dados do Instituto Brasileiro de Geografia e Estatística (IBGE) mostram que entre 1979 e 2009 a prevalência de sobrepeso e obesidade em mulheres adultas aumentou de 28,7% para 48,0% e de 8,0% para 16,9%, respectivamente.77 No mesmo período, a prevalência de obesidade em crianças de 5‐9 anos aumentou de 2,4% para 14,2%,77 revelou‐se o desafio de impedir o avanço de um quadro obesogênico da população.
Em contrapartida, alguns autores revelaram resultados promissores quanto à alteração do estilo de vida da população brasileira. O aumento de 33,0% para 35,2% no consumo de frutas e hortaliças entre 2008 a 2016 em adultos sugere uma potencial alteração na dieta da população brasileira.75 A frequência no consumo regular de frutas e hortaliças em 2016 foi superior nas mulheres (40,7%), quando comparada com a dos homens (28,8%).75 No mesmo período, em ambos os sexos o consumo regular de frutas e hortaliças aumentou com a idade e com a escolaridade.75 No que tange à prática de atividade física no tempo livre, houve aumento de 30,3% em 2009 para 37,6% em 2016 na população adulta, sugeriu‐se, também, uma possível alteração no estilo de vida da população.75
É imprescindível que as políticas públicas voltadas para o controle/monitoramento da saúde da mulher levem em consideração, também, as condições culturais, sociodemográficas, econômicas e até mesmo regionais do país. Muitas vezes a influência cultural dos parentes e amigos próximos podem ser determinantes no estado nutricional do par mãe‐criança. É fundamental envolver os parentes nas estratégias de melhoria da qualidade de vida da família, principalmente no que se refere à prática regular de atividade física e dieta adequadas.13
Do ponto de vista da saúde pública parece evidente que assistência primária à saúde e seu constante monitoramento devem ser oferecidos às mulheres antes, durante e após o período gestacional. Mesmo que a mulher inicie a gestação com IMC pré‐gestacional excessivo, intervenções para retornar ao estado nutricional adequado são mais efetivas quando feitas nos primeiros meses da gestação, momento em que a adesão à prática regular de atividade física e o controle da dieta tornam‐se mais eficientes. Caso o ganho de peso excessivo ocorra durante a gestação, estratégias específicas e com acompanhamento de uma equipe multidisciplinar tornam possível adequar o peso da mulher de forma a evitar o estabelecimento de potenciais comorbidades e o nascimento de crianças com excesso de peso ao nascer. O sucesso de uma intervenção direcionada à melhoria do estado nutricional da mãe durante qualquer momento de sua gestão está diretamente associado ao envolvimento da família, e não à mãe isoladamente.
Entre os pontos fortes deste estudo destacam‐se a extensa revisão de literatura que envolveu cinco bases de dados e incluiu estudos de corte transversal e longitudinal. A revisão não se limitou a idioma e ano de publicação e dessa forma abrangeu quatro décadas. Outro ponto a ser destacado refere‐se à organização dos dados, os quais foram apresentados de forma a diminuir a heterogeneidade entre os estudos e facilitar a análise. Finalmente, por ser o primeiro estudo de revisão sistemática a descrever diversos fatores de risco para excesso de peso ao nascer em crianças brasileiras, contribuirá substancialmente para a elaboração de políticas públicas voltadas para a melhoria da qualidade de vida ao nascer.
Algumas limitações para a condução desta revisão sistemática devem ser consideradas. Primeiro, os diferentes padrões de referência78–87 para excesso de peso ao nascer adotados pelos estudos dificultaram a comparação dos dados, limitaram até mesmo uma análise mais substancial dos dados, como a metanálise. Segundo, a ausência do critério de referência para a classificação do estado nutricional em alguns artigos impossibilitou identificar exatamente quantas e quais definições foram usadas. Essa é uma questão importante, visto que alguns países usam o próprio critério de classificação e, portanto, deve‐se ter cautela na comparação entre os estudos. Terceiro, os diferentes critérios adotados para avaliar a associação/relação (qui‐quadrado, RR, RP, OR) entre a variável desfecho e os preditores dos estudos dificultaram a comparação dos resultados, visto que a magnitude de cada critério adotado não é a mesma. Quarta, a impossibilidade de desenvolver uma metanálise em nosso estudo nos impediu de avaliar o efeito da região nos diferentes fatores de risco identificados. A grande maioria dos estudos incluídos na revisão foi conduzida nas regiões Sul e Sudeste, justamente por serem regiões onde a distribuição de recursos para ensino e pesquisa ainda é maior. Nesse sentido, os dados apresentados podem não refletir exatamente as características das outras regiões (Norte, Nordeste e Centro‐Oeste). Finalmente, a ausência de uma única ferramenta capaz de avaliar o risco de viés nos diferentes delineamentos de estudos também dificultou a análise de viés entre os estudos.
Considerações finaisGanho de peso gestacional, IMC pré‐gestacional e DM revelaram‐se os principais preditores do excesso de peso ao nascer em crianças brasileiras. O fator determinante para garantir o estabelecimento de um estado nutricional adequado no período gestacional e mesmo após o parto parece ser a qualidade e a frequência do acompanhamento dos órgãos de saúde junto às mães e a seus filhos. Cabe lembrar que os dados apresentados e discutidos nesta revisão foram baseados nos 33 estudos identificados. A desproporcional distribuição desses estudos segundo a região não permite generalizar os resultados para todo o país.
FinanciamentoCoordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes); Fundo de Apoio à Pesquisa da Universidade da Região de Joinville.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
| Base de dados | Busca |
|---|---|
| PubMed/Medline (26/06/2017) | (((((((((((((“birth weight”[Title/Abstract]) OR “large for gestational age”[Title/Abstract]) OR “LGA”[Title/Abstract]) OR fetal macrosomia[Title/Abstract]) OR obesity[Title/Abstract]) OR overweight[Title/Abstract]) OR “Body mass index‐for‐age”[Title/Abstract]) OR “BMI‐for‐age”[Title/Abstract])) AND ((((((((newborn) OR neonate) OR infant) OR offspring) OR baby) OR babies) OR child) OR children)) AND ((((((((((((((((((((((((((((((((“pre‐pregnancy bmi”) OR “maternal bmi”) OR “gestational weight gain”) OR “type of delivery”) OR “cesarean section”) OR “caesarian section”) OR “caesarean”) OR “surgical delivery”) OR “c‐section”) OR parity) OR pregnancies) OR “pre natal visits”) OR “pre natal care”) OR “delivery time interval”) OR diabetes) OR hypertension) OR preeclampsia) OR smoking) OR “smoking during pregnancy”) OR “smoking before pregnancy”) OR smoke) OR “maternal age”) OR “mother age”) OR “education”) OR “marital status”) OR “household income”) OR “family income”) OR “wage”) OR “working”) OR “studying”)) OR ((((determinants) OR “risk of”) OR “risk for”) OR “risk factors”) OR predictor)) (AND ((brazil[Title/Abstract]) OR brazilian[Title/Abstract]))))) |
| Cochranea, Scopusa,b, Web of Scienceb (26/06/2017) | (“birth weight” OR “large for gestational age” OR “LGA” OR fetal macrosomia OR obesity OR overweight OR “Body mass index‐for‐age” OR “BMI‐for‐age”) AND (newborn OR neonate OR infant OR offspring OR baby OR babies OR child OR children) AND (“pre‐pregnancy bmi” OR “maternal bmi” OR “gestational weight gain” OR “type of delivery” OR “cesarean section” OR “caesarian section” OR “caesarean” OR “surgical delivery” OR “c‐section” OR parity OR pregnancies OR “pre natal visits” OR “pre natal care” OR “delivery time interval” OR diabetes OR hypertension OR preeclampsia OR smoking OR “smoking during pregnancy” OR “smoking before pregnancy” OR smoke OR “maternal age” OR “mother age” OR education OR “marital status” OR “household income” OR “family income” OR “wage” OR “working” OR “studying” OR determinants OR “risk of” OR “risk for” OR “risk factors” OR predictor) AND (Brazil OR Brazilian) |
| Lilacs (26/06/2017) | “birth weight” OR “large for gestational age” OR “LGA” OR fetal macrosomia OR obesity OR overweight OR “Body mass index‐for‐age” OR “BMI‐for‐age” OR “peso ao nascer” OR “grande para a idade gestacional” OR “GIG” OR macrossomia fetal OR obesidade OR “excesso de peso” OR sobrepeso OR “IMC por idade” OR “índice de massa corporal por idade” OR “peso al nacer” OR “grande para la edad gestacional” OR “GEG” OR obesidad OR “IMC por edad” OR “indice de masa corporal por edad” AND newborn OR neonate OR infant OR offspring OR baby OR babies OR child OR children OR “recém‐nascido” OR neonate OR infantil OR filho OR bebê OR bebês OR criança OR crianças OR “recién nacido” OR hijos OR bebé OR bebés OR niño OR niños AND “pre‐pregnancy bmi” OR “maternal bmi” OR “gestational weight gain” OR “type of delivery” OR “cesarean section” OR “caesarian section” OR “caesarean” OR “surgical delivery” OR “c‐section” OR parity OR pregnancies OR “pre natal visits” OR “pre natal care” OR “delivery time interval” OR diabetes OR hypertension OR preeclampsia OR smoking OR “smoking during pregnancy” OR “smoking before pregnancy” OR smoke OR “maternal age” OR “mother age” OR “education” OR “marital status” OR “household income” OR “family income” OR “wage” OR “working” OR “studying” OR determinants OR “risk of” OR “risk for” OR “risk factors” OR predictor OR “IMC pré‐gestacional” OR “IMC materno” OR “ganho de peso gestacional” OR “tipo de parto” OR “parto cesárea” OR “cesárea” OR “cesariana” OR paridade OR gravidez OR “visita pré‐natal” OR “cuidado pré‐natal” OR “interval interpartal” OR hipertensão OR pré‐eclâmpsia OR fumar OR “fumar antes da gravidez” OR “fumar durante a gravidez” OR “fumar antes da gestação” OR “fumar durante a gestação” OR “idade materna” OR “idade da mãe” OR “educação” OR “estado civil” OR “renda familiar” OR renda OR salário OR trabalho OR estudo OR determinantes OR “risco de” OR “risco para” OR “fatores de risco” OR preditores OR “IMC pre‐gestacional” OR “aumento de peso gestacional” OR embarazo OR paridad OR “visitas prenatales” OR “cuidado prenatal” OR hipertensión OR “fumar antes de la gestación” OR “fumar durante la gestación” OR “edad materna” OR “edad de la madre” OR educación OR “renta familiar” OR salario OR trabajo OR estudio OR “riesgo” OR “riesgo de” OR “riesgo para” OR “factores de riesgo” OR predictor AND Brazil OR Brazilian OR Brasil OR brasileiro OR brasileira OR brasileño (without patents or citations) |
| Google Scholar (26/06/2017) | “birth weight” AND ”risk factors” AND Brazil |
Motivos: (n = 44):
- 1.
Sem informação para classificar macrossomia fetal e grande para idade gestacional (n = 23).
- 2.
Avaliaram outro desfecho (n = 3).
- 3.
Sem informação para avaliar os fatores de risco (n = 6).
- 4.
Não apresentaram dados de associação (n = 7).
- 5.
Artigo completo não localizado (n = 5).
| N° | Autor (ano) | Motivo |
|---|---|---|
| 01 | Souza1 | 5 |
| 02 | Hofmeister2 | 5 |
| 03 | Silva et al.3 | 1 |
| 04 | Piloto et al.4 | 5 |
| 05 | Halpern et al.5 | 1 |
| 06 | Guerra e Medeiros Filho6 | 5 |
| 07 | Kac e Velásquez‐Meléndez7 | 5 |
| 08 | Rocha et al.8 | 1 |
| 09 | do Carmo Leal et al.9 | 1 |
| 10 | Cecatti et al.10 | 1 |
| 11 | Koifman e Pombo‐de‐Oliveira11 | 4 |
| 12 | Antonio et al.12 | 1 |
| 13 | Carvalho Padilha et al.13 | 1 |
| 14 | Kac et al.14 | 1 |
| 15 | Tavares et al.15 | 3 |
| 16 | De Jesus et al.16 | 1 |
| 17 | Sass et al.17 | 2 |
| 18 | Braga et al.18 | 4 |
| 19 | Cidade et al.19 | 3 |
| 20 | Cocetti et al.20 | 1 |
| 21 | Kac et al.21 | 1 |
| 22 | Moreira et al.22 | 4 |
| 23 | Cisneiros et al.23 | 1 |
| 24 | Addo et al.24 | 1 |
| 25 | Vieira et al.25 | 1 |
| 26 | Viana et al.26 | 2 |
| 27 | Calderon et al.27 | 1 |
| 28 | Woodhouse et al.28 | 1 |
| 29 | Barbosa et al.29 | 1 |
| 30 | Castillo et al.30 | 3 |
| 31 | Coelho et al.31 | 4 |
| 32 | Costa e Silva et al.32 | 1 |
| 33 | Portela et al.33 | 1 |
| 34 | Ramos et al.34 | 1 |
| 35 | Silva et al.35 | 1 |
| 36 | Zanrosso et al.36 | 1 |
| 37 | Toro‐Ramos et al.37 | 1 |
| 38 | Castro et al.38 | 3 |
| 39 | Sirimarco et al.39 | 2 |
| 40 | Oliveira et al.40 | 4 |
| 41 | Siqueira et al.41 | 4 |
| 42 | Melo et al.42 | 4 |
| 43 | Silva et al.43 | 3 |
| 44 | Paiva et al.44 | 3 |
Referências.
1. Souza MdGdF Peso ao nascer: avaliaçäo dos efeitos de variáveis biológicas e sócio‐culturais, em uma amostra de Salvador, BA. 1982;<74>‐<74>.
2. Hofmeister VA Incidência e consequências fetais da hipertensäo arterial na gravidez: estudo de 1.687 gestaçöes. 1983;<119>‐<119>.
3. Silva AAMd, Gomes UA, Bettiol H, Dal Bo CM, Mucillo G, Barbieri MA Associaçäo entre idade, classe social e hábito de fumar maternos com peso ao nascer. Rev Saude Publica. 1992;26:150‐4.
4. Piloto RF, Magna LA, Beiguelman B Factors influencing human birth weight in normal pregnancy: a prospective study in a brazilian university hospital. Rev bras genét. 1993;16:457‐69.
5. Halpern R, Barros FC, Victora CG, Tomasi E [Prenatal care in Pelotas, Rio Grande do Sul, Brazil, 1993]. Cad Saude Publica. 1998;14:487‐92.
6. Guerra AQS, Medeiros Filho JGd Avaliaçäo nutricional da gestante e suas repercussöes sobre o peso do recém‐nascido. Rev bras cienc saude. 2001;5:9‐22.
7. Kac G, Velásquez‐Meléndez G. Gestational weight gain and macrosomia in a cohort of mothers and their children. J Pediatr (Rio J). 2005;81:47‐53.
8. Rocha DDS Netto MP, Priore SE, De Lima NM, Rosado LE, Franceschini SD Nutritional status and iron‐deficiency anemia in pregnant women: Relationship with the weight of the child at birth. Revista de Nutricao. 2005;18:481‐9.
9. do Carmo Leal M, da Gama SG, da Cunha CB [Consequences of sociodemographic inequalities on birth weight]. Rev Saude Publica. 2006;40:466‐73.
10. Cecatti JG, Correa‐Silva EP, Milanez H, Morais SS, Souza JP. The associations between inter‐pregnancy interval and maternal and neonatal outcomes in Brazil. Matern Child Health J. 2008;12:275‐81.
11. Koifman S, Pombo‐de‐Oliveira MS. High birth weight as an important risk factor for infant leukemia. Br J Cancer. 2008;98:664‐7.
12. Antonio MA, Zanolli Mde L, Carniel Ede F, Morcillo AM. [Factors associated with insufficient birth weight]. Rev Assoc Med Bras (1992). 2009;55:153‐7.
13. Carvalho Padilha PD, Accioly E, Chagas C, Portela E, Da Silva CL, Saunders C Birth weight variation according to maternal characteristics and gestational weight gain in Brazilian women. Nutr Hosp. 2009;24:207‐12.
14. Kac G, Nucci LB, Spyrides MH, Duncan BB, Schmidt MI Evaluation of the ability of a Latin‐American gestational weight curve to predict adverse pregnancy outcomes. Int J Gynaecol Obstet. 2009;106:223‐6.
15. Tavares JS, Melo AS, de Amorim MM, Barros VO, Benício MH, Takito MY, et al. Association between maternal physical activity, gestational weight gain and birth weight in a cohort of 118 pregnant women in campina grande, Northeast of Brazil. Rev Assoc Med Bras. 2009;55:335‐41.
16. De Jesus GM, Vieira GO, Vieira TO, Martins CD, Mendes CM, Castelão ES. Determinants of overweight in children under 4 years of age. J Pediatr (Rio J). 2010;86:311‐6.
17. Sass N, de Figueredo Junior AR, Siqueira JM, da Silva FR, Sato JL, Nakamura UM, et al. [Maternal and perinatal outcomes in Bolivian pregnant women in the city of Sao Paulo: a cross‐sectional case‐control study]. Rev Bras Ginecol Obstet. 2010;32:398‐404.
18. Braga CP, Hirakawa HS, Calderon IdM, Silva EGd, Santos FAd, Fernandes AAH. Relação do ganho de peso, antes e durante a gravidez, com a macrossomia fetal em gestações complicadas pelo diabetes gestacional e hiperglicemia leve. Nutrire Rev Soc Bras Aliment Nutr. 2011;36.
19. Cidade DG, Margotto PR, Guedes AC, Rocha AA, Assis FR, Cardoso FF et al. PP156. High prevalence of pre‐pregnancy overweight and obesity associated with maternal and perinatal complications. Pregnancy Hypertens. 2012;2:323.
20. Cocetti M, Taddei JA, Konstantyner T, Konstantyner TC, Barros Filho AdA. Prevalência e fatores associados ao excesso de peso em crianças brasileiras menores de 2 anos. J Pediatr (Rio J). 2012;88:503‐8.
21. Kac G, Schlussel MM, Perez‐Escamilla R, Velasquez‐Melendez G, da Silva AA. Household food insecurity is not associated with BMI for age or weight for height among brazilian children aged 0‐60 Months. Plos One. 2012;7.
22. Moreira MdA, Cabral PC, Ferreira HdS, Lira PI. Excesso de peso e fatores associados em crianças da região nordeste do Brasil. J Pediatr (Rio J). 2012;88:347‐52.
23. Cisneiros RM, Dutra LP, Silveira FJ, Souza AR, Marques M, Amorim MM, et al. Visceral adiposity in the first half of pregnancy predicts newborn weight among adolescent mothers. J Obstet Gynaecol Can. 2013;35:704‐9.
24. Addo OY, Stein AD, Fall CH, Gigante DP, Guntupalli AM, Horta BL, et al. Maternal height and child growth patterns. J Pediatr. 2013;163:549‐54.
25. Vieira CE, Mariz LS, Medeiros CC, Enders BC, Coura AS. Nursing care in childcare services: Acantose nigricans as a marker for metabolic risk. Rev Lat Am Enfermagem. 2013;21:1220‐7.
26. Viana KdJ, Warkentin S, Cocetti M, Taddei JÁ. Peso ao nascer de crianças brasileiras menores de dois anos. Cad Saude Publica. 2013;29:349‐56.
27. Calderon AC, Quintana SM, Marcolin AC, Berezowski AT, Brito LG, Duarte G, et al. Obesity and pregnancy: A transversal study from a low‐risk maternity. BMC Pregnancy and Childbirth. 2014;14.
28. Woodhouse C, Lopez Camelo J, Wehby GL A comparative analysis of prenatal care and fetal growth in eight South American countries. PLoS One. 2014;9:e91292.
29. Barbosa IR, Silva WB, Cerqueira GS, Novo NF, Almeida FA, Novo JL. Maternal and fetal outcome in women with hypertensive disorders of pregnancy: the impact of prenatal care. Ther Adv Cardiovasc Dis. 2015;9:140‐6.
30. Castillo H, Santos IS, Matijasevich A Relationship between maternal pre‐pregnancy body mass index, gestational weight gain and childhood fatness at 6‐7 years by air displacement plethysmography. Matern Child Nutr. 2015;11:606‐17.
31. Coelho ND, Cunha DB, Esteves AP, Lacerda EM, Filha MM. Dietary patterns in pregnancy and birth weight. Rev Saude Publica. 2015;49.
32. Costa e Silva LI, Gomes FM, Valente MH, Escobar AM, Brentani AV, Grisi SJ. The intergenerational effects on birth weight and its relations to maternal conditions, Sao Paulo, Brazil. Biomed Res Int. 2015;2015:615034.
33. Portela DS, Vieira TO, Matos SM, de Oliveira NF, Vieira GO. Maternal obesity, environmental factors, cesarean delivery and breastfeeding as determinants of overweight and obesity in children: Results from a cohort. BMC Pregnancy Childbirth. 2015;15.
34. Ramos CV, Dumith SC, Cesar JA. Prevalence and factors associated with stunting and excess weight in children aged 0‐5 years from the Brazilian semi‐arid region. J Pediatr (Rio J). 2015;91:175‐82.
35. Silva L, Gomes F, Valente MH, Escobar AD, Brentani AV, Grisi S. The Intergenerational effects on birth weight and its relations to maternal conditions, São Paulo, Brazil. Biomed Res Int. 2015.
36. Zanrosso CD, Schuch T, Camassola M, Pizzolotto L, Bisotto C, Andreazza T. Desfechos materno‐fetais do diabetes gestacional em serviço terciário de atenção obstétrica. Rev AMRIGS. 2015;59:112‐115.
37. Toro‐Ramos T, Sichieri R, Hoffman DJ. Maternal fat mass at mid‐pregnancy and birth weight in Brazilian women. Ann Hum Biol. 2016;43:212‐8.
38. Castro NP, Euclydes VV, Simões FA, Vaz‐de‐lima LR, De Brito CA, Luzia LA, et al. The relationship between maternal plasma leptin and adiponectin concentrations and newborn adiposity. Nutrients. 2017;9.
39. Sirimarco MP, Guerra HM, Lisboa EG, Vernini JM, Cassetari BN, Araujo Costa RA, et al. (2017) Diagnostic protocol for gestational diabetes mellitus (GDM) (IADPSG/ADA, 2011): influence on the occurrence of GDM and mild gestational hyperglycemia (MGH) and on the perinatal outcomes. Diabetol Metab Syndr.2017;9:2
40. Oliveira GZ, Guimarães SZ, Lavado MM. Recém‐nascidos grandes para a idade gestacional em gestantes diabéticas do pré‐natal de alto risco de Itajaí: fatores de risco. Arq Catarin Med 2017;46:80‐96.
41. Siqueira AA, Areno FB, Almeida PA, Tanaka AC. Relação entre peso ao nascer, sexo do recém‐nascido e tipo de parto. Rev Saude Publica. 1981;15:282‐90.
42. Melo AM, Kassar SB, Lira PI, Coutinho SB, Eickmann SH, Lima MC. Characteristics and factors associated with health care in children younger than 1 year with very low birth weight. J Pediatr (Rio J). 2013;89:75‐82.
43. Silva KS, Silva RC, Duarte MF, Lopes AS, Silva FM. Undernutrition and obesity associated with high blood pressure in children and adolescents from Joao Pessoa, Paraiba, Brazil. Pediatr Cardiol.. 2009;30:248‐55.
44. Paiva LV, Nomura RM, Dias MC, Zugaib M. Obesidade materna em gestações de alto risco e complicações infecciosas no puerpério. Rev Assoc Med Bras. 2012;58:453‐8.
Como citar este artigo: Czarnobay SA, Kroll C, Schultz LF, Malinovski J, Mastroeni SS, Mastroeni MF. Predictors of excess birth weight in Brazil: a systematic review. J Pediatr (Rio J). 2018. https://doi.org/10.1016/j.jped.2018.04.006