To discuss the etiology and growth consequences of small size at birth and the indications, effects, and safety of biosynthetic growth hormone therapy in children born small for gestational age.
Source of dataA comprehensive and non‐systematic search was carried out in the PubMed, LILACS, and SciELO databases from 1980 to the present day, using the terms “small for gestational age,” “intrauterine growth restriction,” and “growth hormone”. The publications were critically selected by the authors.
Data synthesisAlthough the majority of children born small for gestational age show spontaneous catch‐up growth during the first two years of life, some of them remain with short stature during childhood, with high risk of short stature in adult life. Treatment with growth hormone might be indicated, preferably after 2–4 years of age, in those small for gestational age children who remain short, without catch‐up growth. Treatment aims to increase growth velocity and to reach a normal height during childhood and an adult height within target height. Response to growth hormone treatment is variable, with better growth response during the pre‐pubertal period.
ConclusionsTreatment with growth hormone in short children born small for gestational age is safe and effective to improve adult height. Efforts should be done to identify the etiology of small size at birth before treatment.
Discutir a etiologia e as consequências para o crescimento e as indicações, os efeitos e a segurança da terapia com hormônio de crescimento biossintético em crianças pequenas para idade gestacional.
Fonte dos dadosUma busca abrangente e não sistemática foi feita nas bases de dados PubMed, LILACS e SciELO de 1980 até a presente data, com os termos “small for gestational age” (pequeno para a idade gestacional), “intrauterine growth restriction” (restrição de crescimento intrauterino) e “growth hormone” (hormônio do crescimento). As publicações foram selecionadas criticamente pelos autores.
Síntese dos dadosEmbora a maioria das crianças nascidas pequenas para idade gestacional apresente recuperação espontânea do crescimento durante os dois primeiros anos de vida, algumas delas permanecem com baixa estatura durante a infância, com alto risco de baixa estatura na vida adulta. O tratamento com hormônio de crescimento pode ser indicado, preferencialmente após os dois aos quatro anos, naquelas crianças sem recuperação espontânea do crescimento e com baixa estatura. Seus objetivos são aumentar a velocidade de crescimento e atingir uma altura normal durante a infância e uma altura adulta dentro da altura‐alvo. A resposta ao tratamento com hormônio de crescimento é variável, com melhor resultado se iniciado durante o período pré‐puberal.
ConclusõesO tratamento com hormônio de crescimento em crianças baixas nascidas pequenas para idade gestacional é seguro e eficaz para melhorar a estatura adulta. Esforços devem ser feitos para identificar a etiologia do nascimento pequenas para idade gestacional antes do tratamento.
Cerca de 20 milhões de crianças nascem no mundo todo com baixo peso (< 2.500g) a cada ano, mas essa definição abrange crianças nascidas prematuramente (< 37 semanas de gestação) e crianças nascidas pequenas para a idade gestacional (PIG).1 A prevalência estimada de crianças nascidas a termo e PIG difere entre países e regiões, varia de 2,3% nos Estados Unidos,2 5,5% na Suécia,3 3,4% no Japão4 e 12,5% na América Latina5 a 44,5% no Sul da Ásia.5 Entre as crianças nascidas pré‐termo, especialmente abaixo de 34 semanas, a prevalência de PIG é maior.4–6
Múltiplos critérios foram usados para definir crianças nascidas PIG. Em 1995, a Organização Mundial de Saúde (OMS) recomendou a definição de PIG como o peso ao nascer menor do que o percentil 10 para a idade gestacional, devido ao aumento dos riscos perinatais e neonatais dessas crianças em comparação com os recém‐nascidos com tamanho adequado.7,8 O consenso das Sociedades de Endocrinologia Pediátrica9,10 recomendou que um recém‐nascido PIG seja definido como aquele com peso ao nascer e/ou comprimento no nascimento igual ou menor do que −2,0 DP para o sexo e a idade gestacional, a fim de incluir principalmente aqueles com risco aumentado de distúrbios de crescimento e metabólicos.9
Além desses critérios, a datação gestacional precisa e as medidas ao nascimento são necessárias para a definição de PIG, além do padrão internacional de crescimento escolhido. A influência do padrão selecionado para a definição de PIG é crítica. Recentemente, os padrões Intergrowth‐21st para tamanho no nascimento foram validados com a possibilidade de uso para crianças nascidas entre 33 e 42 semanas pós‐concepção.11 Aproximadamente 24% dos recém‐nascidos considerados PIG, de acordo com os padrões do Intergrowth‐21st, foram considerados adequados para a idade gestacional (AIG), de acordo com os gráficos de crescimento pré‐termo de Fenton.12 Entretanto, o Intergrowth‐21st não é recomendado para idade gestacional menor do que 33 semanas. Nesse caso, a recomendação atual da Sociedade Brasileira de Pediatria para o monitoramento do crescimento pré‐termo é considerar o canal de crescimento alcançado após a estabilização da perda de peso neonatal, mas ela não recomenda qualquer referência específica para definição do tamanho ao nascimento.13 Os gráficos de crescimento intrauterino (fetal) não têm sido considerados uma boa opção para avaliar o tamanho no nascimento,14 embora os gráficos de crescimento de Fenton & Kim15 ainda sejam usados para esse fim em recém‐nascidos muito ou extremamente prematuros.
A maioria das crianças nascidas PIG mostra um catch‐up (recuperação espontânea do crescimento) para peso e altura acima de −2,0 EDP (escore de desvio‐padrão) durante os primeiros dois anos de vida,16,17 e atingirá uma estatura adulta (EA) na faixa normal para a população e/ou sua altura alvo. Cerca de 10% das crianças nascidas PIG não apresentam catch‐up do crescimento e constituirão aproximadamente 20% de todos os casos de baixa estatura durante a vida adulta.18 Algumas dessas crianças podem se beneficiar do tratamento com hormônio de crescimento (GH).
Nesta revisão, discutimos a etiologia, as consequências, os efeitos e a segurança da terapia com GH nas crianças nascidas PIG que não apresentaram catch‐up do crescimento.
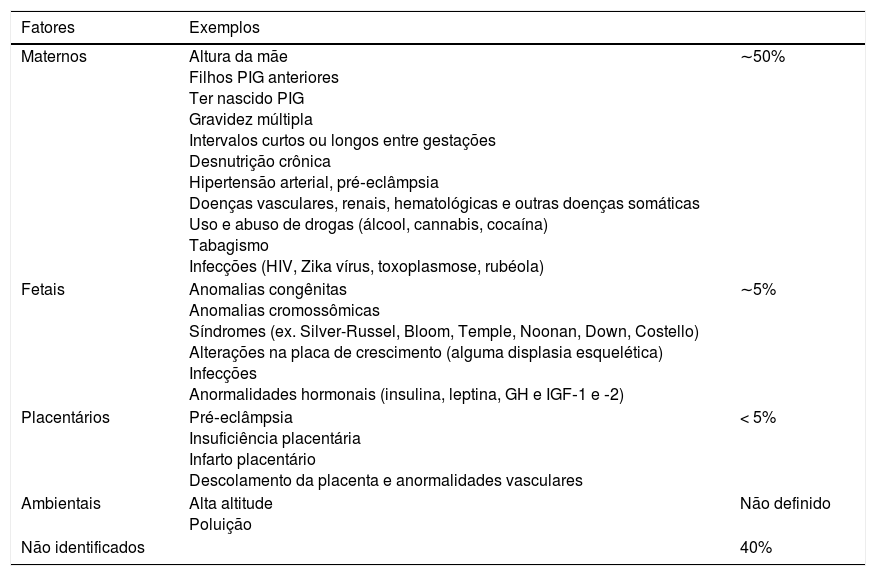
Etiologia e classificaçãoAs crianças nascidas PIG têm uma etiologia multifatorial, inclusive fatores fetais, placentários, maternos e ambientais. Em cerca de 40% dos casos o motivo do tamanho pequeno no nascimento não é identificado (tabela 1). Muitas dessas situações podem induzir um crescimento fetal deficiente com restrição do crescimento intrauterino (RCIU). No entanto, a RCIU não deve ser usada como sinônimo de PIG: PIG refere‐se ao tamanho corporal ao nascer e a RCIU refere‐se à redução da velocidade de crescimento documentada por pelo menos duas medidas fetais.9
Etiologia do nascimento pequeno para a idade gestacional
| Fatores | Exemplos | |
|---|---|---|
| Maternos | Altura da mãe Filhos PIG anteriores Ter nascido PIG Gravidez múltipla Intervalos curtos ou longos entre gestações Desnutrição crônica Hipertensão arterial, pré‐eclâmpsia Doenças vasculares, renais, hematológicas e outras doenças somáticas Uso e abuso de drogas (álcool, cannabis, cocaína) Tabagismo Infecções (HIV, Zika vírus, toxoplasmose, rubéola) | ∼50% |
| Fetais | Anomalias congênitas Anomalias cromossômicas Síndromes (ex. Silver-Russel, Bloom, Temple, Noonan, Down, Costello) Alterações na placa de crescimento (alguma displasia esquelética) Infecções Anormalidades hormonais (insulina, leptina, GH e IGF‐1 e ‐2) | ∼5% |
| Placentários | Pré‐eclâmpsia Insuficiência placentária Infarto placentário Descolamento da placenta e anormalidades vasculares | < 5% |
| Ambientais | Alta altitude Poluição | Não definido |
| Não identificados | 40% |
GH, hormônio do crescimento; HIV, vírus da imunodeficiência humana; IGF, fator de crescimento semelhante à insulina; PIG, pequeno para a idade gestacional.
As crianças nascidas PIG podem ser subclassificadas em PIG devido ao peso (PIG‐p), ao comprimento (PIG‐c) ou a ambos (PIG‐p/c), todas com prognóstico de crescimento diferentes.9 Por exemplo, o risco relativo de baixa estatura durante a vida adulta é 7,1 vezes maior para aqueles nascidos PIG‐c e 5,2 para aqueles nascidos PIG‐p, em comparação com crianças nascidas AIG.19 De acordo com o período de gravidez em que ocorreu o comprometimento do crescimento fetal, as crianças PIG também podem ser subdivididas em simétricas, quando ele ocorreu no início da gestação, e assimétricas, quando ocorreu principalmente durante o terceiro trimestre. Crianças PIG simétricas têm proporcionalmente diminuição de peso, comprimento e perímetro cefálico e PIG assimétricas têm baixo peso, mas comprimento e perímetro cefálico normais ou quase normais.9
Entre as anormalidades que resultam em tamanho pequeno no nascimento citadas na tabela 1, algumas merecem mais atenção quando se discute o tratamento com GH. A síndrome de Silver‐Russell (SRS) e a síndrome de Temple são distúrbios de imprinting que estão associados ao retardo do crescimento fetal e pós‐natal. A SRS tem uma incidência global de 1:30.000 a 1:100.000 nascimentos e é caracterizada pela cabeça em formato triangular com protuberância frontal, clinodactilia, assimetria de face e/ou corpo, retardo de crescimento fetal e pós‐natal e dificuldades de alimentação.20 Quase todos os bebês nascem PIG, permanecem pequenos durante a infância e atingem uma altura adulta média em torno de −4.0 EDP. Crianças com síndrome de Temple apresentam obesidade, hipotonia, puberdade precoce e baixa estatura.21 A dissomia uniparental materna (DUM) do cromossomo 20 causa uma síndrome caracterizada por retardo de crescimento fetal e pós‐natal e dificuldades de alimentação, difere da SRS porque não há assimetria e relativa macrocefalia.22 A síndrome de Bloom é uma síndrome de quebra cromossômica com retardo de crescimento fetal e pós‐natal grave, erupção cutânea eritematosa após exposição ao sol, microcefalia e hipoplasia malar, imunodeficiência e aumento do risco de câncer em idade precoce.23 A anemia de Fanconi, neurofibromatose tipo 1 e ataxia‐telangiectasia também são condições de baixa estatura e aumento do risco de malignidades.23 Além disso, alguns defeitos genéticos que afetam a placa de crescimento podem estar associados ao tamanho pequeno no nascimento e à baixa estatura, principalmente naqueles nascidos como PIG‐c, por exemplo mutações heterozigóticas dos genes ACAN (codificador de Aggrecan) e IHH (Indian Hedgehog), resultam em displasia esquelética. No entanto, ser PIG é incomum na acondroplasia.22 Em resumo, os procedimentos diagnósticos extensos e a identificação da causa do tamanho pequeno no nascimento são obrigatórios antes da decisão do tratamento com GH em crianças baixas nascidas PIG, a fim de aumentar a eficácia e garantir a segurança do tratamento.
Crescimento pós‐natalA recuperação espontânea do crescimento (catch‐up) é definida como uma taxa de crescimento maior do que a mediana para a idade cronológica e sexo para alcançar uma altura acima de −2,0 DP ou 3° percentil, mas a altura alvo também deve ser considerada.24 A maioria das crianças nascidas PIG mostra catch‐up do crescimento espontâneo para peso e altura acima de −2,0 DP durante os primeiros dois anos de vida,16,17 a maioria durante os primeiros dois a três meses,19,25 chega a 86% até os nove a 12 meses de vida para PIG com peso no nascimento < −2 DP e 79% quando o 5° percentil era usado.26 Quando crianças nascidas PIG e as pré‐termo foram avaliadas, 82,5% apresentaram catch‐up do crescimento até os dois anos, com catch‐up do crescimento mais tardio para aquelas que nasceram com menor EDP de comprimento ao nascer. O comprimento e o peso no nascimento apresentaram uma associação positiva significativa com o catch‐up do crescimento aos dois anos em crianças nascidas a termo e pré‐termo PIG, sem associação com a idade gestacional naquelas nascidas prematuramente.16
Cerca de 10‐15% das crianças nascidas PIG permanecem baixas e a razão para o catch‐up do crescimento insuficiente pode estar relacionada a anormalidades genéticas e/ou distúrbios da secreção de GH e/ou níveis reduzidos de fator de crescimento semelhante à insulina tipo 1 (IGF‐1),17,27 embora a maioria das crianças PIG não tenha deficiência de GH. A falta de recuperação espontânea do comprimento nos primeiros quatro meses de vida pode ser usada para identificar precocemente as crianças que nasceram pequenas para a idade gestacional com maior risco de baixa estatura aos cinco anos.28
Embora aproximadamente 10% dos adultos nascidos PIG permaneçam com baixa estatura, em apenas 3,7% a estatura está abaixo de −2,5 DP.29 Para aqueles com catch‐up do crescimento espontâneo, uma média de altura adulta de −0,7 DP tem sido relatada, enquanto que para aqueles que permanecem baixos durante toda a infância a altura final relatada foi de −1,7 DP, 7,5cm menos do que a altura‐alvo em homens e 9,6 menos em mulheres.3 Leger et al. encontraram déficit na estatura adulta ajustado para altura‐alvo de 0,8 DP (−3,9cm) em meninos e 0,9 DP (−3,64cm) em meninas nascidos PIG em comparação com indivíduos nascidos AIG (p < 0,0001).30 O catch‐up do crescimento na primeira infância e a estatura dos adultos estavam associados ao comprimento no nascimento e à altura dos pais.18,29,31 O risco de baixa estatura durante a vida adulta foi 3,2 vezes maior para cada redução de 1 DP na altura da mãe, 2,2 vezes maior para cada redução de 1 DP na altura do pai e 1,3 vez maior para cada redução de 1cm de comprimento no nascimento.29
A puberdade precoce ou rápida tem sido associada à perda do potencial de altura.32 Adrenarca e pubarca precoces, início precoce do desenvolvimento puberal e do pico de velocidade de crescimento foram relatados em crianças nascidas PIG,20,33–35 embora nenhuma diferença tenha sido relatada a respeito da idade do início puberal e do estirão do crescimento em comparação com crianças nascidas AIG. Faixa etária normal, mais precoce e nenhuma diferença na idade da menarca30,33–35 entre meninas nascidas PIG e aquelas nascidas AIG36,37 foram relatadas. A estatura no início da puberdade foi relatada como menor do que a esperada em alguns estudos,30,38 bem como uma fusão epifisária acelerada.39–41 Uma progressão puberal mais rápida foi descrita em meninas com redução do crescimento puberal e déficit na altura de aproximadamente 4cm.42
Intervenção pós‐natalManejo nutricional em lactentes nascidos PIGA velocidade de crescimento pós‐natal e o ganho de peso ideais em crianças nascidas PIG ou em prematuros ainda não estão totalmente estabelecidos. O catch‐up do crescimento esperado deve ser gradual, não tão rápido e nem demasiado. É benéfico para o neurodesenvolvimento e as funções cognitivas, mas também pode ser prejudicial ao metabolismo.43 Os recém‐nascidos PIG frequentemente recebem necessidades nutricionais semelhantes àquelas oferecidas aos prematuros.44 A despeito da idade gestacional ou tamanho ao nascer, o leite materno é o melhor nutriente para os recém‐nascidos e a amamentação exclusiva é recomendada nos primeiros seis meses de vida.45 O aleitamento materno deve ser promovido para mães de filhos PIG46,47 e é uma forma de prevenir doenças crônicas e obesidade mais tarde na vida do individuo.47
O uso de fórmula com alto teor de energia para bebês PIG foi previamente sugerido porque melhoraria o ganho de peso e o incremento no perímetro cefálico, sem efeito deletério no crescimento linear.48 Entretanto, o rápido ganho de peso durante os dois primeiros anos de vida tem sido associado com obesidade e composição corporal anormal no decorrer da vida, com mais gordura visceral e abdominal e menor massa corporal magra em crianças e adultos nascidos PIG em comparação aos indivíduos AIG.49,50
Tratamento com hormônio de crescimento em crianças baixas nascidas PIGO tratamento com GH tem sido indicado para crianças nascidas PIG que não apresentaram catch‐up do crescimento espontâneo até os dois a quatro anos. O objetivo do tratamento com GH é aumentar a velocidade de crescimento e atingir uma altura normal durante a infância e uma estatura adulta dentro da altura alvo. Devem ser feitos esforços para identificar, sempre que possível, a causa do tamanho pequeno no nascimento. A avaliação pediátrica de rotina é necessária e a necessidade de um cariótipo e de testes genéticos deve ser considerada. Os testes de estimulação de GH não são necessários antes do início do tratamento, exceto se houver suspeita de deficiência de GH (GHD). A secreção de GH durante esses testes não prediz com precisão a resposta ao tratamento com GH.9 No entanto, as crianças com GHD nascidas PIG apresentaram menor velocidade de crescimento durante o primeiro ano de tratamento com GH, em comparação com as crianças com GHD nascidas AIG.51
A decisão do tratamento baseado na idade óssea e na previsão da estatura adulta deve ser tomada com cautela em crianças nascidas PIG. A idade óssea frequentemente é menor do que a idade cronológica durante os anos pré‐púberes, porém um ritmo acelerado de maturação da idade óssea geralmente ocorre dos seis aos oito anos de vida,9,20 com perda do potencial de altura. Consequentemente, a previsão da estatura adulta tem sido superestimada com frequência durante os anos pré‐púberes em crianças baixas nascidas PIG.9
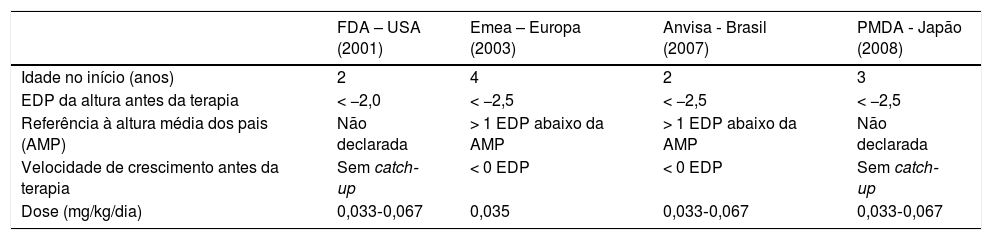
A indicação e dose de GH variam entre países e regiões (tabela 2). No Brasil, a Agência Nacional de Vigilância Sanitária (Anvisa) aprovou tratamento com GH para crianças nascidas PIG sem catch‐up do crescimento em 2007. Crianças com síndrome de Russel‐Russel compreendem um grupo especial de crianças nascidas PIG e que podem se beneficiar da terapia. Em condições associadas à hipoglicemia grave, o tratamento pode ser iniciado antes dos dois anos.20 Um incremento na velocidade da altura deve ser esperado no primeiro ano de terapia com uma leve diminuição da velocidade durante os anos seguintes. O tratamento é recomendado até que se esteja próximo da altura final, quando a velocidade de crescimento cai abaixo de 2cm/ano e/ou a idade óssea é maior do que 14 anos em meninas ou 16 anos em meninos, corresponde ao fechamento da cartilagem epifisária de crescimento.9 Quando a resposta de crescimento não é a esperada, é indicada uma reavaliação que inclua o diagnóstico, a dose de GH, a avaliação da adesão e o uso de medicamentos que interferem na resposta do crescimento, como o metilfenidato.52
Indicações para o tratamento com GH em crianças baixas nascidas pequenas para a idade gestacional
| FDA – USA (2001) | Emea – Europa (2003) | Anvisa ‐ Brasil (2007) | PMDA ‐ Japão (2008) | |
|---|---|---|---|---|
| Idade no início (anos) | 2 | 4 | 2 | 3 |
| EDP da altura antes da terapia | < −2,0 | < −2,5 | < −2,5 | < −2,5 |
| Referência à altura média dos pais (AMP) | Não declarada | > 1 EDP abaixo da AMP | > 1 EDP abaixo da AMP | Não declarada |
| Velocidade de crescimento antes da terapia | Sem catch‐up | < 0 EDP | < 0 EDP | Sem catch‐up |
| Dose (mg/kg/dia) | 0,033‐0,067 | 0,035 | 0,033‐0,067 | 0,033‐0,067 |
AMP, altura média dos pais; Anvisa, Agência Nacional de Vigilância Sanitária; EDP, escore do desvio‐padrão; Emea, European Agency for the Evaluation of Medical Products; FDA, Food and Drug Administration; PMDA, Pharmaceuticals and Medical Devices Agency.
Embora a recomendação seja iniciar o tratamento com GH entre dois e quatro anos, muitas crianças de baixa estatura nascidas PIG iniciam o tratamento perto ou no início da puberdade. Ainda controversa e considerada uma opção não rotineira para crianças baixas nascidas PIG,53 a combinação de GH com análogos do hormônio liberador de gonadotrofina (GnRHa) pode atrasar a maturação epifisária e prolongar o tempo para o tratamento com GH, e a EA para crianças baixas, com tempo puberal normal, pode não ser melhorado.54–56 Lem et al.57 e van der Steen et al.58 mostraram que a terapia combinada em crianças com estatura abaixo de 140cm no início da puberdade e previsão de estatura adulta < −2,5 EDP resultou em uma estatura adulta semelhante a indivíduos cuja puberdade se iniciou com altura acima de 140cm tratados somente com GH.57,58 No estudo holandês, o ganho de altura durante a terapia com GnRHa + GH foi mais expressivo em meninos que receberam altas doses de GH (0,067 vs. 0,033mg/kg/dia; 12,7 vs. 15,2cm, p = 0,015), embora o ganho de estatura após a interrupção do GnRHa para a estatura adulta tenha sido semelhante com ambas as doses.57 Outro estudo mostrou que a estatura alcançada antes do início da puberdade apresentou maior associação com o ganho de altura puberal do que a dose de GH, reforça a necessidade de iniciar o GH e normalizar a estatura antes da puberdade.59
A resposta ao tratamento com GH é variável. A resposta do crescimento durante o primeiro ano de terapia está principalmente associada à menor idade no início do tratamento e à dose de GH. Outros determinantes da resposta de crescimento são maior EDP de peso no início do tratamento e maior EDP de altura parental média. Para o segundo e terceiro anos, a velocidade de crescimento durante o primeiro ano, a menor idade, a maior dose de GH e o maior EDP de altura média dos pais mostraram uma correlação positiva com a resposta do crescimento.60–62
Em uma revisão sistemática, Maiorana e Cianfarani verificaram que a estatura final de adultos nascidos PIG tratados com GH foi significativamente maior do que a dos não tratados, excedendo em 0,9 EDP, com ganho médio de estatura de 1,5 EDP.63 Resultados semelhantes foram mostrados por Ross et al.64 e Tanaka et al.41 Ganho menos intenso na estatura adulta tem sido relatado em indivíduos com SRS comparados com indivíduos não sindrômicos nascidos PIG (−2,17 vs. −1,65 EDP, p = 0,002)65 e poucos relatos mostraram efeito benéfico do tratamento com GH na altura adulta.66
A terapia de longo prazo com GH para crianças nascidas PIG é segura e bem tolerada.41,43 Ela não parece afetar o tempo de início e progressão puberal;40 no entanto, uma menor altura no início da puberdade40,41 e um ganho menos intenso de altura puberal em comparação com os pares nascidos AIG foram relatados.40,54 A dose alta de GH mostrou induzir aceleração da idade óssea e início da puberdade em crianças com baixa estatura idiopática (BEI).67 Em conjunto, o ritmo anormal da maturação óssea em crianças nascidas PIG e a possibilidade de aceleração óssea durante o tratamento com GH exigem um acompanhamento mais próximo do ganho de altura e progressão puberal. Embora o tratamento com GH não esteja associado ao risco aumentado de malignidade,68 um estudo mostrou aumento significativo na incidência de câncer ósseo e de bexiga em pacientes tratados com GH sem malignidades prévias e não estava relacionado à dose cumulativa ou à duração do tratamento.69 O tamanho pequeno no nascimento pode estar associado a síndromes com alto risco de malignidade, inclusive síndrome de Noonan, neurofibromatose tipo 1, anemia de Fanconi e síndrome de Bloom,23,43 condições que exigem maior conscientização e pronta avaliação de possíveis sintomas de câncer.70 Um diagnóstico extenso e cuidadoso é necessário para identificar essas condições antes da decisão do tratamento com GH.
ConclusãoO tratamento com GH em crianças baixas nascidas PIG é seguro e eficaz para melhorar a altura do adulto, especialmente se iniciado antes da puberdade. A terapia combinada com GnRHa pode ser considerada para aqueles já na puberdade e com baixa estatura. Esforços devem ser feitos para identificar a causa do tamanho pequeno no nascimento antes do tratamento.
Conflitos de interesseBoguszewski MCS recebeu pagamento de palestras pela Pfizer e Sandoz. Os outros autores declaram não haver conflitos de interesse.
Cardoso-Demartini AA, Boguszewski MC, Alves CA. Postnatal management of growth failure in children born small for gestational age. J Pediatr (Rio J). 2019;95:S23–S9.