To present the currently available evidence of the effects of congenital Zika virus infection on infant growth, to discuss possible intervening factors, and to describe preliminary data on this growth in a cohort of exposed children.
Source of dataNon‐systematic review in PubMed, BVS, CAPES, Scopus, Web of Science, Cochrane and Google Scholar databases in the last 5 years, using the terms infection/disease by Zika virus and growth/nutrition/nutritional status/infant nutrition and nutritional needs. Additionally, the anthropometric data of the first 2.5 years of a cohort of children exposed to the Zika virus during pregnancy were reviewed.
Synthesis of dataBoth intrauterine growth restriction and low birth weight were reported in series of cases of children with congenital Zika syndrome. The postnatal growth deficit of these children appears to be directly proportional to the degree of neurological impairment. The etiology is multifactorial, and nutritional and non‐nutritional factors are probably involved. The data from the present cohort show that the head circumference evolution depends on this measurement at birth and that weight‐height growth has a trend toward lower weight and length in children with congenital microcephaly and normocephalic at birth who develop some neurological abnormality.
ConclusionsThe few existing data suggest that, in children with congenital Zika, the greater the degree of neurological impairment, the greater the impact on growth, whether or not associated with microcephaly at birth.
Apresentar as evidências atualmente disponíveis das repercussões da infecção congênita pelo vírus Zika no crescimento infantil, discutir possíveis fatores intervenientes e descrever dados preliminares desse crescimento em uma coorte de crianças expostas.
Fonte dos dadosRevisão não sistemática nos portais de banco de dados PubMed, BVS, Capes, Scopus, Web of Science, Cochrane e Google Scholar nos últimos cinco anos, com o uso dos termos infecção/doença pelo vírus Zika e crescimento/nutrição/status nutricional/nutrição infantil e necessidades nutricionais. Além disso, foram revistos os dados antropométricos dos primeiros dois anos e meio de uma coorte de crianças expostas ao vírus Zika durante a gestação.
Síntese dos dadosTanto a restrição do crescimento intrauterino como o baixo peso ao nascer têm sido relatados em séries de casos de crianças com síndrome de Zika congênita. O déficit de crescimento pós‐natal dessas crianças parece ser diretamente proporcional ao grau de comprometimento neurológico. A etiologia é multifatorial, com fatores nutricionais e não nutricionais provavelmente envolvidos. Os dados de nossa coorte mostram que a evolução do perímetro cefálico é dependente do valor dessa medida ao nascimento e que o crescimento pondero‐estatural apresenta uma tendência de menor peso e comprimento em crianças com microcefalia congênita e normocefálicas ao nascimento, mas com alguma anormalidade neurológica evolutiva.
ConclusõesOs poucos dados existentes sugerem que em crianças com Zika congênita, o impacto sobre o crescimento será tanto maior quanto maior for o grau de comprometimento neurológico, associado ou não à microcefalia ao nascimento.
Em outubro de 2015, o Ministério da Saúde brasileiro notificou à Organização Mundial da Saúde (OMS) a ocorrência de um aumento expressivo nos casos de microcefalia congênita na Região Nordeste do Brasil, em associação com a epidemia de infecção pelo vírus Zika na região.1 Em fevereiro de 2016, a OMS declarou essa associação uma Emergência de Saúde Pública de Preocupação Inernacional.2 A seguir, evidências se acumularam em favor da associação entre a infecção pelo vírus Zika na gestação e o desenvolvimento de microcefalia congênita e outras anormalidades neurológicas em recém‐nascidos.3–5 Autoridades de saúde pública da Europa e Estados Unidos alertaram para o risco de disseminação mundial do vírus Zika e para a importância do aumento da vigilância e de medidas de prevenção e controle da doença.6 Apesar de a microcefalia ter sido o sinal clínico inicial mais impactante para o acompanhamento desse grupo de crianças, acredita‐se hoje que o espectro da infecção congênita pelo vírus Zika possa ir muito além da microcefalia, demande especial atenção do pediatra e da equipe de saúde.7,8
Crianças com microcefalia e encefalopatia crônica não progressiva, como observado na síndrome da Zika congênita (SZC), em geral crescem menos, apresentam estatura e peso menores do que as saudáveis da mesma idade.9 A etiologia desse déficit de crescimento é multifatorial, pode estar relacionada tanto a fatores nutricionais como não nutricionais, secundários às malformações cerebrais.9
Ainda são escassos os relatos do crescimento de crianças expostas ao vírus Zika durante a gestação, microcefálicas ou não. Os estudos até o momento têm dado mais ênfase ao desenvolvimento. Assim, o objetivo desta revisão é apresentar as evidências atualmente disponíveis das repercussões da infecção congênita pelo vírus Zika no crescimento infantil, discutir possíveis fatores intervenientes e descrever dados preliminares desse crescimento em uma coorte de crianças expostas.
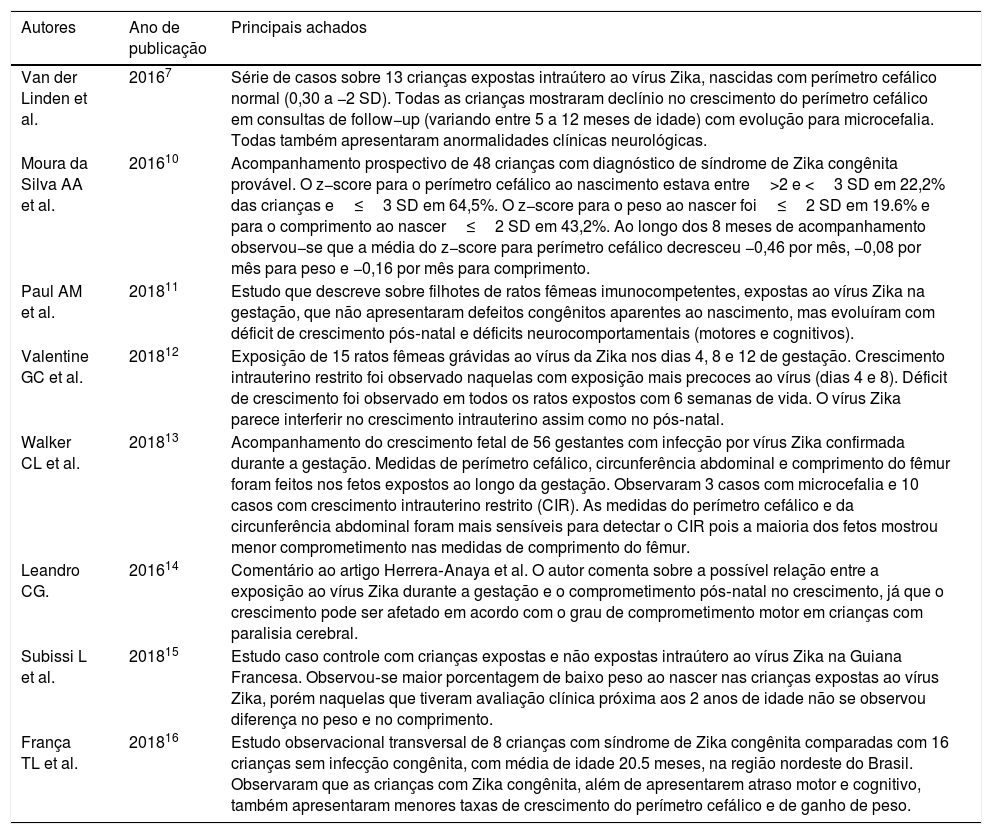
Fonte dos dadosUma revisão não sistemática foi feita nos portais de banco de dados Pubmed, BVS, Capes, Scopus, Web of Science e Cochrane, compreendeu os últimos cinco anos e usou os termos (“Zika Virus Infection”, “ZikV Infection”, “Zika Virus Disease”) e (“Growth”, “Failure to Thrive”, “Growth and Development”, “Nutrition Assessment”, “Nutritional Status”, “Deficiency Diseases”, “Child Nutrition”, “Infant Nutrition”, “Recommended Dietary Allowances”, “Diet, Food and Nutrition”, “Nutritional Requirements”, “Nutrition Status”, “Nutrition Assessment”). A busca também foi feita no Google Scholar. Foram encontrados 182 artigos. Após avaliação criteriosa feita por dois autores (MMM e ABG), que tomou como base a sua relação com o tema proposto, 171 artigos foram excluídos pelo título e seis pelo leitura do resumo, permaneceram no fim oito artigos que abordavam o crescimento de expostos à infecção intrauterina pelo vírus Zika (tabela 1).7,10–16
Artigos científicos selecionados que abordavam o crescimento de expostos à infecção intrauterina pelo vírus Zika
| Autores | Ano de publicação | Principais achados |
|---|---|---|
| Van der Linden et al. | 20167 | Série de casos sobre 13 crianças expostas intraútero ao vírus Zika, nascidas com perímetro cefálico normal (0,30 a −2 SD). Todas as crianças mostraram declínio no crescimento do perímetro cefálico em consultas de follow−up (variando entre 5 a 12 meses de idade) com evolução para microcefalia. Todas também apresentaram anormalidades clínicas neurológicas. |
| Moura da Silva AA et al. | 201610 | Acompanhamento prospectivo de 48 crianças com diagnóstico de síndrome de Zika congênita provável. O z−score para o perímetro cefálico ao nascimento estava entre>2 e <3 SD em 22,2% das crianças e≤3 SD em 64,5%. O z−score para o peso ao nascer foi≤2 SD em 19.6% e para o comprimento ao nascer≤2 SD em 43,2%. Ao longo dos 8 meses de acompanhamento observou−se que a média do z−score para perímetro cefálico decresceu −0,46 por mês, −0,08 por mês para peso e −0,16 por mês para comprimento. |
| Paul AM et al. | 201811 | Estudo que descreve sobre filhotes de ratos fêmeas imunocompetentes, expostas ao vírus Zika na gestação, que não apresentaram defeitos congênitos aparentes ao nascimento, mas evoluíram com déficit de crescimento pós‐natal e déficits neurocomportamentais (motores e cognitivos). |
| Valentine GC et al. | 201812 | Exposição de 15 ratos fêmeas grávidas ao vírus da Zika nos dias 4, 8 e 12 de gestação. Crescimento intrauterino restrito foi observado naquelas com exposição mais precoces ao vírus (dias 4 e 8). Déficit de crescimento foi observado em todos os ratos expostos com 6 semanas de vida. O vírus Zika parece interferir no crescimento intrauterino assim como no pós‐natal. |
| Walker CL et al. | 201813 | Acompanhamento do crescimento fetal de 56 gestantes com infecção por vírus Zika confirmada durante a gestação. Medidas de perímetro cefálico, circunferência abdominal e comprimento do fêmur foram feitos nos fetos expostos ao longo da gestação. Observaram 3 casos com microcefalia e 10 casos com crescimento intrauterino restrito (CIR). As medidas do perímetro cefálico e da circunferência abdominal foram mais sensíveis para detectar o CIR pois a maioria dos fetos mostrou menor comprometimento nas medidas de comprimento do fêmur. |
| Leandro CG. | 201614 | Comentário ao artigo Herrera‐Anaya et al. O autor comenta sobre a possível relação entre a exposição ao vírus Zika durante a gestação e o comprometimento pós‐natal no crescimento, já que o crescimento pode ser afetado em acordo com o grau de comprometimento motor em crianças com paralisia cerebral. |
| Subissi L et al. | 201815 | Estudo caso controle com crianças expostas e não expostas intraútero ao vírus Zika na Guiana Francesa. Observou‐se maior porcentagem de baixo peso ao nascer nas crianças expostas ao vírus Zika, porém naquelas que tiveram avaliação clínica próxima aos 2 anos de idade não se observou diferença no peso e no comprimento. |
| França TL et al. | 201816 | Estudo observacional transversal de 8 crianças com síndrome de Zika congênita comparadas com 16 crianças sem infecção congênita, com média de idade 20.5 meses, na região nordeste do Brasil. Observaram que as crianças com Zika congênita, além de apresentarem atraso motor e cognitivo, também apresentaram menores taxas de crescimento do perímetro cefálico e de ganho de peso. |
Além disso, foram revistos os dados antropométricos de uma coorte de crianças acompanhadas no ambulatório de seguimento na Maternidade‐Escola da UFRJ, como parte de um protocolo de pesquisa aprovado pelo CEP da instituição sob o n° 1.541.109 (CAAE 55465616.0.0000.5275). Nessa coorte, todas as crianças participantes foram comprovadamente expostas ao vírus Zika durante a gestação, tomou‐se por base: (1) resultado positivo da reação em cadeia da polimerase (PCR) contra o vírus Zika no sangue materno; (2) presença de IgM positiva contra o vírus Zika no sangue materno e (3) infeção congênita provável pelo vírus Zika pelos critérios clinico‐epidemiológicos do Ministério da Saúde do Brasil. Esses pacientes foram acompanhados do nascimento aos dois anos e meio, de fevereiro de 2016 a agosto de 2018. A cada consulta foram feitas as medidas de peso, comprimento e perímetro cefálico, por equipe previamente treinada. Foram usados balança digital calibrada, estadiômetro e fita métrica não extensível para aferição do perímetro cefálico. Os valores aferidos foram inseridos nos gráficos da OMS de acordo com idade e sexo. Essa coorte foi dividida em três grupos: (1) microcefálicos, (2) normocefálicos, com alguma anormalidade neurológica detectada ao longo do acompanhamento, (3) normocefálicos, sem anormalidades neurológicas.
Síntese dos dados e discussãoSíndrome da Zika congênitaPequenas séries de casos têm descrito algumas características congênitas e pós‐natais da infecção intraútero pelo vírus Zika. Além da microcefalia, esse grupo de crianças pode apresentar retardo do crescimento intrauterino, redução do volume cerebral, malformações cerebrais (especialmente calcificações subcorticais, ventriculomegalia e defeitos de migração cortical), desproporção craniofacial, acúmulo de pele na região occipital, hiperexcitabilidade, hipertonia, irritabilidade, epilepsia, disfagia e artrogripose.17–19 Durante o acompanhamento evolutivo observa‐se atraso na aquisição dos marcos do desenvolvimento, com dificuldade de sustento cervical e hipertonia apendicular. A persistência dos reflexos primitivos também é observada, além de sinais e sintomas piramidais (hipertonia, hiperreflexia, clônus e persistência dos reflexos primitivos) e extrapiramidais (tônus flutuante e discinesia simétrica das extremidades durante a vigília),10,20 em crianças com e sem microcefalia ao nascimento.7,8 Anormalidades oculares, como a presença de máculas pigmentares, a atrofia coriorretiana na região macular e perda da função visual, provavelmente associada a perda visual cortical, também foram descritas em 21‐55% dos casos.21–23
Embora impactantes, essas alterações relatadas como parte da SZC são encontradas principalmente em crianças que apresentam microcefalia ao nascimento. Entretanto, têm despertado cada vez maior interesse de pesquisadores e equipe de saúde as consequências decorrentes da infecção congênita pelo Zika em recém‐nascidos não microcefálicos e os primeiros relatos evolutivos desse grupo começam a surgir.7,8 Estudos em animais têm demonstrado a ocorrência de alterações do crescimento e desenvolvimento em animais oligossintomáticos ao nascimento,11 o que parece estar associado com o período gestacional em que ocorreu a infecção.12
Crescimento intrauterinoRestrição do crescimento intrauterino, representado por um peso fetal inferior ao percentil 10 nas curvas padrão usadas, tem sido relatada em cerca de 10‐18% das gestações que reportam infecção da gestante pelo vírus Zika.13,24 Estudos ultrassonográficos nesses casos revelam um padrão de redução da circunferência craniana e abdominal, com relativa preservação do comprimento femoral, que leva a desproporções na relação perímetro cefálico/comprimento femoral e perímetro abdominal/comprimento femoral (< percentil 10).13 Quanto ao comprometimento do crescimento cerebral, que leva à microcefalia, os relatos têm demonstrado que quanto mais precoce é a infecção materna, maior o risco de microcefalia.24 Sofisticados estudos de bancada que usaram minicérebros originados a partir de células‐tronco pluripotentes induzidas (iPS), precocemente infectados pelo vírus Zika, foram capazes de demonstrar o grande poder destruidor do vírus sobre a formação de neuroesferas e precursores neurais corticais.25,26
Peso ao nascimentoAs séries de casos de crianças expostas ao vírus Zika durante a gestação mostram que a prevalência de baixo peso ao nascer e de recém‐nascidos pequenos para a idade gestacional ao nascimento pode ser o dobro do habitual.10,24,27,28 Crianças com baixo peso ao nascer ou pequenas para a idade gestacional normalmente atingem menores peso, estatura e perímetro cefálico ao longo do crescimento, além de apresentar menos massa magra e maior percentagem de massa adiposa corporal.14,29
Crescimento pós‐natal e fatores intervenientesMoura da Silva et al.,10 em uma coorte de 45 crianças com provável síndrome de Zika congênita, evidenciaram, já ao nascimento, baixo comprimento em 43,2% dos recém‐nascidos e baixo peso em 19,6%. Além disso, no acompanhamento prospectivo dessas crianças, evidenciaram manutenção de baixos comprimento e peso aos oito meses.
Uma má ingesta alimentar é um dos principais fatores que levam a um status nutricional inadequado em crianças com algum tipo de comprometimento neurológico.9 Somente 20% dessas crianças recebem a quantidade calórica adequada. As necessidades energéticas desse grupo de crianças estarão relacionadas com a composição corporal, com o grau de comprometimento motor e com o nível de atividade física, inclusive a reabilitação, que pode aumentar as necessidades energéticas diárias.30 Esses pacientes normalmente necessitam de mais energia para a deambulação, enquanto que nos que não deambulam necessitam cerca de 60 a 70% das necessidades energéticas quando comparados com crianças sem comprometimento neurológico na mesma faixa etária e sexo.31 De uma forma geral, múltiplos fatores podem afetar a adequada ingesta alimentar dessas crianças mesmo em diferentes graus de comprometimento neurológico. Fatores sensoriais relacionados à textura e ao sabor dos alimentos podem levar a um consumo limitado de determinados grupos alimentares. A fadiga é um outro fator contribuinte para uma inadequada ingesta alimentar, tanta a fadiga que pode estar presente antes das refeições como naquela que ocorre em decorrência do esforço no processo de alimentação desses pacientes.32 Refeições com um tempo muito prolongado causam estresse e fadiga tanto nas crianças como em seus pais, acarretam comportamentos negativos relacionados aos momentos de alimentação. Outros fatores incluem distúrbios na sensação de fome e saciedade, incapacidade de comunicação sobre as necessidades nutricionais, cáries dentárias, má oclusão dentária e condições secundárias, como o refluxo gastroesofagiano e constipação.33 Deficiências de micronutrientes (cálcio, ferro, zinco, selênio, vitaminas C, D e E) também são comum nessas crianças com comprometimento neurológico e podem contribuir para o déficit de crescimento.34–36
Outros fatores não nutricionais podem afetar o crescimento pondero‐estatural de crianças com microcefalia associada à SZC. Crianças com déficit intelectual têm risco maior de desnutrição e déficit de crescimento, especialmente quando a deficiência intelectual está associada a paralisia cerebral (associação presente em cerca de 50% dos casos). A obesidade também pode constituir um problema nutricional nessa população, em especial naquelas com baixa atividade física e que não apresentam disfunção de deglutição.37 O uso de drogas antiepilépticas, comuns em crianças com microcefalia decorrente da SZC também está associado a ganho ponderal, pode ser observado em até 57% dos pacientes que fazem uso crônico de ácido valproico, provavelmente é devido a alterações metabólicas em razão da diminuição da betaoxidação dos ácidos graxos e do aumento da insulina e da leptina.38 Por outro lado, a perda de peso é observada comumente com o uso crônico de topiramato, envolve possivelmente redução de ingestão calórica, envolvimento hormonal (especialmente adiponectina) e alterações no metabolismo lipídico e da glicose.39
Curvas de crescimentoO Ministério da Saúde recomenda o acompanhamento do crescimento de crianças com provável infecção congênita pelo vírus Zika através do uso das curvas de crescimento do Consórcio Internacional de Crescimento Fetal e Neonatal para o Século 21 (Intergrowth 21st) para recém‐nascidos pré‐termo até 64 semanas de idade gestacional corrigida e das curvas de crescimento da OMS para crianças a termo e pós‐termo.40,41 Equações propostas por Stevenson permitem avaliar a estatura em crianças de 2 a 12 anos, impossibilitadas de ficar na posição ereta.42
Crescimento pondero‐estatural e do perímetro cefálico em uma coorte de expostos à infecção intrauterina pelo vírus ZikaFace à escassez de dados na literatura que reportem o crescimento de crianças cujas mães foram comprovadamente expostas à infecção pelo vírus Zika durante a gestação, apresentamos a evolução dos dados antropométricos de uma coorte de 29 pacientes, assim dividida: (a) cinco crianças com microcefalia congênita e comprometimento neurológico grave; (b) 11 crianças normocefálicas ao nascimento, com alguma anormalidade neurológica leve, detectada ao longo do acompanhamento; e (c) 13 crianças normocefálicas ao nascimento, sem anormalidades neurológicas durante o acompanhamento (tabela 2).
Evolução de uma coorte de 29 pacientes cujas mães foram comprovadamente expostas ao vírus Zika durante a gestação
| Caso | PC ao nascer | IG na infecção (sem) | IG ao nascer (sem) | Peso ao nascer (g) | Comp. ao nascer (cm) | PC ao nascer (cm) | Apgar 5° minuto | Escore Z para o crescimento | Neuroimagem (achados) | Desenvolvimento (Gesell) | Tratamento |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Microcefálico | 10 | 39 | 2690 | 47 | 30 | 9 | Peso: ‐1,23 a ‐0,86 Comp: ‐1,15 a ‐0,43 PC: ‐3,53 a ‐4,43 | Achados “a” | Importante atraso global do desenvolvimento | Fisioterapia, fonoaudiologia e estimulação. Uso de clonazepam e topiramato. |
| 2 | Microcefálico | 12 | 38+1 | 3140 | 45 | 29,5 | 9 | Peso: ‐0,52 a ‐1,29 Comp: ‐2,58 a ‐1,68 PC: ‐3,91 a ‐4,81 | Achados “b” | Importante atraso global do desenvolvimento | Fisioterapia, fonoaudiologia e estimulação |
| 3 | Microcefálico | s/sintomas | 39 | 3570 | 48,5 | 31,5 | 9 | Peso: ‐0,51 a ‐0,98 Comp: ‐0,73 a ‐1,38 PC: ‐2,33 a ‐3,15 | Achados “c” | Importante atraso global do desenvolvimento | Fisioterapia, fonoaudiologia e estimulação |
| 4 | Microcefálico | s/sintomas | 37+1 | 2110 | 43 | 27,5 | 9 | Peso: ‐2,95 a ‐2,06 Comp: ‐3,64 a ‐1,73 PC: ‐5,48 a ‐5,46 | Achados “d” | Importante atraso global do desenvolvimento | Fisioterapia, fonoaudiologia e estimulação |
| 5 | Microcefálico | 12 | 38+3 | 2005 | 40 | 29 | 9 | Peso: ‐3,09 a ‐4,74 Comp: ‐4,37 a ‐3,10 PC: ‐4,12 a ‐6,48 | Achados “e” | Importante atraso global do desenvolvimento | Fisioterapia, fonoaudiologia e estimulação |
| 6 | Normocefálico | 25 | 31+3 | 1620 | 38,5 | 28,5 | 9 | Peso: ‐0,02 a ‐1,26 Comp: ‐1,21 a ‐3,83 PC: ‐0,27 a ‐1,64 | Normal | Atraso Adaptativo, motor fino e linguagem | Fisioterapia, fonoaudiologia e estimulação |
| 7 | Normocefálico | 38+5 | 39 | 3395 | 51 | 35 | 9 | Peso: 0,36 a 1,17 Comp: 0,99 a 1,01 PC: 0,95 a ‐0,17 | Normal | Atraso Adaptativo, motor fino, linguagem e Pessoal‐Social | Fisioterapia, fonoaudiologia e estimulação |
| 8 | Normocefálico (gemelar 1) | 21 | 32 | 1905 | 44 | 30 | 8 | Peso: 0,74 a 0,92 Comp: 0,78 a 1,23 PC: 0,51 a 0,23 | Normal | Atraso de linguagem | Fonoaudiologia e estimulação |
| 9 | Normocefálico (gemelar 2) | 21 | 32 | 1650 | 40,5 | 31,5 | 8 | Peso: ‐0,88 a 0,02 Comp: ‐1,05 a ‐0,55 PC: 0,59 a 1,48 | Normal | Atraso de linguagem | Fonoaudiologia e estimulação |
| 10 | Normocefálico | 21 | 39+1 | 3540 | 48,5 | 34 | 9 | Peso: 0,31 a 0,83 Comp: ‐0,73 a 0,40 PC: ‐0,36 a 0,29 | Normal | Atraso Adaptativo, motor fino, linguagem e Pessoal‐Social | Fisioterapia, fonoaudiologia e estimulação |
| 11 | Normocefálico | 12+5 | 40+4 | 3570 | 49 | 36 | 9 | Peso: 1,18 a 0,55 Comp: ‐0,08 a 0,74 PC: 1,79 a 1,68 | Calcificação subcortical em lobos frontais e parietais | Normal | Estimulação. |
| 12 | Normocefálico | 37+3 | 39 | 2995 | 47,5 | 35 | 9 | Peso: ‐0,73 a ‐0,31 Comp: ‐1,26 a ‐0,43 PC: 0,42 a ‐0,31 | Normal | Atraso motor fino | Fisioterapia e estimulação. |
| 13 | Normocefálico | 34 | 39 | 2870 | 46 | 35 | 9 | Peso: ‐0,75 a ‐0,99 Comp: ‐1,69 a ‐0,85 PC: ‐0,99 a ‐1,04 | Mielinização mais evidente que o habitual | Normal | Estimulação. |
| 14 | Normocefálico | 8 | 38+4 | 2785 | 48 | 34 | 7 | Peso: ‐0,75 a ‐0,39 Comp: ‐0,62 a ‐0,20 PC: 0,10 a 0,56 | Leve aumento do espaço liquórico frontal com ectasia leve de ventrículos laterais | Atraso de linguagem | Fonoaudiologia e estimulação |
| 15 | Normocefálico | 16+2 | 39+4 | 3080 | 49,5 | 33 | 10 | Peso: ‐0,29 a 1,06 Comp: 0,19 a 1,63 PC: 3,48 a 2,70 | Normal | Normal | Estimulação. |
| 16 | Normocefálico | 35 | 39 | 3340 | 50 | 33,5 | 9 | Peso: 0,15 a ‐0,57 Comp: 0,46 a ‐0,92 PC: ‐0,32 a ‐0,08 | Discretos espaços perivasculares proeminentes nas regiões peritrigonais | Normal | Estimulação. |
| 17 | Normocefálico | 28+4 | 38+2 | 2620 | 47 | 34 | 9 | Peso: ‐1,655 a ‐0,67 Comp: ‐1,52 a ‐0,25 PC: ‐0,36 a ‐0,50 | Normal | Normal | Estimulação. |
| 18 | Normocefálico | 26+6 | 37 | 2855 | 48,5 | 33,5 | 9 | Peso: ‐0,75 a ‐1,68 Comp: ‐0,35 a ‐0,91 PC: ‐0,32 a ‐0,43 | Normal | Normal | Estimulação. |
| 19 | Normocefálico | 21 | 40+4 | 3350 | 50,5 | 34,5 | 9 | Peso: 0,36 a 1,50 Comp: 0,73 a 1,00 PC: 0,52 a 2,43 | Não feita | Normal | Estimulação. |
| 20 | Normocefálico | 5 | 40+4 | 3750 | 51 | 35 | 8 | Peso: 1,18 a 1,40 Comp: 0,99 a 1,34 PC: 0,95 a 1,66 | Não feita | Normal | Estimulação. |
| 21 | Normocefálico | 9 | 40+1 | 3535 | 50,5 | 34,5 | 9 | Peso: 0,78 a 0,42 Comp: 0,73 a 0,33 PC: 0,52 a 1,4 | Normal | Normal | Estimulação. |
| 22 | Normocefálico | 9 | 38 | 2160 | 43,4 | 31,7 | 9 | Peso: ‐2,53 a ‐0,31 Comp: ‐3,09 a ‐1,86 PC: ‐1,84 a 1,24 | Normal | Normal | Estimulação. |
| 23 | Normocefálico | 9 | 39+5 | 3490 | 48 | 34 | 9 | Peso: 0,57 a 0,56 Comp: ‐0,62 a ‐0,07 PC: 0,10 a 1,50 | Normal | Normal | Estimulação. |
| 24 | Normocefálico | 19+4 | 38+4 | 3055 | 47,5 | 34 | 9 | Peso: ‐0,29 a ‐0,14 Comp: ‐0,88 a 0,42 PC: 0,10 a 0,93 | Não feito | Normal | Estimulação. |
| 25 | Normocefálico | 18 | S/I | 4130 | 52 | 36 | 9 | Peso: 1,76 a 1,35 Comp: 1,53 a 1,97 PC: 1,79 a 2,43 | Normal | Normal | Estimulação. |
| 26 | Normocefálico | 11+4 | 36+3 | 2990 | 46,5 | 33 | 9 | Peso: ‐0,52 a 1,50 Comp: ‐1,42 a 0,59 PC: ‐0,74 a 1,13 | Normal | Normal | Estimulação. |
| 27 | Normocefálico | 10 | 38+3 | 3220 | 48 | 35 | 9 | Peso: 0,15 a 0,33 Comp: ‐0,62 a 0,72 PC: 0,95 a 0,18 | Normal | Normal | Estimulação. |
| 28 | Normocefálico | 16 | 41+1 | 3850 | 46,7 | 35,7 | 9 | Peso: 1,08 a 0,37 Comp: ‐1,68 a ‐0,28 PC: 0,97 a 1,20 | Normal | Estimulação. | |
| 29 | Normocefálico | 12 | 37+6 | 3200 | 48 | 36 | 9 | Peso: ‐0,30 a 1,86 Comp: ‐1,00 a 0,75 PC: 1,21 a 2,56 | Normal | Normal | Estimulação. |
PC, perímetro cefálico; IG, Idade gestacional; Comp, comprimento; Neuroimagem (achados): a) oligogiria frontal, calcificações subcorticais frontais, hipoplasia de corpo caloso, ventriculomegalia; b) oligogiria, redução do volume da substância branca, calcificações subcorticais frontais, parietais, occipitais e temporais, imagens císticas junto às paredes dos ventrículos laterais, hipoplasia de corpo caloso, discreta redução do volume do tronco cerebral, acentuada ventriculomegalia supratentorial, aumento do espaço subaracnoide; c) encéfalo hipodesenvolvido, oligogiria, polimicrogiria, calcificações cortiço‐subcortical dos lobos frontais e parietais, formações císticas subependimárias nos polos temporais, região occipital e região frontal, hipoplasia de corpo caloso, tronco cerebral e cerebelo, ventriculomegalia; d) oligogiria, redução do volume da substância branca, calcificações cortiço‐subcorticais, ao redor dos ventrículos laterais e nos núcleos lentiformes, hipoplasia de corpo caloso, malácia junto aos cornos temporais dos ventrículos laterais, redução volumétrica do tronco cerebral, ventriculomegalia; e) oligogiria, redução global do volume da substância branca, calcificações parenquimatosas, com predomínio da região subcortical dos hemisférios cerebrais, hipoplasia de corpo caloso, hipocampos reduzido, ventriculomegalia; f) questionável redução da espessura do trato geniculo‐calcarino, presença de pequenos cistos no plexo coroide à direita, os dois maiores medindo 1,1 x 0,8cm (átrio ventricular) e 0,5x0,3cm (corpo do ventrículo).
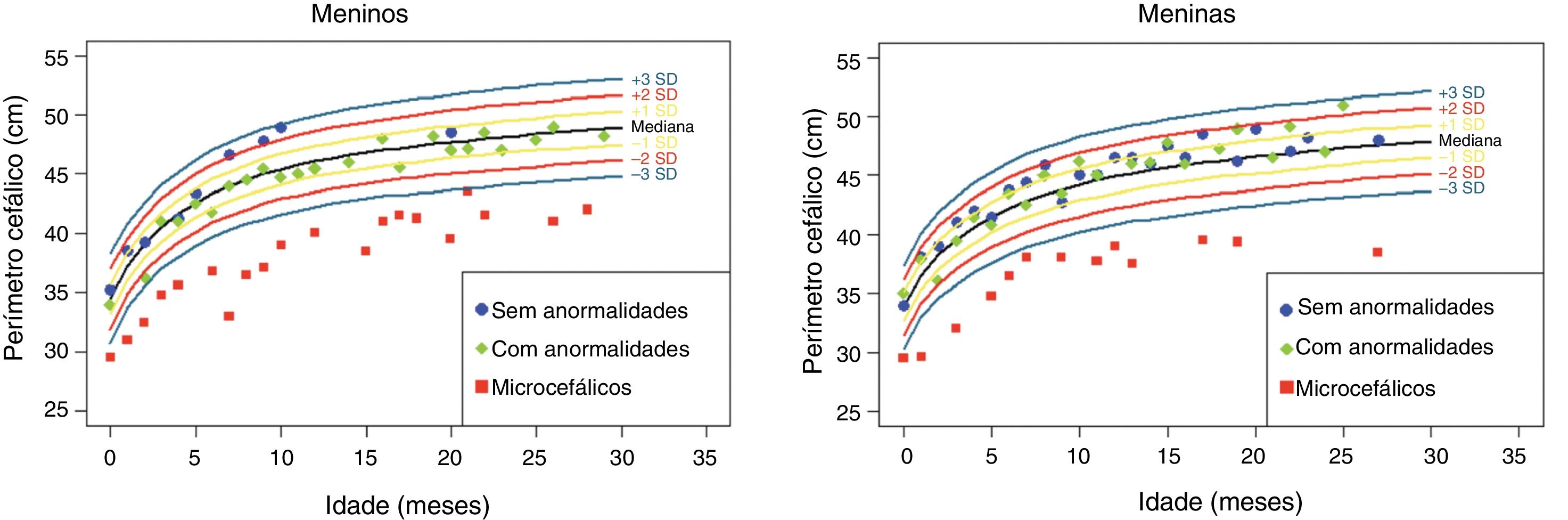
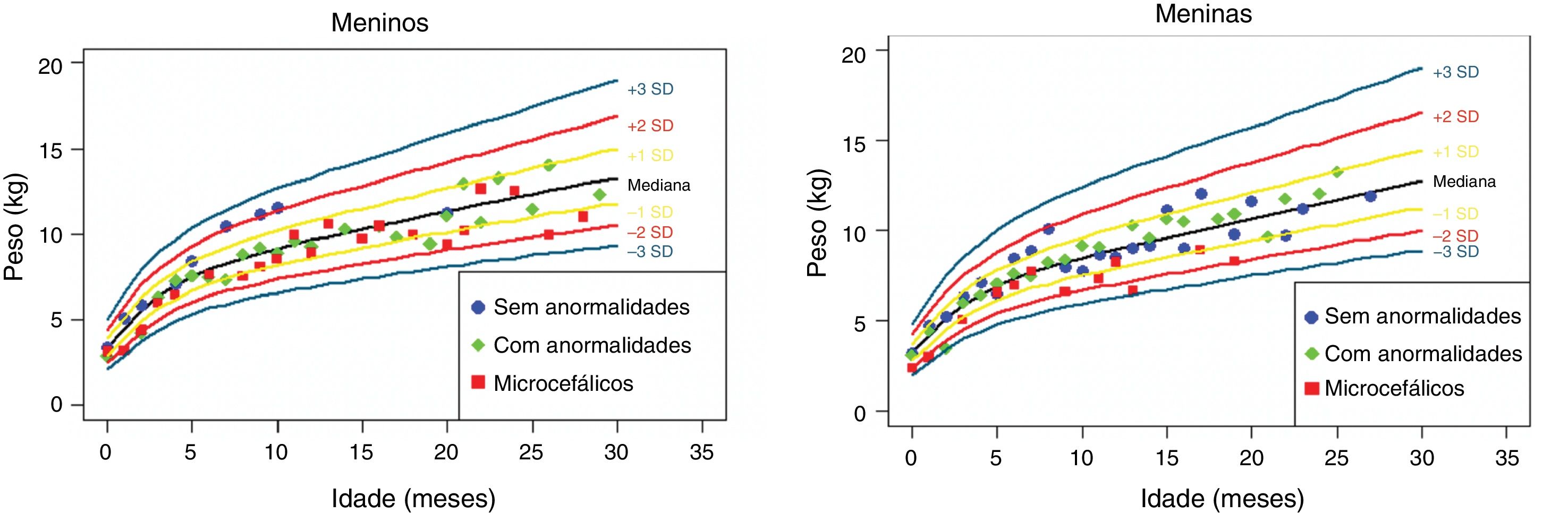
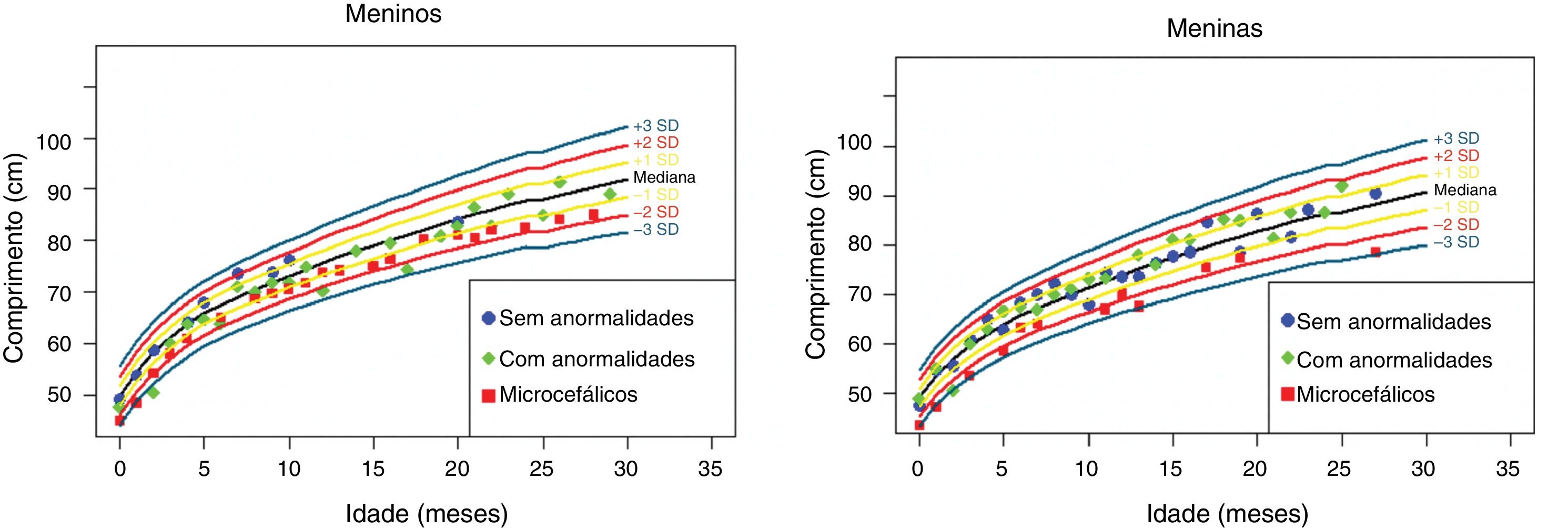
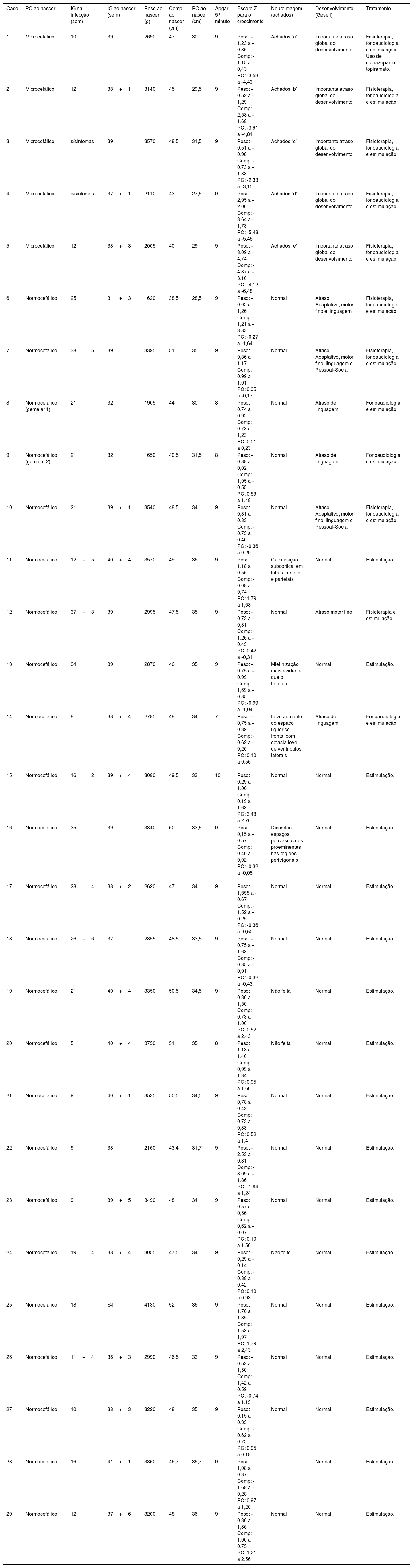
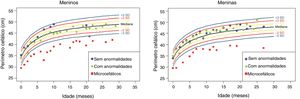
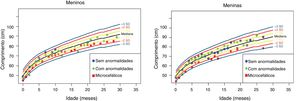
Os dados antropométricos (perímetro cefálico e comprimento em centímetros e peso em quilogramas) obtidos ao longo do acompanhamento prospectivo dessas crianças foram plotados nos seguintes gráficos da OMS41: Perímetro cefálico x Idade (meses), Peso x Idade (meses) e Comprimento x Idade (meses) para meninos e meninas (figs. 1‐3).
Evolução do perímetro cefálico nos dois primeiros anos e meio de vida em uma coorte de 29 crianças cujas mães foram expostas à infecção pelo vírus Zika na gestação, cinco crianças com microcefalia congênita e comprometimento neurológico grave, 11 normocefálicas ao nascimento, com alguma anormalidade neurológica leve, detectada ao longo do acompanhamento, e 13 normocefálicas ao nascimento, sem anormalidades neurológicas durante o acompanhamento.
Ganho ponderal nos dois primeiros anos e meio de vida em uma coorte de 29 crianças cujas mães foram expostas à infecção pelo vírus Zika na gestação, cinco crianças com microcefalia congênita e comprometimento neurológico grave, 11 normocefálicas ao nascimento, com alguma anormalidade neurológica leve, detectada ao longo do acompanhamento, e 13 normocefálicas ao nascimento, sem anormalidades neurológicas durante o acompanhamento.
Evolução da estatura nos dois primeiros anos e meio de vida em uma coorte de 29 crianças cujas mães foram expostas à infecção pelo vírus Zika na gestação, cinco crianças com microcefalia congênita e comprometimento neurológico grave, 11 normocefálicas ao nascimento, com alguma anormalidade neurológica leve, detectada ao longo do acompanhamento, e 13 normocefálicas ao nascimento, sem anormalidades neurológicas durante o acompanhamento.
Crianças que nasceram com microcefalia mantiveram o perímetro cefálico abaixo de três desvios‐padrão (DP) ao longo dos dois primeiros anos de vida. Crianças nascidas normocefálicas apresentaram crescimento do perímetro cefálico adequado ao longo do mesmo período. Já o ganho ponderal permaneceu na faixa de+1DP a ‐2DP para meninos microcefálicos e para os normocefálicos com anormalidades neurológicas, enquanto os normocefálicos sem anormalidades neurológicas se mantiveram entre a mediana e+2DP. Nas meninas não se observou diferença no ganho de peso entre as normocefálicas com ou sem anormalidades neurológicas e observou‐se um ganho de peso menor nas microcefálicas (entre a mediana e ‐3DP). Em relação ao comprimento, a evolução durante os dois primeiros anos de vida foi semelhante entre meninos e meninas, com valores que variaram entre ‐3DP a+2DP, mas com uma tendência a valores menores nos microcefálicos (abaixo da mediana) e mais intensa nas meninas.
Esses dados sugerem que exista uma associação entre a presença de comprometimento neurológico e déficit pondero‐estatural em crianças expostas ao vírus Zika durante a gestação. O provável risco para deficiência de crescimento parece estar associado à presença de algum grau de comprometimento neurológico, mesmo em crianças nascidas sem microcefalia. Em nossa coorte, o crescimento do perímetro cefálico ao longo dos dois primeiros anos de vida mostrou‐se dependente do perímetro cefálico ao nascimento. Crianças nascidas microcefálicas mantiveram‐se microcefálicas e as nascidas normocefálicas mantiveram‐se com valores normais para a idade. Esse comportamento provavelmente está associado ao maior grau de comprometimento estrutural cerebral de crianças nascidas microcefálicas, já que o crescimento craniano depende de um adequado crescimento cerebral e esse é menor na presença de malformações cerebrais mais graves. O crescimento pondero‐estatural não se mostrou tão deficitário como o crescimento do perímetro cefálico, mas se observa uma tendência a menor peso e comprimento ao longo dos dois primeiros anos de vida em crianças com microcefalia congênita e naquelas normocefálicas mas com alguma anormalidade neurológica menor (mais observada em meninas que em meninos). Crianças com algum grau de comprometimento neurológico têm maior risco de déficit pondero‐estatural, diretamente relacionado com o grau de comprometimento neurológico, o que está de acordo com a literatura recente no assunto.9,30,43 Fatores nutricionais e não nutricionais podem contribuir para o déficit pondero‐estatural nessas crianças. De todo modo, as crianças de nossa coorte não mostraram déficit pondero‐estatural expressivo. Isso pode estar relacionado ao fato de terem sido acompanhadas desde o nascimento em um serviço multiprofissional de um hospital universitário, onde diferentes profissionais das áreas de pediatria, neurologia infantil, fisioterapia, nutrição e fonoaudiologia contribuíram para a prevenção e a abordagem precoce de fatores que pudessem contribuir para o déficit pondero‐estatural neste grupo de crianças.
ConclusãoAté o presente momento são escassos na literatura dados que demostrem que a infecção congênita pelo vírus Zika possa afetar o crescimento pondero‐estatural infantil. Os poucos dados existentes sugerem que em crianças com Zika congênita o impacto sobre o crescimento será tanto maior quanto maior for o grau de comprometimento neurológico, associado ou não à microcefalia ao nascimento.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.