To describe the clinical characteristics of children and adolescents admitted to intensive care with confirmed COVID‐19.
MethodProspective, multicenter, observational study, in 19 pediatric intensive care units. Patients aged 1 month to 19 years admitted consecutively (March–May 2020) were included. Demographic, clinical‐epidemiological features, treatment, and outcomes were collected. Subgroups were compared according to comorbidities, age < 1 year, and need for invasive mechanical ventilation. A multivariable logistic regression model was used for predictors of severity.
ResultsSeventy‐nine patients were included (ten with multisystemic inflammatory syndrome). Median age 4 years; 54% male (multisystemic inflammatory syndrome, 80%); 41% had comorbidities (multisystemic inflammatory syndrome, 20%). Fever (76%), cough (51%), and tachypnea (50%) were common in both groups. Severe symptoms, gastrointestinal symptoms, and higher inflammatory markers were more frequent in multisystemic inflammatory syndrome. Interstitial lung infiltrates were common in both groups, but pleural effusion was more prevalent in the multisystemic inflammatory syndrome group (43% vs. 14%). Invasive mechanical ventilation was used in 18% (median 7.5 days); antibiotics, oseltamivir, and corticosteroids were used in 76%, 43%, and 23%, respectively, but not hydroxychloroquine. The median pediatric intensive care unit length‐of‐stay was five days; there were two deaths (3%) in the non‐ multisystemic inflammatory syndrome group. Patients with comorbidities were older and comorbidities were independently associated with the need for invasive mechanical ventilation (OR 5.5; 95% CI, 1.43–21.12; p=0.01).
ConclusionsIn Brazilian pediatric intensive care units, COVID‐19 had low mortality, age less than 1 year was not associated with a worse prognosis, and patients with multisystemic inflammatory syndrome had more severe symptoms, higher inflammatory biomarkers, and a greater predominance of males, but only comorbidities and chronic diseases were independent predictors of severity.
Descrever as características clínicas de crianças e adolescentes internados em unidade de terapia intensiva com COVID‐19 confirmada.
MétodoEstudo prospectivo, multicêntrico, observacional, em 19 unidades de terapia intensiva pediátrica. Foram incluídos pacientes entre um mês e 19 anos, admitidos consecutivamente (março a maio de 2020). As características demográficas, clínico‐epidemiológicas, o tratamento e os resultados foram coletados. Os subgrupos foram comparados de acordo com as comorbidades, idade < 1 ano e necessidade de ventilação mecânica invasiva. Um modelo de regressão logística multivariável foi utilizado para preditores de gravidade.
ResultadosSetenta e nove pacientes foram incluídos (10 com síndrome inflamatória multi-ssistêmica). Mediana de idade, quatro anos; 54% eram do sexo masculino (síndrome inflamatória multissistêmica, 80%); 41% tinham comorbidades (síndrome inflamatória multissistêmica, 20%). Febre (76%), tosse (51%) e taquipneia (50%) foram comuns nos dois grupos. Sintomas graves egastrointestinais e marcadores inflamatórios mais elevados foram mais frequentes na presença de síndrome inflamatória multissistêmica. Infiltrados intersticiais pulmonares foram comuns em ambos os grupos, mas o derrame pleural foi mais prevalente no grupo com síndrome inflamatória multissistêmica (43% vs. 14%). A ventilac¸ão mecânica invasiva foi utilizada em 18% (mediana 7,5 dias); antibióticos, oseltamivir e corticosteroides foram utilizados em 76%, 43% e 23%, respectivamente, mas não a hidroxicloroquina. A mediana do tempo de permanência na unidade de terapia intensiva pediátrica foi de 5 dias; duas mortes ocorreram (3%) no grupo não- síndrome inflamatória multissistêmica. Os pacientes com comorbidades eram mais velhos, e as comorbidades foram independentemente associadas à necessidade de ventilac¸ão mecânica invasiva(OR 5,5; IC95%, 1,43-21,12; P 0,01).
ConclusõesNas unidades de terapia intensiva pediátrica brasileiras, a COVID‐19 apresentou baixa mortalidade, a idade inferior a um ano não foi associada a um pior prognóstico, os pacientes com síndrome inflamatória multissistêmica apresentaram sintomas mais graves, biomarcadores inflamatórios mais elevados e uma grande predominância no sexo masculino, mas apenas a presença de comorbidades e doenças crônicas foi um preditor independente de gravidade.
O Brasil se tornou o epicentro da infecção pelo novo coronavírus (SARS‐CoV‐2) na América do Sul e o segundo país com o maior número de casos e mortes no mundo. A COVID‐19, como essa doença foi chamada pela Organização Mundial da Saúde, ainda representa um desafio na população pediátrica, embora o número e a gravidade dos casos sejam menores quando comparados à população adulta. Dados de vários países mostram que crianças e adolescentes foram responsáveis por menos de 2% dos casos sintomáticos, com taxas de hospitalização (0,6‐20%) e mortalidade (0‐4%) significativamente menores do que nos adultos.1–5 Bebês e crianças com doenças crônicas prévias representam a população pediátrica mais vulnerável, com maior gravidade.1,2,4,5 Recentemente, vários países relataram casos de uma síndrome inflamatória multissistêmica (MIC, do inglês multisystemic inflammatory syndrome) em crianças (MIS‐C) temporariamente associada à COVID‐19. Essa síndrome é caracterizada por febre prolongada, sintomas gastrointestinais e marcadores inflamatórios alterados, associados a sinais de disfunção orgânica, insuficiência cardíaca aguda, doença de Kawasaki (completa ou não) ou síndrome do choque tóxico.6–8
O relato da experiência latino‐americana com a COVID‐19 em pediatria ainda é bastante limitado, principalmente em relação a crianças internadas em unidades de terapia intensiva. Este estudo tem como objetivo descrever as características clínicas de uma coorte de crianças e adolescentes internados em Unidades de Terapia Intensiva Pediátricas (UTIPs) no Brasil.
Material e métodosDesenho do estudo, seleção de pacientes e local do estudoEste é um estudo prospectivo, multicêntrico, feito em 19 UTIPs associadas à Rede Brasileira de Pesquisa em Terapia Intensiva Pediátrica (Brazilian Research Network in Pediatric Intensive Care, BRnet‐PIC). Pacientes pediátricos (um mês a 19 anos) com COVID‐19 confirmada foram incluídos consecutivamente entre 1° de março e 31 de maio de 2020, após a obtenção do consentimento informado. O estudo foi aprovado pelos Comitês de Ética em pesquisa de todas as instituições.
Diagnóstico e coleta de dadosO diagnóstico de COVID‐19 foi confirmado pelo ensaio de reação em cadeia da polimerase com transcrição reversa (RT‐PCR) a partir de swabs oro/nasofaríngeos ou aspirados traqueais e quando fora do período de positividade para RT‐PCR, foram usados anticorpos IgM e/ou IgG positivos contra SARS‐CoV‐2. Os dados demográficos, epidemiológicos, clínicos e de desfecho dos pacientes foram coletados prospectivamente, em formulários padronizados de relato de caso (REDCap, Vanderbilt University, EUA). Os pacientes com MIS e não MIS foram comparados, de acordo com a presença de comorbidades, idade inferior a um ano e necessidade de ventilação mecânica invasiva (VMI).
Processamento de dados e análise estatísticaAs variáveis categóricas foram descritas como frequências e porcentagens e as variáveis contínuas como medianas e intervalos interquartis (IIQs). As comparações entre os grupos foram feitas pelo teste do qui‐quadrado ou exato de Fisher para variáveis categóricas e teste de Mann‐Whitney para variáveis contínuas. Um modelo de regressão logística multivariável foi usado para avaliar a associação das covariáveis com idade inferior a um ano, sexo, etnia e presença de comorbidades com as formas mais graves da doença, caracterizadas pela necessidade de VMI. Foram estabelecidos um nível de significância de 5% (bicaudal) e intervalos de confiança de 95%. O software R, versão 3.6.1 (R Foundation, Viena, Áustria), foi usado para a análise estatística.
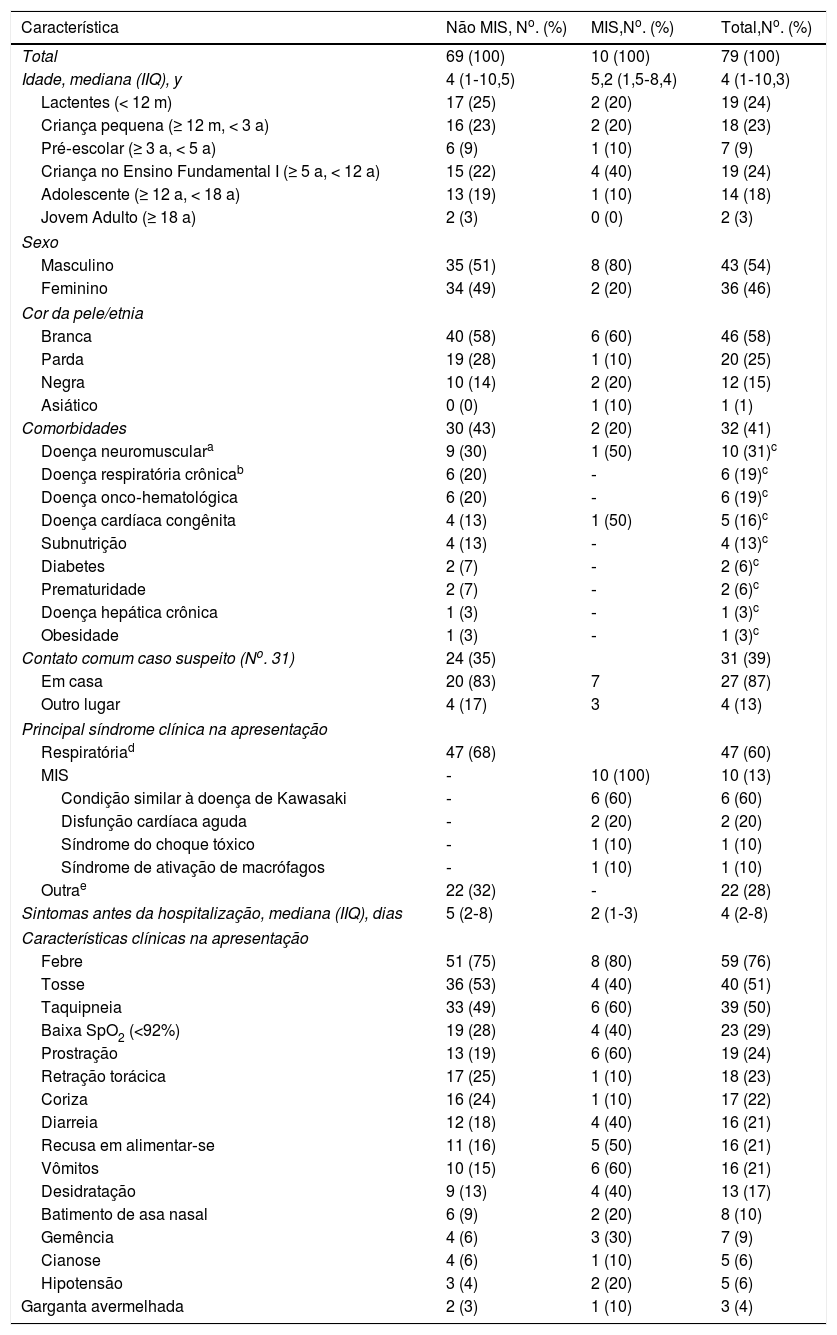
ResultadosCaracterísticas demográficas e epidemiológicasForam incluídos 79 pacientes (10 com MIS). No geral, a média de idade foi de quatro anos, 54% eram do sexo masculino (MIS, 80%), 58% brancos e 41% tinham comorbidades prévias (MIS, 20%), nas quais predominaram doenças neuromusculares (28%), principalmente encefalopatia não progressiva. Outras comorbidades, como doença respiratória crônica, doença onco‐hematológica, doença cardíaca congênita e desnutrição, também foram prevalentes, representaram juntas 27% do total. Trinta e um pacientes (39%) relataram contato com um caso suspeito (domicílio, 87%) (tabela 1).
Dados demográficos, epidemiológicos e clínicos de pacientes pediátricos com COVID‐19
| Característica | Não MIS, No. (%) | MIS,No. (%) | Total,No. (%) |
|---|---|---|---|
| Total | 69 (100) | 10 (100) | 79 (100) |
| Idade, mediana (IIQ), y | 4 (1‐10,5) | 5,2 (1,5‐8,4) | 4 (1‐10,3) |
| Lactentes (< 12 m) | 17 (25) | 2 (20) | 19 (24) |
| Criança pequena (≥ 12 m, < 3 a) | 16 (23) | 2 (20) | 18 (23) |
| Pré‐escolar (≥ 3 a, < 5 a) | 6 (9) | 1 (10) | 7 (9) |
| Criança no Ensino Fundamental I (≥ 5 a, < 12 a) | 15 (22) | 4 (40) | 19 (24) |
| Adolescente (≥ 12 a, < 18 a) | 13 (19) | 1 (10) | 14 (18) |
| Jovem Adulto (≥ 18 a) | 2 (3) | 0 (0) | 2 (3) |
| Sexo | |||
| Masculino | 35 (51) | 8 (80) | 43 (54) |
| Feminino | 34 (49) | 2 (20) | 36 (46) |
| Cor da pele/etnia | |||
| Branca | 40 (58) | 6 (60) | 46 (58) |
| Parda | 19 (28) | 1 (10) | 20 (25) |
| Negra | 10 (14) | 2 (20) | 12 (15) |
| Asiático | 0 (0) | 1 (10) | 1 (1) |
| Comorbidades | 30 (43) | 2 (20) | 32 (41) |
| Doença neuromusculara | 9 (30) | 1 (50) | 10 (31)c |
| Doença respiratória crônicab | 6 (20) | ‐ | 6 (19)c |
| Doença onco‐hematológica | 6 (20) | ‐ | 6 (19)c |
| Doença cardíaca congênita | 4 (13) | 1 (50) | 5 (16)c |
| Subnutrição | 4 (13) | ‐ | 4 (13)c |
| Diabetes | 2 (7) | ‐ | 2 (6)c |
| Prematuridade | 2 (7) | ‐ | 2 (6)c |
| Doença hepática crônica | 1 (3) | ‐ | 1 (3)c |
| Obesidade | 1 (3) | ‐ | 1 (3)c |
| Contato comum caso suspeito (No. 31) | 24 (35) | 31 (39) | |
| Em casa | 20 (83) | 7 | 27 (87) |
| Outro lugar | 4 (17) | 3 | 4 (13) |
| Principal síndrome clínica na apresentação | |||
| Respiratóriad | 47 (68) | 47 (60) | |
| MIS | ‐ | 10 (100) | 10 (13) |
| Condição similar à doença de Kawasaki | ‐ | 6 (60) | 6 (60) |
| Disfunção cardíaca aguda | ‐ | 2 (20) | 2 (20) |
| Síndrome do choque tóxico | ‐ | 1 (10) | 1 (10) |
| Síndrome de ativação de macrófagos | ‐ | 1 (10) | 1 (10) |
| Outrae | 22 (32) | ‐ | 22 (28) |
| Sintomas antes da hospitalização, mediana (IIQ), dias | 5 (2‐8) | 2 (1‐3) | 4 (2‐8) |
| Características clínicas na apresentação | |||
| Febre | 51 (75) | 8 (80) | 59 (76) |
| Tosse | 36 (53) | 4 (40) | 40 (51) |
| Taquipneia | 33 (49) | 6 (60) | 39 (50) |
| Baixa SpO2 (<92%) | 19 (28) | 4 (40) | 23 (29) |
| Prostração | 13 (19) | 6 (60) | 19 (24) |
| Retração torácica | 17 (25) | 1 (10) | 18 (23) |
| Coriza | 16 (24) | 1 (10) | 17 (22) |
| Diarreia | 12 (18) | 4 (40) | 16 (21) |
| Recusa em alimentar‐se | 11 (16) | 5 (50) | 16 (21) |
| Vômitos | 10 (15) | 6 (60) | 16 (21) |
| Desidratação | 9 (13) | 4 (40) | 13 (17) |
| Batimento de asa nasal | 6 (9) | 2 (20) | 8 (10) |
| Gemência | 4 (6) | 3 (30) | 7 (9) |
| Cianose | 4 (6) | 1 (10) | 5 (6) |
| Hipotensão | 3 (4) | 2 (20) | 5 (6) |
| Garganta avermelhada | 2 (3) | 1 (10) | 3 (4) |
COVID‐19, doença do coronavírus 2019; IIQ, intervalo interquartil; MIS, Síndrome Inflamatória Multissistêmica; UTIP, Unidade de Terapia Intensiva Pediátrica, SpO2, saturação de oxigênio no oxímetro de pulso.
Na hospitalização, 47 pacientes (60%) apresentavam sintomas respiratórios, a maioria pneumonia ou bronquiolite (70%), 10 (13%) apresentavam MIS e 60% apresentavam uma condição semelhante à doença de Kawasaki. Os outros 22 (28%) apresentavam principalmente sintomas gastrointestinais e neurológicos (tabela 1). A mediana do tempo dos sintomas antes da hospitalização foi de cinco dias no grupo não MIS e dois dias no grupo MIS. Os sinais e sintomas mais comuns na apresentação foram febre (76%), tosse (51%) e taquipneia (50%). Entretanto, outros achados também foram prevalentes (tabela 1). No grupo MIS, sintomas graves como taquipneia (60%), baixa SpO2 (40%), prostração (60%), gemência (30%), hipotensão (20%), batimento de asa nasal (20%) e cianose (10%), bem como sintomas gastrointestinais (40‐60%), foram mais frequentes do que no grupo não MIS (tabela 1).
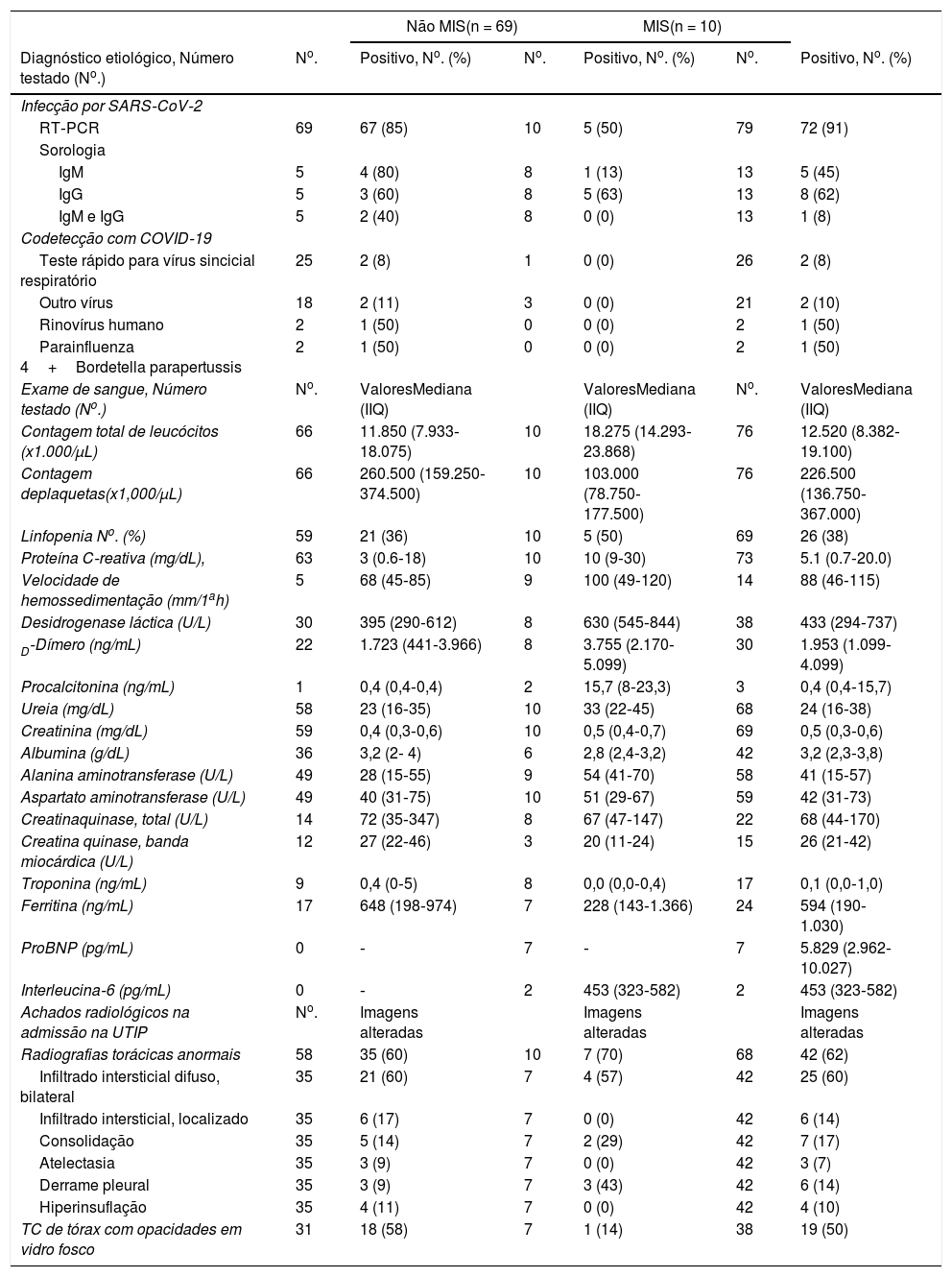
Confirmação do diagnóstico, achados laboratoriais e radiológicosO diagnóstico foi confirmado por RT‐PCR em 72 pacientes (todos os 79 testados, 91% positivos). Os demais tiveram o diagnóstico confirmado pela detecção de anticorpos IgM e/ou IgG (cinco no grupo MIS) (tabela 2). Houve codetecção com outros vírus em 15% dos testados (dois vírus sincicial respiratório, um rinovírus humano e um uma associação de Parainfluenza 4 com Bordetella pertussis) (tabela 2).
Confirmação diagnóstica, achados laboratoriais e radiológicos de pacientes pediátricos com COVID‐19
| Não MIS(n = 69) | MIS(n = 10) | |||||
|---|---|---|---|---|---|---|
| Diagnóstico etiológico, Número testado (No.) | No. | Positivo, No. (%) | No. | Positivo, No. (%) | No. | Positivo, No. (%) |
| Infecção por SARS‐CoV‐2 | ||||||
| RT‐PCR | 69 | 67 (85) | 10 | 5 (50) | 79 | 72 (91) |
| Sorologia | ||||||
| IgM | 5 | 4 (80) | 8 | 1 (13) | 13 | 5 (45) |
| IgG | 5 | 3 (60) | 8 | 5 (63) | 13 | 8 (62) |
| IgM e IgG | 5 | 2 (40) | 8 | 0 (0) | 13 | 1 (8) |
| Codetecção com COVID‐19 | ||||||
| Teste rápido para vírus sincicial respiratório | 25 | 2 (8) | 1 | 0 (0) | 26 | 2 (8) |
| Outro vírus | 18 | 2 (11) | 3 | 0 (0) | 21 | 2 (10) |
| Rinovírus humano | 2 | 1 (50) | 0 | 0 (0) | 2 | 1 (50) |
| Parainfluenza 4+Bordetella parapertussis | 2 | 1 (50) | 0 | 0 (0) | 2 | 1 (50) |
| Exame de sangue, Número testado (No.) | No. | ValoresMediana (IIQ) | ValoresMediana (IIQ) | No. | ValoresMediana (IIQ) | |
| Contagem total de leucócitos (x1.000/μL) | 66 | 11.850 (7.933‐18.075) | 10 | 18.275 (14.293‐ 23.868) | 76 | 12.520 (8.382‐19.100) |
| Contagem deplaquetas(x1,000/μL) | 66 | 260.500 (159.250‐374.500) | 10 | 103.000 (78.750‐177.500) | 76 | 226.500 (136.750‐367.000) |
| Linfopenia No. (%) | 59 | 21 (36) | 10 | 5 (50) | 69 | 26 (38) |
| Proteína C‐reativa (mg/dL), | 63 | 3 (0.6‐18) | 10 | 10 (9‐30) | 73 | 5.1 (0.7‐20.0) |
| Velocidade de hemossedimentação (mm/1ah) | 5 | 68 (45‐85) | 9 | 100 (49‐120) | 14 | 88 (46‐115) |
| Desidrogenase láctica (U/L) | 30 | 395 (290‐612) | 8 | 630 (545‐844) | 38 | 433 (294‐737) |
| D‐Dímero (ng/mL) | 22 | 1.723 (441‐3.966) | 8 | 3.755 (2.170‐5.099) | 30 | 1.953 (1.099‐4.099) |
| Procalcitonina (ng/mL) | 1 | 0,4 (0,4‐0,4) | 2 | 15,7 (8‐23,3) | 3 | 0,4 (0,4‐15,7) |
| Ureia (mg/dL) | 58 | 23 (16‐35) | 10 | 33 (22‐45) | 68 | 24 (16‐38) |
| Creatinina (mg/dL) | 59 | 0,4 (0,3‐0,6) | 10 | 0,5 (0,4‐0,7) | 69 | 0,5 (0,3‐0,6) |
| Albumina (g/dL) | 36 | 3,2 (2‐ 4) | 6 | 2,8 (2,4‐3,2) | 42 | 3,2 (2,3‐3,8) |
| Alanina aminotransferase (U/L) | 49 | 28 (15‐55) | 9 | 54 (41‐70) | 58 | 41 (15‐57) |
| Aspartato aminotransferase (U/L) | 49 | 40 (31‐75) | 10 | 51 (29‐67) | 59 | 42 (31‐73) |
| Creatinaquinase, total (U/L) | 14 | 72 (35‐347) | 8 | 67 (47‐147) | 22 | 68 (44‐170) |
| Creatina quinase, banda miocárdica (U/L) | 12 | 27 (22‐46) | 3 | 20 (11‐24) | 15 | 26 (21‐42) |
| Troponina (ng/mL) | 9 | 0,4 (0‐5) | 8 | 0,0 (0,0‐0,4) | 17 | 0,1 (0,0‐1,0) |
| Ferritina (ng/mL) | 17 | 648 (198‐974) | 7 | 228 (143‐1.366) | 24 | 594 (190‐1.030) |
| ProBNP (pg/mL) | 0 | ‐ | 7 | ‐ | 7 | 5.829 (2.962‐10.027) |
| Interleucina‐6 (pg/mL) | 0 | ‐ | 2 | 453 (323‐582) | 2 | 453 (323‐582) |
| Achados radiológicos na admissão na UTIP | No. | Imagens alteradas | Imagens alteradas | Imagens alteradas | ||
| Radiografias torácicas anormais | 58 | 35 (60) | 10 | 7 (70) | 68 | 42 (62) |
| Infiltrado intersticial difuso, bilateral | 35 | 21 (60) | 7 | 4 (57) | 42 | 25 (60) |
| Infiltrado intersticial, localizado | 35 | 6 (17) | 7 | 0 (0) | 42 | 6 (14) |
| Consolidação | 35 | 5 (14) | 7 | 2 (29) | 42 | 7 (17) |
| Atelectasia | 35 | 3 (9) | 7 | 0 (0) | 42 | 3 (7) |
| Derrame pleural | 35 | 3 (9) | 7 | 3 (43) | 42 | 6 (14) |
| Hiperinsuflação | 35 | 4 (11) | 7 | 0 (0) | 42 | 4 (10) |
| TC de tórax com opacidades em vidro fosco | 31 | 18 (58) | 7 | 1 (14) | 38 | 19 (50) |
COVID‐19, doença do coronavírus 2019; SARS‐CoV‐2, síndrome respiratória aguda grave do coronavírus 2; RT‐PCR, reação em cadeia da polimerase com transcrição reversa; IgM, imunoglobulina M; IgG, imunoglobulina G; IIQ, intervalo interquartil; proBNP, peptídeo natriurético do tipo Pro‐B; UTIP, Unidade de Terapia Intensiva Pediátrica, TC, Tomografia computadorizada.
Linfopenia foi observada em 36% dos pacientes no grupo não MIS (MIS, 50%). A proteína C reativa (PCR) foi de 3mg/dL ou superior em 50% dos 63 pacientes do grupo não MIS, em comparação com 10mg/dL ou superior em 50% dos 10 pacientes do grupo MIS. A velocidade de hemossedimentação (VHS), a desidrogenase láctica (LDH) e o D‐dímero foram testados em 5, 30 e 22 pacientes, respectivamente, no grupo não MIS e quase todos os pacientes no grupo MIS. Eles estavam aumentados em pelo menos 75% de todos os pacientes, mas muito mais altos no grupo MIS. Em contraste, as funções renal e hepática foram testadas na maioria dos pacientes e estavam preservadas em pelo menos 75% delas nos dois grupos. A ferritina e a troponina foram testadas em apenas 24 e 17 pacientes, respectivamente, a maioria deles no grupo MIS. A ferritina estava aumentada em pelo menos 50% dos pacientes e foi maior no grupo não MIS. A troponina estava elevada em pelo menos 50% dos pacientes do grupo não MIS, mas não no grupo MIS. Dos outros marcadores de lesão cardíaca, a creatinofosfoquinase (CK) apresentou anormalidade em 5 dos 22 pacientes (408‐2.345 U/L) e a creatinofosfoquinase fração MB (CK‐MB) estava elevada em 8 dos 15 pacientes (25 e 89 U/L). Apenas um desses pacientes estava no grupo MIS (síndrome do choque tóxico, CK 1.389 U/L, CK‐MB 28 U/L). O peptídeo natriurético do tipo B (pro‐BNP) estava aumentado em 6 dos 7 (86%) pacientes testados, todos no grupo MIS, com uma mediana de 5.829 (variação de 222‐16.996 pg/mL). A procalcitonina foi investigada em apenas três pacientes e estava elevada em todos (um no grupo não MIS, 0,4 ng/mL; dois no grupo MIS: uma disfunção cardíaca aguda, 0,37 ng/mL e uma síndrome de choque tóxico, 31 ng/mL). Por fim, a interleucina‐6 foi mensurada em apenas dois pacientes do grupo MIS, ambos com valores muito altos, em um paciente com disfunção cardíaca aguda (711 pg/mL) e um com síndrome de choque tóxico (194 pg/mL) (tabela 2)
A radiografia de tórax mostrou anormalidades em 60‐70% dos pacientes nos dois grupos, com predominância do infiltrado intersticial difuso bilateral (57‐60%). O derrame pleural estava presente em sete pacientes (43%) no grupo MIS e em apenas três pacientes (9%) no grupo não MIS. Trinta e oito pacientes foram submetidos à tomografia computadorizada (TC) de tórax e opacidades em vidro fosco estavam presentes em 58% no grupo não MIS e em apenas 14% no grupo MIS (tabela 2).
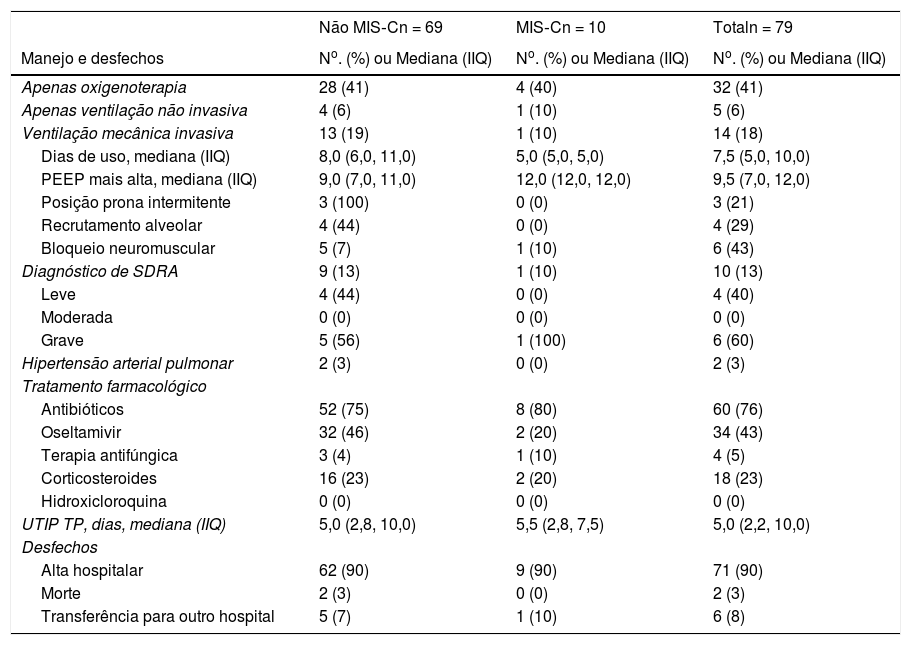
Manejo e resultados clínicosCinquenta e um de todos os pacientes (65%) precisaram de algum tipo de suporte ventilatório: 32 (41%) usaram apenas oxigenoterapia, cinco (6%) precisaram apenas de ventilação não invasiva (VNI) e 14 (18%) necessitaram de VMI. Nos pacientes que necessitaram de VMI, 10 (71%) apresentavam síndrome do desconforto respiratório agudo (SDRA), dos quais seis foram classificados como graves, exigiram bloqueio neuromuscular (n=6), manobra de recrutamento alveolar (n=4) e posição prona intermitente (n = 3) Dois desses pacientes desenvolveram hipertensão arterial pulmonar. A mediana de duração da VMI foi de 7,5 dias (IIQ 5‐10) e a mediana da pressão expiratória final positiva (PEEP) mais alta foi de 9,5 cmH2O (IIQ 7‐12). Um desses casos graves de SDRA estava no grupo MIS (tabela 3).
Manejo e resultados clínicos de pacientes pediátricos com COVID‐19
| Não MIS‐Cn = 69 | MIS‐Cn = 10 | Totaln = 79 | |
|---|---|---|---|
| Manejo e desfechos | No. (%) ou Mediana (IIQ) | No. (%) ou Mediana (IIQ) | No. (%) ou Mediana (IIQ) |
| Apenas oxigenoterapia | 28 (41) | 4 (40) | 32 (41) |
| Apenas ventilação não invasiva | 4 (6) | 1 (10) | 5 (6) |
| Ventilação mecânica invasiva | 13 (19) | 1 (10) | 14 (18) |
| Dias de uso, mediana (IIQ) | 8,0 (6,0, 11,0) | 5,0 (5,0, 5,0) | 7,5 (5,0, 10,0) |
| PEEP mais alta, mediana (IIQ) | 9,0 (7,0, 11,0) | 12,0 (12,0, 12,0) | 9,5 (7,0, 12,0) |
| Posição prona intermitente | 3 (100) | 0 (0) | 3 (21) |
| Recrutamento alveolar | 4 (44) | 0 (0) | 4 (29) |
| Bloqueio neuromuscular | 5 (7) | 1 (10) | 6 (43) |
| Diagnóstico de SDRA | 9 (13) | 1 (10) | 10 (13) |
| Leve | 4 (44) | 0 (0) | 4 (40) |
| Moderada | 0 (0) | 0 (0) | 0 (0) |
| Grave | 5 (56) | 1 (100) | 6 (60) |
| Hipertensão arterial pulmonar | 2 (3) | 0 (0) | 2 (3) |
| Tratamento farmacológico | |||
| Antibióticos | 52 (75) | 8 (80) | 60 (76) |
| Oseltamivir | 32 (46) | 2 (20) | 34 (43) |
| Terapia antifúngica | 3 (4) | 1 (10) | 4 (5) |
| Corticosteroides | 16 (23) | 2 (20) | 18 (23) |
| Hidroxicloroquina | 0 (0) | 0 (0) | 0 (0) |
| UTIP TP, dias, mediana (IIQ) | 5,0 (2,8, 10,0) | 5,5 (2,8, 7,5) | 5,0 (2,2, 10,0) |
| Desfechos | |||
| Alta hospitalar | 62 (90) | 9 (90) | 71 (90) |
| Morte | 2 (3) | 0 (0) | 2 (3) |
| Transferência para outro hospital | 5 (7) | 1 (10) | 6 (8) |
SDRA, Síndrome do Desconforto Respiratório Agudo; IIQ, intervalo interquartil; TP, Tempo de permanência; PEEP, pressão expiratória final positiva; UTIP, Unidade de Terapia Intensiva Pediátrica.
Antibióticos foram usados por 76% de todos os pacientes, oseltamivir em 43% e corticosteroides em 23%. Nenhum paciente recebeu hidroxicloroquina (tabela 3). A mediana do tempo de permanência (TP) na UTIP foi de 5 dias (IIQ 2,2‐10) e a maioria dos pacientes recebeu alta (90%). As únicas duas mortes (3% de mortalidade) ocorreram no grupo não MIS, ambos os pacientes com comorbidades graves e uso crônico de corticosteroides (tabela 3). Um caso era uma menina de 14 anos com doença hepática crônica e o outro, uma menina de um ano com doença pulmonar crônica e síndrome do intestino curto.
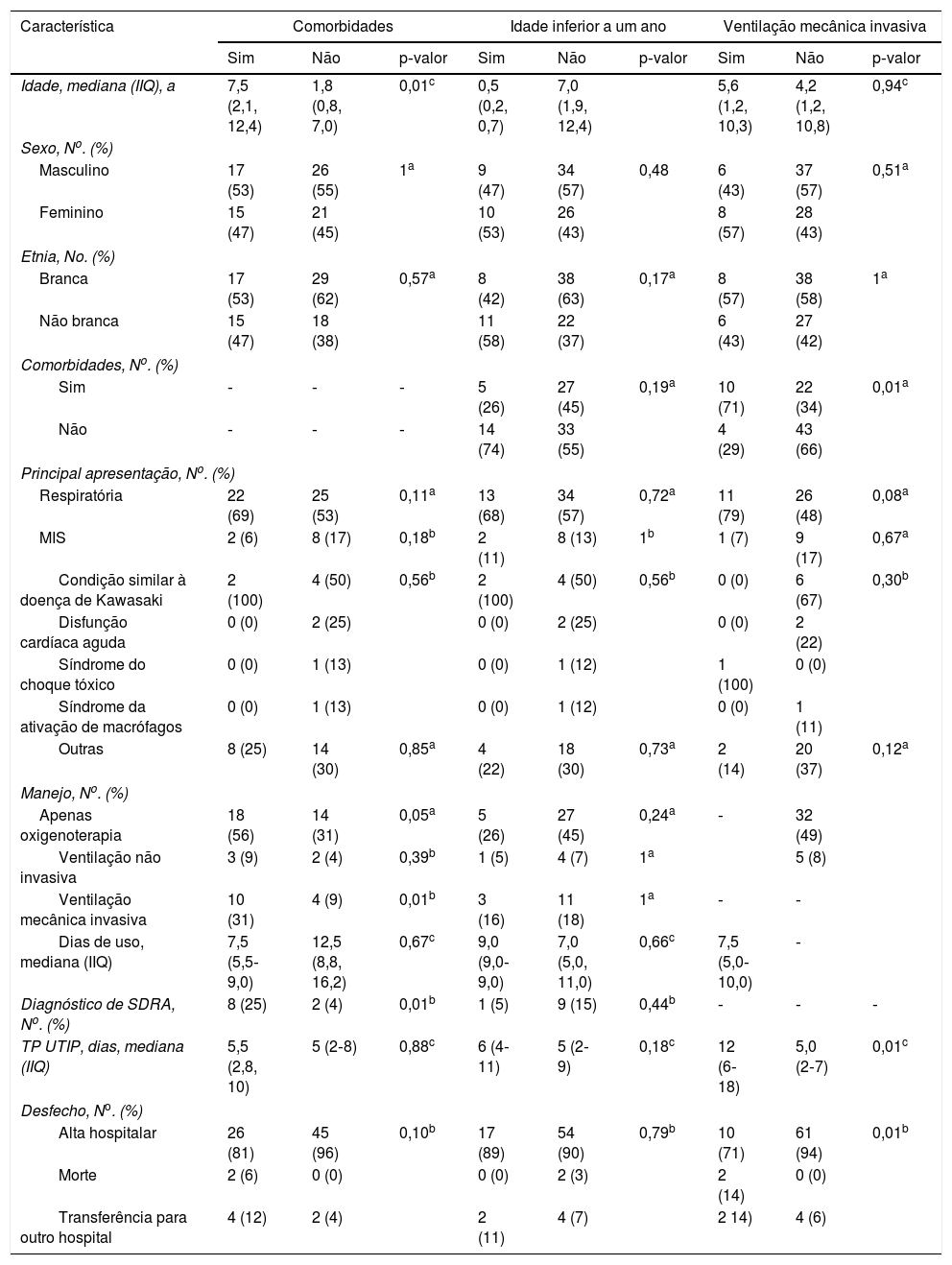
Subgrupos específicosO subgrupo de pacientes com comorbidades era significativamente mais velho (média de idade: 7,5 anos vs. 1,8 ano, p 0,01), tinha maior necessidade de oxigenoterapia (56% vs. 31%, p 0,05) e VMI (31% vs. 9%, p 0,01) e diagnóstico mais frequente de SDRA (25% vs. 4%, p 0,01), mas não houve diferenças em relação à duração do suporte respiratório e do TP na UTIP. Nos pacientes que necessitaram de VMI, o TP na UTIP foi significativamente maior (12,0 vs. 5,0 dias, p 0,01). A idade inferior a um ano não determinou uma apresentação clínica diferente. Nos pacientes com MIS, não observamos diferenças significativas entre os pacientes com comorbidades, idade inferior a um ano e necessidade de VMI (tabela 4a). Também comparamos esses três grupos específicos, consideramos apenas pacientes que não apresentavam MIS, mas os resultados foram bastante semelhantes (tabelas S1 e S2, material suplementar).
Dados demográficos e características clínicas de pacientes pediátricos com COVID‐19 de acordo com a presença de comorbidades, idade inferior a um ano e necessidade de ventilação mecânica invasiva em todos os pacientes (n = 79).
| Característica | Comorbidades | Idade inferior a um ano | Ventilação mecânica invasiva | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Sim | Não | p‐valor | Sim | Não | p‐valor | Sim | Não | p‐valor | |
| Idade, mediana (IIQ), a | 7,5 (2,1, 12,4) | 1,8 (0,8, 7,0) | 0,01c | 0,5 (0,2, 0,7) | 7,0 (1,9, 12,4) | 5,6 (1,2, 10,3) | 4,2 (1,2, 10,8) | 0,94c | |
| Sexo, No. (%) | |||||||||
| Masculino | 17 (53) | 26 (55) | 1a | 9 (47) | 34 (57) | 0,48 | 6 (43) | 37 (57) | 0,51a |
| Feminino | 15 (47) | 21 (45) | 10 (53) | 26 (43) | 8 (57) | 28 (43) | |||
| Etnia, No. (%) | |||||||||
| Branca | 17 (53) | 29 (62) | 0,57a | 8 (42) | 38 (63) | 0,17a | 8 (57) | 38 (58) | 1a |
| Não branca | 15 (47) | 18 (38) | 11 (58) | 22 (37) | 6 (43) | 27 (42) | |||
| Comorbidades, No. (%) | |||||||||
| Sim | ‐ | ‐ | ‐ | 5 (26) | 27 (45) | 0,19a | 10 (71) | 22 (34) | 0,01a |
| Não | ‐ | ‐ | ‐ | 14 (74) | 33 (55) | 4 (29) | 43 (66) | ||
| Principal apresentação, No. (%) | |||||||||
| Respiratória | 22 (69) | 25 (53) | 0,11a | 13 (68) | 34 (57) | 0,72a | 11 (79) | 26 (48) | 0,08a |
| MIS | 2 (6) | 8 (17) | 0,18b | 2 (11) | 8 (13) | 1b | 1 (7) | 9 (17) | 0,67a |
| Condição similar à doença de Kawasaki | 2 (100) | 4 (50) | 0,56b | 2 (100) | 4 (50) | 0,56b | 0 (0) | 6 (67) | 0,30b |
| Disfunção cardíaca aguda | 0 (0) | 2 (25) | 0 (0) | 2 (25) | 0 (0) | 2 (22) | |||
| Síndrome do choque tóxico | 0 (0) | 1 (13) | 0 (0) | 1 (12) | 1 (100) | 0 (0) | |||
| Síndrome da ativação de macrófagos | 0 (0) | 1 (13) | 0 (0) | 1 (12) | 0 (0) | 1 (11) | |||
| Outras | 8 (25) | 14 (30) | 0,85a | 4 (22) | 18 (30) | 0,73a | 2 (14) | 20 (37) | 0,12a |
| Manejo, No. (%) | |||||||||
| Apenas oxigenoterapia | 18 (56) | 14 (31) | 0,05a | 5 (26) | 27 (45) | 0,24a | ‐ | 32 (49) | |
| Ventilação não invasiva | 3 (9) | 2 (4) | 0,39b | 1 (5) | 4 (7) | 1a | 5 (8) | ||
| Ventilação mecânica invasiva | 10 (31) | 4 (9) | 0,01b | 3 (16) | 11 (18) | 1a | ‐ | ‐ | |
| Dias de uso, mediana (IIQ) | 7,5 (5,5‐ 9,0) | 12,5 (8,8, 16,2) | 0,67c | 9,0 (9,0‐ 9,0) | 7,0 (5,0, 11,0) | 0,66c | 7,5 (5,0‐ 10,0) | ‐ | |
| Diagnóstico de SDRA, No. (%) | 8 (25) | 2 (4) | 0,01b | 1 (5) | 9 (15) | 0,44b | ‐ | ‐ | ‐ |
| TP UTIP, dias, mediana (IIQ) | 5,5 (2,8, 10) | 5 (2‐8) | 0,88c | 6 (4‐11) | 5 (2‐9) | 0,18c | 12 (6‐18) | 5,0 (2‐7) | 0,01c |
| Desfecho, No. (%) | |||||||||
| Alta hospitalar | 26 (81) | 45 (96) | 0,10b | 17 (89) | 54 (90) | 0,79b | 10 (71) | 61 (94) | 0,01b |
| Morte | 2 (6) | 0 (0) | 0 (0) | 2 (3) | 2 (14) | 0 (0) | |||
| Transferência para outro hospital | 4 (12) | 2 (4) | 2 (11) | 4 (7) | 2 14) | 4 (6) | |||
| Tabela 4 b ‐ Odds ratio não ajustados e ajustadosd e intervalos de confiança de 95% para pacientes pediátricos com COVID‐19, de acordo com a necessidade de ventilação mecânica invasiva (n = 79) | ||||
|---|---|---|---|---|
| Ventilação mecânica invasiva | ||||
| Não ajustadoOR (CI 95%) | p‐valor | AjustadoOR (CI 95%) | p‐valor | |
| Idade < 1 ano | 1,00 (0,99‐1,01) | 0,69 | 0,99 (0,99‐1,00) | 0,64 |
| Sexo, masculino | 0,57 (0,18‐1,82) | 0,34 | 0,53 (0,15‐1,84) | 0,32 |
| Etnia, não branca | 1,06 (0,33‐3,39) | 0,93 | 0,85 (0,24‐2,98) | 0,80 |
| Comorbidades | 4,89 (1,37‐17,37) | 0,01 | 5,49 (1,43‐21,12) | 0,01 |
IIQ, intervalo interquartil; MIS, síndrome inflamatória multissistêmica; SDRA, Síndrome do Desconforto Respiratório Agudo; UTIP, Unidade de Terapia Intensiva Pediátrica; TP, Tempo de permanência; OR, odds ratio; IC, intervalo de confiança; UTIP, Unidade de Terapia Intensiva Pediátrica.
A análise multivariada mostrou que apenas a presença de comorbidades estava significativamente associada à gravidade, representada pela necessidade de VMI (OR ajustado 5,5; IC95% 1,43‐21,12; p 0,01) (tabela 4b).
DiscussãoQue seja de nosso conhecimento, este é o primeiro estudo prospectivo e multicêntrico a relatar características e resultados de crianças com COVID‐19 internadas em UTIPs no Brasil, o atual epicentro da doença na América Latina e o segundo no mundo, depois dos EUA. Embora a maioria das crianças e adolescentes tenha um curso benigno da doença, demonstramos que alguns pacientes podem desenvolver condições clínicas agudas graves, especialmente aquelas com comorbidades anteriores, e posteriormente também apresentam MIS.
Em nossa coorte, embora a mediana de idade fosse de quatro anos e um quarto dos pacientes fosse lactente, 44% eram crianças em idade escolar, adolescentes e adultos jovens, um percentual superior ao geralmente observado nas UTIPs brasileiras para essa faixa etária, geralmente em torno de 25%.9 Isso é semelhante ao relatado por um grande estudo europeu10 e por UTIPs americanas, que relataram uma porcentagem ainda maior de hospitalizações nessa faixa etária (70%).2,11 Não observamos uma grande diferença entre as medianas das idades dos grupos MIS e não MIS, embora nosso número de pacientes com MIS tenha sido pequeno. Quanto ao sexo, não houve diferenças no grupo não MIS, enquanto nos pacientes com MIS houve predomínio masculino de 4:1, diferentemente do relatado por outros autores.12,13 Houve uma pequena predominância de pacientes de etnia branca (58‐60%), o que está em contraste com a predominância da população brasileira, que é de 56% de não brancos. Entretanto, cerca de metade dos pacientes era de hospitais particulares, acessíveis apenas à população de renda média e alta, onde os brancos são a maioria.
As comorbidades têm sido descritas como um importante fator de risco para casos mais graves de COVID‐19 em crianças, representam entre 50‐80% das admissões em UTIP.11,14,15 Embora tivéssemos uma porcentagem um pouco menor desses pacientes (41%), eles eram significativamente mais velhos e tinham uma apresentação significativamente mais grave (mais SDRA, mais suporte ventilatório, mais VMI). O modelo de regressão logística mostrou que as comorbidades estavam independentemente associadas à necessidade de VMI, com um odds ratio ajustado de 5,5 [IC95%, 1,4‐21,1). Doença neuromuscular, doença respiratória crônica e doença onco‐hematológica foram as comorbidades mais prevalentes em nossa coorte, o que é um pouco diferente de outros relatos em terapia intensiva pediátrica.5,11,14,15
Somente cerca de 40% dos pacientes tinham histórico prévio de contato com um caso suspeito, principalmente em casa, o que é semelhante a outros relatos.4 A febre foi o sintoma predominante, seguido por vários sinais e sintomas respiratórios e gastrointestinais, que não diferiram do que foi relatado em outros estudos.5,10,14,16 Houve maior prevalência de sintomas gastrointestinais no grupo MIS, como diarreia e vômito com desidratação, o que também foi observado por outros autores.12,13 O intervalo entre o início dos sintomas e a hospitalização foi menor no grupo MIS (mediana, 2 vs. 5 dias). Isso pode ser explicado pelos casos mais graves nesse grupo, alguns deles apresentaram sinais de choque e insuficiência cardiorrespiratória. Embora a principal síndrome clínica na hospitalização fosse geralmente de origem respiratória ou gastrointestinal, tivemos 10 pacientes (13%) internados na UTIP por causa da MIS. Esse é um fenômeno novo relacionado à COVID‐19 em crianças e espera‐se que muitos desses pacientes precisem de acompanhamento na UTIP e também por outras especialidades pediátricas.6
A maioria dos nossos pacientes teve seu diagnóstico confirmado por RT‐PCR (91%), mas observamos uma proporção maior de resultados negativos no grupo MIS (50% vs. 15%). Isso é compatível com dados anteriores, mostra que a MIS é uma manifestação tardia associada ao COVID‐19, fora da janela de positividade para a RT‐PCR. Nesse grupo, a associação com uma infecção por SARS‐CoV‐2 foi observada em metade dos pacientes através de sorologia positiva, principalmente IgG. Por outro lado, no grupo não MIS, uma IgM positiva foi detectada em 80% dos poucos casos nos quais foi medida. A codetecção com outros vírus foi observada em 15% dos pacientes nos quais foi investigada (apenas no grupo não MIS), semelhante a outros estudos da COVID‐195,10 e em outras infecções graves por vírus respiratórios em crianças.17
A linfopenia foi observada em geral em 38% dos pacientes (50% no grupo MIS), o que também já foi descrito em outros estudos pediátricos da COVID‐19.5,14,15,18 Embora alguns estudos em adultos tenham associado linfopenia a um prognóstico ruim,19,20 isso ainda não está claro na pediatria. Marcadores inflamatórios, como VHS, PCR, LDH, D‐Dímero, procalcitonina e ferritina, estavam elevados na maioria dos pacientes testados, mas principalmente no grupo MIS, o que está de acordo com os critérios diagnósticos para essa síndrome.21–23 Em nossa coorte, medimos a troponina, CK e CK‐MB em menos de 20% dos pacientes e encontramos níveis elevados em pelo menos 50% deles. Esses biomarcadores de lesões cardíacas também foram relatados com níveis anormais em outros estudos, principalmente em pacientes com algum tipo de insuficiência cardíaca.12–14 Outro marcador sensível conhecido para detecção de insuficiência cardíaca, o ProBNP, estava elevado em todos os sete pacientes nos quais foi medido no grupo MIS, como também relatado em outros estudos.6,24 Também medimos a interleucina‐6 (IL‐6) em dois pacientes do grupo MIS, ambos com disfunção cardíaca grave e choque e níveis muito altos foram encontrados. Níveis elevados já foram descritos em pacientes pediátricos críticos com COVID‐19.5,8,12
Outro achado consistente com disfunção cardíaca em pacientes do grupo MIS foi derrame pleural, detectado por radiografia de tórax, uma característica muito menos frequente no grupo não MIS. Os outros achados radiológicos de infiltrados intersticiais difusos bilaterais e opacidades em vidro fosco, nas radiografias de tórax e na TC, estavam presentes na maioria dos pacientes, o que é consistente com relatos anteriores.10,18,25
Quanto ao manejo dos pacientes, a maioria necessitou de algum tipo de suporte respiratório; a maioria necessitou apenas de oxigenoterapia, mas cerca de 20% necessitaram de VMI (mediana de 7,5 dias), o que está dentro da faixa de uso relatada (18‐50%) descrita em outros estudos.5,10,11,14 Desses, 71% desenvolveram SDRA, principalmente grave, exigiram bloqueio neuromuscular, PEEP alta, manobra de recrutamento alveolar e posição prona em alguns casos. Embora não pudéssemos confirmar infecções bacterianas, a antibioticoterapia foi usada em três quartos dos pacientes e o oseltamivir em quase metade, o que pode ser explicado pelas diretrizes nacionais para o tratamento da SARS, que indicam o uso inicial do oseltamivir empírico.26 A hidroxicloroquina não foi prescrita, embora alguns estudos tenham relatado seu uso em 7 a 47% dos pacientes.5,10,11,14 Talvez essa diferença possa ser explicada pelo fato de os casos na Europa e nos EUA terem começado semanas ou meses antes do Brasil, quando um uso mais compassivo de drogas poderia ser explicado e também menos estudos estavam disponíveis.
Comparamos as características demográficas e clínicas de acordo com a presença de comorbidades, idade abaixo de um ano e necessidade de VMI. Embora nossos números nesses subgrupos fossem pequenos, encontramos diferenças significativas determinadas pela presença de comorbidades. Esses pacientes eram mais velhos e precisavam de mais suporte respiratório, com a maioria dos casos de SDRA. As únicas duas mortes também ocorreram nesse grupo. A presença de comorbidades aumentou de forma independente a chance de VMI, mas os fatores associados a um pior prognóstico precisam de mais investigação. A obesidade, relatada como o pior fator prognóstico em crianças com COVID‐19,5,11 não foi frequente em nossa coorte, na qual as principais comorbidades significativas foram doenças neuromusculares, doenças respiratórias crônicas e câncer. Idade inferior a um ano, sexo e etnia não foram associados a casos mais graves em nosso estudo, embora os lactentes tenham apresentado pior curso clínico na China e nos EUA.1,2 Como a MIS é uma doença pouco compreendida, que parece ocorrer em uma fase subaguda da infecção por SARS‐CoV‐2, também fizemos as mesmas comparações de subgrupos e a avaliação de preditores de gravidade apenas no grupo não MIS, mas os resultados não diferiram. Como também demonstrado em todos os estudos pediátricos sobre a COVID‐19, a grande maioria dos nossos pacientes progrediu bem e recebeu alta, com uma taxa de mortalidade de apenas 3%.
Nosso estudo tem algumas limitações. Como incluiu apenas pacientes brasileiros, isso pode limitar a generalização de nossos resultados. Além disso, faltam alguns detalhes sobre o tratamento, como o motivo do alto percentual de uso de antibióticos ou corticosteroides. Nem todos os pacientes tiveram os marcadores inflamatórios medidos; portanto, eles não puderam ser comparados dependendo da gravidade da doença. Apesar dessas limitações, acreditamos que nosso estudo pode contribuir para uma melhor compreensão da COVID‐19, pois descreve a primeira grande série de pacientes internados em UTIPs no hemisfério sul.
Mostramos que as características dessa doença em locais tropicais e subtropicais são semelhantes às de outros países. Em nossa coorte, a letalidade foi baixa e as doenças crônicas e outras comorbidades desempenharam um papel importante no desenvolvimento de formas graves da doença. Diferentemente de outros estudos, a idade inferior a um ano não foi associada a um pior prognóstico. Pacientes com MIS apresentaram sintomas mais graves, níveis mais altos de biomarcadores inflamatórios e maior predomínio do sexo masculino.
FinanciamentoConselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), processo n° 401597/2020‐2. Fundação Carlos Chagas Filho de Amparo à Pesquisa do Estado do Rio de Janeiro (Faperj), processo n° E‐26/010.000160/2020, concessão n° 2020/0996.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Ana Carolina Cabral P Scarlato ‐ Hospital Rios D’Or; Rodrigo Moulin Silva ‐ Hospital Pedro Ernesto (Uerj); Camila Furtado Guedes Pinto ‐ Hospital Pedro Ernesto (Uerj); Mariana Barros Genuíno de Oliveira ‐ Instituto D’Or de Pesquisa e Ensino (Idor); Jaqueline Rodrigues Robaina ‐ Instituto D’Or de Pesquisa e Ensino (Idor).
Como citar este artigo: Prata‐Barbosa A, Lima‐Setta F, Santos GR, Lanziotti VS, Castro RE, Souza DC, et al. Pediatric patients with COVID‐19 admitted to intensive care units in Brazil: a prospective multicenter study. J Pediatr (Rio J). 2020;96:570.
Estudo vinculado à Rede Brasileira de Pesquisa em Medicina Intensiva Pediátrica (BRnet‐PIC), Brasil.