To analyze the factors associated with leprosy in children who were intradomiciliary contacts of notified adults with the disease in an endemic municipality in Mato Grosso, Brazil.
MethodCase–control study with 204 children under 15 years of age, living in an endemic municipality. Cases (n=40) were considered as the children with leprosy registered at the National Information System of Notifiable Diseases in 2014 and 2015, who were intradomiciliary contacts of at least one adult diagnosed with the disease in the family, and as a control group (n=164) of children living within a radius of up to 100m of the notified cases. Data were obtained through medical file analysis, interviews, and blood samples for anti‐PGL‐I serological test by the ELISA method. The binary logistic regression technique was used, with p≤0.05.
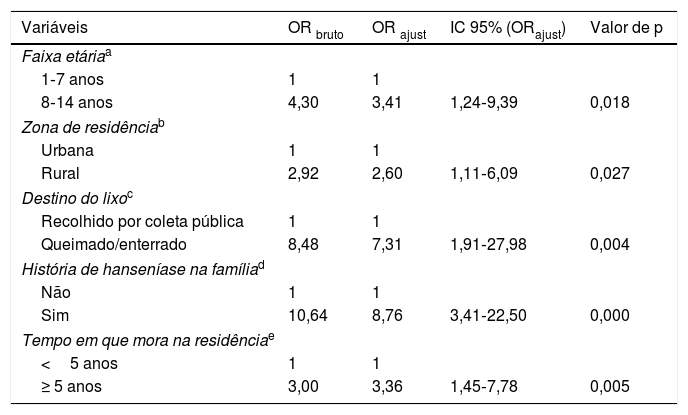
ResultsAfter adjustments, the following were associated with leprosy: age (95% CI: 1.24–9.39, p=0.018), area of residence (95% CI: 1.11–6.09, p=0.027), waste disposal (95% CI: 1.91–27.98, p=0.004), family history of the disease (95% CI: 3.41–22.50, p=0.000), and time of residence (95% CI: 1.45–7.78, p=0.005).
ConclusionFactors associated with the disease indicate greater vulnerability of children aged 8–14 years, associated with living conditions and time of residence, as well as the family history of the disease.
Analisar os fatores associados à hanseníase em crianças contatos intradomiciliares de adultos notificados com a doença em município endêmico, Mato Grosso, Brasil.
MétodoEstudo caso‐controle com 204 menores de 15 anos residentes em um município endêmico. Consideraram‐se casos (n = 40) crianças registradas com hanseníase no Sistema Nacional de Agravos de Notificação em 2014 e 2015 e que eram contatos intradomiciliares de pelo menos um adulto diagnosticado com a doença na família e como grupo controle (n = 164) crianças residentes a um raio de 100 metros dos casos notificados. Os dados foram obtidos por meio de análise de prontuários, entrevistas e coleta de amostras de sangue para investigação sorológica do anti‐PGL‐I pelo método Elisa. Usou‐se a técnica de regressão logística binária e p ≤ 0,05.
ResultadosMostraram‐se associados à hanseníase após ajustes: idade (IC 95%: 1,24–9,39; p = 0,018), zona de residência (IC 95%: 1,11‐6,09; p = 0,027), destino de lixo (IC 95%: 1,91‐27,98; p = 0,004), história da doença na família (IC 95%: 3,41‐22,50; p = 0,000) e tempo de moradia (IC 95%: 1,45‐7,78; p = 0,005).
ConclusãoOs fatores associados à doença indicam maior vulnerabilidade em menores de 8 a 14 anos, ligadas as condições e ao tempo de moradia, bem como a história da doença na família.
A hanseníase em crianças e adolescentes constitui indicador sensível da magnitude do agravo na comunidade, demonstra eficácia limitada dos programas de saúde e permite a identificação dos fatores de risco nessa população.1,2 A presença de deformidades e incapacidades físicas em crianças sugere permanência da transmissibilidade da doença com impacto negativo na autoestima, rendimento escolar e no perfil psicológico.1–3
No Brasil, embora a taxa de detecção da doença em menores de 15 anos aponte uma tendência decrescente em todas as regiões nos últimos 10 anos, algumas unidades federativas e capitais brasileiras se mantêm hiperendêmicas e com tendências estacionárias, o que demanda estratégias preventivas adicionais pela dificuldade de eliminação da doença no país.4,5 Em Mato Grosso, alguns indicadores epidemiológicos, como a proporção de casos multibacilares e a presença de incapacidade física grau 2, revelam o agravo da doença pelo diagnóstico tardio com permanência de fontes de transmissibilidade.3,6
A transmissão do Mycobacterium leprae (M. leprae) na população infantil não difere da ocorrência no adulto. Contudo, a conversão de infecção em doença depende de características intrínsecas do bacilo, da relação desse micro‐organismo com o sistema imunológico do hospedeiro e pode ser influenciada por fatores genéticos, ambientais, estado nutricional, vacinação com BCG (Bacilo de Calmette‐Guerin), carga bacilar, a outras micobactérias e a fatores socioeconômicos desfavoráveis.3,7 Contatos de casos bacilíferos, principalmente intradomicilares menores de 15 anos, são mais susceptíveis de contrair infecção do que o adulto, o risco de desenvolver a doença aumenta entre contatos de cinco a 15 anos e atinge o pico entre os 15 e os 19 anos, seguido por uma diminuição do risco entre os 20 e 29 anos.3,8,9
Acrescenta‐se ainda que quando o doente é portador da forma multibacilar (MB), o risco de seus contatos desenvolverem a doença é maior em relação à forma paucibacilar (PB) e quando esses casos apresentam de duas a cinco lesões, o risco de desenvolver o agravo pode ser semelhante aos contatos de MB.8
Nesse contexto, com vistas a auxiliar no diagnóstico precoce, foram desenvolvidos testes sorológicos capazes de identificar anticorpos específicos contra o M. leprae, entre eles o teste antiglicolipídio fenólico‐1 (anti‐PGL‐I), a fim de detectar a presença de infecção pelo bacilo, antes da manifestação de sinais e sintomas do agravo.10,11 Estudo de revisão sistemática e metanálise indica que a sensibilidade do teste PGL I como preditor do desenvolvimento clínico da hanseníase, entre contatos com a doença, foi inferior a 50% e a especificidade foi superior a 80%.12
Em contatos de casos de hanseníase, o risco de desenvolver a doença é aproximadamente três vezes maior naqueles com resultado positivo para o anti‐PGL I do que naqueles com resultado negativo.12 Contudo, um resultado sorológico negativo não necessariamente significa ausência de infecção, pode se referir a titulação baixa de anticorpos contra o M. leprae, como em formas clínicas PB,13,14 o que reforça a necessidade de acompanhamento sistemático desses indivíduos com a finalidade de diminuir as fontes de infecção do agravo.15,16
A identificação dos fatores de risco para hanseníase em menores de 15 anos e o uso de testes sorológicos podem se configurar como uma estratégia de rastreamento de novos casos nesse grupo populacional mais vulnerável, além de subsidiar intervenções voltadas para o diagnóstico precoce e redução do risco da doença. Atualmente, observa‐se escassez de estudos, principalmente na população infantil, sobre fatores relacionados ao maior risco de desenvolver a doença. Diante desse contexto, o estudo buscou analisar os fatores associados à hanseníase em crianças contatos intradomiciliares de adultos notificados com a doença em município endêmico, Mato Grosso, Brasil.
MétodosEstudo caso‐controle de análise de crianças menores de 15 anos residentes em um município endêmico para hanseníase, Cuiabá, Mato Grosso, Brasil. Foram considerados casos todas as crianças menores de 15 anos diagnosticadas com hanseníase e registradas no Sistema Nacional de Agravos de Notificação (Sinan‐MT) em 2014 e 2015 e que eram contatos intradomiciliares de pelo menos um adulto diagnosticado com a doença na família e como grupo controle todos os contatos de vizinhança sem sinais e sintomas de hanseníase, com resultado do teste sorológico (anti‐PGL‐1) negativo (densidade óptica (DO)<0,150) e que residiam em um raio de até 100 metros dos casos. Todos foram avaliados por especialistas nas unidades de referência para o agravo.
Dos participantes (n=215), foram excluídos aqueles não localizados (grupo casos: n=5), menores avaliados durante o rastreamento para seleção do grupo controle com confirmação diagnóstica de hanseníase (n=2) e com resultado positivo ao teste anti‐PGL‐ I (DO: ≥ 0,150) (n=4). Desses, foram incluídos na análise 40 casos e 164 controles.
As fontes de dados incluíram: fichas de notificação, prontuários médicos (grupo casos) e entrevistas para coleta de dados sociodemográficos, co‐habitacionais, imunológicos e amostra de sangue para a análise do teste sorológico anti‐PGL‐I pelo método Enzyme‐linked immuno sorbent assay (Elisa). A coleta de todos os dados e o rastreamento para identificação do grupo controle foram feitos de fevereiro a julho de 2016.
Foi feito teste‐piloto para adequação das atividades do projeto de pesquisa e instrumento de coleta de todas as informações do presente estudo.
A detecção de anticorpos IgM anti‐PGL‐I foi feita pelo laboratório do Instituto Lauro de Souza Lima, Bauru, São Paulo, Brasil, por meio do método imunoenzimático Elisa, e foi desenvolvida conforme metodologia descrita por Brett17 e Silva.18 Para aplicação da técnica, foram usadas placas de poliestireno com 96 orifícios e revestidas pelo antígeno semissintético ND‐O‐BSA (dissacarídeo natural ligado ao radical octil e acoplado a soro albumina bovina). Para fazer a avaliação da atividade enzimática, foi usada a leitura espectrofotométrica em 490nm (nanômetro). A leitura dos resultados ocorreu por DO, com a subtração dos valores médios das DO dos orifícios com BSA e com ND‐O‐BSA. Considerou‐se uma DO ≥ 0,150 o ponto de corte para positividade ao teste.
Para gerenciamento e análise dos dados usaram‐se os softwares SPSS 20 (Statistical Package for the Social Sciences) e STATA versão 8. Avaliou‐se a consistência dos dados por meio do aplicativo Validate. Para a análise exploratória dos dados quantitativos como a idade, considerou‐se a média e o desvio‐padrão. Para as variáveis categóricas independentes consideraram‐se medidas de frequência absoluta e relativa. Para determinar a relação das variáveis preditoras e o desfecho, usou‐se a odds ratio (OR), com intervalo de confiança de 95%. As variáveis que apresentaram p <0,20 foram inseridas por método stepwise, no modelo de regressão logística binária, mantiveram‐se no modelo final aquelas com significância estatística com valor de p ≤ 0,05.
A presente pesquisa foi aprovada pelo Comitê de Ética em Pesquisa‐ CEP da Secretaria de Estado de Saúde de Mato Grosso/Escola de Saúde Pública, processo n°443.830.
ResultadosEntre os 204 participantes do estudo, 19,6% corresponderam aos casos e 80,4% corresponderam ao grupo controle. As crianças e adolescentes notificados com hanseníase apresentaram média de 10,85 anos, a mínima quatro e a máxima 14 (DP=±2,74). Em relação às características clínicas dos casos, 40% foram classificados como PB e 60% MB. A média de idade entre o grupo controle correspondeu a 7,35 anos, a mínima um e máxima 14 (DP=±3,95). A proporção dos contatos do grupo controle avaliados durante o rastreamento com resultado positivo para teste sorológico anti‐PGL‐1 foi de 2,4%.
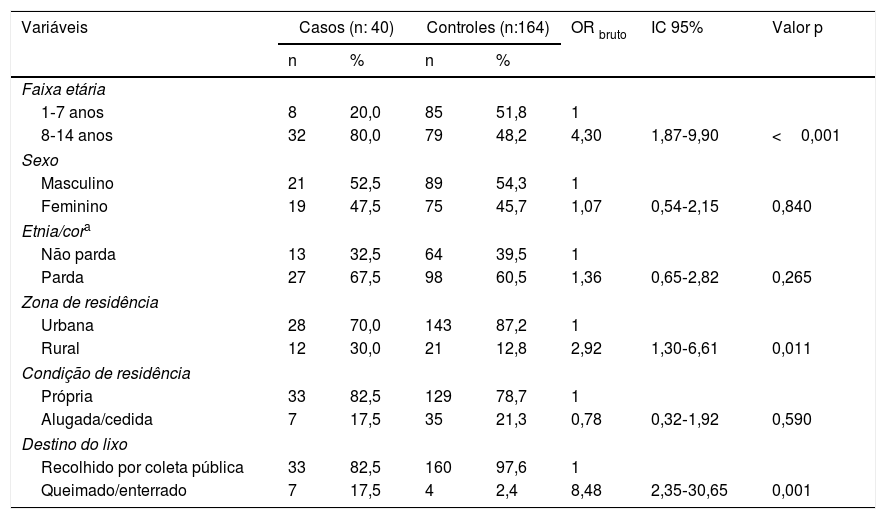
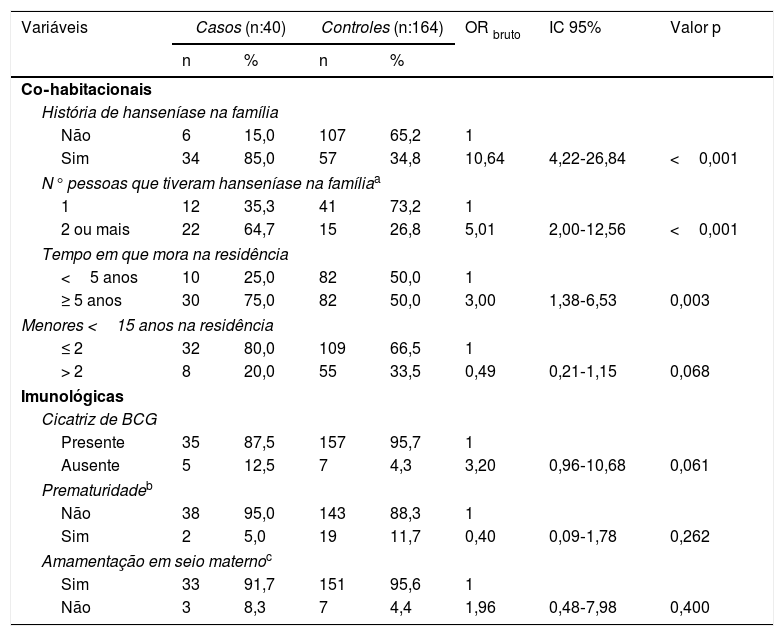
Os resultados das análises bivariadas e ajustadas estão apresentados nas tabelas 1‐3. Verificou‐se após ajustes que a chance de ocorrência de hanseníase nos indivíduos entre oito e 14 anos foi 3,4 vezes maior do que a dos indivíduos com um a sete anos (IC95%: 1,24‐9,39). Para aqueles que residiam em zona rural, a chance de ocorrer a doença foi 2,6 vezes maior quando comparados com aqueles que habitavam em zona urbana (IC95%: 1,11‐6,09). Observou‐se que quando o lixo era queimado ou enterrado a chance de ocorrer hanseníase foi 7,3 vezes maior em comparação com o recolhimento por coleta pública (IC95%: 1,91‐27,98). Crianças com história de doente de hanseníase na família apresentaram chance de manifestação do agravo 8,7 vezes em relação àquelas que não tiveram pessoas com a doença na família (IC95%: 3,41‐22,5). Observou‐se uma probabilidade para a ocorrência de hanseníase de 3,3 vezes entre aqueles com tempo de moradia ≥ 5 anos em relação aos que tinham tempo inferior (IC95%: 1,45‐7,78).
Análise bivariada dos casos de hanseníase menores de 15 anos segundo variáveis sociodemográficas, Cuiabá, Mato Grosso, Brasil
| Variáveis | Casos (n: 40) | Controles (n:164) | OR bruto | IC 95% | Valor p | ||
|---|---|---|---|---|---|---|---|
| n | % | n | % | ||||
| Faixa etária | |||||||
| 1‐7 anos | 8 | 20,0 | 85 | 51,8 | 1 | ||
| 8‐14 anos | 32 | 80,0 | 79 | 48,2 | 4,30 | 1,87‐9,90 | <0,001 |
| Sexo | |||||||
| Masculino | 21 | 52,5 | 89 | 54,3 | 1 | ||
| Feminino | 19 | 47,5 | 75 | 45,7 | 1,07 | 0,54‐2,15 | 0,840 |
| Etnia/cora | |||||||
| Não parda | 13 | 32,5 | 64 | 39,5 | 1 | ||
| Parda | 27 | 67,5 | 98 | 60,5 | 1,36 | 0,65‐2,82 | 0,265 |
| Zona de residência | |||||||
| Urbana | 28 | 70,0 | 143 | 87,2 | 1 | ||
| Rural | 12 | 30,0 | 21 | 12,8 | 2,92 | 1,30‐6,61 | 0,011 |
| Condição de residência | |||||||
| Própria | 33 | 82,5 | 129 | 78,7 | 1 | ||
| Alugada/cedida | 7 | 17,5 | 35 | 21,3 | 0,78 | 0,32‐1,92 | 0,590 |
| Destino do lixo | |||||||
| Recolhido por coleta pública | 33 | 82,5 | 160 | 97,6 | 1 | ||
| Queimado/enterrado | 7 | 17,5 | 4 | 2,4 | 8,48 | 2,35‐30,65 | 0,001 |
IC, intervalo de confiança 95%; OR, odds ratio; p, p‐valor.
Análise bivariada dos casos de hanseníase menores de 15 anos segundo variáveis co‐habitacionais e imunológicas, Cuiabá, Mato Grosso, Brasil
| Variáveis | Casos (n:40) | Controles (n:164) | OR bruto | IC 95% | Valor p | ||
|---|---|---|---|---|---|---|---|
| n | % | n | % | ||||
| Co‐habitacionais | |||||||
| História de hanseníase na família | |||||||
| Não | 6 | 15,0 | 107 | 65,2 | 1 | ||
| Sim | 34 | 85,0 | 57 | 34,8 | 10,64 | 4,22‐26,84 | <0,001 |
| N° pessoas que tiveram hanseníase na famíliaa | |||||||
| 1 | 12 | 35,3 | 41 | 73,2 | 1 | ||
| 2 ou mais | 22 | 64,7 | 15 | 26,8 | 5,01 | 2,00‐12,56 | <0,001 |
| Tempo em que mora na residência | |||||||
| <5 anos | 10 | 25,0 | 82 | 50,0 | 1 | ||
| ≥ 5 anos | 30 | 75,0 | 82 | 50,0 | 3,00 | 1,38‐6,53 | 0,003 |
| Menores <15 anos na residência | |||||||
| ≤ 2 | 32 | 80,0 | 109 | 66,5 | 1 | ||
| > 2 | 8 | 20,0 | 55 | 33,5 | 0,49 | 0,21‐1,15 | 0,068 |
| Imunológicas | |||||||
| Cicatriz de BCG | |||||||
| Presente | 35 | 87,5 | 157 | 95,7 | 1 | ||
| Ausente | 5 | 12,5 | 7 | 4,3 | 3,20 | 0,96‐10,68 | 0,061 |
| Prematuridadeb | |||||||
| Não | 38 | 95,0 | 143 | 88,3 | 1 | ||
| Sim | 2 | 5,0 | 19 | 11,7 | 0,40 | 0,09‐1,78 | 0,262 |
| Amamentação em seio maternoc | |||||||
| Sim | 33 | 91,7 | 151 | 95,6 | 1 | ||
| Não | 3 | 8,3 | 7 | 4,4 | 1,96 | 0,48‐7,98 | 0,400 |
Regressão logística dos fatores associados à ocorrência de hanseníase em menores de 15 anos, Cuiabá, Mato Grosso, Brasil
| Variáveis | OR bruto | OR ajust | IC 95% (ORajust) | Valor de p |
|---|---|---|---|---|
| Faixa etáriaa | ||||
| 1‐7 anos | 1 | 1 | ||
| 8‐14 anos | 4,30 | 3,41 | 1,24‐9,39 | 0,018 |
| Zona de residênciab | ||||
| Urbana | 1 | 1 | ||
| Rural | 2,92 | 2,60 | 1,11‐6,09 | 0,027 |
| Destino do lixoc | ||||
| Recolhido por coleta pública | 1 | 1 | ||
| Queimado/enterrado | 8,48 | 7,31 | 1,91‐27,98 | 0,004 |
| História de hanseníase na famíliad | ||||
| Não | 1 | 1 | ||
| Sim | 10,64 | 8,76 | 3,41‐22,50 | 0,000 |
| Tempo em que mora na residênciae | ||||
| <5 anos | 1 | 1 | ||
| ≥ 5 anos | 3,00 | 3,36 | 1,45‐7,78 | 0,005 |
O presente estudo é pioneiro em fazer o rastreamento de contatos de vizinhança por meio de teste sorológico anti‐PGL‐I em menores de 15 anos, para investigação de fatores associados à ocorrência de hanseníase na população infantil. Os achados indicaram maiores chances de desenvolver a doença a idade entre oito e 14 anos, residir em área rural, com destino de lixo queimado/enterrado, tempo de moradia maior do que cinco anos e história da doença na família.
Embora no estudo os contatos de vizinhança soropositivos ao anti‐PGL‐I em menores de 15 anos tenham sido excluídos (grupo controle), por induzir viés de seleção, evidenciou‐se soropositividade de 2,4% nesse grupo. Outros estudos apontam uma prevalência da soropositividade entre 14% a 18%, contudo entre contatos intradomiciliares na população geral por faixa etária.19,20 Deve‐se considerar que o risco de contrair hanseníase não se restringe ao grupo de parentes diretos que vivem sob o mesmo teto domiciliar, mas compreende contatos de vizinhança e contatos sociais (escolas, trabalho etc.).8
No que se refere à vigilância da doença, os contatos de hanseníase, principalmente a população infantil, devem ser grupos prioritários para o controle do agravo. Orienta‐se às equipes de saúde a avaliação clínica anual, acompanhamento dos casos com maior risco de adoecer por um período de pelo menos cinco anos, imunização com a vacina BCG nos contatos com ausência de sinais e sintomas da doença e orientações à família quanto ao agravo.3
O resultado sorológico positivo entre menores de 15 anos pode ser indicativo de exposição precoce ao M. leprae e permanência da transmissibilidade da doença na comunidade.19 Exposições e reexposições ao bacilo durante relações domiciliares ou extradomiciliares com casos da doença podem levar à infecção. Acrescenta‐se ainda que a imaturidade imunológica das crianças favorece uma maior susceptibilidade a infecções.10
Estudos indicam que menores residentes em área endêmica podem desenvolver anticorpos específicos contra o M. leprae em resposta à exposição precoce ao bacilo e os níveis de anticorpos anti‐PGL‐I no organismo se correlacionam com o índice bacilar presente.16,19
Evidenciou‐se que crianças e adolescentes entre oito e 14 anos apresentam maiores chances de desenvolver o agravo. Outros estudos indicaram que a faixa etária mais acometida entre os menores de 15 anos estava entre 10 e 14 anos, pode se relacionar à resposta imunopatológica dos indivíduos, a fatores genéticos e ao longo período de incubação da doença.21
O maior risco de ocorrência do agravo para aqueles residentes em zona rurais pode ser justificado pelas características locais e sociodemográficas. As áreas rurais apresentam dificuldades de acesso dos indivíduos aos serviços de saúde, o que consequentemente contribui para um diagnóstico tardio, permanência de transmissibilidade ativa da infecção e desenvolvimento de novos casos do agravo.4 O desconhecimento e a não suspeição da patologia por parte dos indivíduos e família e a escassez de profissionais de saúde habilitados também cooperam para o atraso na detecção e proliferação da doença.14 Nesse sentido, é importante desenvolver ações de educação em saúde à população e capacitar as equipes de saúde a fim de torná‐los capazes de fazer suspeição, possibilita um diagnóstico precoce e a quebra da cadeia de transmissão ao se instituir o tratamento.
Outro fator que permaneceu associado à ocorrência da hanseníase nessa população foi o destino do lixo. Sabe‐se que o recolhimento de lixo dos domicílios por meio de coleta pública constitui medida eficaz que objetiva o controle de fatores passíveis de efeitos nocivos à saúde.18 Todavia, parte da população, como os moradores da zona rural e aqueles da periferia urbana, não dispõe desse serviço e provê outras formas de destino ao lixo produzido. Nesse estudo, observou‐se que aqueles que destinavam o lixo para ser queimado ou enterrado apresentaram maiores chances de hanseníase quando comparados com aqueles que tinham recolhimento por coleta pública. Dessa forma, ressalta‐se que as condições ambientais e sanitárias influenciam na qualidade de vida de uma população e no risco de desenvolvimento de doenças.
As crianças e os adolescentes com história de doente de hanseníase na família apresentaram maiores chances de infecção e o risco foi maior dentre aqueles que tiveram dois ou mais casos de hanseníase na família, permaneceu forte associação em análise multivariada. A distância genética e física entre o susceptível e o caso e a intensidade de exposição podem favorecer a incidência do agravo.8,19 Demais estudos referem que o risco de uma pessoa saudável manifestar hanseníase aumenta em nove vezes quando um membro da família é afetado.3 Assim, quanto maior o número de doentes na família, maior será a intensidade de exposição aos bacilos e o risco de infecção nos expostos.8,19
A pesquisa identificou que há maiores chances de ocorrência da doença entre os menores que moravam na residência por um período de cinco anos ou mais. Isso pode estar relacionado ao fato de habitarem aglomerados espaciais endêmicos e compartilharem situações de pobreza, nos quais se tem transmissibilidade facilitada, uma vez que condições socioeconômicas desfavoráveis e precárias condições de moradia influenciam no risco de adoecimento.18,22 Em regiões endêmicas, tais achados são fatores determinantes para manutenção do agravo e aumento da infectividade na população infantil.
Verifica‐se a importância do acompanhamento sistemático das populações de risco, com vistas a um diagnóstico precoce, tratamento oportuno e quebra da cadeia de transmissão, tripé essencial para controle do agravo.21,23 Entretanto, evidenciam‐se dificuldades na implantação rotineira dessa ação pelos serviços de saúde, comprometidos por escassez de recursos humanos e materiais, sobrecarga de trabalho, má administração organizacional, déficit no conhecimento quanto ao agravo, entre outros motivos.
O teste sorológico associado à avaliação clínica pode ser uma estratégia útil para a identificação dos indivíduos infectados em maior risco de desenvolver a doença e auxilia na detecção precoce de casos novos do agravo.19,23 O uso dessas tecnologias torna‐se relevante para subsidiar os serviços de saúde no planejamento e implantação de um acompanhamento metodológico mais eficaz aos contatos de elevado risco.19
Acrescenta‐se ainda que conhecer os fatores associados à hanseníase em contatos menores de 15 anos contribui para a ampliação de conhecimentos, reorientação das políticas públicas e das práticas dos serviços de saúde, além de favorecer o aperfeiçoamento da vigilância do agravo nessa população específica. Recomenda‐se aos profissionais de saúde o desenvolvimento de atividades educacionais entre os indivíduos e as famílias, com a finalidade de contribuir para o conhecimento sobre a doença, condição importante para o exercício do autocuidado nessa população mais vulnerável.
O presente estudo tem como limitações aqueles relacionados ao tipo de estudo adotado, a dados recordatórios que podem influenciar alguns achados. Todavia, para assegurar grupos comparáveis e minimizar possíveis vieses, como a de seleção, incluíram‐se participantes habitantes em mesma área de risco e pertencentes a faixa etária semelhante.
Conclui‐se que os fatores determinantes da ocorrência de hanseníase na população estudada indicam maior vulnerabilidade em menores de oito a 14 anos, ligadas às condições e tempo de moradia, bem como a história da doença na família.
FinanciamentoMinistério da Saúde, Pesquisas Aplicadas em Vigilância em Saúde, Chamamento Público n° 20_2013.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Rodrigues TS, Gomes LC, Cortela DC, Silva EA, Silva CA, Ferreira SM. Factors associated with leprosy in children contacts of notified adults in an endemic region of Midwest Brazil. J Pediatr (Rio J). 2020;96:571–7.