This study aimed to critically review the literature available regarding the Zika virus (ZikaV) outbreak in Brazil and its possible association with microcephaly cases.
SourcesExperts from Instituto do Cérebro do Rio Grande do Sul performed a critical (nonsystematic) literature review regarding different aspects of the ZikaV outbreak in Brazil, such as transmission, epidemiology, diagnostic criteria, and its possible association with the increase of microcephaly reports. The PubMed search using the key word Zika virus in February 2016 yielded 151 articles. The manuscripts were reviewed, as well as all publications/guidelines from the Brazilian Ministry of Health, World Health Organization and Centers for Disease Control and Prevention (CDC‐United States).
Summary of findingsEpidemiological data suggest a temporal association between the increased number of microcephaly notifications in Brazil and outbreak of ZikaV, primarily in the Brazil's Northeast. It has been previously documented that many different viruses might cause congenital acquired microcephaly. Still there is no consensus on the best curve to measure cephalic circumference, specifically in preterm neonates. Conflicting opinions regarding the diagnosis of microcephaly (below 2 or 3 standard deviations) that should be used for the notifications were also found in the literature.
ConclusionThe development of diagnostic techniques that confirm a cause‐effect association and studies regarding the physiopathology of the central nervous system impairment should be prioritized. It is also necessary to strictly define the criteria for the diagnosis of microcephaly to identify cases that should undergo an etiological investigation.
O objetivo deste estudo foi fazer uma revisão crítica da literatura sobre o surto de vírus Zika (ZikaV) no Brasil e sua possível associação com casos de microcefalia.
Fonte de dadosEspecialistas em áreas afins do Instituto do Cérebro do Rio Grande do Sul fizeram uma revisão crítica (não sistemática) da literatura sobre o ZikaV, suas formas de transmissão, a epidemia no Brasil, os critérios diagnósticos e a possível associação com os casos crescentes de microcefalia. O uso da palavra‐chave “Zika vírus” na base de dados do PubMed em fevereiro de 2016 retornou 151 publicações. Esses textos foram revisados, assim como todas as publicações e recomendações do Ministério da Saúde, da Organização Mundial de Saúde e do Centro de Controle de Doenças (CDC‐USA).
Síntese dos dadosOs dados epidemiológicos sugerem uma relação temporal entre aumento da notificação de casos de microcefalia e o surto de ZikaV, principalmente no Nordeste do Brasil. Agentes virais comprovadamente podem ser causadores de microcefalia congênita adquirida. Não existe um consenso sobre a melhor curva de perímetro cefálico a ser usada, principalmente nos prematuros. Assim como também existem divergências sobre a definição de microcefalia (abaixo de dois ou três desvios‐ padrão) a ser padronizada nas notificações.
ConclusãoDeve‐se priorizar o desenvolvimento de técnicas diagnósticas que confirmem uma relação de causa e efeito e estudos sobre mecanismos da patogênese da infecção pelo Zika no sistema nervoso central. Também é necessário definir e universalizar os critérios diagnósticos para a identificação dos casos de microcefalia que devem ser submetidos à investigação etiológica.
A Organização Mundial de Saúde (OMS) lançou um alerta e decretou estado de emergência internacional em função do aumento de incidência de microcefalia em zonas endêmicas com proliferação do vírus Zika (ZikaV).1
A doença, que entrou no Brasil possivelmente em 2014, disseminou‐se na Região Nordeste e está migrando para as Américas. Acredita‐se que deva continuar rapidamente a se propagar, já que o principal vetor, o mosquito Aedes aegypti, está em período de franca disseminação em função das temperaturas elevadas do verão no hemisfério sul.2–4
Uma possível relação entre infecção intrauterina pelo ZikaV e microcefalia precoce foi inicialmente proposta, baseada na observação de médicos do Nordeste do Brasil, que detectaram um súbito aumento na incidência de nascimentos de crianças microcefálicas, após a identificação da entrada do vírus no Brasil. Entretanto, essa relação de causa e efeito ainda necessita ser comprovada.5,6 O fato é que a entrada do ZikaV no sistema nervoso central (SNC), que quebrando a proteção da barreira hematoencefálica, já foi previamente demonstrada em experimentos com animais.7,8
A recente descoberta de outras formas de transmissão do vírus, além da picada do inseto contaminado, através de contato sexual ou por secreções (saliva, urina), e a ausência de vacinas ou tratamento específico têm alarmado a população. Adicionalmente, a falta de marcadores biológicos de maior duração, que possibilitem a confirmação diagnóstica, elevam de forma geométrica o número de casos suspeitos e consequentemente o registro de casos falso‐positivos.9–11
O pediatra é um dos profissionais que estão muito expostos à demanda de conhecimento dessa nova doença, pois é quem atende o neonato e inicia a investigação do quadro de microcefalia. Como a literatura científica é ainda escassa e novas descobertas e informações têm ocorrido rapidamente e com ampla divulgação da mídia, este artigo teve como objetivo reunir um grupo multidisciplinar de especialistas em áreas afins que se propôs a revisar criticamente evidências científicas, protocolos de diagnóstico, diagnóstico diferencial e perspectivas de investigação que possibilitem confirmar a relação entre o ZikaV e a microcefalia.
MetodologiaArtigo de revisão não sistemática feita por painel de especialistas. Este artigo foi dividido em tópicos considerados significativos para um melhor entendimento do surto de ZikaV no Brasil, tais como as dificuldades diagnósticas dessa infecção e o diagnóstico diferencial com as demais infecções cujo vetor é o mosquito Aedes aegypti, as características biológicas do ZikaV, as possíveis relações entre a infecção por ZikaV e alterações do desenvolvimento do SNC, os critérios para determinação de microcefalia e o diagnóstico diferencial etiológico das microcefalias. Adicionalmente discutimos possíveis modelos experimentais que auxiliariam no entendimento da fisiopatogenia das lesões do SNC.
ResultadosO uso da palavra‐chave “Zika vírus” na base de dados do PubMed em fevereiro de 2016 retornou 151 publicações. Esses textos foram revisados, assim como todas as publicações e recomendações do Ministério da Saúde, da Organização Mundial de Saúde e do Centro de Controle de Doenças (CDC‐USA).
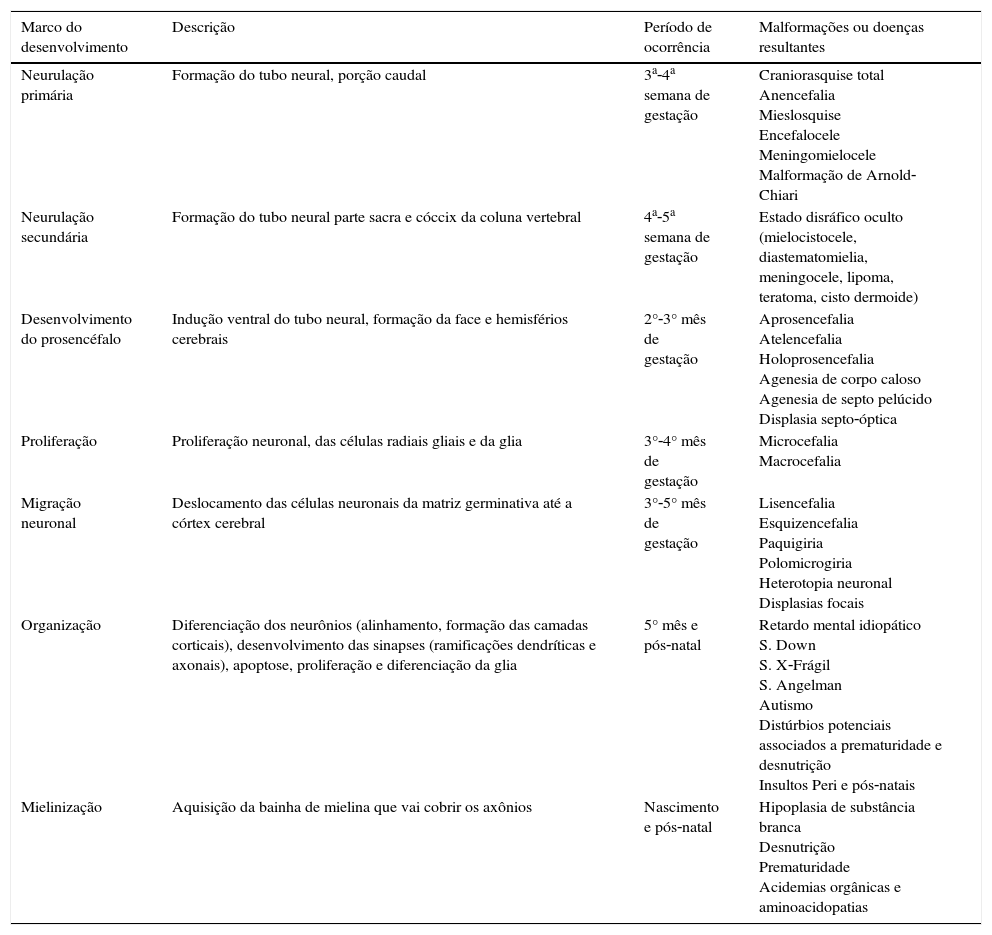
Etapas do desenvolvimento intrauterino do sistema nervoso central (SNC) e distúrbios associadosO desenvolvimento do SNC em humanos inicia na fase de gastrulação, em torno do 14° dia embrionário, quando ocorre um espessamento da membrana ectodérmica, que dará origem à placa neural. A partir daí dois grandes processos vão correr de forma sequencial, a formação do tubo neural e o desenvolvimento do prosencéfalo. Na tabela 1 estão listados os marcos do desenvolvimento, seu período de ocorrência e as malformações decorrentes de problemas ocorridos nessas fases.12
Marcos do desenvolvimento do SNC
| Marco do desenvolvimento | Descrição | Período de ocorrência | Malformações ou doenças resultantes |
|---|---|---|---|
| Neurulação primária | Formação do tubo neural, porção caudal | 3a‐4a semana de gestação | Craniorasquise total Anencefalia Mieslosquise Encefalocele Meningomielocele Malformação de Arnold‐Chiari |
| Neurulação secundária | Formação do tubo neural parte sacra e cóccix da coluna vertebral | 4a‐5a semana de gestação | Estado disráfico oculto (mielocistocele, diastematomielia, meningocele, lipoma, teratoma, cisto dermoide) |
| Desenvolvimento do prosencéfalo | Indução ventral do tubo neural, formação da face e hemisférios cerebrais | 2°‐3° mês de gestação | Aprosencefalia Atelencefalia Holoprosencefalia Agenesia de corpo caloso Agenesia de septo pelúcido Displasia septo‐óptica |
| Proliferação | Proliferação neuronal, das células radiais gliais e da glia | 3°‐4° mês de gestação | Microcefalia Macrocefalia |
| Migração neuronal | Deslocamento das células neuronais da matriz germinativa até a córtex cerebral | 3°‐5° mês de gestação | Lisencefalia Esquizencefalia Paquigiria Polomicrogiria Heterotopia neuronal Displasias focais |
| Organização | Diferenciação dos neurônios (alinhamento, formação das camadas corticais), desenvolvimento das sinapses (ramificações dendríticas e axonais), apoptose, proliferação e diferenciação da glia | 5° mês e pós‐natal | Retardo mental idiopático S. Down S. X‐Frágil S. Angelman Autismo Distúrbios potenciais associados a prematuridade e desnutrição Insultos Peri e pós‐natais |
| Mielinização | Aquisição da bainha de mielina que vai cobrir os axônios | Nascimento e pós‐natal | Hipoplasia de substância branca Desnutrição Prematuridade Acidemias orgânicas e aminoacidopatias |
Modificado de Volpe.12
A fase de proliferação é bastante complexa e ampla, inicia em torno do 2°‐4° mês de gestação com a proliferação neuronal e a geração das células radiais gliais e se prolonga do 5° mês até o fim do 1° ano de vida, quando ocorre a proliferação glial. O processo inicial é caracterizado por células tronco da matriz germinativa que se dividem de forma simétrica, formam as unidades proliferativas neuronais‐gliais, que se distribuem na zona periventricular. Após inicia‐se uma divisão assimétrica, na qual cada célula tronco dá origem a outra célula tronco e a uma célula neuronal pós‐mitótica. Essa divisão assimétrica determina o tamanho da unidade proliferativa.13
Os neurônios pós‐mitóticos migram ao longo das glias radiais para formar as várias camadas do córtex cerebral. Cerca de 1/3 dos neurônios não usa o arcabouço da glia radial e migra de forma tangencial na direção cortical.14 Durante o processo de migração, neurônios passam através de neurônios que já se encontram em posição no córtex, levam a uma laminação na qual os últimos neurônios que chegam na zona cortical posicionam‐se na superfície mais externa do córtex. Essa organização final de seis camadas, histologicamente distintas, reúne uma extraordinária diversidade de subtipos neuronais, que servem como blocos para a formação de um poderoso circuito neural. Nos últimos anos, um enorme progresso tem sido feito para a compreensão dos eventos moleculares que controlam o desenvolvimento do córtex cerebral, bem como das patologias associadas a alterações nesse processo.15
As alterações do desenvolvimento do córtex cerebral apresentam‐se como um grupo de malformações distintas e com patogênese ainda não bem definida. Entre as malformações corticais, um subconjunto de patologias tem sido associado a alterações na migração celular e à neurodiferenciação, entre essas as lisencefalias, as polimicrogirias e as displasias corticais focais. Alguns pesquisadores sugerem que além das alterações na migração celular e neurodiferenciação, devem‐se considerar outros fatores na patogênese das malformações corticais, tais como a proliferação celular, a morte celular, o crescimento e o desenvolvimento intracortical pós‐migração celular e a formação dos axônios e dos dendritos.16,17
A maioria das patologias associadas à alteração na migração celular apresenta uma variedade de genes que podem estar associados ao fenótipo doente, porém em alguns casos o aparecimento é esporádico. Destaca‐se a alta epileptogenicidade do córtex nesses casos.18
Vários fatores ambientais já foram identificados como causadores de malformações corticais. A exposição materna durante o período gestacional a agentes como etanol, alguns ácidos, drogas anticonvulsivantes, mercúrio, radiação e agentes virais, entre outros, pode resultar em distúrbios no desenvolvimento cortical do feto.17
Diagnóstico de microcefaliaA associação observada entre a infecção fetal pelo ZikaV e a ocorrência de microcefalia ao nascer tem elevado a importância de um diagnóstico preciso de microcefalia. É necessário identificar possíveis casos e, ao mesmo tempo, evitar uma investigação custosa e um estado de alerta no sistema de saúde. Na prática, a medida do perímetro cefálico ao nascer abaixo de dois desvios‐padrão da média para a idade gestacional tem sido usada para o diagnóstico clínico de microcefalia. Relatos sobre a prevalência de microcefalia por meio desse critério foram de aproximadamente 0,5%, o que é bem abaixo do que seria esperado para dois desvios.19,20 Isso, provavelmente, deve‐se a uma distribuição não normal da medida do perímetro cefálico. A microcefalia grave, abaixo de três desvios‐padrão da média, ocorre em um a cada 1.000 nascimentos.19
Apesar de ser um método simples e relativamente confiável para diagnóstico, a simples medida do perímetro cefálico pode não refletir um cérebro anormalmente pequeno e não oferece dados para evidenciar um formato anormal do crânio. Dessa forma, é de vital importância que a medida e sua interpretação sejam corretas.
A medida do perímetro cefálico é feita com fita métrica flexível e não elástica. Mede‐se o diâmetro do crânio em sua maior circunferência, com a fita em torno da cabeça, posicionada na testa acima dos olhos, passa acima das orelhas e pela porção mais proeminente da parte posterior do crânio. Em bebês não prematuros, esse perímetro deve ser maior do que 32 cm (pequena variação pela idade gestacional e sexo). O perímetro cefálico aumenta quase linearmente até 37‐38 semanas de gestação.21
A escolha da curva e os critérios de definição de microcefalia têm sido tema de ampla discussão, principalmente no que refere‐se aos prematuros.22,23 A Organização Pan‐Americana de Saúde sugere o uso tanto da curva de Fenton como da curva do estudo InterGrowth.24–26 Entretanto, a análise feita por Victora et al. mostra o quanto a escolha da curva pode impactar no número de casos suspeitos e aumentar de forma exponencial as crianças a serem investigadas e expostas à radiação de tomografia computadorizada. Esses autores sugerem que se deve priorizar instrumentos com maior especificidade, como a curva InterGrowth, em troca da sensibilidade.23
Também é importante uma análise de proporcionalidade do perímetro cefálico em relação às outras medidas de crescimento do recém‐nascido, como peso e comprimento, pois isso também é importante na definição da suspeita sobre a etiologia da microcefalia.19
Apesar de ser uma medida objetiva, um estudo que verificou a variação entre diferentes observadores evidenciou diferenças de mais de 2cm em 5% delas.27 Assim, é necessário o treinamento do pessoal que executa a medida e quando essa for limítrofe ou anormal, deve ser repetida.
Na presença de formas anormais de crânio por características familiares, genéticas ou pelo moldamento decorrente do processo de nascimento, a medida do perímetro cefálico pode ser enganosa e não refletir uma redução do tecido cerebral. Uma das sugestões para reduzir os diagnósticos errôneos de microcefalia seria a repetição das medidas após um ou mais dias do nascimento, especialmente na presença de cavalgamento de suturas ao nascer juntamente com medidas limítrofes. O formato anormal deve direcionar a uma avaliação mais detalhada para presença de cranioestenose e/ou doenças genéticas.
Diagnóstico diferencial etiológico das microcefaliasÉ mais adequado falarmos em microcefalias, por causa das variadas formas, etiologias e expressões clínicas. A patogênese da microcefalia é heterogênea, inclui de causas genéticas a fatores ambientais que podem impactar no neurodesenvolvimento e, assim, influenciar o crescimento do cérebro. Portanto, qualquer fator que possa interferir com a proliferação e/ou diferenciação celular, morte celular etc. pode induzir a microcefalia. Esses fatores podem afetar somente o desenvolvimento do cérebro ou comprometer outras partes do corpo e determinar dismorfismos (microcefalias sindrômicas).22,28
Para facilitar a investigação clínica e o diagnóstico diferencial das microcefalias, vamos inicialmente classificá‐las com base no momento do diagnóstico. Assim, as microcefalias podem ser divididas em duas categorias: a congênita e a pós‐natal, que se desenvolve em geral nos dois primeiros anos de vida.22,28–30 As microcefalias podem ser genéticas ou adquiridas. Essas englobam os fatores externos/ambientais potencialmente lesivos ao cérebro.
Nas microcefalias congênitas adquiridas os fatores agressivos atuam durante o desenvolvimento do cérebro intraútero e incluem as infecções maternas (toxoplasmose, citomegalovírus, herpes vírus, sífilis, rubéola, HIV e agora a possível associação com o ZikaV), a exposição a drogas/substâncias tóxicas (destaca‐se o consumo materno de bebidas alcoólicas, síndrome alcoólica fetal), irradiação, fatores disruptivos que interrompem o desenvolvimento cerebral normal (por ex., hemorragia, isquemia, síndrome hipóxico‐isquêmica, trauma crânio‐encefálico) e carência nutricional (desnutrição materna, insuficiência placentária, hipotireoidismo ou deficiência de folato na mãe).22,28,31–33
As microcefalias congênitas genéticas podem estar associadas a cromossomopatias ou a determinados genes, como na microcefalia autossômica recessiva (MCPH, do inglês, Microcephaly Primary Hereditary, historicamente conhecida como microcefalia vera), na qual pelo menos 12 genes foram identificados, que codificam proteínas associadas ao centrossoma.34,35 Aqui o termo microcefalia primária corresponde àquelas em que a redução do volume cerebral é primariamente decorrente da redução da população neuronal durante a neurogênese.29,36 Em geral na MCPH a estrutura geral do cérebro está mantida, não há outras malformações ou alterações dos padrões de desenvolvimento do cérebro.
As microcefalias pós‐natais são aquelas em que a criança nasce com perímetro cefálico normal, há uma desaceleração do crescimento craniano com o tempo, atinge níveis de microcefalia. As microcefalias de início pós‐natal estão associadas a causas genéticas ou a fatores externos/ambientais (adquiridas).22
Como exemplo de microcefalias pós‐natais adquiridas incluímos aquelas decorrentes de traumatismo crânio‐encefálico, a isquemia/hemorragia cerebral, a encefalite e a desnutrição grave, entre outras. Várias microcefalias pós‐natais são determinadas por mutações que interferem na regulação da expressão de genes durante o desenvolvimento do encéfalo.30
Entre as microcefalias pós‐natais genéticas, todas associadas a mutações (mutação deleção, inserção, duplicação, fusão, mudanças circunstanciais de aminoácidos), encontram‐se as decorrentes de erros inatos do metabolismo, doenças neurodegenerativas e várias síndromes, como, por exemplo, as de Angelman, de Pitt‐Hopkins, de Rubinstein‐Taybi e de Christianson e os transtornos relacionados à MECP2 (síndrome de Rett).30
O conhecimento da prevalência, a história clínica e o exame clínico e neurológico detalhados podem nos conduzir ao diagnóstico. A história clinica pode revelar a exposição a agente, acidente ou episódio nocivo ao cérebro e o exame clínico pode sugerir algumas síndromes menos frequentes.
O vírus ZikaPertencente à família Flaviviridae, o vírus Zika é relacionado a outros flavovírus de relevância médica transmitidos por artrópodes vetores, como os agentes causadores da dengue, febre chikungunya, febre amarela e encefalite do Oeste do Nilo. O vírus Zika foi isolado em 1947 em primatas não humanos (macacos sentinelas para monitoramento da febre amarela), em Uganda, na floresta Zika, motivo dessa denominação para esse vírus.37
Existem pelo menos duas linhagens do vírus Zika, a africana (que alguns autores subdividem em Oeste e Leste da África) e a asiática. Estudos filogenéticos indicam que o vírus atualmente em expansão nas Américas derivou da linhagem asiática.38 A transmissão do vírus Zika é primordialmente vetorial por mosquitos do gênero Aedes, no ciclo selvático por espécies como A. albopictus, entre outras, e no ciclo urbano pelo A. aegypti. O vírus é transmitido pelo vetor hematófago durante o repasto sanguíneo, aloja‐se em suas glândulas salivares, nas quais se multiplica sem afetar o inseto, permanece nesse por toda sua vida. Além de primatas, provavelmente outros mamíferos, como zebras, elefantes e também roedores, podem ser reservatórios naturais do vírus Zika.
Flavovírus são pequenas (∼50nm) partículas esféricas, envoltas em um envelope lipídico.39 O Zika é um vírus RNA simples‐fita com 10.794 kilobases, com duas regiões não codificantes e uma longa fase de leitura que codifica uma poliproteína. Essa é clivada por proteases da célula hospedeira para originar a proteína C do capsídeo, o precursor de membrana (prM), a proteína E do envelope, e sete proteínas não estruturais, classificadas como de NS1 a NS7. Os vírions, ou partículas virais, contêm 180 cópias da proteína E, quantidades desconhecidas das outras proteínas e uma única molécula do RNA viral. A superfície dos vírions é formada pelas proteínas E e M. A proteína E (∼53kDa) é glicosilada, é o principal determinante antigênico viral, com funções de ligação e fusão de membrana quando o vírus entra na célula infectada.40 Postula‐se que os vírions são endocitados e a exposição ao meio acídico nos lisossomos promove a fusão entre o envelope do vírus e as membranas celulares. Após a liberação do RNA viral no citoplasma da célula infectada, esse é reproduzido e traduzido pela maquinaria celular e leva à formação de novas partículas virais.
Dois genomas completos do vírus Zika, inclusive da variedade circulante nas Américas já estão disponíveis.38,41 Faye et al. estudaram 37 isolados do vírus, provenientes de diferentes fontes (mosquitos, pacientes, animais etc.) obtidos na África e evidenciaram indícios de recombinação gênica e alterações no padrão de glicosilação da proteína E como prováveis adaptações ao vetor A. dalzieli.40 Freire e al., ao investigar 17 sequências genômicas do vírus, sugeriram que mudanças no uso de códons para a proteína NS1 na linhagem asiática do vírus Zika podem estar correlacionadas com maiores taxas de reprodução e título viral em humanos.42
Infecções virais intrauterinas que resultam em insultos ao sistema nervoso central são relativamente raras, destacam‐se o citomegalovírus, o herpes vírus e a rubéola entre os já conhecidos por causarem patologias fetais. Entre os flavovírus, apenas alguns casos foram relatados de vírus da encefalite do Oeste do Nilo em gestantes como provável causa de sequelas neurológicas em fetos.43
Epidemiologia e protocolo de vigilância no BrasilOs primeiros casos de infecção em humanos foram descritos na Nigéria e na Tanzânia em 1952‐1954.37 O vírus se disseminou posteriormente para o continente asiático e a comunidade internacional somente passou a reconhecer o potencial epidêmico do vírus Zika a partir de 2005 e principalmente após o surto de 2007 na Micronésia (ilha Yap no Pacífico) e o de 2012/2013 na Polinésia Francesa. Casos importados foram descritos a partir de 2013 na Alemanha, no Canadá, na Itália, no Japão, nos EUA e na Austrália. Em 2014 foi descrita a presença do vírus na Ilha de Páscoa (Chile, Oceano Pacífico).44 Em 29 de de abril 2015 foi detectada pela primeira vez a circulação desse vírus no Brasil e na América do Sul (continente). Pesquisadores da Universidade Federal da Bahia (UFBA) reportaram a identificação ZikaV por meio de técnica RT‐PCR em oito de 25 amostras testadas (Camaçari/BA).3,45
O governo brasileiro deu início em outubro de 2015 às investigações conjuntas com Pernambuco após a observação do aumento do número de casos de microcefalia, principalmente nesse estado, e da confirmação da alteração do padrão de casos de microcefalia. Em novembro lançou a primeira Diretriz Nacional de Microcefalias, ainda com o diagnóstico de microcefalia quando o perímetro cefálico (PC) era ≤33cm. Nesse mesmo mês, após a detecção do ZikaV no líquido amniótico em gestantes na Paraíba pela Fiocruz, confirmou a relação microcefalia com infecção pelo ZikaV.46 Em dezembro do mesmo ano divulgou o Protocolo de Microcefalia – Vigilância – Versão 1, que alterou o diagnóstico de microcefalia, que passou a ser definida quando o PC era ≤32cm, e incluiu nesse protocolo também gestantes com exantema, aborto espontâneo, feto com microcefalia e natimorto.44 Em 14 de dezembro divulgou o Protocolo de Microcefalia – Atenção à Saúde. Importante ressaltar que essa alteração do perímetro cefálico para diagnóstico de microcefalia pode influenciar na análise dos dados.
Em janeiro de 2016 foi lançada a Diretriz Nacional para Estimulação Precoce de Bebês com Microcefalia. Nesse mês também ocorreu a identificação pelo CDC‐EUA de quatro casos relacionados com o ZikaV. O governo brasileiro fez ajustes nas definições operacionais de casos: A) Definições de casos para vigilância de microcefalia: (i) Recém‐nascido com microcefalia, (ii) Aborto espontâneo sugestivo de infecção congênita, (iii) Natimorto com microcefalia e/ou malformações do SNC sugestivas de infecção congênita, (iv) Feto com microcefalia e/ou alterações do sistema nervoso central, sugestivos de infecção congênita; e B) Definições de casos para vigilância de infecção pelo vírus Zika durante a gestação: (i) Gestante com exantema agudo sugestivo de infecção pelo vírus Zika.46
Os casos suspeitos de microcefalias devem ser notificados imediatamente às autoridades sanitárias e registrados no formulário de Registro de Eventos de Saúde Pública (Resp–Microcefalias), disponível no endereço eletrônico: www.resp.saude.gov.br. A notificação do caso suspeito de microcefalia no Resp não exclui a necessidade de se notificar o mesmo caso no Sistema de Informações sobre Nascidos Vivos (Sinasc).47,48
Após o estabelecimento da relação ZikaV com microcefalia, é necessário que os cuidados e as medidas de prevenção sejam feitos e intensificados, porém é fundamental explicar, acalmar e fazer uma análise dos números atuais sobre os casos.
O Ministério da Saúde divulgou em 20 de janeiro de 2016 um informe epidemiológico com algumas alterações relevantes e interessantes, como a troca do nome do Protocolo de Vigilância e Resposta à Ocorrência de Microcefalia Relacionada a Infecção pelo Vírus Zika para Protocolo de Vigilância e Resposta à Ocorrência de Microcefalia, independentemente da causa. Esse mesmo informe descreve, de modo separado, os 224 casos de microcefalia confirmados com exame de imagem com alteração típica dos seis casos com amostra positiva para ZikaV.49
Outro informe epidemiológico em 2 de fevereiro de 2016 foi divulgado com um acumulado (2015‐2016) de 4.783 casos notificados de microcefalias e/ou outras alterações do SNC, incluindo possíveis casos relacionados ao ZikaV e a outras infecções. Importante salientar que não temos quase 5.000 casos de microcefalia relacionados ao ZikaV, como muitas pacientes e também alguns profissionais de saúde possam imaginar. Na realidade, temos essa notificação de casos suspeitos, o número de casos ainda em investigação soma 3.670, enquanto que o número de casos já concluídos é em torno de 1.113. Desses casos concluídos, 709 (63%) já foram descartados para microcefalia relacionada à infecção congênita. Os casos restantes, 404 (37%), foram considerados confirmados para microcefalia e/ou outras alterações SNC, porém a identificação da presença do ZikaV no líquido amniótico, na placenta e em tecidos fetais ocorreu somente em 17 casos até o momento.49
Outro informe epidemiológico em 12 de fevereiro de 2016 foi divulgado com um acumulado (2015‐2016) de 5.079 casos notificados de microcefalias e/ou outras alterações do SNC, incluindo possíveis casos relacionados ao ZikaV e a outras infecções. Importante salientar que não temos em torno 5.000 casos de microcefalia relacionados ao ZikaV como muitas pacientes e também alguns profissionais de saúde possam imaginar. Na realidade temos essa notificação de casos suspeitos, sendo que o número de casos ainda em investigação soma 3.852 e o número de casos já concluídos é em torno de 1.227. Desses casos concluídos, 765 (62%) já foram descartados para microcefalia relacionada à infecção congênita. Os casos restantes, 462(38%), foram considerados confirmados para microcefalia e/ou outras alterações no SNC, porém a identificação da presença do ZikaV no LA, na placenta e em tecidos fetais ocorreu em 41 casos até o momento. Desde o início das investigações, os 462 casos confirmados foram registrados em 175 municípios de 13 estados brasileiros. A Região Nordeste concentra 98% dos municípios com casos confirmados, Pernambuco com 167 casos, seguido por Bahia (101), Rio Grande do Norte (70), Paraíba (54), Piauí (29), Alagoas (21), Ceará (11), Espírito Santo (três), Rio de Janeiro (dois), Pará (um), Goiás (um), Mato Grosso do Sul (um) e Rio Grande do Sul (um).50
A Brazilian Medical Genetics Society – Zika Embryopathy Task Force aponta quatro limitações no relatório dos casos: uma subnotificação prévia dos casos reais de microcefalias no Brasil e que o próprio protocolo de notificação pode ter favorecido o aumento dos casos registrados. Segundo: casos leves de microcefalia talvez não fossem notificados porque o perímetro cefálico não era rotineiramente medido. Terceiro: a infecção do ZikaV não foi confirmada laboratorialmente nos neonatos e nas mães e que a história de uma doença exantemática não específica durante a gravidez é subjetiva, pode levar a um viés de memória e resulta numa classificação errada da potencial exposição pelo ZikaV. Quarto: o relatório dos casos não comenta sobre outros achados comuns em infecções intrauterinas, como hepatoesplenomegalia, exantema e coriorretinite, ou em algumas características que têm sido relatadas em casos de presumível Zika, incluindo perda de audição, máculas pálidas e dificuldade de deglutição.5
Essa análise dos números não deve servir para relaxar com as medidas preventivas, pelo contrário, seria muito interessante orientar as gestantes a adotarem medidas que possam reduzir a presença do mosquito Aedes aegypti, como a eliminação de criadouros, proteger‐se da exposição de mosquitos, manter as portas e janelas fechadas ou teladas, usar calça e camisa de manga comprida e repelentes permitidos na gestação.
Orientações multidisciplinares, como, por exemplo, numa revisão de rotina de uma criança no pediatra, podem ser uma oportunidade para que essa mulher receba a orientação de que ela procure planejar sua próxima gestação e que procure se consultar com o ginecologista antes de parar de usar seu método contraceptivo.
Quadro clínico das infecções por ZikaV e diagnóstico diferencial com dengue e chikungunyaOs vírus da dengue e da chikungunya apresentam sinais e sintomas clínicos semelhantes, principalmente nos estágios iniciais das doenças.51 Isso também acontece com o ZikaV. Por essa razão é fundamental a diferenciação dessas três patologias.
ZikaCerca de 80% das pessoas infectadas são assintomáticas.52,53 Quando presentes, os sintomas podem durar de poucos dias até uma semana. Os sintomas são geralmente brandos, é característico o início súbito de quadro febril, artralgia, rash maculopapular ou conjuntivite não purulenta. Conforme dados de surtos anteriores, formas graves são raras, razão pela qual é incomum ocorrerem hospitalizações e óbitos.53,54 Conforme o CDC (Center for Disease Control and Prevention), deve‐se suspeitar do diagnóstico de Zika quando dois ou mais sintomas (incluindo febre, rash, artralgia ou conjuntivite) estão presentes durante ou no período de até duas semanas de estada em área endêmica pelo vírus.55
Durante o surto de Zika ocorrido na Micronésia em 2007, os sintomas mais frequentes foram rash cutâneo, febre, artralgia e conjuntivite; cefaleia, mialgia, dor retro‐orbitária, edema e vômitos foram menos comuns. Dos 49 casos confirmados, não foram relatadas hospitalizações, manifestações hemorrágicas ou óbitos.53
DengueDeve‐se suspeitar de dengue em todo paciente que reside em áreas endêmicas ou que viajou nas últimas duas semanas para essas regiões.56 O diagnóstico deve ser considerado em pacientes que apresentam febre (início abrupto, com pico de 39°‐40°C), rubor de pele difuso, leucopenia e trombocitopenia.57,58 Os sintomas duram por 5‐7 dias. Cefaleia, artralgia, dores nas costas, mialgia, dores ósseas e sintomas gastrointestinais (anorexia, vômitos e desconforto) são comuns. Dor retro‐orbitária, com pequena pressão no globo ocular, também é usual.56,57 Sinais sugestivos de hemorragia incluem petéquias, púrpura, epistaxe, sangramento vaginal e gengival, melena e hematêmese. Nessa situação, deve‐se ficar alerta para dengue hemorrágica, a qual pode causar um colapso circulatório e consequente choque.56,57
ChikungunyaAo contrário da dengue e da Zika, a maioria das pessoas infectadas pelo vírus chikungunya são sintomáticas, menos de 15% são assintomáticos.59,60 O tempo de viremia é geralmente de uma semana.61 A febre é de início rápido, com altas temperaturas (geralmente superiores a 39°C), acompanhada de mialgia, astenia, cefaleia, artralgia e rash. Logo após o início do quadro febril, surgem as queixas de mialgia e artralgias severas, a ponto de dificultar a deambulação do paciente.62 Rash ocorre de 20 a 80% dos casos, com apresentação maculopapular e localizado geralmente no tronco.63 Sintomas menos comuns e não específicos incluem prurido, linfadenopatia e alterações digestivas.63 Pacientes que requerem hospitalização geralmente são mais velhos e portadores de patologias coexistentes (cardiológica, respiratória, neurológica, diabetes). Outro grupo com importante risco para infecção severa são os neonatos (principalmente com mães portadoras do vírus na gestação e exposição durante o nascimento) e crianças jovens.64
Diagnóstico laboratorialO diagnóstico laboratorial das infecções pelo ZikaV baseia‐se principalmente em testes de biologia molecular e sorológicos.65,66 A amplificação do RNA viral através da reverse transcription‐polymerase chain reaction (RT‐PCR) pode ser feita em diversos materiais biológicos, como soro, líquor, líquido amniótico, saliva e urina.9,10,67 Nos pacientes com suspeita de infecção por transmissão horizontal, sua positividade está associada com a fase aguda da infecção entre três e sete dias após o início dos sintomas, quando ocorre viremia geralmente em baixos níveis.3,65
Quando disponíveis, são os testes de escolha para diagnóstico após a fase aguda. A interpretação dos testes sorológicos para ZikaV, como Elisa IgM e IgG ou plaque‐reduction neutralization test (PRNT), deve ser feita com cuidado, visto que esses apresentam reatividade cruzada para outras arboviroses, especialmente em pacientes previamente infectados com outros flavivírus, como a dengue.65 Idealmente deve ser concomitantemente feita sorologia para dengue e após duas semanas novamente, para comparação de títulos, é considerada confirmatória a positividade em títulos de anticorpos neutralizantes quatro vezes superiores à dengue.53,67
Nos casos suspeitos, como ainda não há ainda completo conhecimento da acurácia de diversos testes no diagnóstico da infecção congênita, se disponível deve‐se fazer RT‐PCR, idealmente nos primeiros dois dias, em sangue do cordão, no líquor e na placenta, associado a dosagens de anticorpos no líquor e no soro. O exame imuno‐histoquímico para ZikaV na placenta e no cordão umbilical também deve ser feito quando possível. A detecção do ZikaV em qualquer dos materiais acima por RT‐PCR ou imuno‐histoquímica é diagnóstico de infecção congênita. A sorologia reagente será confirmatória caso em títulos superiores à sorologia da dengue, conforme descrito acima. Em caso de óbito fetal, o diagnóstico consiste na feitura de RT‐PCR e imuno‐histoquímica nos tecidos fetais.67
Neuroimagem e ZikaVConforme as diretrizes da Academia Americana de Neurologia sobre microcefalia, os estudos de neuroimagem são úteis na identificação de lesões estruturais na avaliação da criança com microcefalia, auxiliam na investigação de etiologias genéticas, adquiridas ou ambientais, a ressonância magnética é o método mais acurado para identificação de padrões específicos que podem auxiliar o diagnóstico.22
Com relação às infecções congênitas, o mecanismo da infecção e o dano cerebral dependem do agente etiológico envolvido, determina manifestações neurorradiológicas e patológicas com padrões distintos. Os agentes virais, por exemplo, tendem a produzir uma necrose seletiva de tipos específicos de células, enquanto que as bactérias e os fungos são menos seletivos. Além disso, diferentes padrões de calcificações visualizadas nos exames de imagem e nos estudos anatomopatológicos são típicos das infeções Storch (sífilis, toxoplasmose, rubéola, CMV, vírus da imunodeficiência humana [HIV] e herpes simplex), o momento do insulto durante a vida fetal está relacionado a efeitos teratogênicos ou encefaloclásticos.68
A investigação por imagem de uma possível infeção intrauterina pelo ZikaV tem como objetivo principal a detecção de complicações neurológicas relacionadas à infecção transplacentária, tais como a microcefalia, calcificações cerebrais, distúrbios da migração neuronal, perda de tecido encefálico e dilatação do sistema ventricular. A extensão e a gravidade das alterações intracranianas tem relação direta com período gestacional em que o feto foi infectado pelo vírus, são mais severas e extensas durante o primeiro trimestre de gestação e mais brandas no terceiro trimestre. A avaliação por imagem do feto ou do recém‐nascido tem sido indicada nos casos de infecção materna confirmada ou inconclusiva pelo ZikaV, bem como mediante provas laboratoriais ou quadro clínico compatíveis.
Durante o período pré‐natal, a ultrassonografia obstétrica é o exame de escolha, é indicada para investigação de possíveis anormalidades estruturais do sistema nervoso central e para o monitoramento do crescimento fetal e cerebral a cada três a quatro semanas.69 No período pós‐natal, a ultrassonografia transfontanelar é o método de investigação inicial para o recém‐nascido com perímetro cefálico igual ou inferior a 32 cm. A presença de qualquer anormalidade detectada pelo ultrassom transfontanelar deve ser investigada com exames mais detalhados e de maior acurácia diagnóstica, tais como a tomografia computadorizada ou a ressonância magnética.67
As anormalidades encefálicas decorrentes da infecção intrauterina pelo vírus Zika têm sido descritas principalmente por meio da tomografia computadorizada no período pós‐natal. Os principais achados por imagem têm origem em uma série de 35 casos de microcefalia, nascidos de mães que tiveram contato com zonas endêmicas. Dos 35 recém‐nascidos, 27 foram submetidos à tomografia computadorizada e posteriormente reportados ao Centro de Controle e Prevenção de Doenças (CDC).5 Os achados de imagem dessa coorte consistem em calcificações cerebrais, predominantemente periventriculares, porém também no parênquima cerebral, nos tálamos e núcleos da base. Também foram detectadas anomalias de migração neuronal, tais como lisencefalia, paquigiria e polimicrogiria, presentes em até um terço dos casos. Ventriculomegalia secundária a atrofia cortical/subcortical também foi frequentemente encontrada.5 Existem também relatos de casos com o uso de outros métodos de imagem, como a ultrassonografia obstétrica para investigação intrauterina de gestantes com história de infecção pelo Zika, que evidenciaram calcificações cerebrais grosseiras, anormalidades no vermis cerebelar e disgenesia do corpo caloso.70
Recentemente, um relato de caso de um feto comprovadamente infectado pelo vírus Zika, submetido a necropsia e estudo neuropatológico, evidenciou microcefalia, calcificações predominantemente corticais e subcorticais, simplificação dos giros cerebrais, distúrbios da migração neuronal, perda de tecido cerebral e dilatação assimétrica dos ventrículos. Apesar de este estudo não ter contemplado exames de neuroimagem mais avançados, os achados ultrassonográficos descritos certamente poderiam ser mais bem identificados e ilustrados por meio de exames de tomografia computadorizada ou ressonância magnética fetal ou pós‐natal.71
Estratégias para estudo da relação entre ZikaV e microcefaliaO entendimento global do neurodesenvolvimento normal, e de suas possíveis alterações, depende do conhecimento amplo da formação do cérebro, do padrão das conexões entre os neurônios e entre as regiões cerebrais, bem como das comunicações sinápticas que constituem essas devidas conexões. As novas metodologias de modelos celulares e organoides permitem simular in vitro os processos envolvidos na neurogênese embrionária, as possíveis alterações ou intervenções que possam estar relacionadas com o desenvolvimento anormal do cérebro. Podem‐se agora elucidar questões relacionadas às principais lacunas da formação do cérebro e gerar resultados únicos sobre a neurogênese embrionária e todos os processos envolvidos durante a formação cortical, bem como o entendimento completo da ação de agentes potencialmente causadores de alterações no neurodesenvolvimento embrionário.
Neurônios e/ou células gliais humanas não estão prontamente disponíveis para a pesquisa experimental. Estudos de patologias associadas ao sistema nervoso central têm sido tradicionalmente limitados a modelos animais ou linhagens celulares de menor relevância para o entendimento da fisiopatologia neuronal.72–74 A importância do uso de células humanas, com proximidade da doença a ser investigada, fica evidente pelo número de drogas que apresentam eficácia e segurança quando testadas em modelos animais, porém subsequentemente falham em ensaios clínicos.74 Assim, faz‐se necessário o uso de novos modelos que fielmente representem as doenças humanas reais e suas peculiaridades fisiológicas, para melhorar a taxa de sucesso das novas descobertas, principalmente relacionadas ao neurodesenvolvimento.73
Atualmente, temos à disposição a tecnologia de gerar os chamados modelos celulares, por meio da reprogramação de células somáticas em nível embrionário, ou até mesmo produzir minicérebros a partir dessas células reprogramadas. Esses modelos apresentam alta relevância para o estudo de doenças em humanos, fornecem excelentes condições para o entendimento de mecanismos e constituem uma exímia ferramenta para experimentos de alto rendimento, permitem até a construção de plataformas para a triagem de novos medicamentos em diversas doenças.72
As células obtidas por meio da reprogramação celular são chamadas de células‐tronco pluripotentes induzidas (iPS, do inglês Induced Pluripotent Stem Cells) e são muito similares às células‐tronco embrionárias, apresentam as mesmas características de autorrenovação e potencial de diferenciação em linhagens dos três folhetos embrionários.75,76 A aplicação da tecnologia da geração de células iPS está baseada em duas grandes áreas de atuação, a geração de células específicas para o uso em medicina regenerativa e/ou a modelagem de doenças e a triagem de novos fármacos. Células iPS podem ser geradas de pacientes portadores de uma determinada doença ou então de indivíduos saudáveis e posteriormente diferenciadas para o células adultas. Com base nas doenças em que o fenótipo é expresso nas células adultas, pode‐se fazer a edição e correção no genoma dessas células, rastrear compostos capazes de corrigir a patologia celular ou avaliar a possível toxicidade de algumas drogas.73 A partir de uma célula iPS, podem ser obtidos in vitro pequenos organoides com uma organização em miniatura muito semelhante à do cérebro humano, chamados de minicérebros, habilitados a recapitular um número surpreendente de características do desenvolvimento do cérebro.
As infecções virais capazes de promover alterações no neurodesenvolvimento podem ser investigadas por meio da exposição de células iPS humanas aos vírus, permitem um estudo detalhado das diferentes etapas da progressão da infecção viral, bem como as consequências dessa exposição durante o desenvolvimento embrionário do cérebro. D’Aiuto et al., em 2014, apresentaram um estudo sobre a susceptibilidade de células iPS humanas ao citomegalovírus e a atuação desse durante a formação de um neurônio adulto. O estudo indicou importantes diferenças nas alterações causadas pelo citomegalovírus em células embrionárias, células precursoras neurais e neurônios adultos. Isso sugere que a exposição ao citomegalovírus no período embrionário é determinante para o desenvolvimento da malformação cerebral ocasionada pelo vírus.77
Em casos de microcefalia causados por mutações genéticas, por exemplo, minicérebros foram gerados a partir de células (iPS) derivadas de fibroblastos de pele de um paciente com microcefalia. Os minicérebros gerados assemelharam‐se com o fenótipo de microcefalia, são muito menores em comparação com minicérebros gerados a partir de células de pacientes controle, permitem um estudo detalhado da neurogênese embrionária, principalmente da formação cortical desses cérebros.78,79
DiscussãoA associação entre a doença por ZikaV durante a gestação e o desenvolvimento de microcefalia vem alarmando a população de forma global.5–8 A microcefalia é um distúrbio da fase de proliferação neuronal, que ocorre de forma precoce na gestação (3°‐4° mês)12 e que, em alguns casos descritos, parece coincidir com os sintomas da infecção na mãe. Como os critérios para definição de microcefalia não têm sido usados de forma padronizada, e como havia claramente uma subnotificação desses casos no Brasil, é difícil estabelecer com certeza se ocorre um aumento real da incidência dessa patologia.22–26 Adicionalmente, os exames de neuroimagem disponíveis mostram que outras malformações do desenvolvimento cortical fetal também estão presentes, tais como distúrbios da migração neuronal (3‐5° mês de gestação) e calcificações difusas (morte neuronal). Isso sugere ou uma longa duração da patogênese do vírus no SNC ou uma suscetibilidade de mais fases do desenvolvimento cortical.5,12–14,70
Se considerarmos a ampla dispersão do Aedes aegypti no território nacional e que os métodos adotados para controle da população do vetor tardam em mostrar resultado, é esperado que os casos de infecção pelo ZikaV continuem a aumentar, tornem prioritário e urgente conhecer mais a fundo tanto a patologia como o agente etiológico. Estudos recentes sugerem que alterações nos componente moleculares do ZikaV, em especial da proteína E, presente na superfície do vírus, poderiam estar correlacionadas com uma maior “agressividade” do ZikaV, reforçariam seu neurotropismo e sua capacidade de causar doença em humanos.40,42 A situação exige abordagens múltiplas e multidisciplinares para controle do vetor e da infecção pelo ZikaV e passa pelo esclarecimento da população. O médico pediatra bem informado é uma figura central nesse processo.
É fato que o ZikaV consegue vencer a barreira placentária e atingir o líquido amniótico e os tecidos fetais.11 Porém, é necessário tranquilizar as gestantes, pois não é possível afirmar que esse aumento nas notificações de microcefalia seja exclusivamente relacionado ao vírus, muitos casos inicialmente suspeitos já foram descartados.23 Os casos com confirmação laboratorial são poucos em relação ao alto número de notificações. Independentemente disso, as medidas de prevenção continuam a ser necessárias e devem ser identificadas.
A disponibilidade de testes para o diagnóstico laboratorial da infecção por Zika, tanto na fase aguda quanto posteriormente a essa, ainda é muito restrita. A dificuldade na confirmação ou exclusão da infecção ainda prejudica o entendimento da história natural da doença e da relação com a microcefalia e também com a síndrome de Guillain‐Barré.54 Em virtude da grande preocupação mundial em relação ao potencial teratogênico da infecção por Zika, haverá maior esforço para desenvolvimento de testes com custo acessível e com maior acurácia, como sorologias com menor risco de reação cruzada.80
Concluindo, existe claramente uma relação temporal entre aumento da notificação de casos de microcefalia e a epidemia de vírus Zika, principalmente no Nordeste do Brasil. Entretanto, o desenvolvimento de técnicas diagnósticas que confirmem uma relação de causa e efeito, os mecanismos da patogênese da infecção pelo Zika no sistema nervoso central e critérios diagnósticos mais adequadamente definidos para a identificação dos casos de microcefalia que devem ser submetidos a investigação ainda são necessários.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
MLN, CRC e JCC têm Bolsa de Produtividade em Pesquisa pelo Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).
Como citar este artigo: Nunes ML, Carlini CR, Marinowic D, Neto FK, Fiori HH, Scotta MC, et al. Microcephaly and Zika virus: a clinical and epidemiological analysis of the current outbreak in Brazil. J Pediatr (Rio J). 2016;92:230–40.
Trabalho desenvolvido no Instituto do Cérebro (InsCer) do Rio Grande do Sul e na Faculdade de Medicina, Pontifícia Universidade Católica do Rio Grande do Sul (PUC‐RS), Porto Alegre, RS, Brasil.