To assess if magnetic resonance enterography (MRE) is capable of showing evidence/extent of disease in pediatric patients with biopsy‐proven celiac disease (CD) by comparing with a control group, and to correlate the MRE findings with anti‐endomysial antibody (EMA) level, which is an indicator of gluten‐free dietary compliance.
MethodsThirty‐one pediatric patients (mean age 11.7±3.1 years) with biopsy‐proven CD and 40 pediatric patients as a control group were recruited in the study. The MRE images of both patients with CD and those of the control group were evaluated by two pediatric radiologists in a blinded manner for the mucosal pattern, presence of wall thickening, luminal distention of the small bowel, and extra‐intestinal findings. Patient charts were reviewed to note clinical features and laboratory findings. The histopathologic review of the duodenal biopsies was re‐conducted.
ResultsThe mean duration of the disease was 5.6±1.8 years (range: 3‐7.2 years). In 24 (77%) of the patients, EMA levels were elevated (mean 119.2±66.6 RU/mL). MRE revealed normal fold pattern in all the patients. Ten (32%) patients had enlarged mesenteric lymph nodes.
ConclusionAlthough a majority of the patients had elevated EMA levels indicating poor dietary compliance, MRE did not show any mucosal abnormality associated with the inability of MRE to detect mild/early changes of CD in children. Therefore, it may not be useful for the follow‐up of pediatric CD.
Avaliar se a enterografia por ressonância magnética (ERM) consegue comprovar/mostrar a extensão da doença em pacientes pediátricos com doença celíaca (DC) comprovada por biópsia, comparar com um grupo de controle e correlacionar os achados da ERM com o nível de anticorpo antiendomísio (EMA) indicador de dieta sem glúten.
MétodosForam recrutados 31 pacientes pediátricos (idade média entre 11,7±3,1 anos) com DC comprovada por biópsia e 40 pacientes pediátricos em um grupo de controle. As imagens da ERM dos pacientes com DC e no grupo de controle foram avaliadas por dois radiologistas pediátricos às cegas para o padrão da mucosa, presença de espessamento da parede, dilatação luminal do intestino delgado e achados extraintestinais. Os prontuários dos pacientes foram revisados para anotação de características clínicas e achados laboratoriais. A avaliação histopatológica das biópsias duodenais foi feita novamente.
ResultadosA duração média da doença foi 5,6±1,8 anos (faixa de 3‐7,2 anos). Em 24 (77%) dos pacientes, os níveis EMA estavam elevados (média 119,2±66,6 RU/mL). A ERM revelou um padrão de pregas normal em todos os pacientes; 10 (32%) dos pacientes apresentaram gânglios linfáticos mesentéricos aumentados.
ConclusãoApesar de a maioria dos pacientes ter níveis elevados de EMA, o que indica uma dieta pobre, a ERM não mostrou anomalia na mucosa associada à incapacidade de a ERM detectar alterações leves/precoces de DC nas crianças. Portanto, ela pode não ser útil no acompanhamento da DC pediátrica.
A doença celíaca (DC), uma síndrome de má absorção com origem autoimune, afeta aproximadamente 1% da população.1,2 A incidência da DC aumentou ao longo das décadas, possivelmente devido ao aumento da exposição ao glúten, à conscientização do amplo espectro do quadro clínico e à disponibilidade de ferramentas diagnósticas sensíveis e específicas.3–6 Contudo, o ‘modelo em iceberg’ indica a extensão da população com DC não diagnosticada.7 Assim, a DC constitui um problema de saúde substancial em todo o mundo e afetando a população adulta e pediátrica.8
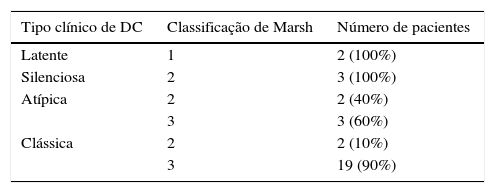
Em crianças geneticamente suscetíveis, a doença é desencadeada pela exposição a alimentos que contêm glúten. O glúten afeta predominantemente o duodeno e jejuno; contudo, todo o intestino delgado pode ser envolvido. As alterações na mucosa são caracterizadas por atrofia das vilosidades, hiperplasia da cripta, espessamento da membrana basal sob o epitélio de superfície, menor número de células caliciformes e sinais de inflamação.9 As características clínicas são amplas e não específicas. O espectro do quadro clínico na DC pode ser classificado como: a) forma clássica, relacionada a sintomas intestinais e diagnosticada predominantemente em pacientes pediátricos; b) forma atípica, quadro com sintomas comumente extraintestinais, como deficiência de ferro; c) forma silenciosa e d) forma latente, os pacientes são assintomáticos e diagnosticados durante o exame devido à presença de histórico familiar ou DC doenças relacionadas à DC, como diabetes mellitus tipo 1, síndrome de Down e artrite idiopática juvenil. Na forma latente, os testes sorológicos são positivos, acompanhados por nenhuma alteração histopatológica no intestino ou apenas aumento nos linfócitos intraepiteliais (estágio 1 de Marsh). A positividade dos testes sorológicos inclusive anticorpos antiendomísios (EMA) e transglutaminase antitecido (tTG) durante a exposição a alimentos que contêm glúten e a melhoria sorológica e clínica ao seguir uma dieta sem glúten ajudam a diagnosticar a DC. O diagnóstico definitivo é estabelecido por biópsia endoscópica duodenal ou jejunal.10
O achado radiológico característico de DC é anormalidade na prega mucosa do intestino delgado, que inclui rompimento das pregas, redução da quantidade de ramos jejunais e aumento da quantidade de ramos ileais, depende da extensão e do grau de envolvimento. Essas alterações nas pregas mucosas foram avaliadas normalmente com estudos com bário. A enterografia por ressonância magnética (ERM) é método sem radiação relativamente novo, porém bem estabelecido para a avaliação intestinal, particularmente em casos de doença inflamatória intestinal.11,12 Como a ERM possibilita visualizar todo o intestino delgado, ela se mostrou benéfica na determinação da extensão da doença, das complicações relacionadas à DC, inclusive jejunoileite ulcerativa e neoplasias malignas, e da DC refratária em pacientes com sintomas persistentes apesar da dieta sem glúten.13–16 Contudo, os estudos que focaram na DC com a ERM foram conduzidos especialmente em grupos de estudo com adultos e há poucos desses estudos na literatura que avaliam os achados da DC na ERM em crianças.17
O exame histopatológico dos pacientes com DC não fornece informações suficientes sobre a extensão da doença, pois ele é limitado ao duodeno e jejuno proximal. Assim, a finalidade deste estudo de um único centro prospectivo foi verificar se a ERM consegue mostrar a extensão da doença em pacientes pediátricos com DC comprovada por biópsia, compará‐los com um grupo de controle e correlacionar os achados da ERM com o nível de anti‐EMA indicador de dieta sem glúten.18
Material e métodosPacientesEste estudo foi aprovado pelo conselho de revisão institucional e é compatível com a Declaração de Helsinque. O consentimento informado por escrito foi obtidos dos pais de todos os pacientes. O estudo foi feito entre janeiro de 2014 e janeiro de 2015. Os pacientes acompanhados com o diagnóstico de DC pelas clínicas de gastrenterologia pediátrica de nossa instituição foram recrutados para o estudo. Os critérios de inclusão incluíram crianças acima de cinco anos com capacidade de seguir as instruções de prender a respiração e não se mexer durante todo o procedimento sem necessidade de sedação. O diagnóstico de DC teve como base os critérios descritos pela Sociedade Europeia de Gastroenterologia, Hepatologia e Nutrição Pediátrica.8
Revisão dos prontuários dos pacientesOs prontuários dos pacientes foram revisados antes dos exames de ERM para obter as características clínicas, os achados laboratoriais e os registros posteriores por um gastroenterologista pediátrico (ES). Os exames histopatológicos das biópsias duodenais obtidas anteriormente (no momento do diagnóstico) dos pacientes foram novamente analisados por um patologista (KD) sem conhecimento das características clínicas. Os pacientes foram classificados e agrupados de acordo com a classificação de Marsh, que é obtida do exame histopatológico e reflete a gravidade da doença (tabela 1). A classificação de Marsh consiste em 4 estágios (0‐3) interpretados com base em várias características do espécime de biópsia: o estágio 0 reflete biópsia normal, ao passo que os estágios 1, 2 e 3 são predominantemente associados ao aumento nos linfócitos intraepiteliais, na hiperplasia da cripta e na atrofia das vilosidades, respectivamente.19,9
Técnica de enterografia por RMOs pacientes foram submetidos ao exame em um aparelho clínico Tesla 1.5 (Magnetom, Aera, Siemens Healthcare, Erlangen, Alemanha) com uma bobina de corpo de 18 canais. Antes do exame de ERM, 24 pacientes com DC não estavam em dieta sem glúten, ao passo que oito seguiam a dieta sem glúten. A preparação para a ERM consistiu em jejum por 4‐6 horas e administração de solução de manitol (3%) como meio de contraste oral. A ERM foi feita em posição supina com as seguintes sequências: half‐Fourier acquisition single‐shot turbo spin‐echo (Haste) coronal ponderada em T2, para avaliar a distensão do intestino delgado, imagem Cine com imagem coronal balanceada em precessão livre no estado estacionário (True‐Fisp), axial (com saturação de gordura) e coronal True‐Fisp, Haste coronal ponderada em T2 com saturação de gordura, imagem ponderada por difusão planar axial single‐shot fast spin‐echo echo (b=50, 400, 800 s/mm2) e gadolínio intravenoso prévio e subsequente com base na injeção de meio de contraste (0,1 mmol/kg) por exame interpolado de respiração volumétrica ponderado em T1 axial e coronal com saturação de gordura (VIBE). Foi administrado brometo de N‐butilescopolamina (Buscopan, Boehringer, Ingelheim, Alemanha) intravenoso duas vezes mais lentamente por dois minutos a uma dose de 0,3mg/kg, com dose máxima de 20mg para eliminar a movimentação e contração intestinal; seguiu‐se a obtenção de imagens dinâmicas (Cine) e antes da administração do agente contrastante. Os parâmetros de sequência são apresentados na tabela 2.
Parâmetros das sequências da RM
| Sequências | Parâmetros | |||||
|---|---|---|---|---|---|---|
| TR (msec) | TE (msec) | Espessura do corte (mm) | Lacuna (mm) | AF | Matriz | |
| Haste em T2 | 2.000 | 91 | 5 | 1 | ‐ | 320x320 |
| True‐Fisp | 3,21 | 1,04 | 4 | 1 | 50 | 256x256 |
| Vibe em T1 | 4,36 | 1,91 | 3 | 0 | 10 | 256x180 |
| Cine True‐Fisp | 3,21 | 1,04 | 4 | 1 | 50 | 256x180 |
| Difusão | 6.810 | 62 | 5 | 5 | ‐ | 256x256 |
AF: ângulo de flip; Haste: Half‐Fourier acquisition single‐shot turbo spin‐echo; TE: tempo de eco; TR: tempo de repetição; True‐Fisp: imagem balanceada em precessão livre no estado estacionário; VIBE: exame interpolado de respiração volumétrica.
Os exames de ERM de pacientes pediátricos (idade média 8,0±1,2 anos, faixa etária 5‐8,4 anos), como um grupo de controle, que foram submetidos a exame, com suspeita de doença inflamatória intestinal, porém que apresentaram achados radiológicos normais, e o grupo de pacientes com diagnóstico de DC foram anonimizados e enviados de volta para um sistema de arquivamento e comunicação de quadros clínicos por um radiologista pediátrico (MSD), que não se posicionou sobre a avaliação das imagens.
As imagens foram avaliadas de maneira independente por dois radiologistas pediátricos (SD; GK, experiência de quatro e cinco anos na leitura de ERM, respectivamente) sem conhecimento das informações clínicas dos pacientes. Cada ERM foi classificada para ausência (0) ou presença (1) de 1 – anomalias nos padrões das pregas das alças duodenais, jejunais e ileais; 2 – melhoria, restrição de difusão e aumento na espessura da parede do intestino delgado; 3 – aumento do diâmetro das alças intestinais; 4 – intussuscepção; 5 – gânglios linfáticos mesentéricos, infiltração gordurosa e ingurgitamento vascular. Eles buscaram especificamente perda na prega duodenal, ilealização do jejuno (< 3 pregas por polegada), jejunização do íleo (> 5 pregas por polegada) e perda global de válvulas. A espessura da parede do jejuno e o íleo foram medidos em mm na sequência Haste ponderada em T2, evitaram‐se as interfaces das pregas intestinais e pregas mucosas para evitar superestimação da espessura. As sequências True‐Fisp e Vibe não foram preferenciais devido à vulnerabilidade ao artefato de limitação preto que resultaria em medições incorretas. Os gânglios linfáticos mesentéricos maiores do que 1cm de diâmetro do eixo curto foram considerados patológicos.
Adicionalmente, os radiologistas tiveram de classificar as imagens de cada paciente com uma escala incremental de 3 pontos (0=inadequada, 1=moderada, 2=adequada) para distensão do intestino delgado.
ResultadosForam inicialmente recrutados para o estudo 45 pacientes pediátricos com diagnóstico de DC. Nove dos pacientes cuja biópsia duodenal e exame histopatológico foram feitos em outro centro e cinco pacientes que não toleraram a ERM (devido a doenças crônicas relacionadas, como deficiência de IgA, síndrome de Turner, diabetes mellitus tipo 1 e síndrome de Down, que podem ter tornado os pacientes incompatíveis) foram excluídos.
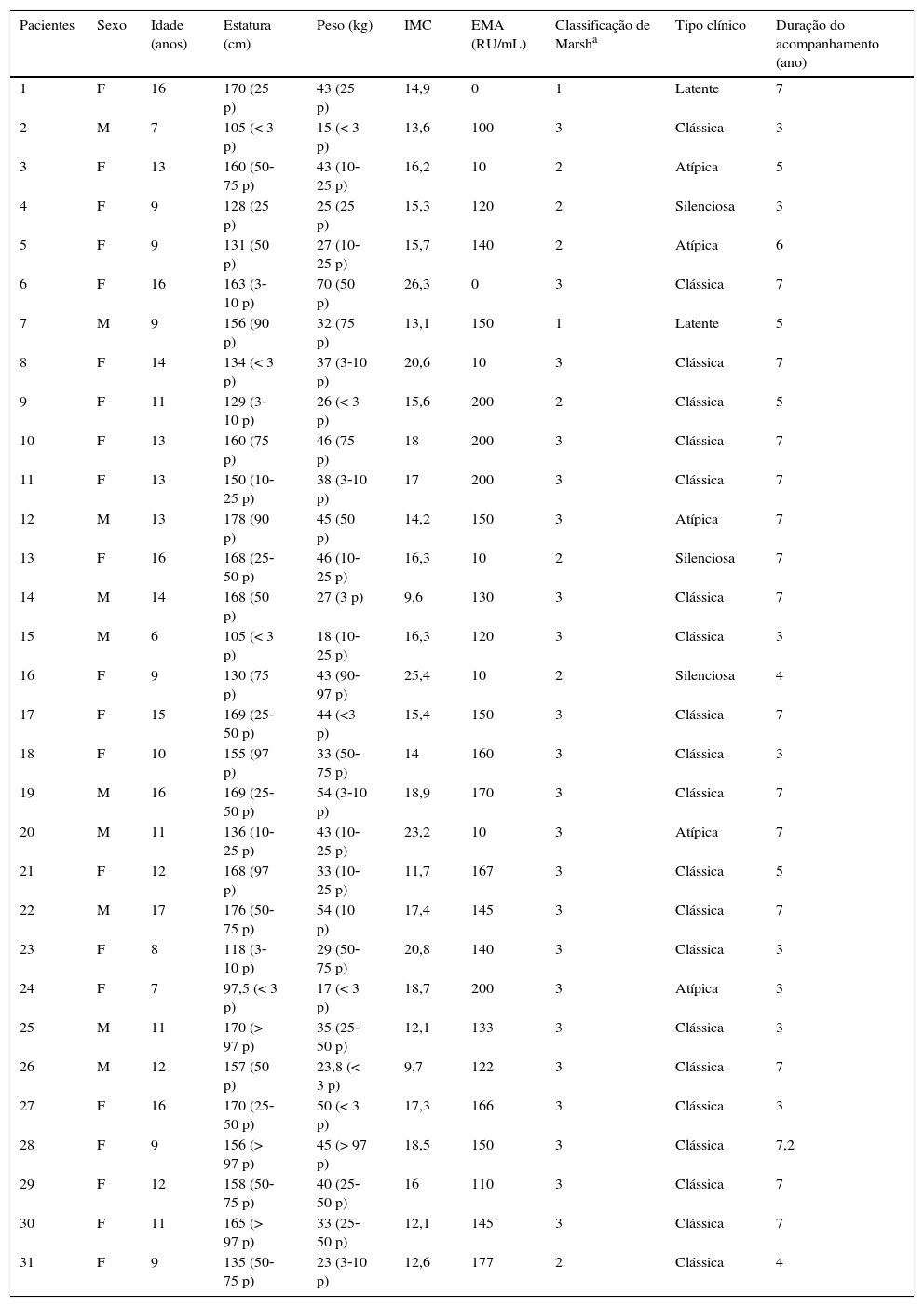
Por fim, foram incluídas 31 crianças com DC (10 meninos e 21 meninas; idade média 11,7±3,1 anos e faixa etária 6‐16 anos); 21 (68%) pacientes dos 31 foram categorizados como DC clássica, ao passo que cinco (16%) como DC atípica, dois (6%) como latente e três (10%) como silenciosa. Os sintomas de todos os pacientes com DC clássica foram diarreia crônica, distensão abdominal e dor. Os pacientes com DC atípica apresentaram constipação e anemia ferropriva resistente à Fe oral. Os pacientes com DC latente e silenciosa não apresentaram sinais/sintomas. Eles foram diagnosticados por meio de exame feito devido ao aumento no risco de DC, considerando o histórico familiar.
A duração média da doença foi de 5,6±1,8 anos (faixa de 3‐7,2 anos). Em 24 pacientes que não seguiam a dieta sem glúten, os níveis de EMA estavam elevados (média 119,2±66,6 RU/mL e faixa de 0‐200 RU/mL). Em nossa instituição, os níveis de anti‐EMA de 0‐20 RU/mL são considerados dentro dos limites normais, ao passo que os níveis de 21‐200 RU/mL são considerados elevados. O tempo médio entre o nível sérico de EMA obtido e o exame de ERM foi de 12±3,0 dias (intervalo de 8‐16 dias). Antes do exame de ERM, os pacientes com EMA não elevado e 10 dos 24 pacientes com EMA elevado não apresentaram sintomas; 14 pacientes com EMA elevado apresentaram dor abdominal ou diarreia. Os dados demográficos e achados laboratoriais dos pacientes estão listados na tabela 3.
Características clínicas e laboratoriais do grupo de estudo
| Pacientes | Sexo | Idade (anos) | Estatura (cm) | Peso (kg) | IMC | EMA (RU/mL) | Classificação de Marsha | Tipo clínico | Duração do acompanhamento (ano) |
|---|---|---|---|---|---|---|---|---|---|
| 1 | F | 16 | 170 (25 p) | 43 (25 p) | 14,9 | 0 | 1 | Latente | 7 |
| 2 | M | 7 | 105 (< 3 p) | 15 (< 3 p) | 13,6 | 100 | 3 | Clássica | 3 |
| 3 | F | 13 | 160 (50‐75 p) | 43 (10‐25 p) | 16,2 | 10 | 2 | Atípica | 5 |
| 4 | F | 9 | 128 (25 p) | 25 (25 p) | 15,3 | 120 | 2 | Silenciosa | 3 |
| 5 | F | 9 | 131 (50 p) | 27 (10‐25 p) | 15,7 | 140 | 2 | Atípica | 6 |
| 6 | F | 16 | 163 (3‐10 p) | 70 (50 p) | 26,3 | 0 | 3 | Clássica | 7 |
| 7 | M | 9 | 156 (90 p) | 32 (75 p) | 13,1 | 150 | 1 | Latente | 5 |
| 8 | F | 14 | 134 (< 3 p) | 37 (3‐10 p) | 20,6 | 10 | 3 | Clássica | 7 |
| 9 | F | 11 | 129 (3‐10 p) | 26 (< 3 p) | 15,6 | 200 | 2 | Clássica | 5 |
| 10 | F | 13 | 160 (75 p) | 46 (75 p) | 18 | 200 | 3 | Clássica | 7 |
| 11 | F | 13 | 150 (10‐25 p) | 38 (3‐10 p) | 17 | 200 | 3 | Clássica | 7 |
| 12 | M | 13 | 178 (90 p) | 45 (50 p) | 14,2 | 150 | 3 | Atípica | 7 |
| 13 | F | 16 | 168 (25‐50 p) | 46 (10‐25 p) | 16,3 | 10 | 2 | Silenciosa | 7 |
| 14 | M | 14 | 168 (50 p) | 27 (3 p) | 9,6 | 130 | 3 | Clássica | 7 |
| 15 | M | 6 | 105 (< 3 p) | 18 (10‐25 p) | 16,3 | 120 | 3 | Clássica | 3 |
| 16 | F | 9 | 130 (75 p) | 43 (90‐97 p) | 25,4 | 10 | 2 | Silenciosa | 4 |
| 17 | F | 15 | 169 (25‐50 p) | 44 (<3 p) | 15,4 | 150 | 3 | Clássica | 7 |
| 18 | F | 10 | 155 (97 p) | 33 (50‐75 p) | 14 | 160 | 3 | Clássica | 3 |
| 19 | M | 16 | 169 (25‐50 p) | 54 (3‐10 p) | 18,9 | 170 | 3 | Clássica | 7 |
| 20 | M | 11 | 136 (10‐25 p) | 43 (10‐25 p) | 23,2 | 10 | 3 | Atípica | 7 |
| 21 | F | 12 | 168 (97 p) | 33 (10‐25 p) | 11,7 | 167 | 3 | Clássica | 5 |
| 22 | M | 17 | 176 (50‐75 p) | 54 (10 p) | 17,4 | 145 | 3 | Clássica | 7 |
| 23 | F | 8 | 118 (3‐10 p) | 29 (50‐75 p) | 20,8 | 140 | 3 | Clássica | 3 |
| 24 | F | 7 | 97,5 (< 3 p) | 17 (< 3 p) | 18,7 | 200 | 3 | Atípica | 3 |
| 25 | M | 11 | 170 (> 97 p) | 35 (25‐50 p) | 12,1 | 133 | 3 | Clássica | 3 |
| 26 | M | 12 | 157 (50 p) | 23,8 (< 3 p) | 9,7 | 122 | 3 | Clássica | 7 |
| 27 | F | 16 | 170 (25‐50 p) | 50 (< 3 p) | 17,3 | 166 | 3 | Clássica | 3 |
| 28 | F | 9 | 156 (> 97 p) | 45 (> 97 p) | 18,5 | 150 | 3 | Clássica | 7,2 |
| 29 | F | 12 | 158 (50‐75 p) | 40 (25‐50 p) | 16 | 110 | 3 | Clássica | 7 |
| 30 | F | 11 | 165 (> 97 p) | 33 (25‐50 p) | 12,1 | 145 | 3 | Clássica | 7 |
| 31 | F | 9 | 135 (50‐75 p) | 23 (3‐10 p) | 12,6 | 177 | 2 | Clássica | 4 |
IMC, índice de massa corporal;<15, abaixo do peso, 15‐24: normal;>24, acima do peso; EMA, anti‐endomysial antibody; 0‐20 RU/ml: normal; 20‐200 RU/ml: elevado; p: percentil.
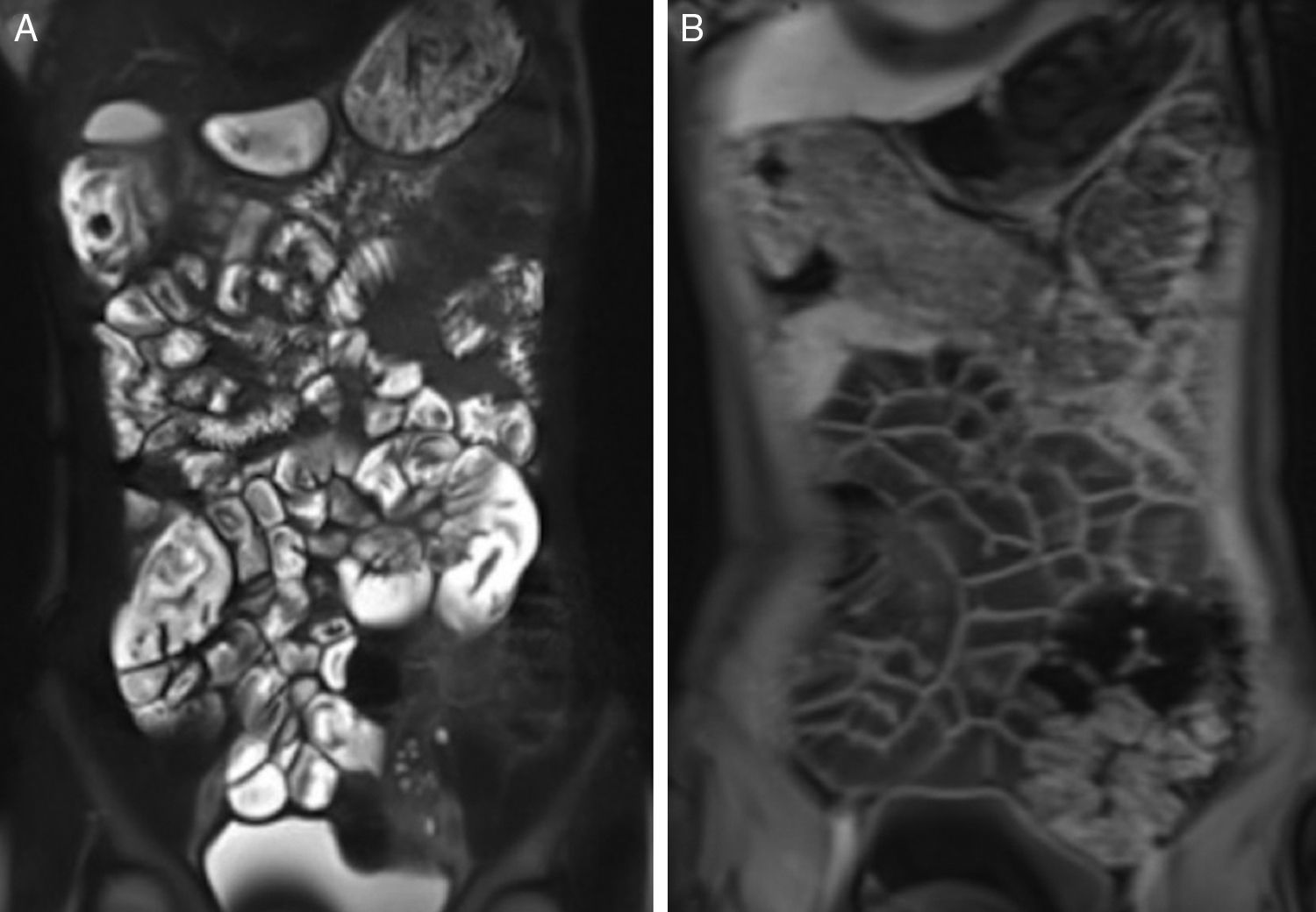
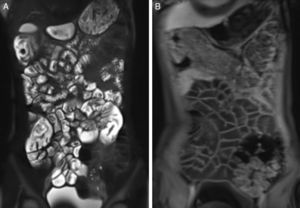
Os dois radiologistas classificaram todos os exames dos pacientes com DC e do grupo de controle como 0: o padrão de pregas foi interpretado como normal em todos os pacientes. Não houve perda na prega duodenal, ilealização do jejuno, jejunização do íleo ou perda global de válvulas. A espessura da parede estava dentro dos limites normais (média 1,5±0,26 e 1,58±0,28mm para jejuno e íleo, respectivamente). Não encontramos melhoria anormal ou restrição de difusão da parede intestinal (fig. 1).
Dez pacientes dos 31 (32%) apresentaram gânglios linfáticos mesentéricos com>1cm de diâmetro do eixo curto. Não foi detectada outra anomalia extraintestinal.
Os radiologistas classificaram as imagens dos pacientes com DC como adequadas em 25 (81%) e 27 (87%) dos exames dos 31 (concordância substancial entre avaliadores, κ=0,73) e as imagens dos pacientes do grupo de controle como adequadas em 34 (85%) e 32 (80%) dos 40 (concordância quase perfeita entre avaliadores, κ=0,82), respectivamente, ao passo que as restantes foram classificadas como moderadas para distensão do intestino delgado.
Os exames foram bem tolerados e não houve efeito adverso significativo.
DiscussãoEste estudo conduzido para avaliar os achados de DC por ERM em crianças não revelou anormalidade radiológica. Vários estudos mostraram as anomalias no padrão de pregas em imagens de pacientes com DC não complicada.20,21 Os achados incluem redução no número de pregas jejunais (< 3 por polegada) e aumento no número de pregas ileais (> 5 pregas por polegada); a combinação desses dois achados faz referência ao padrão de pregas jejunoileais revertidas. Os outros achados intestinais incluem dilatação e aumento da espessura da parede do intestino delgado, que afetaram principalmente o jejuno. Contudo, Laghi et al.17 e Tomei et al.13 relataram ausência de achados na ERM em 29% e 42% dos pacientes, inclusive adultos e crianças com DC comprovada por biópsia, respectivamente. Os pacientes no nosso grupo de estudo, exclusivamente com pacientes pediátricos, podem não ter desenvolvido o dano à mucosa intestinal visto em pacientes adultos. Isso é justificado pelo fato de que 29% (9/31) de nossas crianças apresentaram alterações leves na mucosa refletidas pelos estágios 1 e 2 de Marsh, que não podem ser detectados pela ERM.
Cinco dos 31 (16%) pacientes em nosso grupo de estudo foram diagnosticados com DC latente ou silenciosa. O exame histopatológico das biópsias duodenais desses pacientes revelou estágios 1 ou 2 de Marsh. Tomei et al.13 relataram que 90% de seus pacientes diagnosticados com DC silenciosa apresentaram padrão de pregas normal. Apesar de haver uma quantidade limitada de estudos que focam nos achados de DC na ERM, a grande experiência na doença de Crohn revelou incapacidade de a ERM mostrar alterações na mucosa, mas envolvimento inflamatório da parede.22 De acordo com esse fato, em um estudo atual, todos os pacientes diagnosticados com DC silenciosa ou latente não apresentaram anormalidades no padrão de pregas na ERM. De fato, em nosso estudo, que consistiu, em sua na maioria (68%), em crianças com a forma clássica, não foi vista anormalidade nas pregas em quaisquer dos pacientes.
O aumento nos níveis de EMA foi detectado em 77% de nossos pacientes antes da ERM. Os anticorpos, inclusive EMA e tTG, são essenciais para o acompanhamento dos pacientes com DC e parecem ter uma boa correlação com a dieta sem glúten em pacientes adultos e pediátricos.23 O aumento nos níveis de EMA indica uma adesão não estrita, pelo paciente, à dieta sem glúten.24 Van den Bosch et al. relataram uma boa correlação entre a resposta à dieta sem glúten e os achados de enteróclise, em comparação com a biópsia em adultos com DC.23 Contudo, não há esses estudos com relação à ERM. Uma explicação opcional, pelo menos em parte, para a inexistência de achados radiológicos em pacientes com níveis normais de anti‐EMA pode ser a prevenção do dano à mucosa com a dieta sem glúten.
As manifestações radiológicas extraluminais da DC incluem gânglios linfáticos mesentéricos aumentados, ingurgitamento vascular mesentérico e intussuscepções transitórias. Os gânglios linfáticos mesentéricos aumentados (> 1cm de diâmetro do eixo curto) é o achado extraluminal mais comum associado à DC, é visto em até 42% dos casos.25 O tamanho dos linfonodos reduz com o tratamento com dieta sem glúten e sua persistência deve levantar a suspeita de linfoma.25,26 Esses linfonodos hipertróficos podem agir como ponto de partida para a intussuscepção apresentada inicialmente por 57% dos pacientes com DC.27 O ingurgitamento vascular mesentérico é um sinal não específico da doença. Os gânglios linfáticos mesentéricos foram o único achado extraluminal em nossos pacientes, a intussuscepção e o ingurgitamento vascular não foram detectados.
Este estudo tem algumas limitações. Apesar o número total de pacientes estudados ter sido relativamente aceitável, o grupo de pacientes foi diverso, inclusive pacientes com DC clássica, atípica, silenciosa e latente. Como os pacientes com DC silenciosa e latente apresentaram classificações de Marsh mais baixas com relação às alterações leves na mucosa, que podem ter resultado na ausência de achados na ERM, um estudo conduzido com um grupo de pacientes homogeneizado e maior pode ser viável para investigação adicional. Como não acompanhamos os pacientes radiologicamente, as imagens ERM em série adquiridas no momento do diagnóstico e após a ingestão de alimentos sem glúten ajudaria a avaliar as alterações radiológicas no curso da doença. Por fim, o exame histopatológico da biópsia duodenal foi feita no momento do diagnóstico. A comparação dos resultados da biópsia recém‐obtidos com os achados radiológicos possibilitaria deduzir uma hipótese mais plausível sobre a relação dos achados radiológicos e das alterações histopatológicas.
Em conclusão, apesar de o nível elevado de EMA na maioria de nossas crianças indicar baixa adesão à dieta, nosso estudo não mostrou achado significativo na ERM de DC comprovada por biópsia, o que indica incapacidade de a ERM detectar o dano leve e/ou precoce à mucosa (sugerido pela menor classificação de Marsh) visto em crianças com DC. Assim, ela pode não ser útil, como teste diagnóstico, no acompanhamento da DC. Contudo, conforme indicado por alguns autores anteriormente,17 a ERM pode ser útil na detecção de possíveis complicações da DC, como estenose e linfoma, na avaliação da DC não responsiva à dieta sem glúten e na exclusão de um diagnóstico opcional.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Koc G, Doganay S, Sevinc E, Deniz K, Chavhan G, Gorkem SB, et al. Magnetic resonance enterography in pediatric celiac disease. J Pediatr (Rio J). 2017;93:413–9.