To evaluate the presence of insulin resistance and its association with other metabolic abnormalities in obese children and adolescents.
MethodsRetrospective study of 220 children and adolescents aged 5‐14 years. Anthropometric measurements were performed (weight, height, and waist circumference) and clinical (gender, age, pubertal stage, and degree of obesity) and biochemical (glucose, insulin, total cholesterol, and fractions, triglycerides) data were analyzed. Insulin resistance was identified by the homeostasis model assessment for insulin resistance (HOMA‐IR) index. The analysis of the differences between the variables of interest and the HOMA‐IR quartiles was performed by ANOVA or Kruskal‐Wallis tests.
ResultsInsulin resistance was diagnosed in 33.20% of the sample. It was associated with low levels of high‐density lipoprotein cholesterol (HDL‐C; p=0.044), waist circumference measurement (p=0.030), and the set of clinical and metabolic (p=0.000) alterations. Insulin‐resistant individuals had higher mean age (p=0.000), body mass index (BMI; p=0.000), abdominal circumference (p=0.000), median triglycerides (p=0.001), total cholesterol (p≤0.042), and low‐density lipoprotein cholesterol (LDL–C; p≤0.027); and lower HDL‐C levels (p=0.005). There was an increase in mean BMI (p=0.000), abdominal circumference (p=0.000), and median triglycerides (p=0.002) as the values of HOMA ‐IR increased, with the exception of HDL‐C, which decreased (p=0.001). Those with the highest number of simultaneous alterations were between the second and third quartiles of the HOMA–IR index (p=0.000).
ConclusionThe results confirmed that insulin resistance is present in many obese children and adolescents, and that this condition is associated with alterations that represent an increased risk for developing metabolic disorders in adulthood.
Avaliar a presença de resistência à insulina e sua relação com outras alterações metabólicas, em crianças e adolescentes obesos.
MétodosEstudo retrospectivo de 220 crianças e adolescentes de 5 a 14 anos. Foram realizadas avaliações antropométricas (peso, estatura e circunferência abdominal), clínicas (sexo, idade, estágio puberal e grau de obesidade) e bioquímicas (glicemia, insulina, colesterol total e frações, triglicerídeos). A resistência à insulina foi identificada pelo índice HOMA‐IR. A análise das diferenças entre as variáveis de interesse e os quartis do HOMA‐IR foi realizada pelos testes ANOVA ou Kruskal‐Wallis.
ResultadosA resistência à insulina foi diagnosticada em 33,20% da amostra. Associou‐se a níveis baixos de HDL‐C (p=0,044), medida da circunferência abdominal aumentada (p=0,030) e ao conjunto de alterações clínicas e metabólicas (p=0,000). Os indivíduos resistentes apresentaram maiores médias de idade (p=0,000), IMC (p=0,000), medida da circunferência abdominal (p=0,000) e maiores medianas de triglicerídeos (p=0,001), colesterol total (p≤0,042), LDL‐C (p≤0,027) e menores de HDL‐C (p=0,005). Houve aumento das médias de IMC (p=0,000), medida da circunferência abdominal (p=0,000) e mediana de triglicerídeos (p=0,002) à medida que os valores do HOMA‐IR se elevavam, com exceção dos níveis de HDL‐C que diminuíram (p=0,001). Aqueles que apresentaram o maior conjunto de alterações simultâneas estavam entre o segundo e terceiro quartis do HOMA‐IR (p=0,000).
ConclusãoOs resultados confirmaram que a resistência à insulina está presente em muitas crianças e em muitos adolescentes obesos, e que esta condição está associada a alterações que representam aumento do risco para o desenvolvimento de distúrbios metabólicos na maturidade.
A obesidade é uma doença crônica de etiologia multifatorial. Sua ocorrência está associada ao aumento da morbimortalidade e à diminuição da expectativa de vida. Na infância e adolescência costuma acarretar alterações metabólicas importantes que, dependendo da duração e gravidade, podem determinar o desenvolvimento das doenças crônicas não transmissíveis na fase adulta.1,2 Nesse contexto, a resistência à insulina (RI) tem surgido como importante distúrbio entre populações jovens. Estudos têm destacado que os portadores de RI apresentam maior predisposição para o desenvolvimento futuro de síndrome metabólica (SM), diabetes tipo II e doença cardiovascular. Foram identificadas correlações entre RI e alterações clínicas e metabólicas, principalmente entre crianças e adolescentes obesos, apontando a obesidade como importante gatilho para o seu estabelecimento.3–7
Os mecanismos pelos quais a RI ocorre não estão totalmente esclarecidos. É caracterizada essencialmente pela redução da capacidade de concentrações normais de insulina plasmática promoverem a adequada captação periférica de glicose, manterem a glicogênese hepática em equilíbrio e inibirem a produção de lipoproteína de muito baixa densidade.8 Diagnosticar a RI não é fácil, devido à inexistência de um único método capaz de estimar o grau de sensibilidade individual à insulina.
Dentre os diferentes métodos encontram‐se os diretos, que procuram analisar os efeitos de uma quantidade pré‐determinada de insulina administrada (teste de tolerância à insulina, teste de supressão da insulina e clampeamento), e os indiretos, que avaliam o efeito da insulina endógena (insulinemia de jejum, HOMA [homeostasis model assessment] e o teste de tolerância oral à glicose [TTOG]). O padrão ouro é o clamp euglicêmico hiperinsulinêmico, mas a complexidade do método e o elevado custo inviabilizam o seu uso na prática clínica diária e em estudos epidemiológicos.9 O homeostasis model assessment for insulin resistance (HOMA‐IR) é um índice bastante utilizado em adultos, e tem sido validado em crianças e adolescentes por meio da comparação com índices fundamentados no teste de tolerância oral à glicose e com o clamp euglicêmico hiperinsulinêmico.
Alguns autores apontam que pontos de corte com valores ao redor de três são capazes de identificar RI nesta população.10–15 A RI é uma das mais importantes repercussões encontradas em portadores de obesidade e parece ser o fator que propicia o desencadeamento das demais alterações metabólicas. Assim sendo, o presente estudo teve como objetivo avaliar a presença de RI e a sua relação com outras alterações metabólicas em crianças e adolescentes obesos.
MétodosEstudo transversal retrospectivo com coleta de dados primários de crianças e adolescentes atendidos em um Ambulatório de Obesidade, no município de Osasco, São Paulo, no período de abril de 2010 a janeiro de 2012. Foram analisados 220 pacientes de 5 a 14 anos de idade, que não haviam passado por intervenção para redução de peso. O tamanho mínimo exigido para a amostra (201 crianças e adolescentes) foi calculado levando‐se em consideração o desfecho de RI nessa população, nível de significância de 5% (α=0,05), poder estatístico de 95% (1‐β=0,95) e 20% de eventuais perdas.
Na avaliação antropométrica foram utilizadas medidas de peso, estatura e circunferência abdominal (CA). O peso foi obtido por meio de balança do tipo plataforma da marca Filizola (Filizola, São Paulo, Brasil), colocada em superfície lisa, com capacidade para até 150kg e precisão de 100g. Os indivíduos estavam descalços e com roupas leves, posicionados no centro da balança, no plano vertical. A estatura foi aferida em posição ereta, pés descalços e unidos em paralelo, utilizando‐se como instrumento um estadiômetro com resolução de 1mm. Para a classificação do estado nutricional das crianças e dos adolescentes foi utilizado o escore‐z de IMC, de acordo com os critérios propostos pela Organização Mundial da Saúde,16 e os indivíduos foram categorizados em obesos (Z IMC > +2 ≤ +3) ou obesos graves (Z IMC > +3). A CA foi mensurada com o indivíduo em posição vertical, no ponto médio entre a margem inferior da última costela e a borda superior da crista ilíaca, no plano horizontal, com fita métrica inextensível graduada em milímetros. A CA foi considerada aumentada quando o seu valor estava no percentil 90 ou acima deste, segundo o sexo e a idade.17
O grau de maturação sexual dos indivíduos foi avaliado por pediatra endocrinologista e classificado pela comparação com as planilhas de Tanner.18 Dessa forma, foram considerados pré‐púberes quando estavam no estágio 1, púberes nos estágios 2, 3 e 4, e pós‐púberes no estágio 5. Os exames laboratoriais foram solicitados na rotina do Ambulatório de Obesidade e incluíram dosagem sérica de colesterol total e frações, triglicerídeos, insulina e glicemia de jejum.
As amostras de sangue foram coletadas por meio de punção venosa, após jejum de 12 horas. A coleta foi realizada em tubo a vácuo contendo gel separador sem anticoagulante. Após a coleta o sangue foi centrifugado por 10 minutos a 3.000rpm para separar o soro dos demais componentes, e este foi utilizado para efetuar as análises. Os níveis de colesterol total, triglicerídeos, HDL‐C e glicose foram determinados utilizando kit calorimétrico enzimático processado no aparelho Autohumalyzer A5, (Human GMBH, Kaiserslautern, Alemanha). A insulina foi determinada em equipamento ACS‐180 Automated Chemiluminescense System (Ciba Corning, Diagnostics Corp; Medifield, EUA) e os níveis de LDL‐C foram calculados por meio da equação de Friedewald et al.19
Os resultados foram comparados com os valores de referência para a infância e adolescência da I Diretriz de Prevenção da Aterosclerose na Infância e na Adolescência.20 O índice HOMA‐IR foi utilizado para avaliar a RI, tendo sido obtido com o cálculo do produto da insulina plasmática de jejum (μU/mL) e da glicemia de jejum (mmol/L) dividido por 22,5. O ponto de corte utilizado foi maior ou igual a 3,43 para ambos os sexos, segundo García Cuartero et al.15
Foram consideradas alterações clínicas e metabólicas: glicemia de jejum ≥ 100mg/dL, insulina de jejum ≥15 microU/mL, colesterol total ≥ 170mg/dL, LDL‐C ≥130mg/dL, HDL‐C ≤ 45mg/dL, triglicerídeos ≥130mg/dL e a medida da circunferência abdominal ≥ P90. Para cada indivíduo foi definido um conjunto de alterações clínicas e metabólicas de acordo com o número de condições prevalentes, que variou de 0 (nenhuma alteração) até 7 (presença de todas as alterações). O projeto foi submetido e aprovado pelo Comitê de Ética em Pesquisa da Universidade Federal de São Paulo – UNIFESP. A coleta dos dados foi realizada após o consentimento escrito e informado da instituição onde foi realizado o estudo. Os dados foram digitados em planilhas Excel 2010 (Microsoft, Washington, EUA) e analisados no programa SPSS 19.0 (IBM Company, New York, EUA). As variáveis contínuas foram testadas quanto à normalidade da distribuição pelo teste de Kolmogorov Smirnov. As diferenças para estas variáveis foram analisadas pelo teste‐t ou Mann‐Whitney, de acordo com a distribuição. As variáveis categóricas foram avaliadas pelo teste Qui‐quadrado (com correção pelo teste exato de Fisher). Para avaliação da RI e a sua relação com as variáveis clínicas e metabólicas, o índice HOMA‐IR foi distribuído em quartis e as diferenças entre os valores destas variáveis foram avaliadas pelo teste ANOVA ou Kruskal‐Wallis, de acordo com a distribuição. Para todas as análises considerou‐se significância estatística o valor de p menor que 0,05.
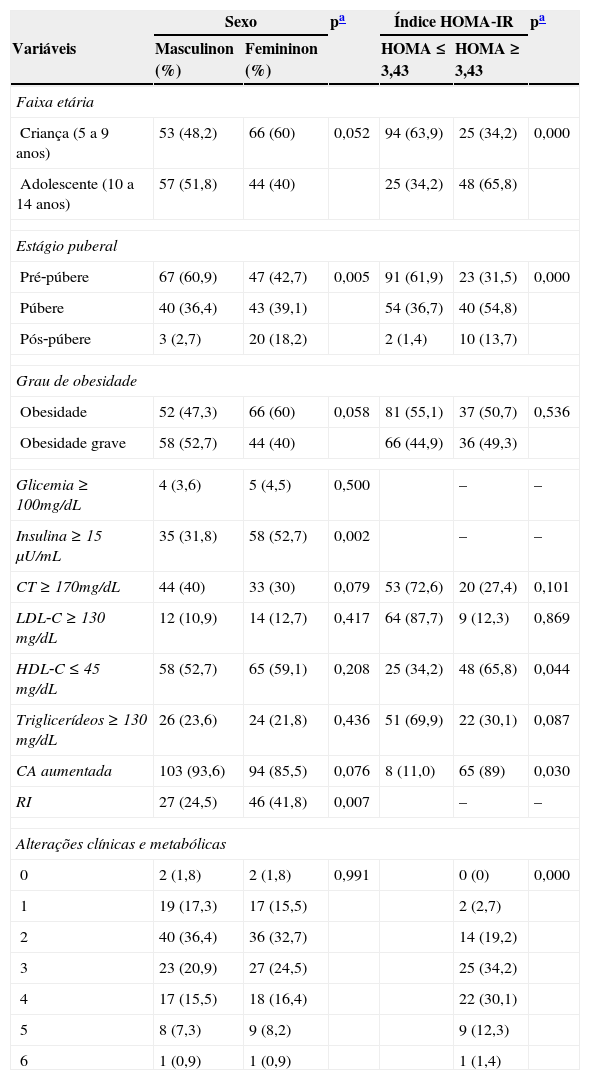
ResultadosForam incluídos no estudo 220 crianças e adolescentes obesos (50% meninas, 54,1% crianças, 46,4% obesos graves e 51,8% pré‐púberes) com média de idade de 9,13±2,11 anos. Percentuais expressivos de alterações clínicas e metabólicas foram encontrados: aumento da medida da CA (89,5%), hiperinsulinemia (42,3%), hipercolesterolemia (35%), LDL‐C elevado (23%) e HDL‐C baixo (55,9%). Observou‐se alteração de glicemia de jejum em uma criança e oito adolescentes. A tabela 1 mostra os valores absolutos e percentuais das características clínicas e metabólicas das crianças e dos adolescentes. As maiores frequências de indivíduos pós‐púberes (18,2 vs. 2,7%, p=0,005), alteração da insulina de jejum (52,7 vs. 31,8%, p=0,002) e RI (41,8 vs. 24,5%, p=0,007) foram observadas entre as meninas. A glicemia de jejum esteve alterada em 3,6% dos meninos e 4,5% das meninas, embora não tenha havido diferença significativa entre os sexos (p=0,500).
Valores absolutos e percentuais das características clínicas e metabólicas das crianças e dos adolescentes obesos, segundo o sexo e o índice HOMA‐IR
| Sexo | pa | Índice HOMA‐IR | pa | |||
|---|---|---|---|---|---|---|
| Variáveis | Masculinon (%) | Femininon (%) | HOMA ≤ 3,43 | HOMA ≥ 3,43 | ||
| Faixa etária | ||||||
| Criança (5 a 9 anos) | 53 (48,2) | 66 (60) | 0,052 | 94 (63,9) | 25 (34,2) | 0,000 |
| Adolescente (10 a 14 anos) | 57 (51,8) | 44 (40) | 25 (34,2) | 48 (65,8) | ||
| Estágio puberal | ||||||
| Pré‐púbere | 67 (60,9) | 47 (42,7) | 0,005 | 91 (61,9) | 23 (31,5) | 0,000 |
| Púbere | 40 (36,4) | 43 (39,1) | 54 (36,7) | 40 (54,8) | ||
| Pós‐púbere | 3 (2,7) | 20 (18,2) | 2 (1,4) | 10 (13,7) | ||
| Grau de obesidade | ||||||
| Obesidade | 52 (47,3) | 66 (60) | 0,058 | 81 (55,1) | 37 (50,7) | 0,536 |
| Obesidade grave | 58 (52,7) | 44 (40) | 66 (44,9) | 36 (49,3) | ||
| Glicemia ≥ 100mg/dL | 4 (3,6) | 5 (4,5) | 0,500 | – | – | |
| Insulina ≥ 15μU/mL | 35 (31,8) | 58 (52,7) | 0,002 | – | – | |
| CT ≥ 170mg/dL | 44 (40) | 33 (30) | 0,079 | 53 (72,6) | 20 (27,4) | 0,101 |
| LDL‐C ≥ 130 mg/dL | 12 (10,9) | 14 (12,7) | 0,417 | 64 (87,7) | 9 (12,3) | 0,869 |
| HDL‐C ≤ 45 mg/dL | 58 (52,7) | 65 (59,1) | 0,208 | 25 (34,2) | 48 (65,8) | 0,044 |
| Triglicerídeos ≥ 130 mg/dL | 26 (23,6) | 24 (21,8) | 0,436 | 51 (69,9) | 22 (30,1) | 0,087 |
| CA aumentada | 103 (93,6) | 94 (85,5) | 0,076 | 8 (11,0) | 65 (89) | 0,030 |
| RI | 27 (24,5) | 46 (41,8) | 0,007 | – | – | |
| Alterações clínicas e metabólicas | ||||||
| 0 | 2 (1,8) | 2 (1,8) | 0,991 | 0 (0) | 0,000 | |
| 1 | 19 (17,3) | 17 (15,5) | 2 (2,7) | |||
| 2 | 40 (36,4) | 36 (32,7) | 14 (19,2) | |||
| 3 | 23 (20,9) | 27 (24,5) | 25 (34,2) | |||
| 4 | 17 (15,5) | 18 (16,4) | 22 (30,1) | |||
| 5 | 8 (7,3) | 9 (8,2) | 9 (12,3) | |||
| 6 | 1 (0,9) | 1 (0,9) | 1 (1,4) | |||
HOMA‐IR, homeostasis model assessment for insulin resistance; CT, colesterol total; LDL‐C, lipoproteína de baixa densidade‐colesterol; HDL‐C, lipoproteína de alta densidade‐colesterol; CA, circunferência abdominal; RI, resistência à insulina.
Meninos e meninas foram semelhantes em relação à faixa etária (p=0,052), ao grau de obesidade (p=0,058), ao aumento da CA (p=0,076) e às alterações de colesterol total (p=0,079), LDL‐C (p=0,417), HDL‐C (p=0,208) e triglicerídeos (p=0,436). Identificou‐se que 15,5% dos meninos e 16,4% das meninas apresentavam quatro alterações clínicas ou metabólicas simultâneas, ainda que não tenha sido observada diferença entre os sexos (p=0,991). A RI foi diagnosticada em 33,20% da amostra (valor médio do índice HOMA‐IR=3,26±2,67). As maiores frequências de RI foram observadas entre os adolescentes (65,8%) e os indivíduos púberes (54,8%). Foram encontradas associações entre RI e níveis baixos de HDL‐C (p=0,044), medida da CA aumentada (p=0,030) e o número de alterações clínicas e metabólicas (p=0,000) (tabela 1).
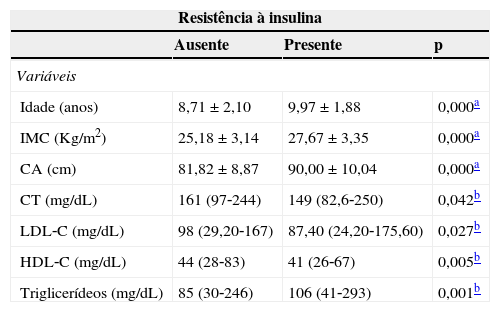
Na tabela 2 observamos que os indivíduos resistentes à insulina apresentaram maiores médias de idade (9,97±1,88 vs. 8,71±2,10, p=0,000), IMC (27,67±25 vs.18±3,14, p=0,000), medida da CA (90±10,04cm vs. 81,82±8,87cm, p=0,000) e maior mediana de triglicerídeos (85mg/dL (30‐246mg/dL) vs. 106mg/dL (41‐293mg/dL), p=0,001), em comparação com aqueles que não tinham RI. Exceções foram observadas em relação à mediana de colesterol total (153,35±32,64mg/dL vs. 162,70±29,99mg/dL, p ≤ 0,042), LDL‐C (87,40mg/dL (24,20‐175,60mg/dL) vs. 98mg/dL (29,20‐167mg/dL), p ≤ 0,027) e HDL‐C (41mg/dL (26‐67mg/dL) vs. 44mg/dL (28‐83mg/dL), p=0,005), que diminuíram na presença da RI. Na distribuição das variáveis clínicas e metabólicas das crianças e dos adolescentes segundo os quartis do HOMA‐IR, observou‐se também o aumento das médias de IMC (p=0,000), medida da CA (p=0,000) e mediana de triglicerídeos (p=0,002) à medida que os valores do HOMA‐IR elevavam, com exceção dos níveis de HDL‐C, que diminuíram (p=0,001).
Valores de tendência central e dispersão das variáveis clínicas e metabólicas de crianças e adolescentes, segundo a ausência ou a presença de resistência à insulina
| Resistência à insulina | |||
|---|---|---|---|
| Ausente | Presente | p | |
| Variáveis | |||
| Idade (anos) | 8,71±2,10 | 9,97±1,88 | 0,000a |
| IMC (Kg/m2) | 25,18±3,14 | 27,67±3,35 | 0,000a |
| CA (cm) | 81,82±8,87 | 90,00±10,04 | 0,000a |
| CT (mg/dL) | 161 (97‐244) | 149 (82,6‐250) | 0,042b |
| LDL‐C (mg/dL) | 98 (29,20‐167) | 87,40 (24,20‐175,60) | 0,027b |
| HDL‐C (mg/dL) | 44 (28‐83) | 41 (26‐67) | 0,005b |
| Triglicerídeos (mg/dL) | 85 (30‐246) | 106 (41‐293) | 0,001b |
IMC, índice de massa corporal; CA, circunferência abdominal; CT, colesterol total; LDL‐C, lipoproteína de baixa densidade‐colesterol; HDL‐C, lipoproteína de alta densidade‐colesterol.
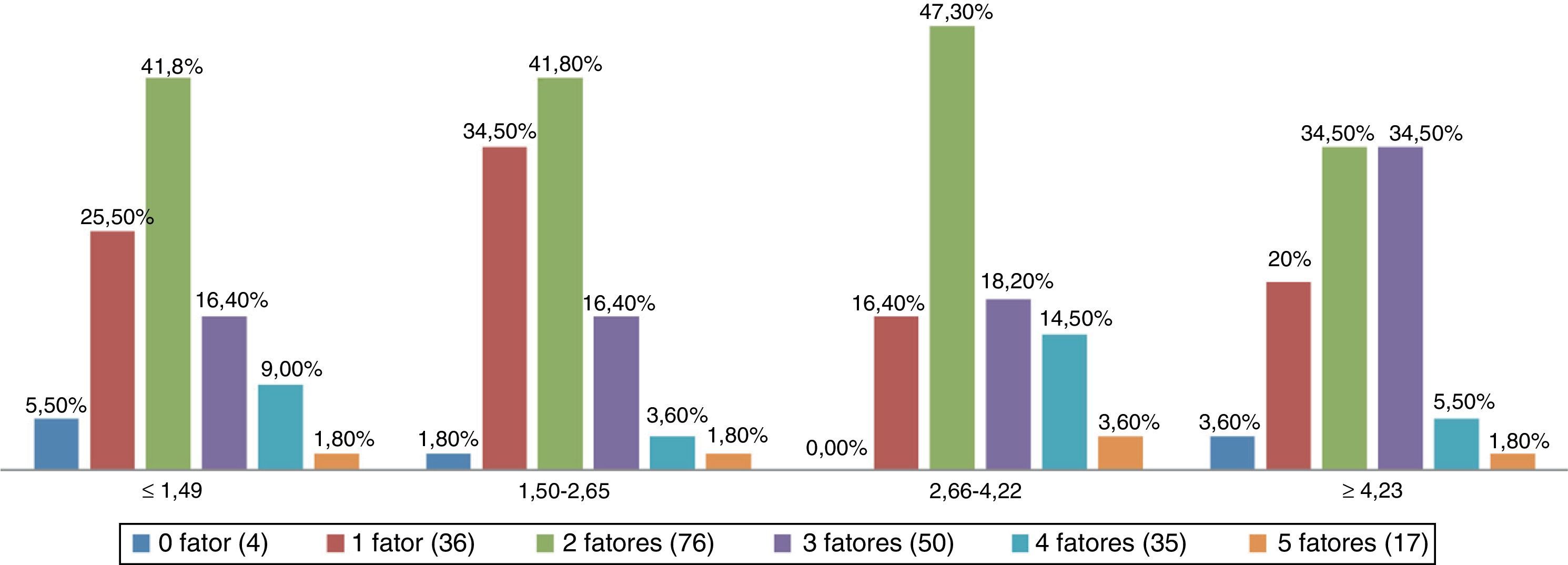
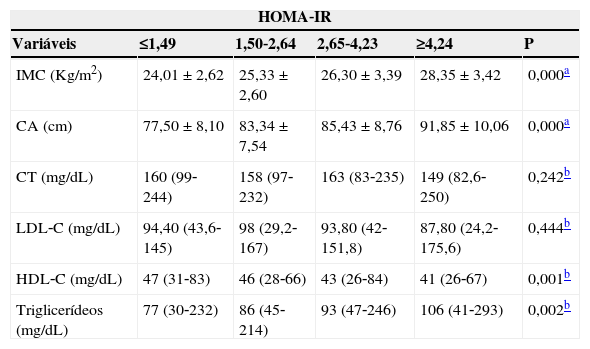
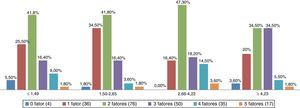
Não houve diferenças significantes entre os valores de colesterol total (p=0,242) e LDL‐C e os quartis do HOMA‐IR (p=0,444) (tabela 3). Aqueles que apresentaram o maior conjunto de alterações clínicas e metabólicas simultâneas estavam entre o segundo e o terceiro quartis do HOMA‐IR (p=0,000) (fig. 1).
Perfil clínico e metabólico de crianças e adolescentes obesos, segundo os quartis do índice HOMA‐IR
| HOMA‐IR | |||||
|---|---|---|---|---|---|
| Variáveis | ≤1,49 | 1,50‐2,64 | 2,65‐4,23 | ≥4,24 | P |
| IMC (Kg/m2) | 24,01±2,62 | 25,33±2,60 | 26,30±3,39 | 28,35±3,42 | 0,000a |
| CA (cm) | 77,50±8,10 | 83,34±7,54 | 85,43±8,76 | 91,85±10,06 | 0,000a |
| CT (mg/dL) | 160 (99‐244) | 158 (97‐232) | 163 (83‐235) | 149 (82,6‐250) | 0,242b |
| LDL‐C (mg/dL) | 94,40 (43,6‐145) | 98 (29,2‐167) | 93,80 (42‐151,8) | 87,80 (24,2‐175,6) | 0,444b |
| HDL‐C (mg/dL) | 47 (31‐83) | 46 (28‐66) | 43 (26‐84) | 41 (26‐67) | 0,001b |
| Triglicerídeos (mg/dL) | 77 (30‐232) | 86 (45‐214) | 93 (47‐246) | 106 (41‐293) | 0,002b |
HOMA‐IR, homeostasis model assessment for insulin resistance; IMC, índice de massa corporal; CA, circunferência abdominal; CT, colesterol total; LDL‐C, lipoproteína de baixa densidade‐colesterol; HDL‐C, lipoproteína de alta densidade‐colesterol.
Prevalência de simultaneidade de alterações clínicas e metabólicas em crianças e adolescentes obesos, segundo os quartis do índice HOMA‐IR.
P=0,00 ‐ Teste qui‐quadrado com correção pelo teste exato de Fisher.
Os fatores de risco clínicos e metabólicos são: Colesterol total ≥ 170mg/dL, LDL‐C ≥ 130mg/dL, HDL‐C ≤ 45mg/dL, triglicerídeos ≥130mg/dL e a medida da circunferência abdominal aumentada.
A infância pode ser considerada um período crítico para o princípio ou constância da obesidade e ponto de partida para o surgimento e o desenvolvimento de alterações clínicas e metabólicas importantes que, dependendo da duração e da gravidade, podem gerar danos à saúde na idade adulta.21 Ao avaliar o estado nutricional de crianças e adolescentes, torna‐se importante não só o conhecimento da idade cronológica, mas também o grau de maturação sexual, especialmente para avaliação do risco de persistência da obesidade e das morbidades associadas, já que a probabilidade de uma criança obesa permanecer obesa na idade adulta varia de 20 a 50% antes da maturação sexual e de 50 a 70% após a puberdade.22
Em nosso estudo observamos que 42,7% dos indivíduos já haviam iniciado a puberdade e que a maioria destas crianças e adolescentes, além da obesidade, apresentavam alterações clínicas e metabólicas importantes, semelhantes ao encontrado em outros estudos que demonstraram que o aumento do IMC potencializa o surgimento de fatores de risco metabólicos nesta população. O achado de nove casos de glicemia de jejum alterada (um caso entre crianças e oito entre adolescentes) é preocupante pela precocidade, uma vez que essa alteração raramente é verificada em crianças e adolescentes, mesmo em amostras compostas só por obesos.
As prevalências de alterações na insulina de jejum e nas frações lipídicas HDL‐C e LDL‐C são relevantes, uma vez que estudos têm demonstrado que a hiperinsulinemia é fator de risco independente para o desenvolvimento de doenças cardiovasculares por potencializar o surgimento de dislipidemia. Nessa situação ocorre diminuição da capacidade da insulina de estimular a utilização da glicose pelo músculo e pelo tecido adiposo, gerando prejuízos à supressão da lipólise, condição que eleva a circulação de ácidos graxos livres e altera ainda mais o transporte de glicose para os tecidos‐alvo, inibindo a ação da insulina. A RI conduz ao aumento da oxidação de ácidos graxos, provê substrato para a síntese de triglicerídeos e aumenta a liberação de LDL‐C para o soro.23,24 Estudo que avaliou por oito anos os níveis de insulina sérica de crianças de 5 a 9 anos e adultos jovens de 17 a 23 anos mostrou que, entre aqueles que apresentavam hiperinsulinemia, os casos de dislipidemia foram três vezes maiores.25
Serrano et al. observaram que adolescentes com excesso de peso apresentavam chance 4,5 vezes maior de ter o índice HOMA‐IR alterado, e que os seus valores eram maiores nas adolescentes com maior percentual de gordura.26 Costa et al. pesquisaram o agrupamento de fatores de risco cardiovasculares entre 118 crianças e adolescentes de acordo com os quartis de IMC e verificaram que o excesso de peso esteve associado ao aumento da pressão arterial, dos triglicerídeos, do índice HOMA‐IR e do HDL colesterol baixo, configurando perfil pró‐aterosclerótico nesta população.27 No presente estudo, a prevalência de RI identificada é consistente com a encontrada por outros autores em estudos nacionais e internacionais, e confirma a gravidade do problema.4,6,7 Esta condição associou‐se ao sexo feminino, aos adolescentes, aos indivíduos púberes, à diminuição dos níveis séricos de HDL‐C, ao aumento da circunferência abdominal e ao conjunto de alterações clínicas e metabólicas encontradas no grupo.
A literatura mostra que ainda não existe consenso em relação aos pontos de corte do HOMA‐IR para avaliação de crianças e adolescentes, uma vez que estes valores tendem a variar durante estas fases da vida. Para o estabelecimento da correlação entre o ponto de corte e o risco associado é necessário o desenvolvimento de estudos prospectivos que considerem, entre outros aspectos, que os valores de insulina de jejum variam durante a infância e a adolescência, o que demanda longo período de observação. No entanto, existe concordância de que pesquisas sobre a relação entre obesidade e RI, em crianças e adolescentes, podem favorecer a identificação precoce de fatores que influenciam o surgimento de doenças cardiovasculares e diabetes tipo II.11–15 Neste estudo, para atender à RI fisiológica que ocorre durante a fase da adolescência, optou‐se por utilizar o ponto de corte do HOMA‐IR de 3,43 sugerido por García Cuartero et al.,15 que avaliaram crianças e adolescentes com idades entre 1 mês e 18 anos, levando em consideração as variações deste índice por idade e sexo, observando também o estadiamento puberal segundo os critérios de Tanner.18
Em nosso estudo, quando avaliamos o comportamento dos valores das variáveis clínicas e metabólicas destas crianças e adolescentes frente à presença ou ausência de RI, observamos que aquelas que eram resistentes à insulina apresentaram maiores valores de IMC, CA, triglicerídeos e diminuição do HDL‐C em concordância com outros estudos que também destacaram a relação existente entre obesidade, RI e alterações do metabolismo de crianças e adolescentes.
Mieldazis et al., ao investigarem a relação entre o IMC, HOMA‐IR e a insulinemia em um grupo de crianças pré púberes, concluíram que existe forte associação entre o hiperinsulinismo e a obesidade, e que quanto maior o IMC maior será o valor de HOMA.3 Madeira et al., ao analisarem o impacto da obesidade sobre componentes da síndrome metabólica (SM) em crianças, verificaram que as obesas apresentavam diferenças nas médias do HDL colesterol, do índice HOMA‐IR, da insulina sérica, da relação glicose/insulina e da circunferência abdominal, evidenciando que a obesidade apresentou influência importante sobre o metabolismo das crianças avaliadas.13
Lavrador et al. observaram, em amostra de 80 adolescentes obesos pós‐púberes divididos em obesos com menor e maior grau de obesidade, que aqueles com maior grau de obesidade apresentavam maiores frequências de alterações para glicemia, HOMA‐IR, triglicerídeos, HDL e pressão arterial, demonstrando que o grau de obesidade influenciou no aparecimento de alterações clínicas e metabólicas.28 Diferentemente do nosso estudo, que não encontrou diferenças significativas entre o grau de obesidade por sexo e presença de RI. O método de distribuir a amostra, segundo os quartis do índice HOMA‐IR das crianças e dos adolescentes avaliados, confirmou que quanto maiores os valores do HOMA‐IR, maiores eram os valores de IMC, medida da CA e triglicerídeos, e menores os valores de HDL‐C, em consonância com outros estudos, como o de Ferreira et al., que avaliou a associação do IMC e da RI com a SM em crianças brasileiras. A SM identificada entre as obesas e muitos dos fatores de risco que a compunha estavam acima do terceiro quartil do índice HOMA‐IR. Esses achados reforçam a provável participação da obesidade e RI no desenvolvimento de fatores de risco cardiovascular, já que esses fatores eram mais elevados nos percentis mais altos de IMC e HOMA‐IR.7 Em estudo de caso controle, que avaliou a relação de fatores de risco para doença cardiovascular com RI em 52 crianças, observou‐se que as obesas apresentavam alta prevalência de SM. Aquelas com maior RI exibiram mais fatores de risco metabólico. A SM esteve presente em 17,3% das crianças investigadas. No mesmo estudo, a média do índice HOMA‐IR foi significativamente diferente para o sexo feminino (3,8±2,2, IC 2,9‐4,8, 95%) em comparação ao masculino (2,6±1,3, IC95%, 2,1‐3,1), p=0,016.6
Em nosso estudo, a frequência de simultaneidade de alterações clínicas e metabólicas esteve mais presente entre o segundo e o terceiro quartis. No entanto, os valores médios do índice HOMA‐IR deste estudo foram superiores ao encontrados por Medeiros et al.5 (2,4), Ferreira et al.6 (3,2), Weiss et al.29 (3,12 a 8,69, de acordo com o grau de obesidade) e Hirschler et al.30 (2,76), diferenças estas que podem ser parcialmente explicadas pela obesidade. Outros fatores que não foram abordados no presente estudo, como o tempo de exposição à obesidade e o hábito alimentar, podem exercer forte contribuição para a RI. Muito embora não haja consenso sobre o diagnóstico de RI em crianças e adolescentes, recomenda‐se que as ocorrências isoladas ou associadas de alterações clínicas e metabólicas devam ser monitoradas principalmente em obesos, visto que o excesso de gordura corporal é o mais importante fator de risco para o desenvolvimento de doenças crônicas não transmissíveis na maturidade.
De fato, o presente estudo confirma dados da literatura ao mostrar que a RI está presente em crianças e adolescentes obesos, e que esta condição associa‐se a alterações clínicas e metabólicas. Apesar das limitações impostas a todos os estudos de delineamento transversal, no que se refere à dificuldade em definir a sequência temporal da linha de casualidade, os resultados encontrados contribuem para o melhor entendimento da relação entre a RI e as repercussões metabólicas frequentemente observadas em crianças e adolescentes obesos. Cabe ressaltar que a relação observada entre a RI e as variáveis analisadas, neste estudo, aponta para o aumento do risco para o desenvolvimento de doenças cardiovasculares, diabetes tipo II e SM, na maturidade, para este grupo.
O acompanhamento dessa população, com reavaliações periódicas dos parâmetros analisados, poderá fornecer maior consistência aos resultados encontrados. A obesidade é uma doença crônica com importantes repercussões, que tendem a piorar com a persistência e a gravidade do excesso de peso. Assim, o tratamento deve ser realizado de forma adequada, com equipe multidisciplinar e sempre com a inclusão da família. Devem ser estabelecidas metas possíveis dentro da realidade de cada paciente, com o objetivo de conseguir a redução progressiva do IMC e a manutenção dos resultados alcançados, em relação ao estado nutricional e à melhora das alterações clínicas e metabólicas.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Nossos agradecimentos especiais à equipe multidisciplinar do Programa de Obesidade Infantil da prefeitura de Osasco‐SP, pela valorosa contribuição com este estudo: Dra. Bianca Souza Maas, Coordenadora do Programa; Dra. Ana Paula Paiano Franco, Pediatra; Célia Regina Mota G. Santos, Assistente Social; e Silvana de Jesus Baptista Alegret, Psicóloga.
Como citar este artigo: Romualdo MC, de Nóbrega FJ, Escrivão MA. Insulin resistance in obese children and adolescents. J Pediatr (Rio J). 2014;90:600–7.
Estudo conduzido na Pós‐Graduação em Nutrição, Universidade Federal de São Paulo (UNIFESP), Escola Paulista de Medicina (EPM), São Paulo, SP, Brasil.