The cardioprotective enzyme paraoxonase‐1 (PON1) suffers an important influence from genetic polymorphisms and nutritional factors. The aim of this study was to investigate the influence of diet, nutritional status, and the C(‐107)T polymorphism on PON1 arylesterase activity in children.
MethodsThis was a cross‐sectional study with 97 children, aged between 5 and 8 years, of both genders, from a pediatric outpatient clinic in southern Brazil. A sociodemographic, behavioral, and food consumption questionnaire was applied, and anthropometric measurements and laboratory blood samples were taken. PON1 arylesterase activity was measured by phenol extinction (U/mL), and DNA extraction and analysis of the PON1 C(‐107)T polymorphism were performed. The Hardy–Weinberg equilibrium was tested with the chi‐squared test and linear regression was used to estimate PON1 activity according to four adjustment models, with an acceptable error of 5%.
ResultsIn the sample, the male gender accounted for 50.5%, 39.2% were 6 years of age, 54.5% had normal weight, and 51.5% had PON1 activity below the median (90.0, 15–30U/mL). Genotype frequency was 54.6% (53/97), 31.0% (30/97), and 14.4% (14/97), respectively, for CT, CC, and TT, consistent with the Hardy–Weinberg equilibrium (p=0.22). In the regression analysis, the model that included sociodemographic variables as well as frequency of consumption of fruits, vegetables, legumes, dairy products, and beans estimated a variability of 14.8% in PON1 activity combined with the PON1 C(‐107)T polymorphism.
ConclusionsDuring childhood, a good‐quality diet with greater inclusion of healthy foods was important to predict the activity of the cardioprotective enzyme PON1 combined with the C(‐107)T polymorphism of the PON1 gene.
A enzima cardioprotetora Paraoxonase 1 (PON1) sofre importante influência de polimorfismos genéticos e fatores nutricionais. O objetivo deste estudo foi investigar a influência da alimentação, do estado nutricional e do polimorfismo C(‐107)T sobre a atividade arilesterase da PON1 em crianças.
MétodosEstudo transversal com 97 crianças entre 5 e 8 anos, de ambos os sexos, de um ambulatório de pediatria no sul do Brasil. Realizou-se questionário sociodemográfico, de comportamento e de consumo alimentar, medidas antropométricas e coleta de sangue em laboratório. A atividade arilesterase da PON1 foi mensurada pela extinção de fenol (U/mL), realizada extração do DNA e análise do polimorfismo PON1 C(‐107)T. O equilíbrio de Hardy‐Weinberg foi testado com qui‐quadrado e usada regressão linear para estimar a atividade da PON1 segundo quatro modelos de ajuste, erro aceitável de 5%.
ResultadosNa amostra o sexo masculino representou 50,5%, 39,2% tinham 6 anos, 54,5% eram eutróficos e 51,5% tinha atividade da PON1 inferior à mediana (90,0;15‐30U/ml). A frequência dos genótipos foi 54,6% (53/97), 31,0% (30/97) e 14,4% (14/97), respectivamente, para CT, CC e TT, estiveram em equilíbrio de Hardy‐Weinberg (p=0,22). Na análise de regressão o modelo que incluiu variáveis sociodemográficas, de frequência do consumo de frutas, verduras, legumes, laticínios e feijões estimou uma variabilidade de 14,8% na atividade da PON1 combinada ao polimorfismo PON1 C(‐107)T.
ConclusõesNa infância uma alimentação de boa qualidade, com maior participação de alimentos saudáveis foi importante para predizer a atividade da enzima cardioprotetora PON1 combinada ao polimorfismo C(‐107)T do gene da PON1.
A PON1 é uma enzima de 43kDa expressa em humanos, sobretudo no fígado, detectada no plasma ligada às Apo‐proteínas A1 e J das partículas da lipoproteína de alta densidade (HDL).1 A enzima impede o dano oxidativo aos fosfolipídios das lipoproteínas, em especial na lipoproteína de baixa densidade (LDL).1,2 Dessa maneira a PON1 previne o efeito pró‐inflamatório dos lipoperóxidos na camada íntima dos vasos sanguíneos e sua maior atividade repercute em redução do risco de doença cardiovascular (DCV).2,3 Essa enzima hidrolisa um amplo espectro de substratos, mas sua atividade arilesterase (fenilacetato) é especialmente importante para redução do dano endotelial e DCV.1–3 A PON1 sofre importante influência de polimorfismos genéticos e fatores nutricionais.1,3,4
O gene da PON1 se localiza no cromossomo humano 7, exibe 9 éxons e codifica uma proteína com 354 aminoácidos.1,5 Mais de 200 polimorfismos foram descritos nesse gene.1,3 No entanto, o polimorfismo caracterizado na região promotora PON1C(‐107)T exerce efeito significativo na enzima, é um forte preditor de sua atividade arilesterase.5,6 O alelo –107C proporciona níveis de PON1 até duas vezes mais elevados do que aqueles observados com o alelo –107T.5,6 Há evidências de que esse polimorfismo no promotor do gene PON1 se localiza no ponto de ligação do fator de transcrição Sp1.5,6 Portanto, a presença do alelo C resulta em maior expressão do gene PON1 e maior atividade sérica da enzima.5,6
Dentre os fatores nutricionais, os ácidos graxos monoinsaturados e as vitaminas antioxidantes, a exemplo das vitaminas C e E, aparecem como responsáveis pelo aumento da atividade da PON1.7–10 Da mesma forma um maior consumo de frutas, verduras e legumes se associou a uma atividade mais elevada da enzima.9,10 Por outro lado, estudos indicam que o excesso de peso repercute em menor atividade da PON1, inclusive na infância.11–13 A infância é um período vulnerável da vida, contudo na atualidade as crianças estão expostas a múltiplos fatores de risco cardiovasculares e metabólicos.14 Sabe‐se que a alimentação das crianças brasileiras é pobre em frutas, legumes e verduras e rica em bebidas açucaradas, biscoitos recheados, hambúrgueres, salgados e embutidos.15 Além disso, o expressivo aumento da prevalência do excesso de peso a partir dos 5 anos correlaciona‐se diretamente ao incremento de morbidades associadas na população infantil.15,16 Essa alimentação de má qualidade e o excesso de peso predispõem ao acúmulo de espécies reativas de oxigênio, ao dano oxidativo as membranas biológicas e ao início de doenças, em particular DCV.11,12,16
Nesse contexto, o objetivo deste estudo foi investigar a influência da alimentação, do estado nutricional e do polimorfismo genético C(‐107)T sobre a atividade arilesterase da enzima antiaterogênica PON1 na infância.
MétodosAmostraEstudo transversal feito com crianças entre 5 e 8 anos incompletos, de ambos os sexos, atendidas no Ambulatório de Pediatria da Faculdade de Medicina da Universidade Federal de Pelotas (UFPEL), na cidade de Pelotas – RS. O protocolo de pesquisa foi aprovado pelo Comitê de Ética em Pesquisa da Faculdade de Medicina da UFPEL (504.362/2013).
Crianças diagnosticadas com doenças hepáticas, paralisia cerebral, displasia óssea ou neoplasias, aquelas portadoras de necessidades especiais (físicas ou motoras) e alterações genéticas, como síndrome de Down e talassemia, foram excluídas do estudo. Os responsáveis das crianças elegíveis foram devidamente esclarecidos e convidados, os que autorizaram a participação no estudo assinaram um Termo de Consentimento Livre Esclarecido – TCLE. O assentimento da criança foi questionado oralmente antes do início das avaliações e respeitada sua decisão.
Foram entrevistadas 227 crianças, dessas 193 atenderam aos critérios de inclusão, houve cinco recusas (2,6%). Noventa e uma crianças (49,7%) não completaram o protocolo do estudo, caracterizaram‐se como perdas. Destaca‐se como causa dessas perdas o não comparecimento ao laboratório para coleta de sangue (40,0%). No fim, o estudo contou com a participação de 97 crianças.
Dados sociodemográficos, antropometria e coleta de sangueOs responsáveis responderam a um questionário sociodemográfico, de comportamento e de consumo alimentar das crianças, foram feitas medidas antropométricas e foi a coleta de sangue em laboratório de análises clínicas.
As duas primeiras categorias de variáveis do questionário foram renda familiar (em R$ convertidos a salários mínimos vigentes), idade da mãe (anos completos), escolaridade materna (anos completos de estudo), número de pessoas no domicílio e tempo (em horas) frente a telas (computador, celular, tablet, videogames, televisão). A cor da pele foi observada e classificada como branca ou não branca.
O peso e altura foram coletados com balança plataforma digital (Welmy®), com capacidade de 150kg e precisão de 100g e estadiômetro acoplado com capacidade de 200cm e precisão de 0,5cm. Para avaliar o estado nutricional usou‐se o Índice de Massa Corporal (IMC) para idade em escore‐z, segundo recomendação da Organização Mundial da Saúde de 2007,17 por meio do programa AnthroPlus. Crianças com IMC‐para‐idade >+1DP foram classificadas com excesso de peso. A circunferência da cintura foi aferida na linha da cintura, no ponto médio entre a última costela e a crista ilíaca. O referencial de comparação foi o proposto por Freedman et al.18
Após jejum de 12 horas amostras de 5mL de sangue foram coletadas, aliquotadas e congeladas a ‐80oC para análises posteriores.
Determinação da atividade arilesterase da PON1A atividade arilesterase da PON1 foi medida em amostras de soro com o uso de fenilacetato como substrato. A atividade enzimática foi calculada a partir da velocidade de formação de fenol através do aumento da absorbância a 270nm, temperatura de 25°C, em espectrofotômetro (FEMTO®). As amostras foram diluídas 1:3 em 20mM de Tampão Tris/HCl (Sigma Chemical Co, St. Louis, USA), pH 8,0, com 1mM de CaCl2 (Vetec Chemical Co, RJ, Br). A solução reagente foi composta pelo tampão, ao qual foi adicionado 1mM de fenilacetato (Sigma Chemical Co, St. Louis, USA). A reação foi determinada após 20 segundos de retenção e a absorbância medida por 80 segundos. Considerou‐se uma unidade de atividade arilesterase da PON1 igual a 1μM de fenol/minuto e essa foi expressa em U/mL, com base no coeficiente de extinção de fenol.16 As análises foram em duplicata e amostras em branco com água deionizada foram usadas para corrigir a hidrólise não enzimática.
Extração do DNA e análise do polimorfismo PON1 C(‐107)TO DNA foi extraído das amostras de sangue que continham EDTA de acordo com procedimento padrão descrito previamente por Kanai et al.19 e quantificado em espectrofotômetro. As amostras de DNA foram diluídas para concentração de 50 ng/mL. A genotipagem dos indivíduos para o polimorfismo PON1 C(‐107)T foi feita através da técnica de restriction fragment length polymorphism (RFLP) de acordo com o validado por Campo et al.20
Brevemente, um fragmento de 240pb da região do promotor do gene da PON1 foi amplificado por PCR em 35 ciclos (5min a 94°C, seguido por 45s a 94°C (desnaturação), 45s a 67°C (anelamento) e 45s a 72°C (extensão), seguido de 5min a 72° C). Para tal foram usados os primers: forward 5’AGCTAGCTGCGGACCCGGCGGGGAGGaG3’ e reverse 5’GGCTGCAGCCCTCACCACAACCC3’. A letra minúscula no primer forward indica um erro de pareamento proposital introduzido no amplicon para gerar um sítio de restrição para a enzima BsrBI, pois não há sítio de restrição específico que corte a sequência original do DNA. A digestão foi feita através da incubação da amostra de PCR com 3 UI da enzima BsrBI (New England Bio Labs, Cambridge, UK) por duas horas a 37° C. Após a digestão os fragmentos de DNA foram separados por eletroforese em gel de agarose (Kasvi, Paraná, BR) de 3%, corados com SYBR Safe (Applied Biosystems). O alelo C foi identificado pela presença dos fragmentos de 28 e 212 pb, enquanto o alelo T resultou em um fragmento de 240 pb não digerido.
Índice de Qualidade da AlimentaçãoO Índice de Qualidade da Alimentação (IQA) foi elaborado com referência no Índice de Alimentação do Escolar (Ales).21,22 Porém, a questão sobre o local das refeições foi colocada no lugar da original que investigava consumo de peixe. O IQA baseou‐se: 1) na identificação de componentes comportamentais das crianças, especificamente do hábito de fazer desjejum e de fazer as refeições à mesa; 2) na frequência do consumo alimentar.
A cada frequência específica foi atribuída uma pontuação positiva ou negativa (material suplementar). Para os alimentos de alta qualidade nutricional, como fruta, verdura, legume, feijão e leite, foi acrescido um ponto quando consumidos diariamente. No caso de consumo menor do que sete vezes por semana (duas a quatro vezes, a depender do alimento), foi subtraído um ponto. Já para alimentos de baixa qualidade nutricional, como doce, biscoito, refrigerante, salgadinho, fritura, maionese, macarrão instantâneo e hambúrguer, foi acrescido um ponto quando não consumidos ou consumidos raramente. Além disso, foi subtraído um ponto para a frequência diária desses alimentos. A pontuação máxima do IQA correspondeu a 15 pontos. A distribuição das pontuações totais em tercis originou três categorias de qualidade da alimentação: baixa (≤ 3 escore‐ p25), média (4 a 6 escores‐p50) e boa (≥ 7 escores‐p75).
Análises estatísticasOs dados foram digitados no Microsoft Excel 2013 e analisados no programa STATA versão 12.0 (Stata Corp., College Station, USA). A normalidade dos dados foi testada a partir do teste de Shapiro‐Wilk, as variáveis são apresentadas como frequência absoluta e relativa, média e desvio‐padrão (DP), mediana e intervalo interquartil (IIQ)‐ p25‐75. Os testes U de Mann‐Whitney ou Kruskal‐Wallis foram usados para comparar os escores entre duas ou três categorias de variáveis. O qui‐quadrado foi usado para testar o equilíbrio de Hardy‐Weinberg (EHW), com as frequências observadas e as esperadas. Na análise não ajustada foi usada a regressão linear simples para estimar a atividade da PON1 de acordo com o genótipo. As análises ajustadas foram feitas por meio de regressão linear múltipla com quatro modelos diferentes: Modelo 1 = incluiu variáveis sociodemográficas de escolaridade materna, renda familiar, número de pessoas no domicílio, cor da pele e sexo; Modelo 2 = incluiu as frequências absolutas de consumo alimentar dos alimentos de alta qualidade nutricional, ao ajuste do modelo 1; Modelo 3 = incluiu as frequências de consumo alimentar dos alimentos de baixa qualidade nutricional, ao ajuste do modelo 2; Modelo 4 = incluiu o escore z do IMC ao ajuste do modelo 3. Examinou‐se a mudança no coeficiente determinação (R2) ajustado, o nível de significância adotado foi de p < 0,05.
ResultadosAs características da amostra e o escore do IQA são apresentados na tabela 1. O sexo masculino representou 50,5% (n = 49), 39,2% (n = 38) tinham idade igual a 6 anos, a maioria 87,6% (n = 85) era de pele branca, a renda familiar foi de 2 ou menos salários mínimos e 50,5% (n = 49) permaneciam mais de duas horas/dia em atividade sedentária. A circunferência da cintura ficou abaixo do percentil de risco para 65,0% (n = 63) da amostra e 55,0% (n = 53) se encontravam eutróficos. A atividade arilesterase da PON1 correspondeu à mediana de 90,0 (15‐30) U/mL e 51,5% (n = 50) das crianças tinham PON1 inferior a esse valor. Quanto ao IQA, a pontuação mediana foi de 5,0 (3,0‐7,0) pontos e não houve diferença significativa entre as pontuações segundo as características da amostra.
Escore do Índice de Qualidade da Alimentação conforme as características sociodemográficas, comportamentais, antropométricas e do nível de atividade arilesterase da PON1 de crianças entre 5 e 8 anos incompletos (n = 97), Pelotas‐RS
| % (n) | Média | dp | |
|---|---|---|---|
| Sexoa | |||
| Feminino | 49,49 (48) | 5,04 | 4,79 |
| Masculino | 50,51 (49) | 5,10 | 4,64 |
| Idadeb | |||
| 5 anos | 34,02 (33) | 4,84 | 3,04 |
| 6 anos | 39,18 (38) | 5,44 | 4,43 |
| 7 anos | 26,80 (26) | 4,80 | 4,68 |
| Cor da pelea | |||
| Branca | 87,63 (85) | 5,00 | 4,78 |
| Não branca | 12,37 (12) | 5,58 | 4,1 |
| Renda familiara | |||
| ≤ 2 salários mínimos | 84,54 (82) | 5,02 | 4,54 |
| > 2 salários mínimos | 15,36 (15) | 5,33 | 5,55 |
| Tempo frente a telaa | |||
| ≤ 2 horas | 49,48 (40) | 5,75 | 4,48 |
| > 2 horas | 50,52 (49) | 4,75 | 4,81 |
| Circunferência da cinturaa | |||
| Adequada | 64,95 (63) | 4,95 | 4,89 |
| Elevada | 33,05 (33) | 5,27 | 4,37 |
| Classificação do índice de massa corporala | |||
| Eutrofia | 54,64 (53) | 5,15 | 4,72 |
| Excesso de peso | 45,36 (44) | 4,97 | 4,71 |
| Paraoxonase1a | |||
| < 90 U/mL | 51,55 (50) | 5,06 | 4,95 |
| ≥ 90 U/mL | 48,45 (47) | 5,08 | 4,44 |
n, número de indivíduos; dp, desvio‐padrão.
A frequência dos genótipos para o polimorfismo PON1 C(‐107)T foi de 54,6% (53/97) para o genótipo CT, 31,0% (30/97) para o genótipo CC e 14,4% (14/97) para o genótipo TT. A distribuição dos genótipos mostrou que a população está em equilíbrio de Hardy‐Weinberg (p = 0,22). A frequência alélica foi de 58,0% para o alelo C e 42,0% para o alelo T.
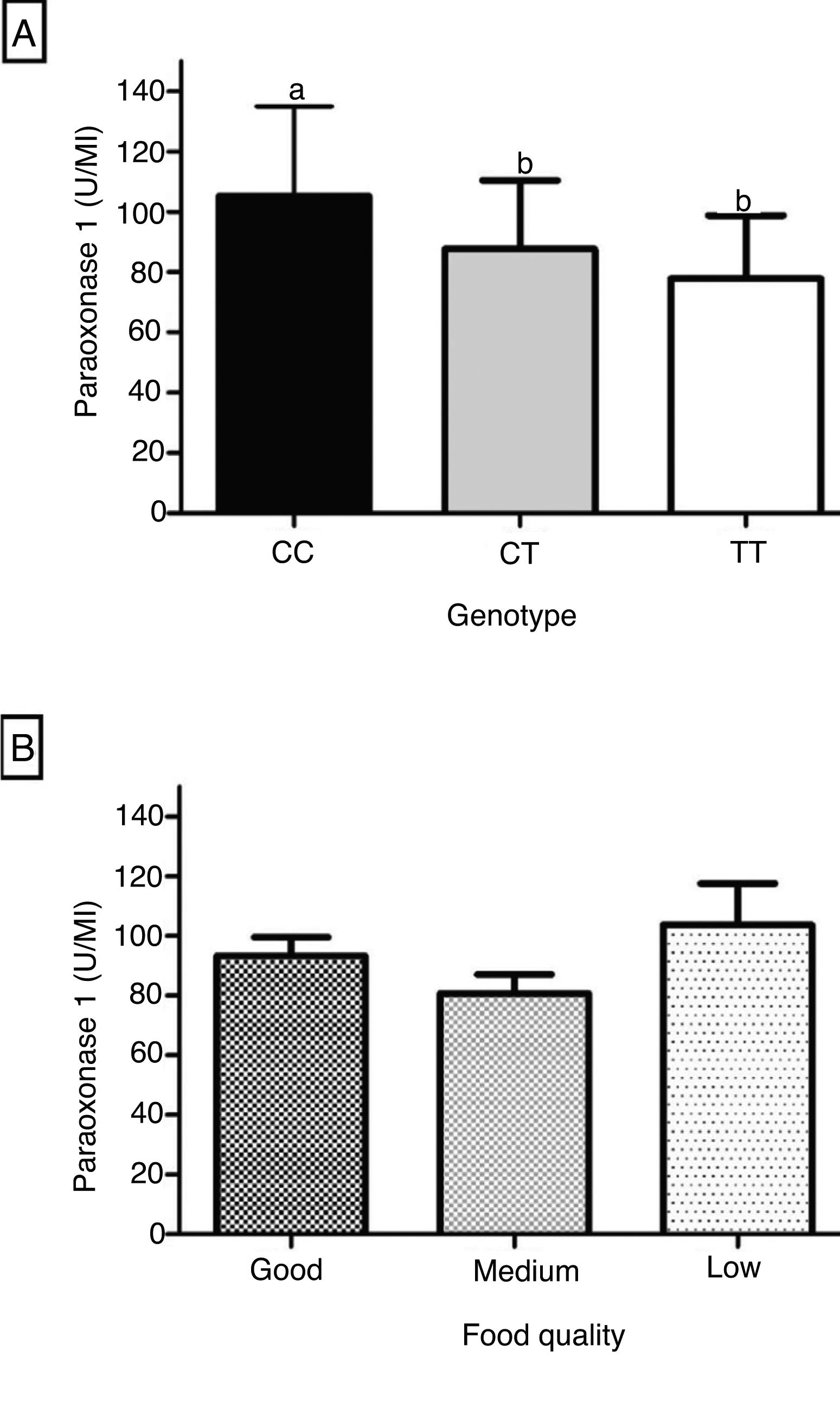
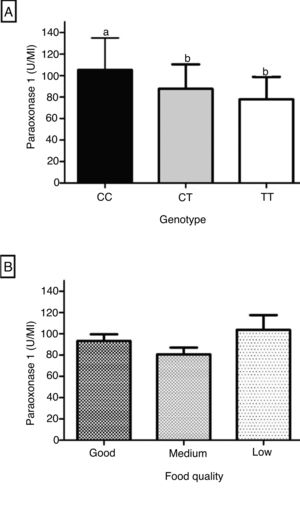
A figura 1 mostra a influência do genótipo e da qualidade da alimentação sobre a PON1. A atividade arilesterase foi significativamente mais elevada no genótipo CC comparada à dos genótipos CT e TT (fig. 1A). A PON1 mostrou nível intermediário de atividade no genótipo heterozigoto, porém não houve diferença significativa comparada à do genótipo TT (fig. 1A). A enzima não mostrou diferença significativa entre as três categorias de qualidade da alimentação, conforme a distribuição das pontuações do IQA em tercis (fig. 1B).
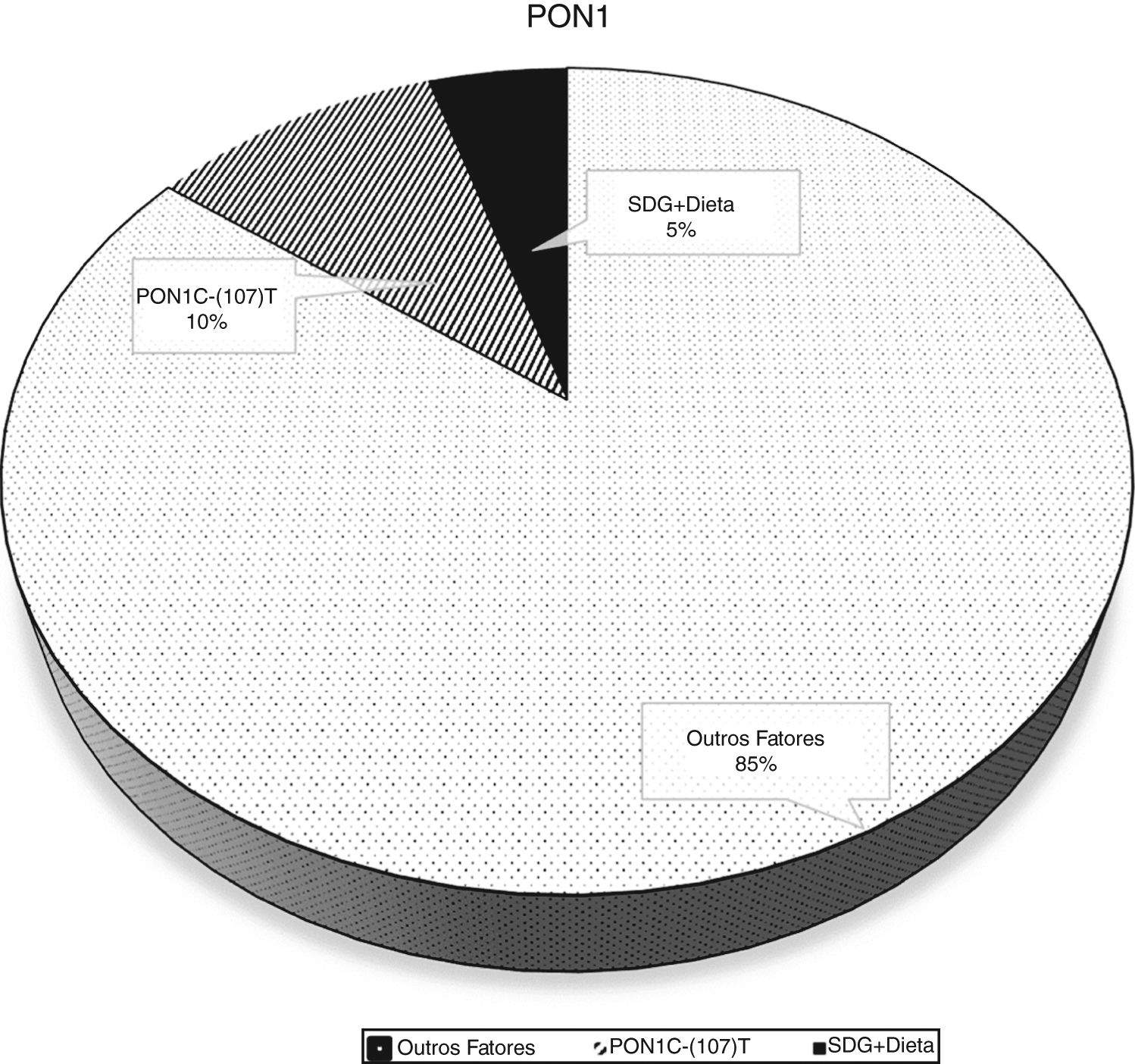
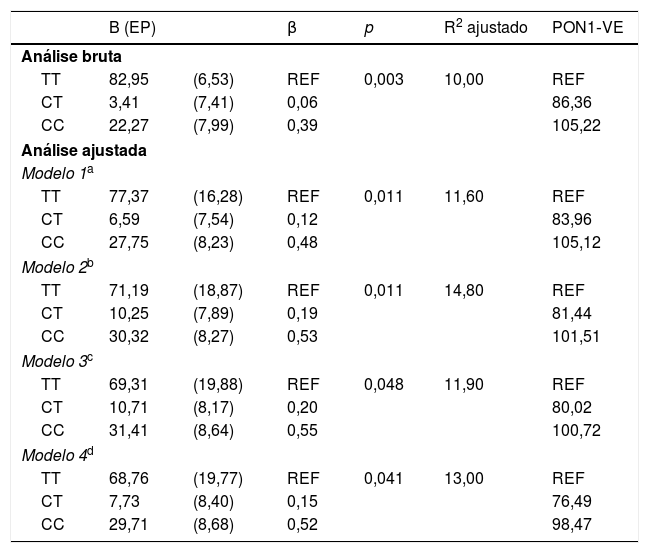
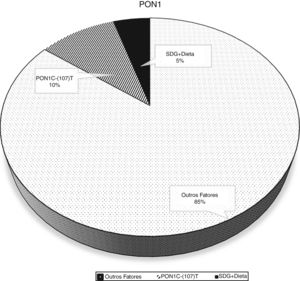
A análise bruta e ajustada da associação entre a atividade da PON1 e o polimorfismo PON1 C(‐107)T são apresentados na tabela 2. Na análise bruta as associações foram altamente significativas. Quando a análise foi ajustada para as variáveis sociodemográficas, de consumo alimentar e de estado nutricional, a associação entre a enzima e o polimorfismo manteve‐se significativa. No ajuste do modelo 1 a inclusão das variáveis sociodemográficas resultou num coeficiente de determinação ajustado foi de 11,6%. Já no ajuste do modelo 2 a inclusão da frequência do consumo de alimentos saudáveis explicou uma variabilidade de 14,8% na atividade da PON1. A porcentagem de variação da PON1 atribuída aos fatores genéticos e nutricionais é mostrada na (fig. 2).
Análise bruta e ajustada da associação entre atividade arilesterase da PON1 e o polimorfismo PON1 C(‐107)T em crianças entre 5 e 8 anos incompletos (n = 97), Pelotas‐RS
| B (EP) | β | p | R2 ajustado | PON1‐VE | ||
|---|---|---|---|---|---|---|
| Análise bruta | ||||||
| TT | 82,95 | (6,53) | REF | 0,003 | 10,00 | REF |
| CT | 3,41 | (7,41) | 0,06 | 86,36 | ||
| CC | 22,27 | (7,99) | 0,39 | 105,22 | ||
| Análise ajustada | ||||||
| Modelo 1a | ||||||
| TT | 77,37 | (16,28) | REF | 0,011 | 11,60 | REF |
| CT | 6,59 | (7,54) | 0,12 | 83,96 | ||
| CC | 27,75 | (8,23) | 0,48 | 105,12 | ||
| Modelo 2b | ||||||
| TT | 71,19 | (18,87) | REF | 0,011 | 14,80 | REF |
| CT | 10,25 | (7,89) | 0,19 | 81,44 | ||
| CC | 30,32 | (8,27) | 0,53 | 101,51 | ||
| Modelo 3c | ||||||
| TT | 69,31 | (19,88) | REF | 0,048 | 11,90 | REF |
| CT | 10,71 | (8,17) | 0,20 | 80,02 | ||
| CC | 31,41 | (8,64) | 0,55 | 100,72 | ||
| Modelo 4d | ||||||
| TT | 68,76 | (19,77) | REF | 0,041 | 13,00 | REF |
| CT | 7,73 | (8,40) | 0,15 | 76,49 | ||
| CC | 29,71 | (8,68) | 0,52 | 98,47 | ||
B, constante de regressão; EP, erro padrão; PON1 VE, valor estimado da Paraoxonase; β, coeficiente de regressão; R2, coeficiente de determinação.
Neste estudo mostrou‐se que fatores nutricionais, a exemplo da dieta e IMC, combinados ao polimorfismo PON1C(‐107)T, são previsores da atividade arilesterase da PON1 na infância. Além disso, foram significativos para explicar uma variação de 14,8% na enzima. O genótipo CC e os alimentos saudáveis, de boa qualidade nutricional foram os fatores que destacadamente influenciaram a uma maior atividade enzimática.
O índice de qualidade de alimentação de escolares é um instrumento prático e adequado à realidade brasileira para monitorar a alimentação de crianças.21,22 Uma alimentação de média e boa qualidade conforme verificada no atual estudo não significa adequação do ponto de vista nutricional. Isso foi evidenciado pela baixa pontuação atingida nos tercis mais elevados de distribuição do IQA. Molina et al.22 avaliaram a qualidade da alimentação de 1282 escolares e verificaram pontuações similares às que definiram a alimentação das crianças deste estudo. Além disso, Molina et al.22 encontraram que a maioria dos escolares consumia uma alimentação de baixa qualidade.
Estudos sugerem uma modulação dietética da enzima e atribuem aos antioxidantes, a exemplo de vitaminas e compostos fenólicos, efeito protetor a sua estrutura e função.3,4,9 Neste estudo a presença de alimentos de boa qualidade nutricional combinada ao polimorfismo PON1C(‐107)T alterou de forma positiva a atividade da PON1. Esse resultado pode ser atribuído a uma maior participação das frutas, legumes e verduras na dieta de uma parcela das crianças.3,4,9 Em particular, um estudo de intervenção mostrou que o consumo de seis porções diárias de frutas, verduras e legumes impactou no aumento de 7% na atividade arilesterase da PON1.9 Jarvik et al.10 mostraram que a atividade da PON1 correlacionou‐se positiva e significativamente com o maior consumo alimentar de vitaminas antioxidantes, em especial das vitaminas C e E.
Diversas pesquisas investigam a relação entre a enzima e o estado nutricional em diferentes fases do ciclo vital.11–13,16,23–25 No entanto, poucas referiram aumento da enzima associada ao IMC conforme observado no atual estudo.13,24,25 As divergências quanto ao efeito do IMC sobre a enzima podem decorrer da idade dos indivíduos selecionados, uma vez que muitas amostras misturam crianças e adolescentes. A obesidade nessas duas fases da vida cursa com diferenças que vão desde o tempo de exposição ao aumento do tecido adiposo, do nível das citocinas pró‐inflamatórias até o status hormonal.11,23–25Um maior tempo de exposição ao excesso de peso e um aumento do estado inflamatório, ainda que esse seja de baixo grau, podem refletir num efeito inibitório sobre a enzima.25,26 Porém, na infância o aumento de peso e de formação de espécies reativas de oxigênio poderiam ser compensados pela elevação da enzima.13 Convém registrar que a natureza complexa da obesidade limita as especulações, pois além dos aspectos citados ainda há influências do estilo de vida e da atividade física.16,27 Em particular, Koncsos et al.27 ao avaliar 151 crianças constataram que após uma mudança no estilo de vida houve aumento da PON1.
O polimorfismo PON1 C(‐107)T influenciou na PON1, o genótipo CC foi relacionado a uma maior atividade, o TT a uma menor atividade e o CT a um efeito intermediário. Os polimorfismos da região ‐107C/T têm maior efeito sobre a atividade arilesterase da enzima, contribuem com 25% da variabilidade de sua expressão em adultos brancos.5,6 Esses polimorfismos afetam a expressão da proteína e a concentração enzimática, indivíduos portadores do alelo T podem ter a produção da enzima afetada.5,6 Deakin et al.5 destacam um mecanismo molecular no polimorfismo C(‐107)T do gene da PON1 que envolve o fator de transcrição Sp1. A presença do alelo C na região promotora resulta em maior expressão do gene PON1 e, consequentemente, maior nível de proteína na circulação e aumento na atividade da enzima.6 Isso condiz com a associação entre o alelo C e maiores concentração e atividade sérica da enzima, indica que o fator de transcrição se liga a essa região do promotor, mas com maior afinidade para a variante‐107C.5,6 A variante ‐107T interrompe a sequência de reconhecimento do fator de transcrição Sp1, resulta em menor concentração de PON1 para esse genótipo.5
O efeito do genótipo CC sobre a atividade da PON1 visto no atual estudo já foi apresentado em outros trabalhos com crianças na mesma faixa etária.13,28 Em especial, Uliano et al.13 mostraram que crianças com o genótipo CC para o polimorfismo PON1 C(−107)T apresentaram maior atividade sérica da enzima do que as portadoras do genótipo TT. Ainda, Huen et al.28 constataram que a atividade da PON1 em crianças com genótipo CC foi maior do que naquelas com o genótipo TT. A frequência dos genótipos observada neste estudo está de acordo com a de outras pesquisas.28–30 Por exemplo, a coorte Chamacos feita com crianças da mesma faixa etária registrou frequência similar a encontrada neste estudo.28,30
Os resultados do presente estudo devem ser ponderados frente a seus pontos fortes e suas limitações. Entre os pontos fortes encontra‐se a seleção de uma amostra de crianças em fase precoce do desenvolvimento e isenta doenças crônicas. Ainda, a identificação de um polimorfismo associado a atividade de uma enzima cardioprotetora. Entre as limitações está o método de avaliação dietética, que estima apenas a qualidade da dieta e não estima a quantidade, pode a frequência do consumo ser subestimada. O número de perdas de acompanhamento que implicou uma amostra reduzida, frente à estimada, e limita a validade estatística das probabilidades encontradas. No entanto, as análises ajustadas foram esclarecedoras quanto às influências mais relevantes para predizer a variabilidade da enzima na amostra.
Conclui‐se que na infância uma alimentação de boa qualidade, com maior participação de alimentos saudáveis, foi importante para predizer a atividade da enzima cardioprotetora PON1 combinada ao polimorfismo C(‐107)T do gene da PON1. Esse resultado estimula a orientação para o alcance das metas de consumo de alimentos como frutas, legumes e verduras na infância, especialmente na perspectiva de prevenir DCV precoce.
FinanciamentoCoordenação de Aperfeiçoamento do Pessoal de Nível Superior (Capes).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Sigales TS, Uliano G, Muniz L, Barros C, Schneider A, Valle SC. Influence of nutritional factors and the PON1 C(‐107)T polymorphism on paraoxonase‐1 activity in childhood. J Pediatr (Rio J). 2020;96:495–502.