Human immunodeficiency virus infection can result in the early impairment of anthropometric indicators in children and adolescents. However, combined antiretroviral therapy has improved, in addition to the immune response and viral infection, the weight and height development in infected individuals. Therefore, the objective was to evaluate the effect of combined antiretroviral on the growth development of human immunodeficiency virus infected children and adolescents.
Source of dataA systematic review was performed. In the study, the PRISMA (Preferred Reporting Items for Systematic Reviews and Meta‐Analyses) strategy was used as the eligibility criterion. The MEDLINE‐PubMed and LILACS databases were searched using these descriptors: HIV, children, growth, antiretroviral therapy. The objective was defined by the population, intervention, comparison/control, and outcome (PICO) technique. Inclusion and exclusion criteria were applied for study selection.
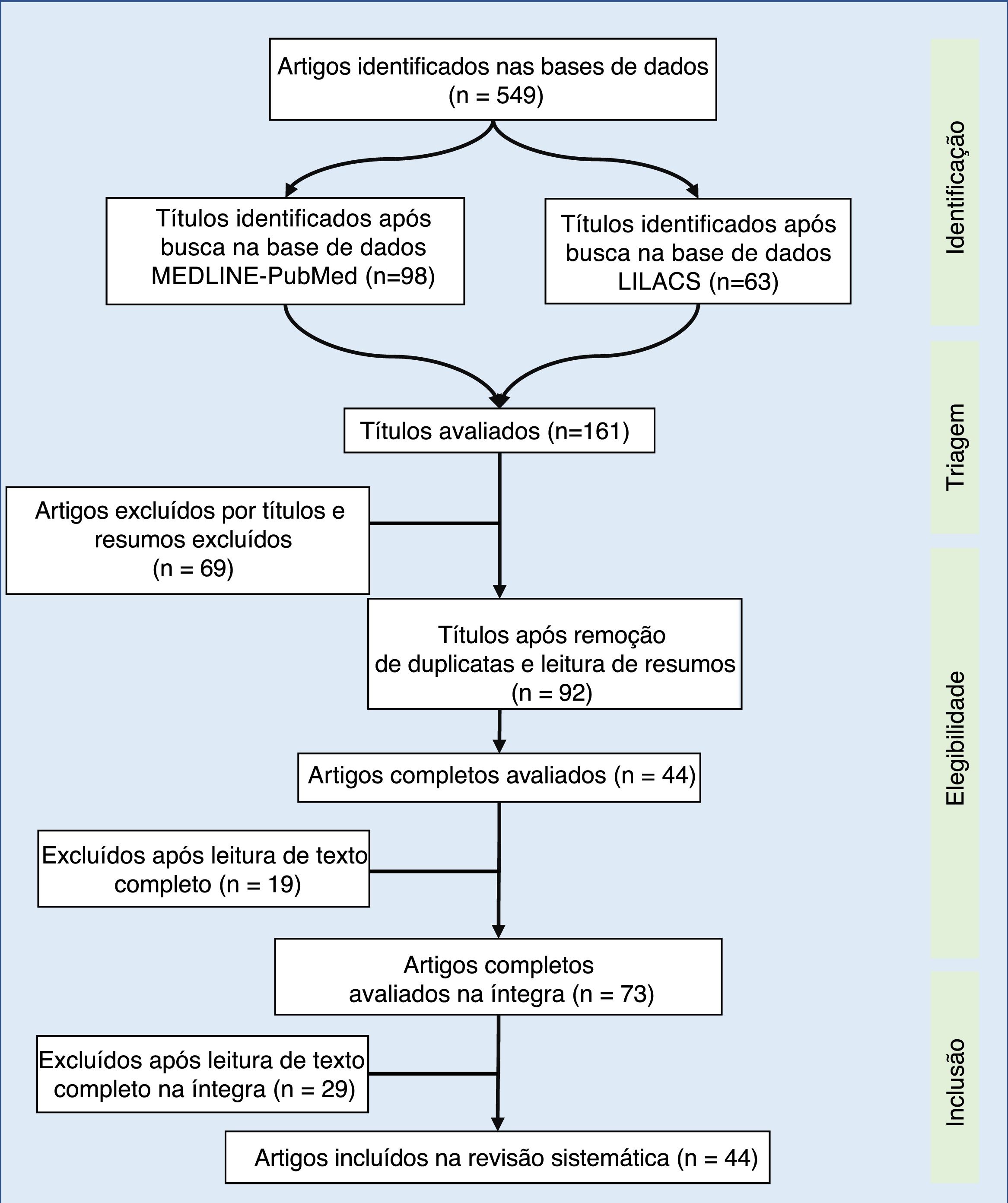
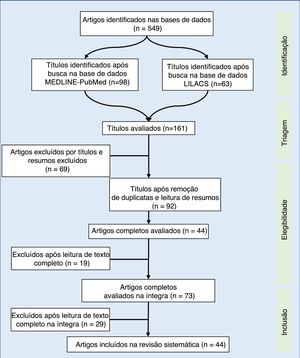
Synthesis of dataOf the 549 studies indexed in MEDLINE‐PubMed and LILACS, 73 were read in full, and 44 were included in the review (33 showed a positive impact of combined antiretroviral therapy on weight/height development, ten on weight gain, and one on height gain in children and adolescents infected with human immunodeficiency virus). However, the increase in growth was not enough to normalize the height of infected children when compared to children of the same age and gender without human immunodeficiency virus infection.
ConclusionsCombined antiretroviral therapy, which is known to play a role in the improvement of viral and immunological markers, may influence in the weight and height development in children infected with human immunodeficiency virus. The earlier the infection diagnosis and, concomitantly, of malnutrition and the start of combined antiretroviral therapy, the lower the growth impairment when compared to healthy children.
A infecção pelo vírus da imunodeficiência humana pode comprometer, precocemente, os indicadores antropométricos de crianças e adolescentes. No entanto, a terapia antirretroviral combinada tem melhorado, além da resposta imunológica e da infecção viral, o ganho pôndero‐estatural dos infectados. Dessa forma, nosso objetivo foi avaliar o efeito da terapia antirretroviral combinada no crescimento, de crianças e adolescentes, infectadas pelo vírus da imunodeficiência humana.
Fonte dos dadosFoi realizada uma revisão sistemática. No estudo, adotou‐se como critério de elegibilidade dos artigos, a estratégia PRISMA (preferred reporting items for systematic reviews and meta‐analyses). Foram consultadas as bases de dados MEDLINE‐PubMed e LILACS pelos descritores: HIV (vírus da imunodeficiência humana), children, growth, antiretroviral therapy. O objetivo foi definido pela estratégia PICO (population, intervention, comparison/control, outcome). Critérios de inclusão e exclusão foram aplicados na seleção dos estudos.
Síntese dos dadosDos 549 estudos indexados no MEDLINE‐PubMed e LILACS, 73 foram lidos na íntegra – 44 incluídos na revisão (33 demonstraram impacto positivo da terapia antirretroviral combinada no ganho pôndero‐estatural, dez no ganho de peso e um no de estatura, em crianças e adolescentes, infectados com vírus da imunodeficiência humana). No entanto, o incremento no crescimento não foi o suficiente para normalizar a estatura de crianças infectadas, quando comparado com crianças da mesma idade e sexo, sem infecção pelo vírus da imunodeficiência humana.
ConclusõesA terapia antirretroviral combinada que, conhecidamente, atua na melhora de marcadores virais e imunológicos, pode influenciar no ganho pôndero‐estatural de crianças infectadas com vírus da imunodeficiência humana. Quanto mais precoce o diagnóstico da infecção e, concomitante, desnutrição e início da terapia antirretroviral combinada, menores serão os prejuízos no crescimento, quando comparado às crianças saudáveis.
A síndrome da imunodeficiência adquirida (AIDS, acquired immunodeficiency syndrome) é uma doença infectocontagiosa causada pelo vírus da imunodeficiência humana (HIV, Human Immunodeficiency Virus) que afeta, qualitativamente e quantitativamente, os linfócitos auxiliares CD4+ (LT CD4+).1 A transmissão vertical do HIV na infância pode ocorrer em três momentos: (i) intraútero por via transplacentária; (ii) durante o parto e/ou nascimento; e (iii) a partir do aleitamento materno. A maior parte dos casos (65%) ocorre durante o trabalho de parto e no parto propriamente dito, os 35% restantes no intrauterino, principalmente nas últimas semanas de gestação e quando do aleitamento materno. O aleitamento materno, como risco de transmissão, é responsável por 7% a 22% dos casos de infecção.1
Dados mundiais de 2016 estimam que 36,7 [30,8–42,9] milhões de pessoas, dessas 2,1 milhões crianças, estejam infectadas pelo HIV.2 No Brasil, de 1980 a 2016, foram identificados 842.710 casos de infecção pelo HIV, aproximadamente 24.900 crianças estavam abaixo de 14 anos – número possivelmente subestimado.3,4
Indivíduos infectados pelo HIV têm redução no número de LT CD4+ – característica marcante do quadro imunológico. O mecanismo que causa a falha em reconstituir os LT CD4+ não é totalmente elucidado, porém aumenta o risco de infecções oportunistas. Além das alterações imunológicas, existem problemas nutricionais e endócrino‐metabólicos na AIDS, a infecção pelo HIV é associada ao comprometimento no crescimento.5
Deficiência de crescimento na AIDSNas crianças e adolescentes com HIV existe maior prevalência de distúrbios do crescimento, que incluem desde a dificuldade para crescer – que resulta em peso e estatura inferiores ao padrão normal para idade –, interrupção do crescimento e síndrome de emaciamento.6 O atraso no crescimento é indicador de progressão de gravidade e fator de risco para o óbito na AIDS.7 Além disso, na AIDS, a deficiência de crescimento é multifatorial, é decorrente do efeito da terapia antirretroviral, bem como de outros fatores, descritos a seguir:
- (i)
desnutrição: pode ocorrer principalmente pelo aporte nutricional inadequado, secundário à anorexia, lesões orais ou do trato digestivo alto (causa infecciosa), redução de ingestão (causa psicológica ou econômica) ou ainda por má absorção de nutrientes (diarreia crônica).8 Outro aspecto importante refere‐se à aceleração do catabolismo proteico e aumento do gasto metabólico, secundários à replicação viral não controlada e à resposta inflamatória dela decorrente (inclusive desregulação da rede de citocinas), bem como infecções oportunistas ou neoplasias secundárias à imunossupressão.2 A desnutrição associada ao HIV foi denominada wasting syndrome ou síndrome de emaciamento;9
- (ii)
distúrbios gastrintestinais (má absorção): podem resultar da infecção pelo próprio HIV, infecções oportunistas (parasitas entéricos, como Cryptosporidium, Mycobacterium avium‐intracellulare, citomegalovírus, dentre outros) ou neoplasias. Diarreia, dor abdominal e disfagia são comumente observados em pacientes infectados pelo HIV. No entanto, a má absorção intestinal pode ocorrer em crianças, com ou sem diarreia.10 A lesão da integridade da mucosa e o aumento da permeabilidade favorecem a disfunção intestinal, levam à má absorção de gorduras, carboidratos e proteínas, interfere no ganho pôndero‐estatural. A disfunção intestinal pode interferir adversamente na habilidade de absorver medicações orais, inclusive a zidovudina (AZT, C10H13N5O4);11
- (iii)
estresse: na AIDS, a expressão das citocinas, inclusive interleucinas (1 e 6), fator de necrose tumoral alpha e interferon estão alterados, promovem um estresse metabólico, podem ocasionar perda de apetite, anorexia e catabolismo;9
- (iv)
doença crônica: a infecção pelo HIV acarreta a redução progressiva da função imune, com diminuição no número de LT CD4+, concomitantemente às alterações na função dessas células e das principais vias regulatórias da imunidade. Assim, a susceptibilidade à infecção de repetição e deficiências de anticorpos alteram o metabolismo por infecção e/ou redução de ingestão, é necessário acompanhamento nutricional dos pacientes;8
- (v)
distúrbios endócrinos: as alterações hormonais são, provavelmente, causadas pela própria infecção viral ou secundárias ao comprometimento das glândulas endócrinas, por infecções oportunistas e/ou medicamentos usados no tratamento das infecções e/ou suas complicações.12
Nesse sentido, se destaca a importância da associação de fatores, para o déficit de crescimento, o que reforça a necessidade de ampliar a compreensão em relação a eles, no intuito de minimizar os prejuízos no estado nutricional.11 O monitoramento adequado pela equipe multidisciplinar contribui para detecção precoce de infecções oportunistas, alterações metabólicas e hormonais, diminuição da ingestão alimentar, má absorção de nutrientes e problemas socioeconômicos, resulta, provavelmente, em benefícios ao ganho pôndero‐estatural.12
Terapia antirretroviral – Aspectos geraisA década de 1990 foi um marco para o tratamento da AIDS, com o uso de esquemas antirretrovirais mais efetivos – terapia antirretroviral altamente ativa. Inicialmente, a terapia antirretroviral era baseada na monoterapia com AZT, porém havia baixa eficácia, com necessidade de progressiva associação de medicamentos. Posteriormente, foi instituída a terapia dupla, com o uso de novos inibidores de transcriptase reversa análogos de nucleosídeos. Em seguida, surgiram os inibidores de protease e inibidores de transcriptase reversa não análogos de nucleosídeos – esquema terapêutico com três medicamentos e denominado terapia antirretroviral combinada (TARVc). A TARVc reduziu a mortalidade por HIV, principalmente, em países desenvolvidos.6,13
Desde 1996, a TARVc é usada na infância, para minimizar a progressão da doença. Estima‐se que sem o uso da terapia antirretroviral um terço das crianças infectadas pelo HIV faleceria antes de um mês de idade e mais da metade antes dos dois anos.14
Terapia antirretroviral – Associação com dados antropométricos e outrosA terapia antirretroviral, na infância e na adolescência, pode causar desordens metabólicas, toxicidade mitocondrial e efeitos adversos no estado nutricional, principalmente nos primeiros meses de tratamento. Os pacientes podem evoluir com náuseas ou vômitos, lipodistrofia e redução da mineralização óssea.2 O diagnóstico e tratamento da desnutrição é necessário, uma vez que a deficiência de micronutrientes, principalmente vitaminas A, C, E, D e minerais (por exemplo, selênio e ferro), altera o sistema imunológico (já alterado na AIDS) e reduz o crescimento.2
Em adultos, a duração da TARVc aumenta o risco de doenças cardiovasculares (acidente vascular cerebral, infarto e miocardiopatia dilatada). Dessa forma, se sugere que as crianças em uso dos antirretrovirais provavelmente terão maior risco de morbidade e mortalidade cardiovascular prematura.3 Além disso, a ativação imune, com inflamação crônica persistente em indivíduos infectados pelo HIV, também aumenta o risco de doença cardiovascular e outras doenças de origem inflamatória. Níveis aumentados de marcadores inflamatórios (proteína C reativa, interleucina 6, D‐dímero, fibrinogênio), associados ao risco de aterosclerose e câncer, por exemplo, também são encontrados na AIDS e se mantêm elevados independentemente da resposta a TARVc.15 Finalmente, a adesão ao tratamento, o que inclui o uso do TARVc, constitui um desafio, principalmente na infância e na adolescência, devido ao uso crônico do medicamento, alterações estéticas relacionadas à lipodistrofia e aspectos psicossociais.16
O crescimento, na infância e na adolescência, é crucial e na AIDS o impacto positivo e negativo da TARVc deve ser avaliado. Dessa forma, o objetivo da revisão sistemática foi avaliar a relação entre terapia antirretroviral e o crescimento de crianças e adolescentes infectados pelo HIV.
MétodoFoi feita uma revisão sistemática, que teve como critério de elegibilidade a estratégia PRISMA (preferred reporting items for systematic reviews and meta‐analyses). Dentro da estratégia PRISMA, o PICO (population, intervention, comparison/control, outcome) foi empregado na construção do objetivo do estudo: P, crianças e adolescentes de 0 a 19 anos; I, indivíduos em uso de TARVc; C, crescimento infantil; O, alteração no padrão de crescimento.
No PRISMA, foi selecionado o período de inclusão de estudos de 1996 (ano de início da TARVc) a setembro de 2017. Foram incluídos artigos originais publicados em periódicos indexados em língua inglesa. Optou‐se pela inclusão de todo o tipo de estudo e entre os artigos selecionados foi feita a classificação por grau de recomendação e nível de evidência.
As buscas foram feitas nas bases de dados Medline‐PubMed (Medical Literature Analysis and Retrieval System Online – Public Medline) e Lilacs (Literatura Latino‐Americana e do Caribe em Ciências da Saúde), pelos descritores: antiretroviral therapy, children, growth, HIV. Como filtros foram usados: (i) presença dos descritores no título e/ou resumo; (ii) publicações nos últimos 21 anos; (iii) ser artigo científico. Foram excluídos artigos: (i) que se repetiram em outra base de dados eletrônica da busca bibliográfica; (ii) sobre o custo do tratamento da AIDS, sem abordar o fator crescimento; (iii) com crianças expostas ao HIV, mas não infectadas; (iii) sobre crescimento perinatal; (iv) sobre TARVc na gestante; (v) com uso exclusivo de uma ou duas drogas antirretrovirais.
Na revisão bibliográfica, foram identificados 549 artigos, dos quais foram selecionados pelo título 98 no Medline‐PubMed e 63 no Lilacs. Na segunda avaliação, feita pela leitura do resumo e pela exclusão dos artigos repetidos (63), foram incluídos 92 artigos – lidos na íntegra. Após a leitura na íntegra, 44 estudos foram incluídos na revisão sistemática (fig. 1). Os artigos selecionados foram classificados por três autores (dois médicos e um nutricionista), contemplaram os principais itens dos métodos e dos resultados de cada estudo selecionado (autor, ano, país de origem do estudo, tamanho da amostra, resultados principais). Todos os artigos foram avaliados e lidos por pelo menos três autores, a leitura na íntegra foi feita por sorteio entre os autores. A partir da consonância dos dados, esses foram dispostos nas tabelas 1 e 2.17–57 Foram incluídas intervenções terapêuticas feitas com pelo menos três drogas com ação antirretroviral, sem considerar o tipo de TARVc.
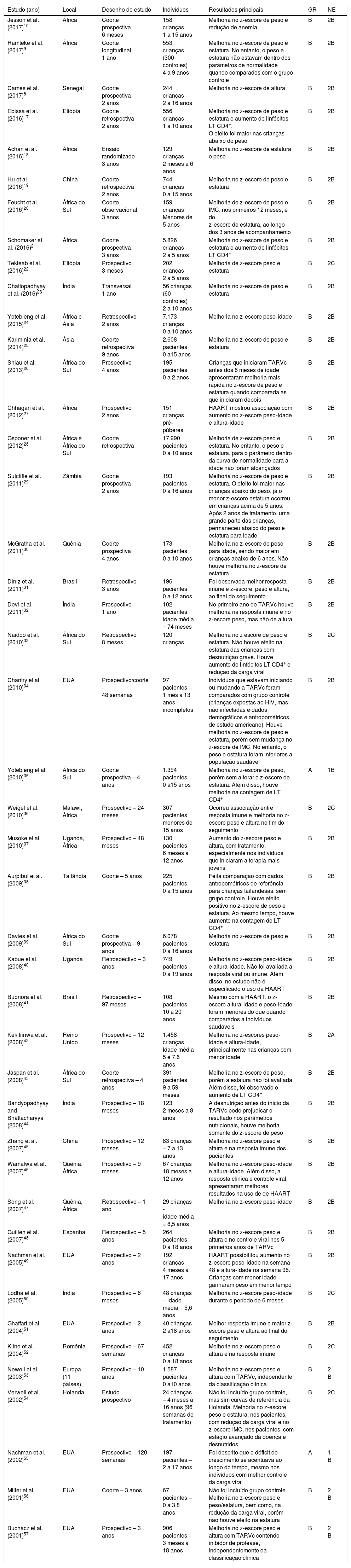
Dados obtidos nos estudos de acordo com ano de publicação, local do estudo, desenho usado na pesquisa, amostra avaliada, principais resultados obtidos, grau de recomendação e nível de evidência
| Estudo (ano) | Local | Desenho do estudo | Indivíduos | Resultados principais | GR | NE |
|---|---|---|---|---|---|---|
| Jesson et al. (2017)10 | África | Coorte prospectiva 6 meses | 158 crianças 1 a 15 anos | Melhoria no z‐escore de peso e redução de anemia | B | 2B |
| Ramteke et al. (2017)9 | África | Coorte longitudinal 1 ano | 553 crianças (300 controles) 4 a 9 anos | Melhoria no z‐escore de peso e estatura. No entanto, o peso e estatura não estavam dentro dos parâmetros de normalidade quando comparados com o grupo controle | B | 2B |
| Cames et al. (2017)8 | Senegal | Coorte prospectiva 2 anos | 244 crianças 2 a 16 anos | Melhoria no z‐escore de altura | B | 2B |
| Ebissa et al. (2016)17 | Etiópia | Coorte retrospectiva 2 anos | 556 crianças 1 a 10 anos | Melhoria no z‐escore de peso e estatura e aumento de linfócitos LT CD4+. O efeito foi maior nas crianças abaixo do peso | B | 2B |
| Achan et al. (2016)18 | África | Ensaio randomizado 3 anos | 129 crianças 2 meses a 6 anos | Melhoria no z‐escore de estatura e peso | B | 2B |
| Hu et al. (2016)19 | China | Coorte retrospectiva 2 anos | 744 crianças 0 a 15 anos | Melhoria no z‐escore de peso e estatura | B | 2B |
| Feucht et al. (2016)20 | África do Sul | Coorte observacional 3 anos | 159 crianças Menores de 5 anos | Melhoria de z‐escore de peso e IMC, nos primeiros 12 meses, e do z‐escore de estatura, ao longo dos 3 anos de acompanhamento | B | 2B |
| Schomaker et al. (2016)21 | África | Coorte prospectiva 3 anos | 5.826 crianças 2 a 5 anos | Melhoria no z‐escore de peso e estatura e aumento de linfócitos LT CD4+ | B | 2B |
| Tekleab et al. (2016)22 | Etiópia | Prospectivo 3 meses | 202 crianças 2 a 5 anos | Melhoria de z‐escore peso e estatura | B | 2C |
| Chattopadhyay et al. (2016)23 | Índia | Transversal 1 ano | 56 crianças (60 controles) 2 a 10 anos | Melhoria no z‐escore de peso e estatura | B | 2B |
| Yotebieng et al. (2015)24 | África e Ásia | Retrospectivo 2 anos | 7.173 crianças 0 a 10 anos | Melhoria no z‐escore peso‐idade | B | 2B |
| Kariminia et al. (2014)25 | Ásia | Coorte retrospectiva 9 anos | 2.608 pacientes 0 a15 anos | Melhoria no z‐escore de peso e estatura | B | 2B |
| Shiau et al. (2013)26 | África do Sul | Prospectivo 4 anos | 195 pacientes 0 a 2 anos | Crianças que iniciaram TARVc antes dos 6 meses de idade apresentaram melhoria mais rápida no z‐escore de peso e estatura quando comparada as que iniciaram depois | B | 2B |
| Chhagan et al. (2012)27 | África | Prospectivo 2 anos | 151 crianças pré‐púberes | HAART mostrou associação com aumento no z‐escore peso‐idade e altura‐idade | B | 2B |
| Gsponer et al. (2012)28 | África e África do Sul | Coorte retrospectiva | 17.990 pacientes 0 a 10 anos | Melhoria de z‐escore peso e estatura. No entanto, o peso e estatura, para o parâmetro dentro da curva de normalidade para a idade não foram alcançados | B | 2B |
| Sutcliffe et al. (2011)29 | Zâmbia | Coorte prospectiva 2 anos | 193 pacientes 0 a 16 anos | Melhoria no z‐escore de peso e estatura. O efeito foi maior nas crianças abaixo do peso, já o menor z‐escore estatura ocorreu em crianças acima de 5 anos. Após 2 anos de tratamento, uma grande parte das crianças, permaneceu abaixo do peso e estatura para idade | B | 2B |
| McGratha et al. (2011)30 | Quênia | Coorte prospectiva 4 anos | 173 pacientes 0 a 10 anos | Melhoria no z‐escore de peso para idade, sendo maior em crianças abaixo de 6 anos. Não houve melhoria no z‐escore de estatura | B | 2B |
| Diniz et al. (2011)31 | Brasil | Retrospectivo 3 anos | 196 pacientes 0 a 12 anos | Foi observada melhor resposta imune e z‐escore, peso e altura, ao final do seguimento | B | 2B |
| Devi et al. (2011)32 | Índia | Prospectivo 1 ano | 102 pacientes idade média = 74 meses | No primeiro ano de TARVc houve melhoria na resposta imune e no z‐escore peso, mas não de altura | B | 2B |
| Naidoo et al. (2010)33 | África do Sul | Retrospectivo 8 meses | 120 crianças | Melhoria no z escore de peso e estatura. Não houve efeito na estatura das crianças com desnutrição grave. Houve aumento de linfócitos LT CD4+ e redução da carga viral | B | 2C |
| Chantry et al. (2010)34 | EUA | Prospectivo/coorte – 48 semanas | 97 pacientes – 1 mês a 13 anos incompletos | Indivíduos que estavam iniciando ou mudando a TARVc foram comparados com grupo controle (crianças expostas ao HIV, mas não infectadas e dados demográficos e antropométricos de estudo americano). Houve melhoria no z‐escore de peso e estatura, porém sem mudança no z‐escore de IMC. No entanto, o peso e estatura foram inferiores a população saudável | B | 2B |
| Yotebieng et al. (2010)35 | África do Sul | Coorte prospectiva – 4 anos | 1.394 pacientes 0 a15 anos | Melhoria no z‐escore de peso, porém sem alterar o z‐escore de estatura. Além disso, houve melhoria na contagem de LT CD4+ | A | 1B |
| Weigel et al. (2010)36 | Malawi, África | Prospectivo – 24 meses | 307 pacientes menores de 15 anos | Ocorreu associação entre resposta imune e melhoria no z‐escore peso e altura no fim do seguimento | B | 2C |
| Musoke et al. (2010)37 | Uganda, África | Prospectivo – 48 meses | 130 pacientes 6 meses a 12 anos | Aumento do z‐escore peso e altura, com tratamento, especialmente nos indivíduos que iniciaram a terapia mais jovens | B | 2B |
| Aurpibul et al. (2009)38 | Tailândia | Coorte – 5 anos | 225 pacientes 0 a 15 anos | Feita comparação com dados antropométricos de referência para crianças tailandesas, sem grupo controle. Houve efeito positivo no z‐escore de peso e estatura. Ao mesmo tempo, houve aumento na contagem de LT CD4+ | B | 2B |
| Davies et al. (2009)39 | África do Sul | Coorte prospectiva – 9 anos | 6.078 pacientes 0 a 16 anos | Melhoria no z‐escore de peso e estatura | B | 2B |
| Kabue et al. (2008)40 | Uganda | Retrospectivo – 3 anos | 749 pacientes ‐ 0 a 19 anos | Melhoria no z‐escore peso‐idade e altura‐idade. Não foi avaliada a resposta viral ou imune. Além disso, no estudo não é especificado o uso da HAART | B | 2B |
| Buonora et al. (2008)41 | Brasil | Retrospectivo – 97 meses | 108 pacientes 10 a 20 anos | Mesmo com a HAART, o z‐escore altura‐idade e peso‐idade foram menores do que quando comparados a indivíduos saudáveis | B | 2B |
| Kekitiinwa et al. (2008)42 | Reino Unido | Prospectivo – 12 meses | 1.458 crianças Idade média 5 e 7,6 anos | Melhoria no z‐escores peso‐idade e altura‐idade, principalmente nas crianças com menor idade | B | 2A |
| Jaspan et al. (2008)43 | África do Sul | Coorte retrospectiva – 4 anos | 391 pacientes 9 a 59 meses | Melhoria no z‐escore de peso, porém a estatura não foi avaliada. Além disso, foi observado o aumento de LT CD4+ | B | 2B |
| Bandyopadhyay and Bhattacharyya (2008)44 | Índia | Prospectivo – 18 meses | 123 2 meses a 8 anos | A desnutrição antes do início da TARVc pode prejudicar o resultado nos parâmetros nutricionais, houve melhoria somente do z‐escore de peso | B | 2B |
| Zhang et al. (2007)45 | China | Prospectivo – 12 meses | 83 crianças – 7 a 13 anos | Melhoria no z‐escore peso e altura e na resposta imune dos pacientes | B | 2B |
| Wamalwa et al. (2007)46 | Quênia, África | Prospectivo – 9 meses | 67 crianças 18 meses a 12 anos | Melhoria no z‐escore peso‐idade e altura‐idade. Além disso, a resposta clínica e controle viral, apresentaram melhores resultados na uso de de HAART | B | 2B |
| Song et al. (2007)47 | Quênia, África | Retrospectivo – 1 ano | 29 crianças ‐ idade média = 8,5 anos | Melhoria no z‐escore peso‐idade | B | 2B |
| Guillen et al. (2007)48 | Espanha | Retrospectivo – 5 anos | 264 pacientes 0 a 18 anos | Melhoria no z‐escore peso e altura e no controle viral nos 5 primeiros anos de TARVc | B | 2B |
| Nachman et al. (2005)49 | EUA | Prospectivo – 2 anos | 192 crianças 4 meses a 17 anos | HAART possibilitou aumento no z‐escore peso‐idade na semana 48 e altura‐idade na semana 96. Crianças com menor idade ganharam peso em menor tempo | B | 2B |
| Lodha et al. (2005)50 | Índia | Prospectivo – 6 meses | 48 crianças – idade média = 5,6 anos | Melhoria no z‐escore peso‐idade durante o período de 6 meses | B | 2C |
| Ghaffari et al. (2004)51 | EUA | Prospectivo – 2 anos | 40 crianças 2 a18 anos | Melhor resposta imune e maior z‐escore peso e altura ao final do seguimento | B | 2B |
| Kline et al. (2004)52 | Romênia | Prospectivo – 67 semanas | 452 crianças 0 a 18 anos | Melhoria no z‐escore peso e altura e na resposta imune | B | 2C |
| Newell et al. (2003)53 | Europa (11 países) | Prospectivo – 10 anos | 1.587 pacientes 0 a10 anos | Melhoria no z‐escore peso e altura com TARVc, independente da classificação clínica | B | 2 B |
| Verwell et al. (2002)54 | Holanda | Estudo prospectivo | 24 crianças – 4 meses a 16 anos (96 semanas de tratamento) | Não foi incluído grupo controle, mas sim curvas de referência da Holanda. Melhoria no z‐escore peso e estatura, nos pacientes, com redução da carga viral e no z‐escore IMC, nos pacientes, com estágio avançado da doença e desnutridos | B | 2C |
| Nachman et al. (2002)55 | EUA | Prospectivo – 120 semanas | 197 pacientes – 2 a 17 anos | Foi descrito que o déficit de crescimento se acentuava ao longo do tempo, mesmo nos indivíduos com melhor controle da carga viral | A | 1 B |
| Miller et al. (2001)56 | EUA | Coorte – 3 anos | 67 pacientes – 0 a 3,8 anos | Não foi incluído grupo controle. Melhoria no z‐escore peso e peso/estatura, bem como, na redução da carga viral, porém não houve efeito na estatura | B | 2 B |
| Buchacz et al. (2001)57 | EUA | Prospectivo – 3 anos | 906 pacientes – 3 meses a 18 anos | Melhoria no z‐escore peso e altura com TARVc contendo inibidor de protease, independentemente da classificação clínica | B | 2 B |
EUA, Estados Unidos da América; GR, grau de recomendação; HAART, highly active antiretroviral therapy; IMC, índice de massa corpórea; LT CD4+, linfócitos CD4+; NE, nível de evidência; TARVc, terapia antirretroviral combinada.
Desfecho relacionado ao ganho pôndero‐estatural, em pacientes infectados pelo HIV (número de infectados totais = 51.992 crianças e adolescentes), submetidos a terapia com TARVc
| Desfecho | Número de estudos | Positiva – N (%) |
|---|---|---|
| Melhoria da altura | 1/44 (2,27%) | 244/51.992 (0,47%)a |
| Melhoria do peso | 10/44 (22,73%) | 9.789/51.992 (18,83%)b |
| Melhoria do peso e altura | 33/44 (75%) | 41.959/51.992 (80,7%)c |
HIV, vírus da imunodeficiência humana; TARVc, terapia antirretroviral combinada.
Ramteke et al., 2017;9 Ebissa et al., 2016;17 Achan et al., 2016;18 Hu et al., 2016;19 Feucht et al., 2016;20 Schomaker et al., 2016;21 Tekleab et al., 2016;22 Chattopadhyay et al., 2016;23 Kariminia et al., 2014;25 Shiau et al., 2013;26 Chhagan et al., 2012;27 Gsponer et al., 2012;28 Sutcliffe et al., 2016;29 Diniz et al., 2011;31 Naidoo et al., 2010;33 Chantry et al., 2010;34 Weigel et al., 2010;36 Musoke et al., 2010;37 Aurpibul et al., 2009;38 Davies et al., 2009;39 Kabue et al., 2008;40 Buonora et al., 2008;41 Kekitiinwa et al., 2008;42 Zhang et al., 2007;45 Wamalwa et al., 2007;46 Guillen et al., 2007;48 Nachman et al., 2005;49 Ghaffari et al., 2004;51 Kline et al., 2004;52 Newell et al., 2003;53 Verweel et al., 2003;54 Miller et al., 2001;56 Buchacz et al., 2001.57
Os dados obtidos estão sintetizados nas tabelas 1 e 2. Na somatória dos estudos avaliados, houve a inclusão de uma população de 51.992 indivíduos infectados por HIV. Nos estudos, a resposta positiva a TARVc, com melhoria do crescimento, foi observada em 34 artigos. No entanto, a melhoria do ganho pôndero‐estatural (peso e estatura), ao mesmo tempo, ocorreu em 33 estudos. Na maioria dos estudos foi ressaltada a importância do diagnóstico precoce da infecção pelo HIV, em crianças e adolescentes, com intuito de protelar a progressão para AIDS e fazer o uso, mais precoce possível, da TARVc.
A TARVc, na literatura, é associada a melhoria dos índices antropométricos e da sobrevida. Na revisão, foi observado que 42.203/51.992 (81,17%) crianças apresentaram melhoria no padrão de crescimento com o uso da TARVc.
Dos artigos incluídos na revisão, 42 têm grau de recomendação B [(i) um com nível de evidência 2ª]; (ii) 35 com nível de evidência 2B; (iii) seis com nível de evidência 2C e dois com nível de evidência 1B (grau de recomendação A). A classificação dos artigos para nível de evidência foi feita segundo recomendações da Oxford Centre for Evidence‐based Medicine.
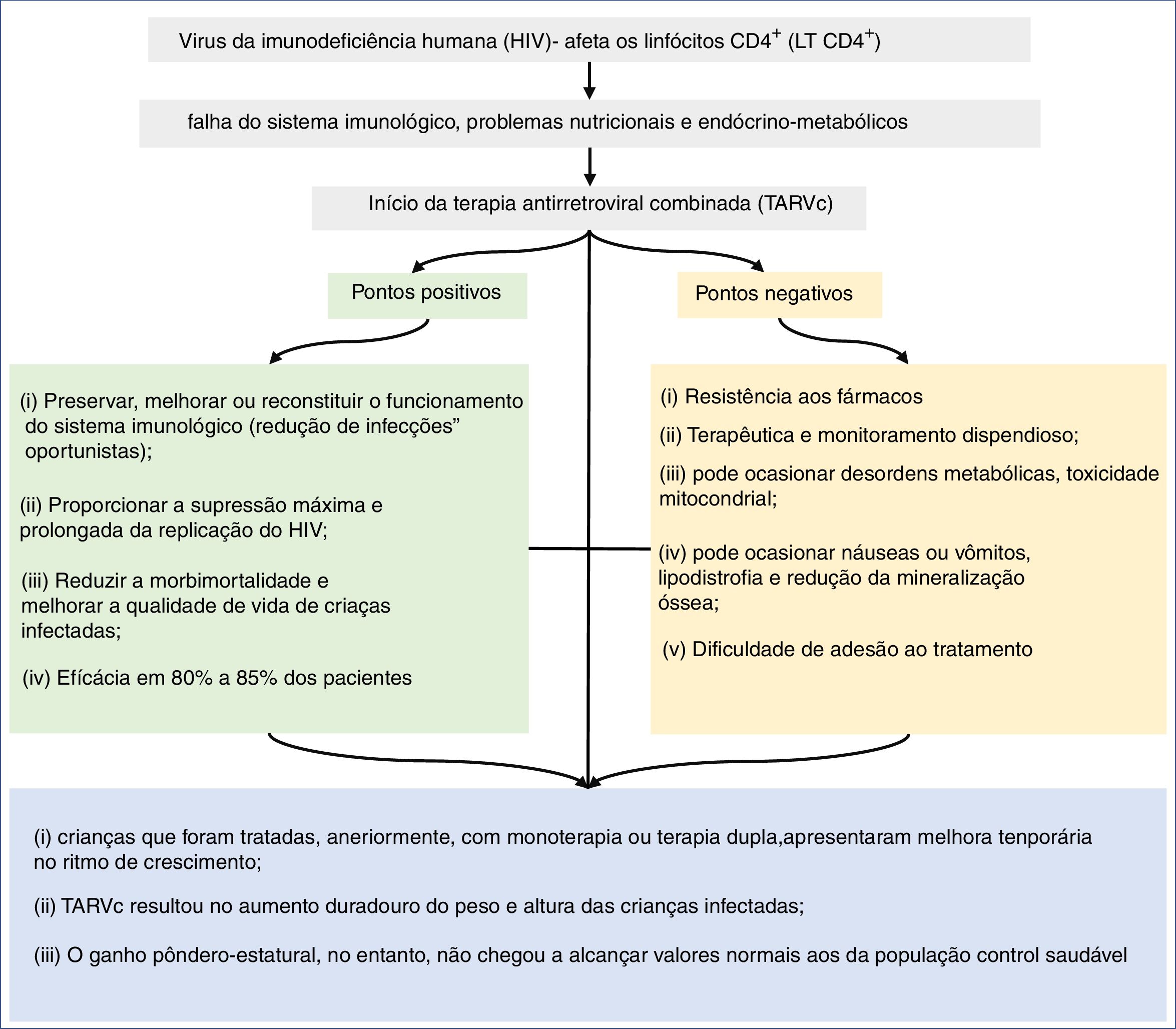
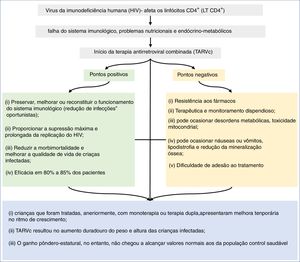
Na figura 2, apresentamos resumidamente os desfechos associados ao crescimento relacionado ao uso da TARVc, em crianças e adolescentes, infectados pelo HIV.
DiscussãoAlterações no crescimento são comuns em crianças infectadas pelo HIV.58 Os distúrbios de crescimento podem estar associados a: (i) infecções oportunistas associadas à doença; (ii) ausência de controle imunológico e viral no acompanhamento; (iii) alterações metabólicas associadas ao HIV.50 Entretanto, após o início da TARVc, mudanças no padrão de crescimento têm sido usadas como parâmetros de efetividade no tratamento de crianças e adolescentes com HIV.
A partir dessa revisão feita nos últimos 21 anos, observou‐se que a maioria dos estudos demonstrou associação positiva no escore z‐escore de altura‐idade e de peso‐idade com o uso da TARVc (tabela 1). Além das melhorias referentes à antropometria, a literatura demonstra que a TARVc tem apresentado quedas nos níveis de morbidade, mortalidade e hospitalizações dos pacientes infectados com HIV. O tratamento com TARVc eleva a contagem de LT CD4+, reduz a replicação viral e restaura parcialmente o sistema imunológico. Como resultado, reduz a incidência de infecções oportunistas.54,58 Benjamin et al. (2003) apresentaram que crianças em uso de TARVc tinham menos alterações no sistema imunológico, melhor resposta ao vírus e melhor curva de z‐escore altura‐idade.4 Verweel et al. (2002) mostraram quedas de 63,69% nas internações após a introdução da TARVc.54
A literatura sugere que crianças que foram tratadas com monoterapia ou terapia dupla mostravam melhoria temporária do ritmo de crescimento. No entanto, que a TARVc resulta em aumento duradouro do peso e altura das crianças infectadas. Esse aumento, no entanto, não chegou a alcançar os valores normais aos da população geral. Buonora et al. (2008) demonstraram que, mesmo com a TARVc, os pacientes infectados tinham parâmetros de crescimento inferiores aos da população não infectada por HIV.41 Outro estudo avaliou que após introdução da TARVc, o z‐escore peso‐idade, foi próximo ao da população sem infecção pelo HIV, independentemente do tempo de início do tratamento. Em contrapartida, o z‐escore altura‐idade permaneceu baixo.26 O mesmo foi observado na Europa, onde, após comparar curvas de crescimento de crianças infectadas e não infectadas durante dez anos, concluiu‐se que a infecção pelo HIV causa crescimento mais lento e que as diferenças aumentam com a idade.53
Crianças mais jovens podem apresentar maior recuperação de peso e altura após o início da TARVc. Nachman et al. (2005) relatam que crianças menores de dois anos apresentaram maior z‐escore de altura durante a terapia.49 O ganho de peso também foi, predominantemente, maior em pacientes de menor idade.49 Shiau et al. (2013) avaliaram quatro anos de seguimento de 195 pacientes com AIDS e demonstraram que pacientes que iniciaram a TARVc com menos de seis meses de vida apresentaram melhoria mais rápida no z‐escore peso‐idade e altura‐idade do que aqueles que iniciaram depois.26 Dessa forma, quanto mais precoce a TARVc for iniciada, menor será a deficiência de crescimento.26,37
Outro dado importante apontado nos estudos refere‐se ao estado nutricional antes do tratamento, pois esse pode influenciar os desfechos antropométricos pós‐introdução da TARVc. Bandyopadhyay e Bhattacharyya (2008) mostraram que crianças desnutridas apresentaram pior resultado na evolução do z‐escores peso‐idade e altura‐idade comparadas àquelas que iniciaram a terapia em condições nutricionais adequadas.44
Na revisão, uma das principais limitações é a inclusão de um grande número de estudos feitos na África, onde a carência nutricional pode influenciar indiretamente o controle do crescimento, pode representar um viés do uso da TARVc. A desnutrição e o atraso no crescimento ocorrem precocemente na infecção vertical pelo HIV e o impacto negativo da infecção crônica e da deficiência nutricional, no crescimento, pode ser irreversível.32 No entanto, a ausência de melhoria no padrão de crescimento ocorreu em estudos feitos em um curto período. Por exemplo, Devi et al. (2011), que avaliaram 102 pacientes apenas no primeiro ano de uso da TARVc.32
Além disso, na revisão, não foi comparado o impacto das diferentes terapias antirretrovirais combinadas entre si. Também não foi possível analisar o crescimento por faixa etária. Nenhum estudo comparou grupos sob TARVc, com e sem falha virológica, para avaliar o crescimento.
Alguns trabalhos destacaram ainda a necessidade de avaliar as interações entre drogas em crianças e os potenciais efeitos adversos da TARVc no metabolismo, mas pesquisas ainda são limitadas nessa faixa etária. Ressalta‐se que os possíveis efeitos metabólicos da TARVc incluem resistência à insulina, dislipidemia, hiperlactatemia, podem tais alterações ocasionar aumento do risco para doenças cardiovasculares e diabetes. A elevação do colesterol total e a lipodistrofia associada ao uso de TARVc persiste um desafio no tratamento desses pacientes. Fatores associados à adesão ao tratamento das crianças a TARVc comprovaram que a baixa adesão foi fortemente associada ao perfil dos cuidadores (baixa escolaridade e/ou grau de pobreza).
Com base nos dados aqui descritos, os possíveis efeitos adversos da TARVc não superam os seus benefícios, em relação ao ganho pôndero‐estatural e à morbimortalidade das crianças infectadas pelo HIV. A TARVc conhecidamente atua na melhoria de marcadores virais e imunológicos e pode influenciar o crescimento de crianças infectadas com HIV. No entanto, o aumento dos marcadores antropométricos (peso e altura) não normalizou o crescimento se comparado à população saudável. Quanto mais precoce o diagnóstico da infecção e, concomitantemente, desnutrição e início da TARVc, menores serão os prejuízos no déficit de crescimento, quando comparados aos das crianças saudáveis. Pacientes com AIDS e sem tratamento prévio, por terapia antirretroviral, têm melhor resposta antropométrica à TARVc do que pacientes previamente tratados. No entanto, condições socioeconômicas e intrafamiliares desfavoráveis refletem na adesão ao tratamento, são fator limitante para resultados mais significativos e duradouros do uso da TARVc na infecção pelo HIV. Finalmente, principalmente em países com baixos recursos econômicos para a quantificação da carga viral, a melhoria dos dados antropométricos, durante o uso da TARVc, como parâmetro de eficácia terapêutica é mais evidente.
FinanciamentoFALM, pela Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp), por meio de bolsa de pós‐doutorado (#2015/12858‐5).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Golucci AP, Marson FA, Valente MF, Branco MM, Prado CC, Nogueira RJ. Influence of AIDS antiretroviral therapy on the growth pattern. J Pediatr (Rio J). 2019;95:7–17.
O estudo foi feito na Faculdade de Ciências Médicas, Universidade Estadual de Campinas, Campinas, SP, Brasil.