This study aimed at evaluating the predictors and outcomes associated with multidrug‐resistant gram‐negative bacterial (MDR‐GNB) infections in an oncology pediatric intensive care unit (PICU).
MethodsData were collected relating to all episodes of GNB infection that occurred in a PICU between January of 2009 and December of 2012. GNB infections were divided into two groups for comparison: (1) infections attributed to MDR‐GNB and (2) infections attributed to non‐MDR‐GNB. Variables of interest included age, gender, presence of solid tumor or hematologic disease, cancer status, central venous catheter use, previous Pseudomonas aeruginosa infection, healthcare‐associated infection, neutropenia in the preceding 7 days, duration of neutropenia, length of hospital stay before ICU admission, length of ICU stay, and the use of any of the following in the previous 30 days: antimicrobial agents, corticosteroids, chemotherapy, or radiation therapy. Other variables included initial appropriate antimicrobial treatment, definitive inadequate antimicrobial treatment, duration of appropriate antibiotic use, time to initiate adequate antibiotic therapy, and the 7‐ and 30‐day mortality.
ResultsMultivariate logistic regression analyses showed significant relationships between MDR‐GNB and hematologic diseases (odds ratio [OR] 5.262; 95% confidence interval [95% CI] 1.282–21.594; p=0.021) and healthcare‐associated infection (OR 18.360; 95% CI 1.778–189.560; p=0.015). There were significant differences between MDR‐GNB and non‐MDR‐GNB patients for the following variables: inadequate initial empirical antibiotic therapy, time to initiate adequate antibiotic treatment, and inappropriate antibiotic therapy.
ConclusionsHematologic malignancy and healthcare‐associated infection were significantly associated with MDR‐GNB infection in this sample of pediatric oncology patients.
Este estudo visou a avaliar os preditores e resultados associados às infecções por bactérias gram‐negativas multirresistentes (BGN‐MR) em uma unidade de terapia intensiva pediátrica oncológica (UTIP).
MétodosForam coletados dados com relação a todos os episódios de infecção por BGN que ocorreram em uma UTIP entre janeiro de 2009 e dezembro de 2012. As infecções por BGN foram divididas em dois grupos para comparação: 1) infecções atribuídas a BGN‐MR e 2) infecções atribuídas a BGN não multirresistente. As variáveis de interesse incluíram idade, sexo, presença de tumor sólido ou malignidade hematológica, câncer, uso de cateter venoso central, infecção anterior por Pseudomonas aeruginosa, infecção hospitalar, neutropenia nos sete dias anteriores, duração da neutropenia, tempo de internação antes da UTI, duração da internação na UTI e uso de quaisquer dos seguintes nos 30 dias anteriores: agentes antimicrobianos, corticosteroides, quimioterapia ou radioterapia. Outras variáveis incluíram: tratamento antimicrobiano inicial adequado, tratamento antimicrobiano definitivo inadequado, duração do uso de antibióticos adequados, tempo de início da terapia antibiótica adequada, mortalidade em sete dias e mortalidade em 30 dias.
ResultadosAs análises de regressão logística multivariada mostraram relações significativas entre as BGN‐MR e as doenças hematológicas (razão de chance (RC) 5,262; intervalo de confiança de 95% (IC de 95%) 1,282‐21,594; p=0,021) e infecções hospitalares (RC 18,360; IC de 95% 1,778‐189,560; p=0,015). Houve diferenças significativas entre os pacientes com BGN‐MR e BGN não MR com relação às seguintes variáveis: recebimento de terapia antibiótica empírica inicial inadequada, tempo para início do tratamento antibiótico adequado e recebimento de terapia antibiótica inadequada.
ConclusõesA malignidade hematológica e a infecção hospitalar foram significativamente associadas à infecção por BGN‐MR nessa amostra de pacientes pediátricos oncológicos.
Pacientes com câncer e malignidade hematológica têm risco elevado de infecções. Vários fatores contribuem para esse risco, incluindo a imunossupressão relacionada à doença e aos tratamentos agressivos, como quimioterapia, radioterapia, uso de esteroides e o transplante de células‐tronco hematopoéticas.1 Assim, a infecção continua sendo uma complicação frequente em pacientes com câncer e é responsável por internações na unidade de terapia intensiva (UTI).1 Entretanto, com os recentes avanços dos tratamentos de câncer e as melhorias no cuidado fundamental, um número cada vez maior de pacientes com malignidades hematológicas está sendo internado na UTI.2 Apesar das melhorias nos resultados associadas a um melhor cuidado, a mortalidade continua elevada em pacientes gravemente doentes com câncer ou malignidades hematológicas, principalmente na presença de infecções hospitalares adquiridas na UTI.2
Especificamente, a taxa de infecções relacionadas a bactérias gram‐negativas multirresistentes (BGN‐MR) em pacientes com câncer aumenta globalmente.3 Contudo, as opções de tratamento de infecções por BGN‐MR normalmente são limitadas. O Carbapenem é o medicamento escolhido para infecções causadas por micro‐organismos produtores de β‐lactamase de espectro ampliado (ESBL), porém seu uso pode não ser adequado em infecções causadas por Pseudomonas aeruginosa, Acinetobacter baumannii ou Stenotrophomonas maltophilia, cuja resistência ao Carbapenem é cada vez maior. Há muito poucos novos agentes antimicrobianos disponíveis para o tratamento contra BGN‐MR.4 Devido à falta de novos agentes para tratar infecções resistentes, os médicos devem fazer uso de antibióticos de forma criteriosa e adequada para limitar o desenvolvimento de bactérias resistentes.5
A presença de câncer, malignidade hematológica e uma internação anterior ou atual na UTI aumenta o risco de mortalidade em pacientes com infecções por BGN‐MR.6 Além disso, a infecção por BGN está associada a bactérias MR em pacientes pediátricos com câncer e com neutropenia febril.7 Estudos anteriores forneceram informações sobre os fatores de risco para a colonização ou infecção por BGN‐MR em populações de pacientes selecionados, como pacientes com transplante e aqueles sob cuidado intensivo ou de longo prazo.8,9 Estudos que envolveram pacientes com câncer têm focado em infecções na corrente sanguínea. Estão disponíveis informações limitadas com relação ao espectro e à microbiologia dessas infecções em outros locais, como o trato urinário, o trato respiratório, o trato gastrointestinal e a pele. Isso ocorre apesar do fato de essas infecções não serem raras.10
Em especial, sabe‐se pouco a respeito dos fatores de risco e dos resultados das infecções por BGN‐MR em uma UTI pediátrica oncológica (UTIP). Portanto, este estudo é destinado a avaliar os fatores de risco e os resultados associados a infecções por BGN‐MR em crianças com câncer e/ou doenças hematológicas.
Materiais e métodosProjeto do estudoFizemos um estudo caso‐controle na UTIP do Instituto Nacional do Câncer (Inca), Rio de Janeiro, Brasil. O Inca é um hospital público terciário de oncologia e a UTIP de seis leitos aceita somente pacientes com tumores sólidos e malignidades hematológicas. Os principais motivos para internação na UTIP são os cuidados pós‐operatórios e as complicações infecciosas em pacientes oncológicos.
Coletamos dados de todos os episódios de infecção relativos a BGN que ocorreram entre 1° de janeiro de 2009 e 31 de dezembro de 2012 em pacientes da UTIP até 18 anos e hospitalizados por mais de 24 horas. O comitê de ética da Universidade Federal Fluminense aprovou o estudo.
As variáveis incluem idade, sexo, presença de tumor sólido ou malignidade hematológica, câncer e presença de cateter venoso central. Também foram coletadas informações antes da data da infecção por BGN: infecção anterior relacionada a P. aeruginosa, neutropenia nos últimos sete dias, duração da neutropenia ≥ 3 dias, duração da internação na UTI>3 dias, duração da internação antes da UTI e infecção hospitalar, além do uso de agentes antimicrobianos, corticosteroides e quimioterapia e/ou radioterapia nos últimos 30 dias.
As infecções causadas por BGN foram divididas em dois grupos: 1) infecções atribuídas a BGN‐MR e 2) infecções atribuídas a BGN suscetível (BGN não MR). Os grupos apresentaram semelhanças a respeito do local da infecção. Os pacientes foram incluídos mais de uma vez na análise de episódios de infecção separados. Outras variáveis incluíram: tratamento antimicrobiano inicial adequado, tratamento antimicrobiano definitivo inadequado, duração do uso de antibióticos adequados, tempo de início da terapia antibiótica inicial adequada, mortalidade em sete dias e mortalidade em 30 dias.
Definição de termosUm episódio de infecção foi definido como o isolamento da BGN na presença de sinais ou sintomas clínicos compatíveis a partir do terceiro dia antes da data da internação na UTIP até o último dia de internação na UTIP. Foram incluídas infecções hospitalares e presença de infecções na internação.
Foram usados os critérios diagnósticos do Centro de Controle e Prevenção de Doenças. A BGN foi isolada das culturas de sangue, urina, fezes, lavado broncoalveolar, aspirado traqueal, líquor ou ponta do cateter durante esse tempo. O aspirado traqueal foi coletado a partir de tubos endotraqueais e da traqueostomia de pacientes submetidos a ventilação mecânica.
Os critérios de diagnóstico para pneumonia incluíram secreção traqueobrônquica purulenta ou novas bactérias patogênicas isoladas do aspirado traqueal e ≥ 2 dos seguintes critérios: febre (temperatura>38°C); leucócitos>12.000 células/mL ou aumento de<4.000 células/mL; infiltração nova e persistente (> 48 horas) detectada em radiografia do tórax; novo surgimento ou pioria de tosse, dispneia ou taquipneia; ou pioria da troca gasosa. Os valores limite das amostras de cultura usadas nos critérios de pneumonia foram ≥ 104 CFU/mL no aspirado traqueal ou lavado broncoalveolar.
As culturas de cateteres foram feitas quando um cateter foi removido para verificar uma suspeita de infecção relacionada ao cateter intravascular, sepse ou eritema inexplicado sobrejacente ao local de inserção do cateter ou purulência no local de inserção do cateter. No mínimo um dos seguintes sinais ou sintomas foi exigido para o diagnóstico de infecção relacionada a cateter: febre (> 38°C), dor, eritema, calor no local na região vascular sem outra causa reconhecida e>15 colônias cultivadas a partir de uma ponta da cânula intravascular com o uso de um método de cultura semiquantitativa e ausência de hemocultura ou organismos cultivados do sangue.
Os critérios de diagnóstico de infecção do trato urinário incluíram urocultura positiva de ≥ 105 CFU/mL com menos de duas espécies de micro‐organismos e pelo menos um dos seguintes sinais ou sintomas foi exigido para o diagnóstico: febre (> 38°C); disúria; sensibilidade suprapúbica; dor no ângulo costovertebral ou sensibilidade sem outra causa reconhecida.
Os critérios de diagnóstico de gastroenterite incluíram surgimento agudo de diarreia (fezes líquidas por>12 horas) com ou sem vômito ou febre (> 38°C), ausência de probabilidade de causa não infecciosa (por exemplo, testes de diagnóstico, regime terapêutico que não agentes antimicrobianos, exacerbação aguda de uma doença crônica ou estresse psicológico) e agente patogênico entérico detectado em uma cultura de fezes.
A infecção por BGN‐MR foi considerada na presença de Enterobacteriaceae produtora de ESBL, micro‐organismos com mecanismos de resistência intrínsecos, como S. maltophilia e Elizabethkingia meningoseptica, ou BGN resistentes ao Carbapanem. P. aeruginosa e A. baumanii resistentes ao Carbapanem foram consideradas BGN‐MR. A infecção polimicrobiana envolveu o isolamento de mais de um patógeno de uma amostra de cultura. A infecção foi classificada como hospitalar quando teve início>48horas após a internação no hospital do estudo (enfermaria ou UTIP). A neutropenia foi definida como uma contagem absoluta de neutrófilos<500/mm3 na amostra de sangue.
A malignidade hematológica incluiu leucemias e linfomas.
A situação do câncer foi classificada em três categorias: remissão/controlado (pacientes em remissão ou controle do câncer submetidos a tratamentos anteriores, sem recidiva comprovada segundo o oncologista/hematologista atendente), diagnóstico recente (pacientes com doença ativa diagnosticada nos três meses anteriores com necessidade de tratamento anticâncer de primeira linha) e recaída/recidiva (pacientes com doença ativa com recaída ou recidiva).
O tratamento antimicrobiano inicial foi considerado inadequado caso o regime de tratamento inicial não tenha incluído no mínimo um ativo antibiótico contra o micro‐organismo in vitro e quando o tratamento antibiótico não iniciou na data da cultura positiva. Em pacientes com culturas de bactérias produtoras de ESBL, o tratamento com penicilina e cefalosporina foi considerado inadequado. O tratamento antimicrobiano definitivo inadequado ocorreu quando o paciente não recebeu ativo antibiótico contra o micro‐organismo in vitro durante o período de internação.
O óbito em até sete dias ou 30 dias após a data da cultura positiva foi considerado a mortalidade de sete ou 30 dias, respectivamente.
Procedimentos microbiológicosA classificação bacteriana foi feita pelo laboratório de microbiologia do Inca com o uso do método automatizado Vitek (Bio‐Merieux Inc., Marcy l’Etoile, França) e manualmente confirmada pela identificação bacteriana isolada e pela resistência antimicrobiana, segundo as normas do Instituto de Normas Laboratoriais e Clínicas (CLSI).
Análise estatísticaA análise estatística foi feita com o SPSS v17 (SPSS Inc., Chicago, Illinois, EUA). Um valor de p<0,05 foi considerado estatisticamente significativo. As variáveis contínuas são apresentadas como medianas e a análise comparativa foi feita com testes t independentes. Os testes qui‐quadrado e de Fisher foram usados para comparar variáveis categóricas e foram calculadas razões de chance (RC) com intervalos de confiança de 95% (IC de 95%). As análises de regressão logística univariada identificaram variáveis estatisticamente significativas (p<0,05) relacionadas à infecção por BGN‐MR para a inclusão na análise de regressão logística multivariada, feita com um modelo gradativo.
ResultadosHouve 765 internações na UTIP entre 1° de janeiro de 2009 e 31 de dezembro de 2012. Houve 101 episódios de infecção por BGN em 76 pacientes em 86 internações e 47 (46,5%) desses episódios foram relacionados à infecção por BGN‐MR.
Os patógenos que ocorreram com mais frequência dentre as BGN‐MR foram os seguintes: A. baumannii, oito (17%); S. maltophilia, sete (15%); Enterobacter spp., sete (15%); e Klebsiella pneumoniae, sete (15%). Os patógenos que ocorreram com mais frequência dentre as BGN não MR foram os seguintes: P. aeruginosa, 22 (41%); A. baumannii, 14 (26%); e K. pneumoniae, oito (15%). A infecção polimicrobiana esteve presente em um paciente com BGN‐MR (2%, n=1/47) e em dois pacientes com BGN não MR (3,8%, n=2/54).
Dentre os episódios de infecção por BGN, BGN‐MR foram encontradas nas seguintes frequências em cada uma das cepas de bactérias: 100% (n=2/2) de Morganella morganii, 100% (n=1/1) de Citrobacter spp., 87,5% (n=7/8) de Enterobacter spp., 50% (n=5/10) de Escherichia coli, 46,6% (n=7/15) de K. pneumoniae, 36,4% (n=8/22) de A. baumannii, 18,5% (n=5/27) de P. aeruginosa e 0% (0/2) de Proteus mirabilis. Houve sete episódios de infecção por S. maltophilia e quatro episódios de infecção por E. meningoseptica, micro‐organismos com mecanismos de resistência intrínsecos. Houve três episódios de infecção polimicrobiana: um de K. pneumoniae e E. coli BGN não MR, um de Klebsiella oxytoca e E. coli BGN não MR e um de P. aeruginosa e S. maltophilia MR.
No grupo com BGN‐MR, as bactérias foram isoladas com mais frequência do aspirado traqueal (n=17, 36,2%), seguido por hemocultura (n=8, 17%), urocultura (n=4, 8,5%) e cultura da ponta do cateter (n=3, 6,4%). No grupo BGN não MR, as bactérias foram isoladas com mais frequência do aspirado traqueal (n=22 40,7%), seguido por urocultura (n=10, 18,5%), hemocultura (n=10, 18,5%) e uma combinação de hemocultura e cultura da ponta do cateter (n=4, 7,4%). Houve concordância entre os micro‐organismos isolados quando a BGN foi isolada de uma combinação de cultura diferente; 63,8% (30/47) do grupo BGN‐MR e 70,3% (38/54) do grupo BGN não MR eram pacientes submetidos a ventilação mecânica.
As doenças mais frequentes no grupo com infecção por BGN‐MR foram tumor no sistema nervoso central (91%), neuroblastoma (15%), linfoma não Hodgkin (15%) e leucemia linfoblástica aguda (15%). No grupo com BGN não MR, as doenças mais frequentes foram tumor no sistema nervoso central (52%), neuroblastoma (11%), rabdomiossarcoma (6%) e tumor de Wilms (6%). Apenas um paciente no grupo de estudo foi submetido a transplante de medula óssea.
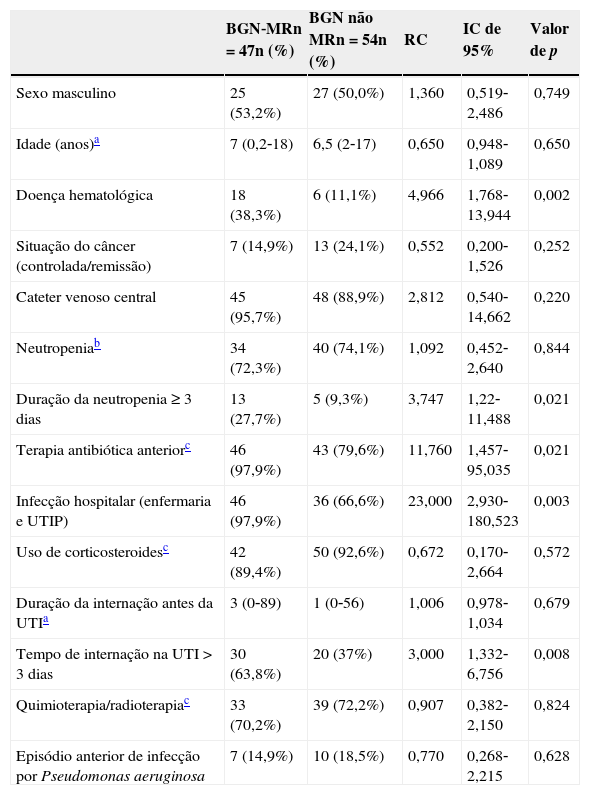
As características demográficas e clínicas estão descritas na tabela 1.
Variáveis demográficas e clínicas relacionadas a infecção por bactérias gram‐negativas multirresistentes (BGN‐MR) em uma unidade de terapia intensiva pediátrica (UTIP) analisadas por meio de regressão logística univariada
| BGN‐MRn=47n (%) | BGN não MRn=54n (%) | RC | IC de 95% | Valor de p | |
|---|---|---|---|---|---|
| Sexo masculino | 25 (53,2%) | 27 (50,0%) | 1,360 | 0,519‐2,486 | 0,749 |
| Idade (anos)a | 7 (0,2‐18) | 6,5 (2‐17) | 0,650 | 0,948‐1,089 | 0,650 |
| Doença hematológica | 18 (38,3%) | 6 (11,1%) | 4,966 | 1,768‐13,944 | 0,002 |
| Situação do câncer (controlada/remissão) | 7 (14,9%) | 13 (24,1%) | 0,552 | 0,200‐1,526 | 0,252 |
| Cateter venoso central | 45 (95,7%) | 48 (88,9%) | 2,812 | 0,540‐14,662 | 0,220 |
| Neutropeniab | 34 (72,3%) | 40 (74,1%) | 1,092 | 0,452‐2,640 | 0,844 |
| Duração da neutropenia ≥ 3 dias | 13 (27,7%) | 5 (9,3%) | 3,747 | 1,22‐11,488 | 0,021 |
| Terapia antibiótica anteriorc | 46 (97,9%) | 43 (79,6%) | 11,760 | 1,457‐95,035 | 0,021 |
| Infecção hospitalar (enfermaria e UTIP) | 46 (97,9%) | 36 (66,6%) | 23,000 | 2,930‐180,523 | 0,003 |
| Uso de corticosteroidesc | 42 (89,4%) | 50 (92,6%) | 0,672 | 0,170‐2,664 | 0,572 |
| Duração da internação antes da UTIa | 3 (0‐89) | 1 (0‐56) | 1,006 | 0,978‐1,034 | 0,679 |
| Tempo de internação na UTI>3 dias | 30 (63,8%) | 20 (37%) | 3,000 | 1,332‐6,756 | 0,008 |
| Quimioterapia/radioterapiac | 33 (70,2%) | 39 (72,2%) | 0,907 | 0,382‐2,150 | 0,824 |
| Episódio anterior de infecção por Pseudomonas aeruginosa | 7 (14,9%) | 10 (18,5%) | 0,770 | 0,268‐2,215 | 0,628 |
IC, intervalo de confiança; RC, razões de chance; UTI, unidade de terapia intensiva.
A duração média da neutropenia foi de 0 dias em ambos os grupos (infecção por BGN‐MR, média de 0‐36; infecção por BGN não MR, média de 0‐6; RC 3,747; IC de 95% 1,222‐11,488; p=0,021). A duração média da internação na UTI foi de oito dias (0‐80) no grupo com infecção por BGN‐MR e dois dias (0‐45) no grupo com infecção por BGN não MR (RC 2,296; IC de 95% 0,001‐0,015; p=0,024).
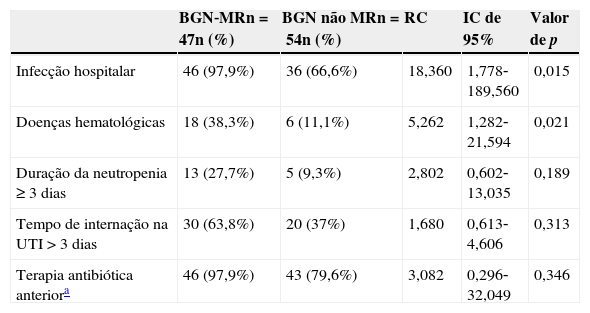
Os resultados da regressão logística univariada estão descritos na tabela 1. Na análise de regressão logística multivariada, a presença de doenças hematológicas (RC 5,262; IC de 95% 1,282‐21,594; p=0,021) e infecção hospitalar (RC 18,360; IC de 95% 1,778‐189,560; p=0,015) foram associadas de forma significativa à infecção por BGN‐MR (tabela 2).
Resultados da análise de regressão logística multivariada para verificar o resultado das bactérias gram‐negativas multirresistentes (BGN‐MR), incluindo as variáveis que foram estatisticamente significativas na análise de regressão logística univariada
| BGN‐MRn=47n (%) | BGN não MRn=54n (%) | RC | IC de 95% | Valor de p | |
|---|---|---|---|---|---|
| Infecção hospitalar | 46 (97,9%) | 36 (66,6%) | 18,360 | 1,778‐189,560 | 0,015 |
| Doenças hematológicas | 18 (38,3%) | 6 (11,1%) | 5,262 | 1,282‐21,594 | 0,021 |
| Duração da neutropenia ≥ 3 dias | 13 (27,7%) | 5 (9,3%) | 2,802 | 0,602‐13,035 | 0,189 |
| Tempo de internação na UTI>3 dias | 30 (63,8%) | 20 (37%) | 1,680 | 0,613‐4,606 | 0,313 |
| Terapia antibiótica anteriora | 46 (97,9%) | 43 (79,6%) | 3,082 | 0,296‐32,049 | 0,346 |
IC, intervalo de confiança; RC, razões de chance.
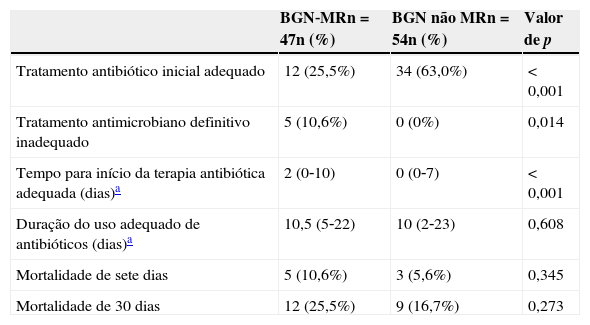
As outras variáveis associadas à infecção por BGN‐MR estão detalhadas na tabela 3. Os pacientes com infecção por BGN‐MR receberam com mais frequência terapia antibiótica empírica inicial inadequada (74,5%) do que os do grupo BGN não MR (37%, p<0,001) e o tempo para iniciar a terapia antibiótica adequada foi maior no grupo BGN‐MR (média de dois dias) do que no grupo BGN não MR (média de 0 dias, p<0,001). O grupo BGN‐MR também estava significativamente mais suscetível a receber terapia antibiótica definitiva inadequada (10,6% em comparação com 0%, p=0,014).
Resultados e outras variáveis associadas à presença de bactérias gram‐negativas multirresistentes (BGN‐MR) em pacientes de uma unidade de terapia intensiva pediátrica
| BGN‐MRn=47n (%) | BGN não MRn=54n (%) | Valor de p | |
|---|---|---|---|
| Tratamento antibiótico inicial adequado | 12 (25,5%) | 34 (63,0%) | < 0,001 |
| Tratamento antimicrobiano definitivo inadequado | 5 (10,6%) | 0 (0%) | 0,014 |
| Tempo para início da terapia antibiótica adequada (dias)a | 2 (0‐10) | 0 (0‐7) | < 0,001 |
| Duração do uso adequado de antibióticos (dias)a | 10,5 (5‐22) | 10 (2‐23) | 0,608 |
| Mortalidade de sete dias | 5 (10,6%) | 3 (5,6%) | 0,345 |
| Mortalidade de 30 dias | 12 (25,5%) | 9 (16,7%) | 0,273 |
Há poucos estudos com pacientes pediátricos oncológicos internados na UTI e com infecção por BGN‐MR. A malignidade hematológica e a infecção hospitalar surgiram como importantes fatores associados à infecção por BGN‐MR neste estudo.
A sepse aumenta a mortalidade em crianças com síndrome da disfunção múltipla dos órgãos.11 Existem muitas variações regionais na incidência de cada patógeno resistente e esses fatores epidemiológicos devem ser considerados na tomada de decisões acerca de antibióticos empíricos.5
Estudos recentes relataram altas taxas de infecção por BGN‐MR na UTIP ou em pacientes pediátricos oncológicos. Em crianças com malignidades hematológicas e neutropenia febril, 51,6% dos episódios de bacteremia por K. pneumonia resistiram ao ceftazidima.12 Além disso, em outro estudo em pacientes pediátricos oncológicos com neutropenia febril, 50% de Acinetobacter spp., 44,4% de E. coli, 66,7% de K. pneumoniae e 100% de P. aeruginosa eram MR.7 Ocorreram casos MR em 57,1% de pacientes pediátricos oncológicos com bacteremia por P. aeruginosa13 e em 31,4% de crianças com bacteremia por P. aeruginosa submetidas a quimioterapia e transplante de células‐tronco hematopoéticas.14
Na UTIP, 30% dos casos de K. pneumoniae15 e 23% dos casos de Enterobacteriaceae16 eram cepas produtoras de ESBL. A resistência ao Carbapenem em pacientes pediátricos na UTI também é comum, observada em 62% dos casos de A. baumannii.17
Neste estudo, a MR foi detectada em 50% de E. coli, 46,6% de K. pneumoniae, 36,4% de A. baumannii e 18,5% de P. aeruginosa.
Estudos recentes em crianças com neutropenia e câncer em diferentes períodos indicaram um aumento na taxa de infecções relacionadas à A. baumannii.7 A A. baumannii MR é considerada, atualmente, um dos patógenos desafiadores em pacientes gravemente doentes,7 principalmente pacientes pediátricos, devido à ausência de novos agentes antimicrobianos eficazes. Neste estudo, a A. baumannii foi responsável por 21,8% (22/101) de todos os episódios de infecção por BGN e foi a bactéria MR mais comum (17%, 8/47), o que confirma a importância desse agente etiológico nessa população.
Neste estudo, os tipos mais comuns de infecção, por ordem de frequência, foram pneumonia, infecções da corrente sanguínea e infecções do trato urinário. Outros estudos mostram que os principais locais das infecções hospitalares na UTIP foram pneumonia e infecções da corrente sanguínea.18,19 Quando submetidos a procedimentos invasivos, como ventilação mecânica, pacientes oncológicos ficam mais suscetíveis a uma complicação por infecção do que a população geral.
Em pacientes com tumor sólido, o principal tratamento normalmente é cirúrgico. Contudo, pacientes com malignidade hematológica normalmente recebem quimioterapia mais agressiva, o que resulta em maiores períodos de neutropenia, mais episódios de neutropenia febril e uso mais frequente de antibióticos. Além disso, como pacientes hematológicos normalmente apresentam doenças patofisiológicas específicas que podem alterar o comportamento farmacocinético de antimicrobianos, pode ser necessário diferenciar os horários de administração e os regimes posológicos de antimicrobianos dos horários e regimes padrão. Especificamente, doses maiores (p. ex., aminoglicosídeos, fluoroquinolonas), infusão prolongada (p. ex., beta‐lactamases) e monitoramento de medicamentos terapêuticos são importantes para aprimorar o uso de antimicrobianos. Os princípios farmacocinético e farmacodinâmico devem ser levados em consideração ao projetar os regimes antimicrobianos, já que está cada vez mais claro que concentrações abaixo do ideal no local da infecção podem contribuir para maior resistência microbiana.20
Nossos resultados a respeito de infecções hospitalares também corroboram aqueles relatados em estudos anteriores em crianças com câncer.21 As taxas de infecções nosocomiais e de resistência antibiótica são muito maiores na UTIP em comparação com outras unidades hospitalares. As infecções nosocomiais afetam até 30% dos pacientes na UTI e ocorrem 5‐10 vezes com mais frequência do que em pacientes que não estão na UTI.5 Em um estudo de pacientes pediátricos com infecção nosocomial, a incidência geral de infecção nosocomial era de 2,5% e variava de 1% em unidades pediátricas em geral para 23,6% na UTIP.18 Diversos fatores podem contribuir para essas diferenças, inclusive o uso de mais procedimentos invasivos, má higiene das mãos, lapsos em técnicas de assepsia, pressão seletiva por antibióticos devido ao uso inadequado, transferências de paciente dentro do hospital, doença de base grave, desnutrição e imunossupressão.5 Neste estudo, o tempo de internação na UTI, o uso anterior de antibióticos e a duração da neutropenia foram associados à infecção por MR na análise univariada, mas não na análise multivariada, provavelmente devido ao fato de essas variáveis estarem inter‐relacionadas a infecções hospitalares ou doenças hematológicas fortemente associadas à infecção por BGN‐MR na análise multivariada.
Foram relatadas as relações entre infecções bacterianas resistentes e resultados insatisfatórios.5 Um fator determinante no resultado de pacientes com infecções é a escolha de uma terapia empírica adequada nas primeiras 48 horas após o início dos sintomas e nas primeiras 24 horas após uma hemocultura positiva.4 Neste estudo, o grupo com infecções por BGN‐MR foi submetido a terapia antibiótica empírica inadequada com mais frequência do que o grupo sem infecções por BGN‐MR e o tempo para receber terapia adequada foi maior para os pacientes com infecções por BGN‐MR. Houve também maior tendência de mortalidade de sete e 30 dias nos pacientes com BGN‐MR; contudo, isso não foi estatisticamente significativo.
Um estudo anterior em pacientes pediátricos com câncer também não relatou diferenças estatisticamente significativas na mortalidade relacionada a infecções ou a todas as causas devido às infecções por BGN‐MR.21
A relação entre a oportunidade de terapia adequada e o prognóstico é complexa. Os médicos tendem a prescrever terapia antimicrobiana precoce de espectro ampliado a pacientes com apresentações clínicas graves. Em contrapartida, a terapia antimicrobiana normalmente é postergada em pacientes que não apresentam disfunção dos órgãos ou que apresentam hemoculturas tardiamente positivas. Por fim, pacientes com rápida progressão para morte nunca receberam terapia antimicrobiana.22
Neste estudo, o tempo médio para iniciar terapia antibiótica adequada foi de dois dias em crianças com infecção por BGN‐MR sem impacto sobre a mortalidade. Faltam estudos relacionados ao efeito da demora em iniciar antibióticos adequados sobre a mortalidade em pacientes pediátricos. Contudo, em estudos com adultos, um atraso de 2‐3 dias em iniciar antibióticos adequados teve pouco efeito sobre a mortalidade dos pacientes.23‐26
Os pontos fortes do estudo atual incluem a população, que apresentou uma combinação de fatores de risco para infecções por BGN‐MR: câncer e internação na UTI. Adicionalmente, o conhecimento dos fatores de risco de BGN‐MR pode ajudar os médicos a identificar os pacientes que exigem mais atenção durante a prescrição empírica de terapia antimicrobiana, acompanhamento especial e medidas de controle de infecções.
Este estudo tem algumas limitações, inclusive a coleta de dados retrospectivos em uma pequena amostra. Apesar disso, não houve dados ausentes e foram observadas diferenças significativas.
ConclusãoPacientes pediátricos com câncer hematológico podem ser acometidos por infecção hospitalar, supostamente associada a BGN‐MR. Isso reforça a necessidade de treinamento acerca dos riscos de transmissão e das medidas preventivas dos profissionais da saúde (por exemplo, como manusear os equipamentos). Devem ser implantadas precauções de contato a todos os pacientes com colonização ou infecção por patógenos MR e um protocolo de antibióticos com base na epidemiologia local.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: de Oliveira Costa P, Atta EH, da Silva AR. Infection with multidrug‐resistant gram‐negative bacteria in a pediatric oncology intensive care unit: risk factors and outcomes. J Pediatr (Rio J). 2015;91:435–41.