Describe the clinical and laboratory profile, follow‐up, and outcome of a series of cases of acute viral myositis.
MethodA retrospective analysis of suspected cases under observation in the emergency department was performed, including outpatient follow‐up with the recording of respiratory infection and musculoskeletal symptoms, measurement of muscle enzymes, creatine phosphokinase (CPK), lactate dehydrogenase (LDH), transaminases (AST and ALT), blood count, C‐reactive protein, and erythrocyte sedimentation rate in the acute phase and during follow‐up until normalization.
ResultsBetween 2000 and 2009, 42 suspected cases were identified and 35 (27 boys) were included. The median age was 7 years and the diagnosis was reported in 89% in the first emergency visit. The observed respiratory symptoms were cough (31%), rhinorrhea (23%), and fever (63%), with a mean duration of 4.3 days. Musculoskeletal symptoms were localized pain in the calves (80%), limited ambulation (57%), gait abnormality (40%), and muscle weakness in the lower limbs (71%), with a mean duration of 3.6 days. There was significant increase in CPK enzymes (5,507 ± 9,180 U/L), LDH (827 ± 598 U/L), and AST (199 ± 245 U/L), with a tendency to leukopenia, (4,590 ± 1,420) leukocytes/mm3. The complete recovery of laboratory parameters was observed in 30 days (median), and laboratory and clinical recurrence was documented in one case after ten months.
ConclusionTypical symptoms with increased muscle enzymes after diagnosis of influenza and self‐limited course of the disease were the clues to the diagnosis. The increase in muscle enzymes indicate transient myotropic activity related to seasonal influenza, which should be considered, regardless of the viral identification, possibly associated with influenza virus or other respiratory viruses.
Descrever o perfil clínico‐laboratorial, o acompanhamento e o desfecho de uma série de casos de miosite aguda viral.
MétodoFoi conduzida uma análise retrospectiva de casos suspeitos, em observação em unidade de emergência, e seguimento ambulatorial com o registro de sintomas de infecção respiratória, sintomas músculo‐esqueléticos, determinação de enzimas musculares, creatina‐fosfoquinase (CPK), desidrogenase lática (DHL), transaminases (AST e ALT), hemograma, proteína C reativa e velocidade de hemossedimentação, na fase aguda e no acompanhamento, até a normalização.
ResultadosEntre 2000 e 2009, 42 casos suspeitos foram identificados e 35 (27 meninos) foram incluídos. A mediana de idade foi de sete anos e o diagnóstico relatado em 89%, na primeira visita de emergência. Os sintomas respiratórios observados foram: tosse (31%), coriza (23%) e febre (63%), com duração média de 4,3 dias. Os sintomas músculo‐esqueléticos foram: dor localizada nas panturrilhas (80%), deambulação limitada (57%), marcha anormal (40%) e fraqueza muscular nos membros inferiores (71%), com duração média de 3,6 dias. Observou‐se elevação importante das enzimas CPK (5.507 ± 9.180) U/l, DHL (827 ± 598) U/l e AST (199 ± 245) U/l e tendência a leucopenia (4.590 ± 1.420) leucócitos/mm3. A recuperação completa dos parâmetros laboratoriais foi observada em 30 dias (mediana) e a recaída clínica e laboratorial em um caso após 10 meses.
ConclusãoOs sintomas típicos com enzimas musculares elevadas após diagnóstico de influenza e o curso autolimitado foram os indícios para o diagnóstico. A elevação de enzimas musculares indica a atividade miotrópica transitória relacionada à influenza sazonal que deve ser considerada, a despeito da identificação viral, possivelmente associada com o vírus influenza ou outros vírus respiratórios.
A miosite aguda viral é uma síndrome caracterizada por acometimento músculo‐esquelético após afecções de vias aéreas superiores que leva a limitações transitórias de mobilidade em crianças e é predominante em meninos. Manifesta‐se com dor e fraqueza muscular em membros inferiores, em particular em panturrilhas e coxas.1‐4 A sua incidência não é conhecida, mas é considerada infrequente. É descrita principalmente durante surtos epidêmicos de influenza.5 Os sintomas respiratórios precedentes são comuns e incluem febre, indisposição, tosse, odinofagia, cefaleia e rinorreia.
Os sinais e os sintomas músculo‐esqueléticos, embora transitórios e autolimitados, frequentemente demandam pronto atendimento em emergência, preocupam os pais e trazem alguns dilemas para o diagnóstico, sobretudo pela limitação de mobilidade.
Há relatos de literatura de casos isolados, pequenas séries ou de surtos epidêmicos.2,6‐12 A investigação sobre a sua patogênese ainda é limitada. O seu pronto reconhecimento poderá melhorar o atendimento de emergência e os cuidados conservadores. O objetivo foi explorar e descrever a apresentação clínico‐laboratorial e o desfecho de uma série de casos de miosite aguda viral.
MétodosFoi feito um estudo retrospectivo de casos atendidos em uma unidade de emergência de junho de 2000 a dezembro de 2009. Os casos foram inicialmente identificados por meio dos registros de diagnósticos durante o acompanhamento ambulatorial. Para a revisão de prontuários, usou‐se um protocolo de coleta de dados demográficos e clínicos: 1) demográficos: data de nascimento, gênero, diagnóstico inicial, procedência, especialidades consultadas, referência, data da primeira consulta, data da última consulta; 2) clínicos: data de início dos sintomas, data do diagnóstico, tempo de resolução dos sintomas, sinais clínicos de apresentação incluindo sinais e sintomas respiratórios e duração, doenças associadas, antecedentes familiares, internação e duração de internação, complicações; 3) laboratoriais: exames laboratoriais ao diagnóstico e seguimento; 4) desfecho: tratamento e duração do quadro. Os casos consecutivos suspeitos foram observados em um hospital público, por diferentes médicos assistentes, com a avaliação clínica do primeiro até último atendimento registrada no prontuário. Identificou‐se nesse intervalo as datas do diagnóstico, do início dos sintomas e na qual se constatou a normalização dos exames laboratoriais e seus respectivos valores. A duração dos sintomas de apresentação e as complicações, bem como a identificação de sintomas respiratórios, músculo‐esqueléticos e a recorrência, foram identificadas nas consultas ambulatoriais. Possíveis diagnósticos diferenciais considerados durante o pronto atendimento foram registrados no protocolo.
Os exames laboratoriais foram indicados pelo médico assistente de acordo com a suspeita ou o encaminhamento diagnóstico no pronto atendimento, consistiram em determinação de enzimas musculares, creatina‐fosfokinase (CPK) e sua fração isoenzima MB (CK‐MB), desidrogenase lática (DHL), transaminase glutâmico‐oxalo‐acética (TGO) e glutâmico‐pirúvica (TGP) e foram feitos no laboratório de rotina do hospital, por meio de ensaio enzimático colorimétrico. Os resultados foram expressos em unidades por litro (U/L). Hemograma e exame de urina foram feitos por métodos de rotina, velocidade de hemossedimentação (método Westergreen) com resultados expressos em mm/hora, proteína‐C reativa por ensaio nefelométrico automatizado e os resultados foram expressos em mg/dL.
Como não há critérios padronizados para o diagnóstico de miosite aguda viral, o protocolo foi estabelecido de acordo os sintomas mais frequentemente descritos na literatura, a dor nos membros e a fraqueza muscular acompanhados de elevação de enzimas musculares. Foram incluídos os casos que preencheram os seguintes critérios: menores de 18 anos com a suspeita confirmada durante o seguimento ambulatorial, de 2000 a 2009, com avaliação clínica e laboratorial ao diagnóstico e pelo menos uma consulta de acompanhamento. Foram excluídos os casos suspeitos, mas sem elevação de enzimas musculares, a despeito de sintomas de mialgia e dor em membros com evolução autolimitada que ocorreu após infecção respiratória.
A frequência das variáveis foi registrada, incluindo gênero, primeiro diagnóstico, procedência, especialidades consultadas, complicações, exames complementares indicados e exames complementares alterados, doenças associadas e a presença de sinais clínicos. Observaram‐se principalmente mialgia, dor nas panturrilhas, limitação para deambulação, anormalidade na marcha, como andar na ponta dos pés, e fraqueza muscular. Os sintomas respiratórios precedentes, tais como espirros, obstrução nasal, tosse, coriza, febre, cefaleia, dor de garganta, vômitos, diarreia, epistaxe, faringo‐amigdalite e uso de medicações, também foram registrados. O protocolo foi aprovado pelo comitê de ética em pesquisa institucional em 7 de dezembro de 2009 (n¿. 3409/2009).
A análise estatística foi conduzida e os dados quantitativos são apresentados por mediana, valores mínimos e máximo, média e desvio‐padrão e as variáveis categóricas por meio de valores absolutos e porcentagem. A frequência e a distribuição anual de casos são apresentadas por meio de histograma de frequência. A comparação entre as variáveis laboratoriais na apresentação clínica e durante a resolução dos sintomas (tempo variável) foi feita por meio de teste t pareado. O limiar de significância foi estabelecido em 5% ou valor de p correspondente (p < 0,05). Os testes e a apresentação gráfica foram feitos por meio do programa Prism Graph Pad v.4.0® (GraphPad Software Inc., Califórnia, EUA).
ResultadosForam identificados 42 casos com suspeita clínica de miosite aguda viral nos registros de atendimento de emergência e ambulatorial, de junho de 2000 a dezembro de 2009. Desses, foram incluídos 35 casos, 27 meninos e oito meninas. Um deles teve recorrência em um segundo episódio.
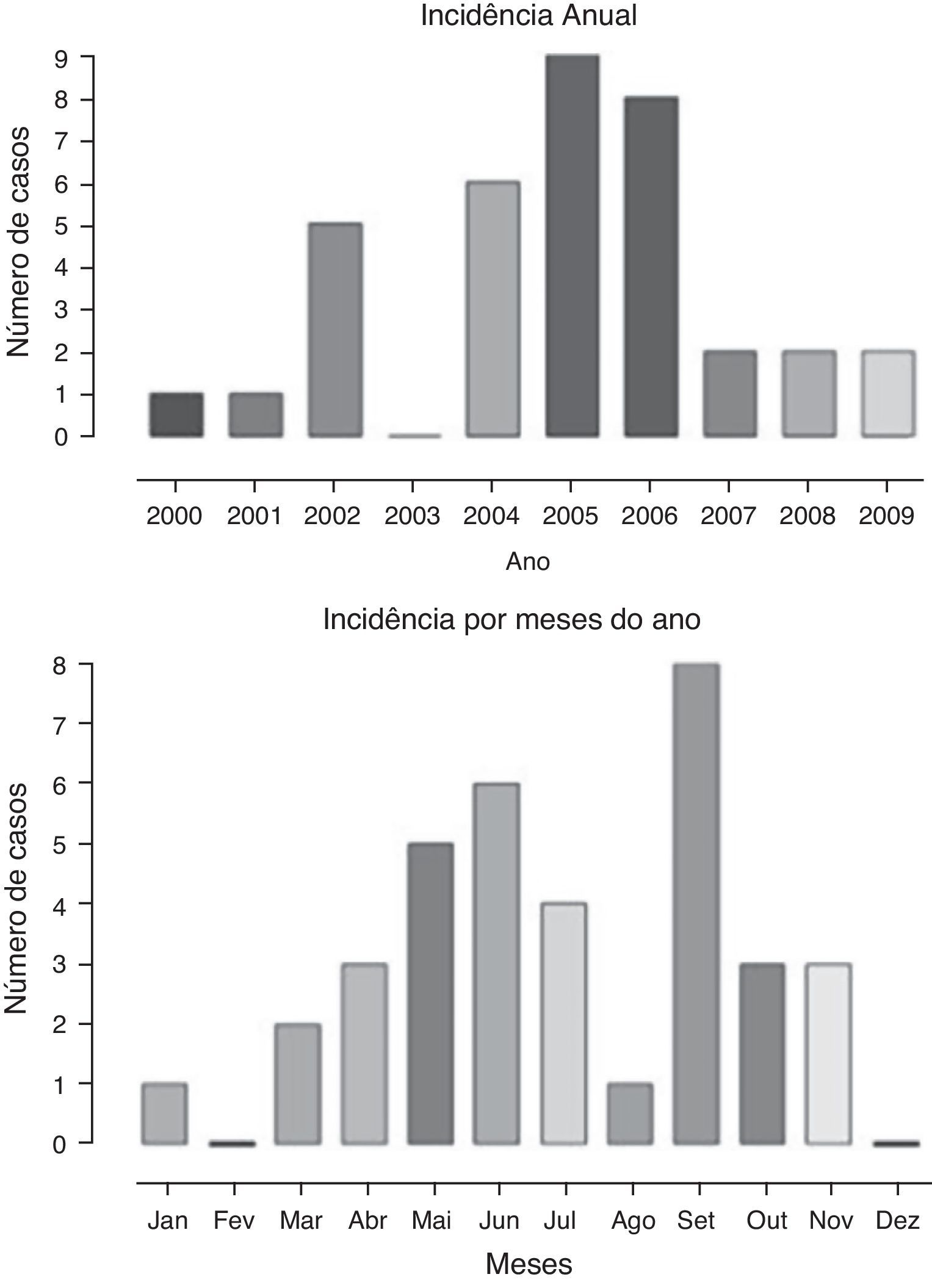
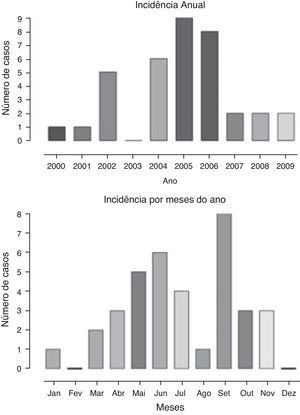
A distribuição anual de casos, assim como a frequência de acordo com os meses do ano, é apresentada na figura 1. Observa‐se maior frequência nos meses de maio, junho, julho e setembro, comparativamente aos demais, o que corresponde aos meses mais frios do ano. Houve maior frequência de casos diagnosticados de 2004 a 2006.
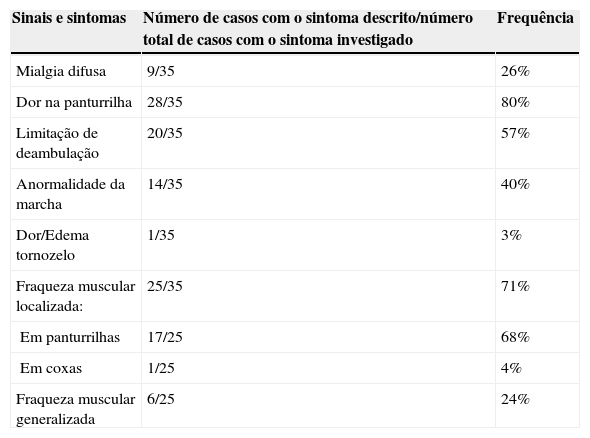
A idade de início dos sintomas variou de 3,4 a 12,5 anos, mediana de 7,5. O intervalo entre o início dos sintomas e a primeira consulta variou de um a seis dias. A duração dos sintomas respiratórios variou de um a 15 dias, mediana de 3,5 e média de 4,3 ± 2,8 dias. Entre os sintomas relatados, febre, tosse e coriza foram observadas em 63%, 31% e 23%, respectivamente. Na tabela 1 são apresentados os sinais e sintomas músculo‐esqueléticos descritos de acordo com o protocolo de coleta de dados. O exame neurológico foi considerado normal em todos os casos. A duração da fraqueza muscular variou de um a oito dias, com mediana de dois e média de 2,7 ± 1,9. O tempo de resolução dos sintomas variou de um a 16 dias, com mediana de três e média de 3,6 ± 3,3. Foram feitas de uma a três 3 consultas durante a fase aguda, internação de até 48horas ocorreu em 4/35 (11%). A duração do acompanhamento variou de 30 a 180 dias, com mediana de 32.
Descrição de sintomas músculo‐esqueléticos de apresentação em uma série de casos de miosite aguda viral
| Sinais e sintomas | Número de casos com o sintoma descrito/número total de casos com o sintoma investigado | Frequência |
|---|---|---|
| Mialgia difusa | 9/35 | 26% |
| Dor na panturrilha | 28/35 | 80% |
| Limitação de deambulação | 20/35 | 57% |
| Anormalidade da marcha | 14/35 | 40% |
| Dor/Edema tornozelo | 1/35 | 3% |
| Fraqueza muscular localizada: | 25/35 | 71% |
| Em panturrilhas | 17/25 | 68% |
| Em coxas | 1/25 | 4% |
| Fraqueza muscular generalizada | 6/25 | 24% |
O tratamento sintomático das manifestações respiratórias e músculo‐esqueléticas incluiu analgésicos ou anti‐inflamatórios. A duração de uso de sintomáticos variou de dois a 45 dias, com mediana de dois e média de 16,3 ± 24,8. Antibióticos foram prescritos em casos complicados por faringo‐amigdalite ou sinusite. A duração do uso de antibióticos variou de cinco a 15 dias, com mediana de 10 e média de 10,6 ± 3,3.
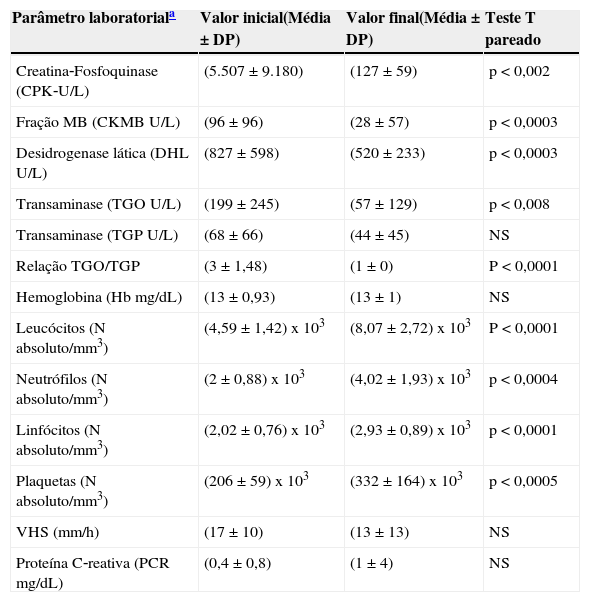
As alterações dos exames laboratoriais são descritas na tabela 2. O tempo de resolução até a normalização das enzimas musculares, bem como os parâmetros do hemograma, velocidade de hemossedimentação (VHS) e proteína C reativa (PCR), variou de 30 a 180 dias (mediana de 32).
Parâmetros laboratoriais de apresentação e seguimento da miosite aguda viral
| Parâmetro laboratoriala | Valor inicial(Média ± DP) | Valor final(Média ± DP) | Teste T pareado |
|---|---|---|---|
| Creatina‐Fosfoquinase (CPK‐U/L) | (5.507 ± 9.180) | (127 ± 59) | p < 0,002 |
| Fração MB (CKMB U/L) | (96 ± 96) | (28 ± 57) | p < 0,0003 |
| Desidrogenase lática (DHL U/L) | (827 ± 598) | (520 ± 233) | p < 0,0003 |
| Transaminase (TGO U/L) | (199 ± 245) | (57 ± 129) | p < 0,008 |
| Transaminase (TGP U/L) | (68 ± 66) | (44 ± 45) | NS |
| Relação TGO/TGP | (3 ± 1,48) | (1 ± 0) | P < 0,0001 |
| Hemoglobina (Hb mg/dL) | (13 ± 0,93) | (13 ± 1) | NS |
| Leucócitos (N absoluto/mm3) | (4,59 ± 1,42) x 103 | (8,07 ± 2,72) x 103 | P < 0,0001 |
| Neutrófilos (N absoluto/mm3) | (2 ± 0,88) x 103 | (4,02 ± 1,93) x 103 | p < 0,0004 |
| Linfócitos (N absoluto/mm3) | (2,02 ± 0,76) x 103 | (2,93 ± 0,89) x 103 | p < 0,0001 |
| Plaquetas (N absoluto/mm3) | (206 ± 59) x 103 | (332 ± 164) x 103 | p < 0,0005 |
| VHS (mm/h) | (17 ± 10) | (13 ± 13) | NS |
| Proteína C‐reativa (PCR mg/dL) | (0,4 ± 0,8) | (1 ± 4) | NS |
NS, não significativo.
Foram indicados apenas três (9%) exames de urina, com resultado anormal em um dos exames, que revelou proteinúria 2 +, mas nenhum indicou mioglobinúria. Foram feitos exames de sorologia, incluindo toxoplasmose IgM +/mononucleose negativa/citomegalovírus IgG+ em um único caso. Nesse caso, o diagnóstico inicial foi dor em membros inespecífica. Não foram indicados exame de imagem ou eletromiografia.
A normalização dos parâmetros laboratoriais, das enzimas musculares (CPK, CK‐MB, DHL, TGO e TGP) e o decréscimo dos valores da relação TGO/TGP são apresentados na tabela 2. Houve diferença significativa pelo teste T pareado, que comparou valores iniciais e de resolução para a CPK (p < 0,002), CK‐MB (p < 0,0003), DHL (p < 0,006) e TGO (p < 0,008), relação TGO/TGP (p < 0,0001), mas a diferença não foi significativa para TGP.
A normalização dos parâmetros de hemograma e as provas de fase aguda, apresentadas na tabela 2, indicaram igualmente diferença estatística entre os parâmetros iniciais e de resolução para a contagem absoluta de leucócitos (p < 0,0001), neutrófilos (p < 0,0004), linfócitos (p < 0,0001) e plaquetas (p < 0,005), mas não foi significativa a diferença entre os valores iniciais e de resolução para hemoglobina, proteína C reativa e velocidade de hemossedimentação.
O intervalo de tempo entre as determinações de apresentação e a resolução foi variável (67 ± 78 dias). Houve recorrência em um único caso, com dois episódios distintos. O primeiro ocorreu aos 8,3 anos e o segundo aos 9,1 anos. Apenas o primeiro episódio foi considerado na análise. O diagnóstico inicial foi de miosite aguda viral em ambos. As características clínicas do primeiro e do segundo episódios foram mialgia, dor nas panturrilhas, limitação à deambulação, anormalidade na marcha e fraqueza muscular localizada nos membros inferiores. A duração dos sintomas foi de três dias no primeiro episódio e de cinco dias no segundo. O perfil laboratorial foi semelhante, comparando‐se o primeiro e o segundo episódio, ambos precedidos por sintomas respiratórios.
Nessa série, o tempo de resolução dos sintomas músculo‐esqueléticos variou de um a 16 dias. Ocorreram outras manifestações registradas em 20% dos casos, incluindo os diagnósticos de sinusite, pneumonia e sinovite transitória do quadril. Os principais diagnósticos diferenciais e de exclusão registrados no pronto atendimento mediante a limitação de mobilidade foram: sinovite inespecífica, sinovite de quadril, síndrome de Guillain‐Barré, doença neuromuscular primária e dermatomiosite.
DiscussãoNesta série, observou‐se uma maior número de casos de miosite aguda viral entre 2004 e 2006. A distribuição anual foi nos meses frios, sem outra explicação aparente. Houve predomínio no gênero masculino 3:1 e atendimento em setor de emergência na maioria, o que denota o seu impacto na saúde da criança. O reconhecimento de sintomas respiratórios associados com sintomas músculo‐esqueléticos levou à suspeita confirmada pela elevação marcante de enzimas musculares, principalmente da CPK, além de outras enzimas musculares, como DHL e TGO. Contudo, a aldolase, outra enzima com especificidade para inflamação muscular, não estava disponível.
Além dos sintomas respiratórios precedentes que indicaram reação hematológica comum às infecções virais, com tendência à leucopenia transitória, e alterações inespecíficas e discretas da reação de fase aguda, a suspeita diagnóstica confirmou‐se mediante sintomatologia músculo‐esquelética autolimitada, por determinação seriada das enzimas musculares, em casos de dor nas panturrilha e recusa para andar ou alteração da marcha, em associação com sintomas de influenza.
O vírus influenza, bem como outros vírus respiratórios, pode causar uma doença febril aguda e autolimitada e ocorrer em surtos, frequentemente no inverno. Uma variedade de complicações associadas é reconhecida, incluindo‐se as respiratórias, como pneumonia viral primária com ou sem infecção bacteriana secundária, laringite, bronquite e bronquiolite. As complicações não respiratórias, como miosite, miocardite, meningite asséptica e encefalite, ocorrem com menor frequência.12
A frequência de miosite aguda viral é proporcionalmente mais elevada na influenza do tipo B e os meninos são mais acometidos.5 A miosite também pode ser causada por infecções bacterianas, fúngicas e parasitárias.13 Outras doenças infecciosas podem associar‐se com mialgias, com ou sem miosite, incluindo, além da influenza, dengue, ricketsioses, endocardite infecciosa, toxoplasmose, doença de Lyme e a infecção pelo vírus HIV. A etiologia bacteriana por agentes piogênicos é denominada piomiosite, que pode ter uma evolução aguda e mais grave, mas o acometimento é localizado em determinados grupos musculares em crianças em idade escolar, visivelmente relacionada ao trauma mecânico desses grupos musculares, como o quadríceps femoral e glúteos.
Entre as infecções parasitárias, cisticercose, esquistossomose e a triquinose podem causar sintomas como mialgias e febre, acompanhadas por eosinofilia. O diagnóstico do acometimento muscular nesses casos é mais comumente feito pela identificação de cistos calcificados em radiografias e da pseudo‐hipertrofia dos músculos das coxas e da panturrilhas, em formas disseminadas.
O diagnóstico ideal da miosite aguda viral seria pela identificação viral, por meio de sorologia ou biópsia mediante o quadro músculo‐esquelético inespecífico. Outras investigações, como a eletromiografia, têm como fator limitante a invasibilidade da técnica e a relação de custo‐benefício, na prática. A despeito da não identificação por sorologia6,7 na prática, há estudos que identificaram o vírus influenza em tecidos musculares de pacientes afetados por miosite aguda viral. Mas os seus mecanismos etiopatogênicos ainda são desconhecidos. Há hipótese de dano muscular por mecanismo imunológico ou por invasão de tecidos musculares por partículas virais, que causa dano às fibras musculares. Há evidências de partículas virais isoladas em biópsias de músculos da panturrilha, com alterações degenerativas não específicas e mionecrose.13 Entre as complicações, a rabdomiólise, embora rara, pode resultar em dano renal secundário à mioglobinúria.14
A miosite aguda viral associada à influenza pandêmica H1N1 foi descrita em crianças e adultos.15,16 Em um dos casos houve acometimento de músculos orbitários, o que caracteriza uma forma rara de miosite orbitária15 em lactente. A recente pandemia, assim como todos os ciclos históricos da influenza epidêmica e sazonal, indicou os benefícios da vacinação em massa.
O presente estudo foi feito em um período no qual a vacinação para influenza sazonal tinha cobertura limitada na rede pública e a documentação de vacinação específica neste série não foi discriminada. A associação entre o status imunológico por vacinação contra influenza e o risco de miosite aguda viral é desconhecida. Embora os pacientes que receberam a vacina para a influenza sazonal pudessem assumidamente ter menor risco de complicações respiratórias (ex. pneumonia, otite média), não há demonstração clara de redução das outras complicações secundárias.
Há que se considerar entre as limitações deste estudo a descrição de uma série pequena, atendida dentro dos limites de um hospital, e o delineamento retrospectivo. Idealmente, os estudos populacionais prospectivos proveriam a melhor descrição da incidência de miosite aguda viral.5 A relação com a identificação dos vírus respiratórios não foi possível.17,18 A despeito dessas limitações, os resultados apontam para algumas recomendações, como a avaliação sistemática de crianças com mialgia nos membros inferiores, na vigência de quadro respiratório, e o acompanhamento com a determinação seriada das enzimas musculares, sobretudo da CPK, concordantes com observações recentes.19
A maioria das crianças com miosite aguda viral é vista nos setores de emergência,20,21 pois os sintomas podem ser alarmantes para os pais e há tendência de consultas múltiplas em diversas especialidades e investigações dispendiosas.4,11,22 O pediatra no setor de emergência deve sentir‐se confortável para dispensar o paciente, fazer o diagnóstico diferencial com doenças neuromusculares e verificar o acompanhamento ambulatorial para revisão dos sintomas e a determinação das enzimas musculares até a normalização durante o seguimento.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
AgradecimentosCoordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes), Programa de Pós‐Graduação em Saúde Coletiva, Faculdade de Medicina de Botucatu, Universidade Estadual Paulista (Unesp).
Como citar este artigo: Cardin SP, Martin JG, Saad‐Magalhães C. Clinical and laboratory description of a series of cases of acute viral myositis. J Pediatr (Rio J). 2015;91:442–7.
Estudo conduzido no Departamento de Pediatria, Faculdade de Medicina de Botucatu, Universidade Estadual Paulista (Unesp), Botucatu, SP, Brasil