to evaluate changes in the biochemical profile of children treated or being treated for moderate or severe stunting in a nutrition recovery and education center.
Methodsthis was a retrospective longitudinal study of 263 children treated at this center between August of 2008 to August of 2011, aged 1 to 6 years, diagnosed with moderate (z‐score of height‐for‐age [HAZ]<−2) or severe stunting (HAZ<−3). Data were collected on socioeconomic conditions, dietary habits, and biochemical changes, as well as height according to age.
Resultsthe nutritional intervention showed an increase in HAZ of children with moderate (0.51±0.4, p=0.001) and severe (0.91±0.7, p=0.001) stunting during the monitoring. Increased levels of insulin‐like growth factor 1 (IGF‐1) (initial: 71.7 ng/dL; final: 90.4ng/dL; p=0.01) were also observed, as well as a reduction in triglycerides (TG) in both severely (initial: 91.8mg/dL; final: 79.1mg/dL; p=0.01) and in moderately malnourished children (initial: 109.2mg/dL; final 88.7mg/dL; p=0.01), and a significant increase in high‐density lipoprotein cholesterol HDL‐C only in the third year of intervention (initial: 31.4mg/dL; final: 42.2mg/dL). The values of total cholesterol (TC) and low‐density lipoprotein cholesterol (LDL‐C) levels remained high throughout the treatment (initial: 165.1mg/dL; final: 163.5mg/dL and initial: 109.0mg/dL; final: 107.3mg/dL, respectively).
Conclusionthe nutritional treatment for children with short stature was effective in reducing stunting and improving TG and HDL‐C after three years of intervention. However, the levels of LDL‐C and TC remained high even in treated children. It is therefore speculated that these changes may result from metabolic programming due to malnutrition.
avaliar as mudanças no perfil bioquímico de crianças tratadas ou em tratamento para déficit estatural moderado ou grave em um centro de recuperação e educação nutricional.
Métodosestudo longitudinal retrospectivo com 263 crianças semi‐internas no Centro no período de agosto/2008 a agosto/2011, com idade entre 1 e 6 anos e diagnóstico de déficit estatural moderado, escore‐Z da altura‐para‐idade (AIZ) <−2 e grave (AIZ<−3). Foram coletados dados socioeconômicos, dietéticos e bioquímicos e a evolução estatural segundo a idade.
Resultadoscom a intervenção nutricional observou‐se incremento no escore‐z das crianças com déficit estatural moderado (0,51±0,4; p=0,001) e grave (0,91±0,7; p=0,001) durante o período de acompanhamento. Observou‐se, ainda, aumento nos níveis de fator de crescimento insulina‐símile (IGF‐1) (inicial: 71,7 ng/dL; final: 90,4 ng/dL; p=0,01), redução nos triglicérides (TG) tanto nas crianças graves (inicial: 91,8mg/dL; final: 79,1mg/dL; p=0,01) como nas moderadamente desnutridas (109,2mg/dL para 88,7mg/dL; p=0,01) e aumento significativo do lipoproteína de alta densidade (HDL‐C) apenas no terceiro ano de intervenção (inicial: 31,4mg/dL; final: 42,2mg/dL). Os valores de colesterol total (CT) e lipoproteína de baixa densidade (LDL‐C) continuaram elevados durante todo o tratamento (inicial: 165,1mg/dL; final: 163,5mg/dL e inicial: 109,0mg/dL; final: 107,3mg/dL, respectivamente).
Conclusãoo tratamento nutricional para as crianças de baixa estatura mostrou‐se eficaz na redução do déficit estatural e dos TG e melhora dos níveis de HDL‐C após três anos de intervenção. Porém, os níveis de LDL‐C e CT mostraram‐se sempre elevados mesmo nas crianças tratadas. Questiona‐se, pois, se essas alterações seriam resultantes da programação metabólica a desnutrição.
A hiperlipidemia na infância e na adolescência vem sendo considerada um dos principais fatores para a ocorrência do processo aterosclerótico em longo prazo.1 Estudos revelam que a aterogênese pode se iniciar nas fases precoces da vida, sendo constatada a presença de lesões como infiltrações de lípides e de proteoglicanos na camada íntima dos vasos, já no primeiro ano de vida da criança.2
Apesar de a dislipidemia estar frequentemente associada à obesidade,3 pesquisas recentes têm observado que a desnutrição intrauterina e/ou no início da vida pode predispor o feto a desordens metabólicas, levando também a alterações no perfil lipídico ainda na infância.4,5
Nesse contexto, estudos têm demonstrado associação negativa entre o baixo peso ao nascer e o perfil lipídico de adultos.6–8 Indivíduos com baixa estatura, manifestação crônica da desnutrição sofrida durante o período de crescimento, apresentam valores séricos mais elevados de colesterol total, lipoproteína de baixa densidade (LDL‐colesterol) e triglicérides do que adultos com estatura normal.7,9
Como possível explicação para esses achados, supõe‐se que crianças desnutridas tendem a apresentar níveis elevados de hormônio do crescimento no plasma (GH) e níveis reduzidos de fator de crescimento insulina‐símile (IGF‐1), sendo essa a principal causa da redução do crescimento.10
Dessa forma, a fim de se manter o funcionamento dos órgãos vitais, ocorrem adaptações metabólicas, como o aumento dos níveis séricos de cortisol, o qual promove o catabolismo proteico e aumento do quociente respiratório. Esses fatores levam a uma menor oxidação lipídica e consequente acúmulo de gordura no fígado.11,12
A tudo isso soma‐se o fato de que o crescimento retardado do fígado no último trimestre da gestação pode levar a mudanças permanentes no metabolismo lipídico, seja pela diminuição de receptores hepáticos ativos e/ou inatividade dos mesmos ou ainda pela produção excessiva de VLDL‐C e LDL‐C e/ou defeitos na expressão da enzima lipase lipoproteica (LPL), podendo também ocorrer uma alteração no número de hepatócitos nas áreas periportal e perivenosa de crianças nascidas com baixo peso.13,14
Apesar de escassos, os dados acerca das alterações no perfil lipídico na desnutrição crônica, apontados em estudo envolvendo crianças nordestinas com déficit estatural moderado/grave atendidas em um centro para recuperação nutricional, mostraram que a maioria delas (98,9%) tinha alguma alteração no perfil lipídico e que os baixos níveis de HDL‐colesterol estavam inversamente associados à gravidade da desnutrição.15
Os centros de recuperação e educação nutricional (CREN) são programas ligados às universidades que contam com ações integradas que valorizam as iniciativas locais bem‐sucedidas, respeitando culturas regionais, realizando a busca ativa dos casos de desnutrição na comunidade e, principalmente, aproveitando o patrimônio de cada pessoa, família e comunidade.16 No CREN, as crianças recebem assistência pedagógica continuada, cinco refeições equilibradas, além cuidados diários de saúde e combate às infecções.17
Nessa perspectiva, o presente estudo teve por objetivo avaliar a evolução do perfil bioquímico de crianças tratadas ou em tratamento para déficit estatural moderado ou grave no CREN na cidade de Maceió‐AL, Nordeste do Brasil. É importante, ainda, salientar que nas principais bases de dados de pesquisas não foram encontradas publicações que apontassem a recuperação do perfil lipídico em crianças submetidas à desnutrição crônica. Estudos dessa natureza são importantes, pois permitem identificar as alterações que ocorrem na desnutrição e as que podem ser recuperadas com o tratamento nutricional. Além disso, servem de subsídios para o planejamento de políticas públicas que visem contribuir para a redução da prevalência da desnutrição infantil e suas consequências em longo prazo.
MétodosPopulação do estudoEstudo longitudinal retrospectivo, no qual foram analisados dados de crianças desnutridas submetidas a tratamento no CREN no período de agosto/2008 a agosto/2011. Das 302 crianças que frequentavam o Centro, foram selecionadas 263 com idades variando entre um e seis anos, com diagnóstico de desnutrição moderada, definida por escore‐z da altura‐para‐idade (AIZ)<–2 e grave (AIZ<–3) e que apresentavam registro de pelo menos duas mensurações dos lípides séricos.
As informações referentes às condições socioambientais das famílias, tais como o tipo de moradia, o número de cômodos, o revestimento de piso, o destino do lixo, o número de moradores por domicílio e a renda, foram também coletadas dos prontuários das crianças, bem como os dados bioquímicos, os dietéticos e os antropométricos.
AntropometriaA avaliação antropométrica foi realizada mensalmente no Centro por nutricionistas treinados. Os menores de 24 meses foram pesados em balança antropométrica com capacidade máxima de 15kg e precisão de 5g (Filizola, BP Baby, Campo Grande, Brasil), e para os maiores de dois anos o peso foi aferido em balança antropométrica com capacidade máxima de 150kg e precisão de 100g (Filizola, Personal, Campo Grande, Brasil), todas previamente calibradas. Para a verificação do comprimento dos menores de dois anos, utilizou‐se infantômetro dotado de fita métrica inextensível com 105cm de comprimento e 0,1cm de precisão. A estatura das crianças com idade igual ou acima de 24 meses foi obtida usando um estadiômetro vertical (campo de medição de 0 a 200cm, precisão de 1mm, Wiso, PR, Brasil) fixado na parede, registrando a medida aproximada de 0,1cm.18 O estado nutricional das crianças foi avaliado através do WHO Anthro‐software (versão 3.0.1, 2007) e classificado de acordo com as recomendações preconizadas pela OMS.19 O diagnóstico do déficit estatural foi definido por escore‐z da altura‐para‐idade (AIZ) <–2 para grau moderado e grave (AIZ <–3).
Dados bioquímicosEm relação ao perfil bioquímico, as coletas de sangue foram obtidas na própria instituição com as crianças em jejum de 12 horas, via punção venosa, e alocadas em frascos adequados para separação de soro ou plasma.
Os exames foram realizados por laboratório de análises clínicas credenciado. As concentrações de colesterol total, triglicerídeos e HDL‐colesterol foram determinadas através do método calorimétrico enzimático e os valores de LDL‐colesterol foram calculados a partir de procedimento padronizado.20 Foram utilizados para avaliação e a classificação do perfil lipídico os valores preconizados pela Sociedade Brasileira de Cardiologia para crianças e adolescentes:21 (a) CT desejável até 150mg/dL, limítrofe entre 150 e 169mg/dL e aumentado a partir de 170mg/dL; (b) LDL desejável até 100mg/dL, limítrofe entre 100 e 129mg/dL e aumentado a partir de 130mg/dL; (c) HDL desejável a partir de 45mg/dL e (d) triglicérides desejável até 100mg/dL, limítrofe entre 100 e 129mg/dL e aumentado a partir de 130mg/dL. O IGF‐1 foi determinado utilizando o ensaio da quimioluminescência, em que as crianças foram classificadas de acordo com o valor de referência indicado pelo Diagnostic System Laboratory, variando de acordo com a idade.22
Para a análise das variáveis bioquímicas foram utilizadas duas dosagens séricas referentes ao momento da admissão e a última dosagem laboratorial, cujo intervalo entre elas pôde variar de um a três anos, dependendo do tempo de tratamento em andamento ou do período entre a admissão e a alta. Ou seja, as dosagens utilizadas para a análise foram a da admissão e a última dosagem do primeiro ano de intervenção para as crianças que ficaram um (1) ano no Centro, a da admissão e a última dosagem do segundo ano para as que permaneceram por dois (2) anos, e as da admissão e após três (3) anos de acompanhamento para as crianças que ficaram esse período no Centro. Para as crianças tratadas foram avaliadas as dosagens da admissão e aquelas referentes à alta do tratamento.
Dados dietéticosAs crianças permaneceram na instituição de segunda à sexta, das 8 às 17 horas, e receberam cinco refeições/dia. A dieta ofertada atingiu 100% das recomendações nutricionais diárias de macro e micronutrientes de acordo com as DRIs (Ingestões Dietéticas de Referência)23, segundo a faixa etária e adaptada às necessidades para recuperação nutricional de crianças desnutridas aproximadamente 90‐100 Kcal/Kg de peso, 3,0 a 3,5g de proteína/Kg peso, 12,15g/kg para hidratos de carbono e 3 a 4g de lipídeos/kg peso24.
Análise estatísticaOs resultados foram avaliados segundo os pressupostos paramétricos de normalidade (teste de Lilliefors) e homogeneidade das variâncias dos resíduos (teste de Levene). Todas as variáveis analisadas neste estudo apresentaram seus resíduos com distribuição normal padronizada e homocedásticos, sendo, então, realizadas as estatísticas‐teste denominadas t‐Student (para amostras independentes; tabela 1) e t‐pareado (para amostras relacionadas; tabelas 2 e 3), para verificar a existência, ou não, de diferença significativa (p<0,05). Adotou‐se α=5% para a probabilidade de erro experimental ao acaso.
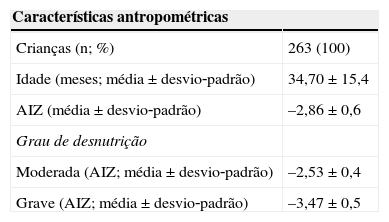
Características antropométricas e socioeconômicas de crianças atendidas no Centro de Recuperação e Educação Nutricional – CREN (Maceió‐Alagoas) no momento da admissão (2008)
| Características antropométricas | |
|---|---|
| Crianças (n; %) | 263 (100) |
| Idade (meses; média±desvio‐padrão) | 34,70±15,4 |
| AIZ (média±desvio‐padrão) | –2,86±0,6 |
| Grau de desnutrição | |
| Moderada (AIZ; média±desvio‐padrão) | –2,53±0,4 |
| Grave (AIZ; média±desvio‐padrão) | –3,47±0,5 |
| Características socioeconômicas | n | % | pa |
|---|---|---|---|
| Tipo de moradia | |||
| Alvenaria | 193 | 73,4 | |
| Outros | 70 | 26,6 | 0,175 |
| Número de cômodos | |||
| 1‐3 | 162 | 61,6 | |
| 4‐6 | 101 | 38,4 | 0,751 |
| Revestimento de piso | |||
| Sim | 84 | 31,9 | |
| Não | 179 | 68,1 | 0,195 |
| Renda familiar | |||
| ≤ 1 salário mínimo | 203 | 77,2 | |
| >1 salário mínimo | 60 | 22,8 | 0,503 |
| Escolaridade | |||
| ≤ 4 anos de estudo | 202 | 77 | 0,216 |
| >4 anos de estudo | 61 | 23 | |
AIZ, escore‐z da altura‐para‐idade.
Este estudo foi aprovado pelo Comitê de Ética em Pesquisa da Universidade Federal de Alagoas (processo n° 009580/2007‐26) em conformidade com os princípios éticos contidos na Declaração de Helsinki, da Word Medical Association. O termo de consentimento livre e esclarecido foi obtido por pelos pais e/ou responsáveis legais das crianças participantes antes do início do estudo.
ResultadosConforme já observado na tabela 1, a amostra foi composta por 263 crianças, sendo 52,5% representados por meninos e 47,1% por meninas. A maioria (65,1%) foi diagnosticada com desnutrição moderada e 34,9% foram classificadas como desnutridas graves. Das crianças estudadas, 87 ficaram (1) um ano em tratamento, 62 por (2) dois anos, 61 por três (3) anos e 53 foram as tratadas, totalizando 263 crianças avaliadas.
No tocante às condições socioeconômicas, observou‐se que as famílias eram numerosas, com 77% delas ganhando menos que um salário mínimo mensal. As casas, na sua maioria, eram de alvenaria com até três cômodos, sem revestimento de piso e com água proveniente de poço artesanal.
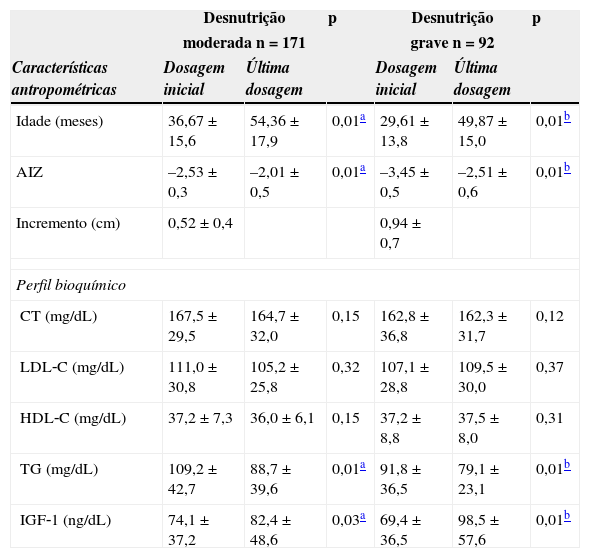
A tabela 2 apresenta a distribuição dos valores antropométricos e bioquímicos obtidos durante o tratamento. Verifica‐se que as crianças com desnutrição moderada permaneceram em acompanhamento por um período de um ano e seis meses, e as desnutridas graves, em média, por um ano e oito meses.
Média e desvio‐padrão de variáveis antropométricas e bioquímicas de crianças desnutridas atendidas no Centro de Recuperação e Educação Nutricional – CREN (Maceió‐Alagoas), entre os anos de 2008‐2011
| Desnutrição | p | Desnutrição | p | |||
|---|---|---|---|---|---|---|
| moderada n=171 | grave n=92 | |||||
| Características antropométricas | Dosagem inicial | Última dosagem | Dosagem inicial | Última dosagem | ||
| Idade (meses) | 36,67±15,6 | 54,36±17,9 | 0,01a | 29,61±13,8 | 49,87±15,0 | 0,01b |
| AIZ | –2,53±0,3 | –2,01±0,5 | 0,01a | –3,45±0,5 | –2,51±0,6 | 0,01b |
| Incremento (cm) | 0,52±0,4 | 0,94±0,7 | ||||
| Perfil bioquímico | ||||||
| CT (mg/dL) | 167,5±29,5 | 164,7±32,0 | 0,15 | 162,8±36,8 | 162,3±31,7 | 0,12 |
| LDL‐C (mg/dL) | 111,0±30,8 | 105,2±25,8 | 0,32 | 107,1±28,8 | 109,5±30,0 | 0,37 |
| HDL‐C (mg/dL) | 37,2±7,3 | 36,0±6,1 | 0,15 | 37,2±8,8 | 37,5±8,0 | 0,31 |
| TG (mg/dL) | 109,2±42,7 | 88,7±39,6 | 0,01a | 91,8±36,5 | 79,1±23,1 | 0,01b |
| IGF‐1 (ng/dL) | 74,1±37,2 | 82,4±48,6 | 0,03a | 69,4±36,5 | 98,5±57,6 | 0,01b |
AIZ, escore‐z da altura‐para‐idade; CT, colesterol total; LDL‐C, lipoproteína de baixa densidade; HDL‐C, lipoproteína de alta densidade; TG, triglicerídeos; IGF‐1, fator decrescimento insulina‐símile.
Com o tratamento, as crianças apresentaram aumento significativo nos níveis de IGF‐1, o que caracterizou ganho de estatura em ambos os grupos, sendo ele superior entre as crianças com déficit grave (incremento médio de 0,91±0,65; p<0,01), quando comparadas àquelas com déficit moderado (0,51±0,43).
Ainda na tabela 2, pode‐se constatar que houve diminuição nos valores séricos de TG, independentemente da gravidade da desnutrição. Em relação ao HDL‐C, observa‐se que a maioria das crianças apresentou concentrações baixas desse lípide no início e no final do tratamento. Entretanto, tanto as crianças desnutridas moderadas como as graves não apresentaram mudanças nos valores de colesterol total durante todo o tratamento, e esses valores permaneceram acima dos níveis séricos desejáveis (150mg/dL e 100mg/dL, respectivamente).
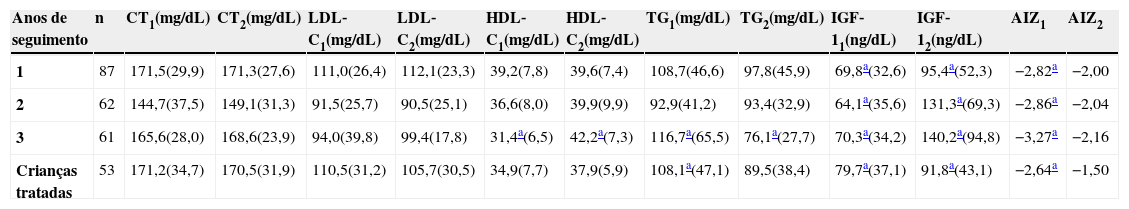
Na tabela 3 encontram‐se os parâmetros estudados segundo a duração da intervenção. Observa‐se que o maior incremento em escore‐z ocorreu após o terceiro ano de tratamento. Os níveis séricos de IGF‐1 foram mais que duas vezes superiores aos valores iniciais após dois anos de acompanhamento. A redução nos triglicérides ocorreu desde o primeiro ano de tratamento, entretanto foi somente significativa após três da intervenção, enquanto que o aumento nos níveis séricos de HDL‐C só foi observado após o terceiro ano de acompanhamento das crianças.
Perfil bioquímico e evolução do crescimento (média±desvio‐padrão) de crianças em tratamento e tratadas atendidas no Centro de Recuperação e Educação Nutricional – CREN (Maceió‐Alagoas), entre os anos de 2008‐2011
| Anos de seguimento | n | CT1(mg/dL) | CT2(mg/dL) | LDL‐C1(mg/dL) | LDL‐C2(mg/dL) | HDL‐C1(mg/dL) | HDL‐C2(mg/dL) | TG1(mg/dL) | TG2(mg/dL) | IGF‐11(ng/dL) | IGF‐12(ng/dL) | AIZ1 | AIZ2 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 87 | 171,5(29,9) | 171,3(27,6) | 111,0(26,4) | 112,1(23,3) | 39,2(7,8) | 39,6(7,4) | 108,7(46,6) | 97,8(45,9) | 69,8a(32,6) | 95,4a(52,3) | −2,82a | −2,00 |
| 2 | 62 | 144,7(37,5) | 149,1(31,3) | 91,5(25,7) | 90,5(25,1) | 36,6(8,0) | 39,9(9,9) | 92,9(41,2) | 93,4(32,9) | 64,1a(35,6) | 131,3a(69,3) | −2,86a | −2,04 |
| 3 | 61 | 165,6(28,0) | 168,6(23,9) | 94,0(39,8) | 99,4(17,8) | 31,4a(6,5) | 42,2a(7,3) | 116,7a(65,5) | 76,1a(27,7) | 70,3a(34,2) | 140,2a(94,8) | −3,27a | −2,16 |
| Crianças tratadas | 53 | 171,2(34,7) | 170,5(31,9) | 110,5(31,2) | 105,7(30,5) | 34,9(7,7) | 37,9(5,9) | 108,1a(47,1) | 89,5(38,4) | 79,7a(37,1) | 91,8a(43,1) | −2,64a | −1,50 |
CT, colesterol total; LDL‐C, lipoproteína de baixa densidade; HDL‐C, lipoproteína de alta densidade; TG, triglicerídeos; IGF‐1, fator de crescimento insulina‐símile; AIZ, escore‐z da altura‐para‐idade.
Ainda são demonstrados na tabela 3 os dados das crianças tratadas, isto é, aquelas com valor de AIZ ≥ ‐1,5. Verificou‐se nelas incremento de escore‐z de altura‐para‐idade superior à média nas crianças em tratamento (1,14 x 0,92, respectivamente). A redução dos triglicérides e o aumento do HDL‐C também foram observados; porém, verifica‐se que, mesmo nas crianças tratadas, os valores de CT e LDL‐C permaneceram alterados.
DiscussãoOs déficits estaturais verificados na desnutrição crônica são acompanhados da redução dos valores séricos de IGF‐1 como os apresentados no início do presente estudo, especialmente entre as crianças com déficit mais grave. Esses achados reforçam a hipótese de que o hormônio citado seja o principal fator para a redução do crescimento em crianças acometidas por tal agravo. Níveis reduzidos de IGF‐1 podem ser resultantes da diminuição dos sítios hepáticos de ligação do GH e da expressão gênica do IGF‐1, o que causaria aumento do GH plasmático e diminuição do IGF‐1, uma vez que as somatomedinas agem em nível de sistema nervoso central, diminuindo a síntese de GH.10Assim, como no presente estudo, pesquisadores têm demonstrado que um tratamento nutricional adequado pode reverter os déficits de IGF‐1 encontrados na desnutrição crônica e recuperar a estatura na infância, sugerindo o IGF‐1 como um forte indicador do estado nutricional.15,24
Além das alterações endócrinas, a elevada prevalência de dislipidemias nas crianças do presente estudo demonstrou que a desnutrição sofrida no início da vida acarreta modificações no metabolismo lipídico. tornando o perfil lipêmico mais aterogênico, conforme também demonstrado por outros autores.7,13,25,26 Neste sentido, a dislipidemia caracterizada pela predominância de níveis reduzidos de HDL‐C e valores elevados de triglicérides pode ser atribuída ao catabolismo acelerado do HDL‐C, mas não à produção diminuída de suas partículas.27
Por sua vez, a hipertrigliceridemia observada entre as crianças com déficit estatural moderado no início desse estudo pode ser entendida pelo fato de crianças desnutridas apresentarem uma massa corpórea diminuída, a qual leva a uma redução na quantidade de LPL, favorecendo um menor clearance de triglicérides circulantes.28 Com o tratamento, houve redução nos níveis séricos de triglicérides, independentemente do grau de desnutrição das crianças, indicando, provavelmente, uma normalização da expressão de LPL. Estudos envolvendo a infusão de emulsões artificiais verificaram que os pacientes deficientes nessa enzima apresentaram valores elevados de TG no sangue, sugerindo saturação da atividade da LPL.29,30
Porém, o déficit estatural parece ter efeitos permanentes no metabolismo do colesterol, resultante de uma diminuição do número e da atividade de receptores hepáticos ativos, os quais regulam a síntese do mesmo.4,5,13 Isto pôde ser evidenciando no presente estudo, uma vez que os valores séricos de CT e LDL‐C das crianças avaliadas mantiveram‐se elevados e acima dos níveis desejáveis (150mg/dL e 100mg/dL, respectivamente) durante todo o tempo de tratamento, inclusive naquelas que recuperaram o estado nutricional (AIZ ≤ ‐1,5).21 Nesse sentido, estudos envolvendo adolescentes com déficit estatural têm revelado que a redução na taxa metabólica de repouso compensada pelo aumento do quociente respiratório e consequente diminuição da oxidação de lipídeos favorece o acúmulo de gordura visceral,30 justificando em parte o perfil lipêmico aterogênico observado nas crianças desnutridas. Supõe‐se, ainda, que pode haver queda nos níveis circulantes de T3 livre em crianças desnutridas, devido à diminuição de proteínas carreadoras (pré‐albumina e albumina), além da diminuição no nível periférico da atividade da enzima que converte T4 em T3 (5‐desiodinase). Essa situação favorece, durante o crescimento, a neoglicogênese e a liberação de ácidos graxos do tecido adiposo e inibe as ações do hormônio do crescimento (GH) dependentes de somatomedina‐c (IGF‐1), cujas alterações poderiam, pelo menos em parte, justificar as elevadas concentrações de CT e de LDL‐C observadas nas crianças do presente estudo.12,27
Por outro lado, estudos recentes com crianças submetidas a tratamento sistematizado em centros de referência em desnutrição no país demonstraram que, além da recuperação em peso e estatura, a composição corporal, o metabolismo de insulina e a glicose se normalizaram dois a três anos após a alta.16,17
Neste estudo, fica também evidente que o tratamento ofertado às crianças desnutridas no CREN foi eficaz no incremento do escore‐z nas crianças em tratamento e na recuperação dos déficits estaturais nas crianças que tiveram alta. Porém, supõe‐se que as alterações funcionais ocorridas no início da vida provocaram alterações no metabolismo de colesterol total e LDL‐C, de modo que, mesmo durante e após o tratamento, os níveis séricos dessas frações lipídicas continuaram acima dos desejáveis. Isso sugere que o tratamento nutricional de desnutridos pode diminuir o risco de desenvolvimento de doenças crônicas na vida adulta, mas não revertê‐los completamente.
Porém, cabe destacar que o desenho do presente estudo apresentou limitações, como a falta de informações sistematizadas das dosagens bioquímicas e o fato de as crianças estarem em diferentes estágios de tratamento.
Nessa perspectiva, novos estudos são necessários para melhor explicar as alterações nos níveis lipêmicos, mesmo após o tratamento da desnutrição. Serão essas alterações resultantes da programação metabólica ocorrida no início da vida?
FinanciamentoA investigação foi realizada com o auxílio financeiro do Conselho Nacional de Desenvolvimento Científico e Tecnológico – CNPq (processo n° 402673/2007‐7). J. F. R. Alves recebeu bolsa de mestrado da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior – CAPES/CNPq.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Os autores agradecem à Direção do CREN/AL pela autorização para a realização do estudo, bem como às nutricionistas Gabriela Stux Veiga, Renata Antunes e Myria Viana pelo apoio na coleta dos dados; à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES); ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pela concessão de bolsa de estudo e auxílio financeiro à pesquisa (processo n° 402673/2007‐7); e ao Prof° Cyro Cabral Rêgo Junior pelas análises estatísticas realizadas durante o Mestrado.
Os autores gostariam, ainda, de assumir inteira responsabilidade pela veracidade das informações prestadas, em nome de todos os coautores e das instituições envolvidas, assim como afirmam não haver conflito de interesses, nem quaisquer problemas de natureza ética.
Artigo baseado na dissertação de mestrado da Jullyana FR Alves, apresentado em 2012 na Escola de Nutrição, Universidade de Alagoas.
Como citar este artigo: Alves JF, Britto RP, Ferreira HS, Sawaya AL, Florêncio TM. Evolution of the biochemical profile of children treated or undergoing treatment for moderate or severe stunting: consequences of metabolic programming? J Pediatr (Rio J). 2014;90:356–62.