to investigate the rate of positivity for immunoglobulin M anti‐Toxoplasma gondii (Toxo‐IgM) in newborns with congenital toxoplasmosis, and the age when these antibodies become negative.
Methodspatients with congenital toxoplasmosis who started monitoring in a congenital infection clinic between 1998 and 2009 were included. Inclusion criteria were routine maternal or neonatal serological screening; diagnostic confirmation by persistence of immunoglobulin G anti‐Toxoplasma gondii at age ≥ 12 months, and Toxo‐IgM screening in the neonatal period. To calculate the frequency of positive Toxo‐IgM, cases detected by neonatal screening were excluded. For the study of the age when Toxo‐IgM results became negative, patients with negative Toxo‐IgM since birth and those in whom it was not possible to identify the month when the negative result was achieved were excluded.
Resultsamong the 28 patients identified through maternal screening, 23 newborns had positive Toxo‐IgM (82.1%, 95% CI: 64.7‐93.1%). When adding the 37 patients identified by neonatal screening, Toxo‐IgM was positive in the first month of life in 60 patients, and it was possible to identify when the result became negative in 51 of them. In 19.6% of patients, these antibodies were already negative at 30 days of life; and in 54.9%, at 90 days. Among the 65 patients included in the study, 40 (61.5%) had some clinical alteration.
Conclusionseven with high sensitivity methods, newborns with congenital toxoplasmosis can have negative Toxo‐IgM at birth. In those who have these antibodies, the positive period may be quite short. It is important not to interrupt the monitoring of infants with suspected congenital toxoplasmosis simply because they present a negative Toxo‐IgM result.
investigar a taxa de positividade para imunoglobulina M anti‐Toxoplasma gondii (Toxo‐IgM) em recém‐nascidos com toxoplasmose congênita, e a idade de negativação desses anticorpos.
Métodosforam incluídos pacientes com toxoplasmose congênita que iniciaram acompanhamento em uma clínica de infecções congênitas entre 1998 e 2009. Os critérios de inclusão foram toxoplasmose congênita detectada por triagem sorológica materna ou neonatal de rotina, confirmação diagnóstica por persistência de imunoglobulina G anti‐Toxoplasma gondii com ≥12 meses e pesquisa de Toxo‐IgM no período neonatal. Para o cálculo da frequência de positividade da Toxo‐IgM foram excluídos os detectados por triagem neonatal. Para o estudo da época de negativação da Toxo‐IgM foram excluídos os pacientes com Toxo‐IgM negativa desde o nascimento e aqueles em que não foi possível identificar o mês da negativação.
Resultadosentre 28 pacientes detectados por triagem materna, 23 recém‐nascidos tiveram Toxo‐IgM positiva (82,1%, IC 95%: 64,7‐93,1%). Somando‐se os 37 pacientes detectados por triagem neonatal, a Toxo‐IgM foi positiva no primeiro mês de vida em 60 pacientes e em 51 foi possível identificar a época de negativação. Em 19,6% dos pacientes esses anticorpos já eram negativos aos 30 dias e em 54,9% aos 90 dias. Entre os 65 pacientes incluídos no estudo, 40 (61,5%) apresentaram alguma alteração clínica.
Conclusõesmesmo com métodos de alta sensibilidade, recém‐nascidos com toxoplasmose congênita podem ter Toxo‐IgM negativa ao nascer. Nos que apresentam esses anticorpos, o período de positividade pode ser bastante fugaz. É importante não interromper o monitoramento dos lactentes com suspeita de toxoplasmose congênita por apresentarem Toxo‐IgM negativa.
A suspeita de toxoplasmose congênita pode surgir em várias situações: a) evidências clínicas ou laboratoriais de toxoplasmose adquirida pela mãe durante a gestação; b) anormalidades ecográficas fetais; c) manifestações clínicas na criança; e d) triagem neonatal, que consiste na pesquisa rotineira de imunoglobulina (Ig) M anti‐Toxoplasma gondii (Toxo‐IgM) no sangue capilar. Em qualquer dessas situações, a confirmação diagnóstica requer uma série de exames clínicos e laboratoriais.1,2
O tratamento da toxoplasmose congênita é indicado mesmo nos casos subclínicos, nos quais o diagnóstico é laboratorial, consistindo principalmente na pesquisa de IgG anti‐T. gondii (Toxo‐IgG) e de Toxo‐IgM no soro. Embora existam outros testes sorológicos que podem colaborar para o diagnóstico, como pesquisa de IgA e IgE específicas e Western Blot IgG/IgM para pares mãe/filho, a Toxo‐IgG e a Toxo‐IgM são as mais utilizadas, e frequentemente são os únicos testes disponíveis, principalmente no Brasil.1–6
Como a IgM não atravessa a barreira placentária, a presença de Toxo‐IgM no soro do recém‐nascido indica a infecção congênita. Por outro lado, sabe‐se que recém‐nascidos com toxoplasmose congênita podem apresentar Toxo‐IgM negativa, embora a frequência desse achado seja controversa.7–14 Informações sobre a prevalência de positividade para Toxo‐IgM no recém‐nascido, assim como sobre a idade em que a mesma costuma tornar‐se negativa nos lactentes com toxoplasmose congênita, são essenciais quando se procura confirmar uma suspeita diagnóstica.
Este estudo teve como principal objetivo demonstrar a dinâmica da Toxo‐IgM em recém‐nascidos e lactentes com toxoplasmose congênita confirmada. Buscou‐se, em primeiro lugar, investigar com que frequência esses anticorpos são detectados no recém‐nascido; em segundo lugar, buscou‐se verificar, nos casos com Toxo‐IgM positiva, com que idade ela se tornou negativa. Foram também investigadas possíveis associações dos aspectos sorológicos com algumas variáveis clínicas.
MétodosEste estudo de coorte incluiu crianças que iniciaram acompanhamento entre janeiro de 1998 e dezembro de 2009 no Ambulatório de Infecções Congênitas do Hospital São Lucas da PUCRS, em Porto Alegre, Rio Grande do Sul. O projeto foi aprovado pelo Comitê de Ética em Pesquisa da Pontifícia Universidade Católica do Rio Grande do Sul e foram obtidos consentimentos informados dos pais ou responsáveis.
Os critérios de inclusão foram: 1) toxoplasmose congênita confirmada por Toxo‐IgG positiva até pelo menos 12 meses de idade; 2) suspeita por triagem sorológica de rotina (materna ou neonatal); e 3) pesquisa de Toxo‐IgM desde o primeiro mês de vida.
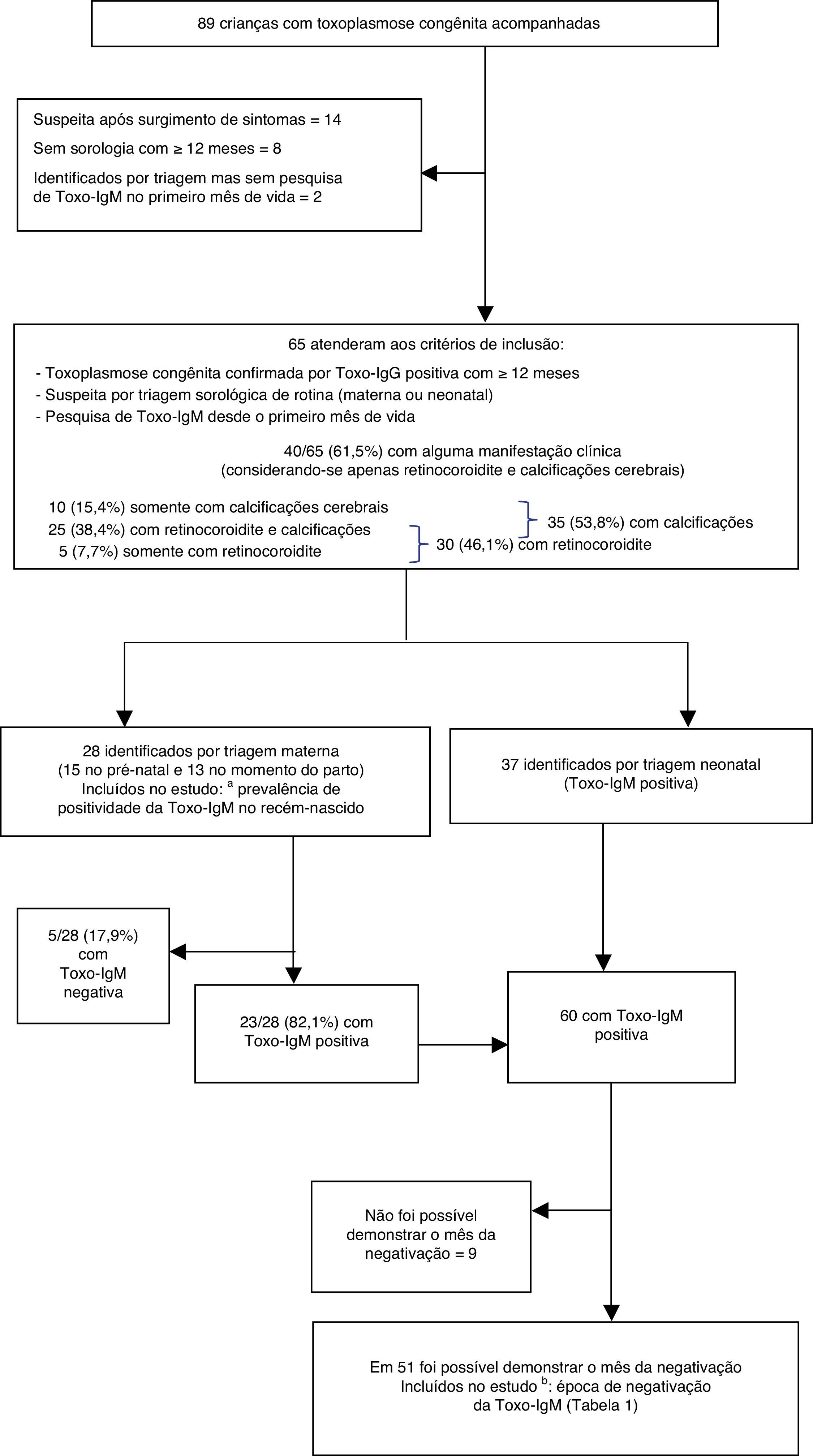
Os critérios de exclusão foram determinados de acordo com os dois objetivos específicos do estudo. Para calcular a taxa de positividade da Toxo‐IgM no recém‐nascido, excluíram‐se os pacientes identificados por triagem neonatal (os quais, obrigatoriamente, apresentavam Toxo‐IgM positiva). Para demonstrar a época de negativação da Toxo‐IgM, foram excluídos os pacientes que nunca apresentaram Toxo‐IgM positiva e aqueles em que não foi possível identificar o mês de negativação (por haver um intervalo muito grande entre o último teste positivo e o primeiro negativo) (fig. 1). Considerou‐se como mês da negativação da Toxo‐IgM aquele em que ocorreu o primeiro teste negativo, desde que o intervalo para o último positivo não fosse maior do que dois meses.
Distribuição dos critérios de inclusão e exclusão para estudo. Pacientes que iniciaram acompanhamento entre 1998‐2009 no Ambulatório de Infecções Congênitas do Hospital São Lucas da PUCRS, em Porto Alegre, RS, Brasil. Toxo‐IgM, Imunoglobulina M anti‐Toxoplasma gondii testada por método imunoenzimático de captura.
a Prevalência de positividade para imunoglobulina Manti‐Toxoplasma gondii (Toxo‐IgM) no recém‐nascido.
b Época de negativação da mesma.
As variáveis estudadas foram momento da triagem, presença da Toxo‐IgM no primeiro mês de vida, idade de negativação da Toxo‐IgM, idade gestacional, tratamento materno, tratamento do lactente, presença de calcificações cerebrais e presença de retinocoroidite dentro do primeiro ano de vida. A suspeita por triagem materna ocorreu quando a gestante com testes negativos apresentava soroconversão, ou sorologia compatível com toxoplasmose recente (Toxo‐IgM positiva e/ou baixa avidez da Toxo‐IgG), detectada no pré‐natal ou no momento da hospitalização para o parto. Nesses casos, os testes sorológicos nos recém‐nascidos eram feitos em amostras de sangue periférico, durante a estadia na maternidade, e repetidos em intervalos variáveis, conforme indicação clínica. O início do tratamento para toxoplasmose congênita foi indicado na presença de uma ou mais das seguintes situações: a) Toxo‐IgM positiva no recém‐nascido; b) manifestações clínicas típicas de toxoplasmose congênita; c) aumento da Toxo‐IgG no decorrer dos primeiros meses de vida.
O método utilizado para pesquisa de Toxo‐IgG e Toxo‐IgM no soro foi o Enzyme Linked Fluorescent Assay – ELFA (VIDAS, BioMérieux, França), cujos pontos de corte para IgM são: índice<0,55 para negatividade e índice>0,65 para positividade. Para a pesquisa da Toxo‐IgM em papel filtro foi utilizado o Fluorometric Enzyme Immunoassay – FEIA (Ani LabSystems, Helsinque, Finlândia). A presença de retinocoroidite nos recém‐nascidos foi avaliada por oftalmoscopia indireta e as calcificações foram pesquisadas por tomografia computadorizada ou ultrassom.
Os dados foram anotados prospectivamente nos prontuários e digitados em arquivo do Excel (Microsoft Corp., Estados Unidos), sendo analisados com ajuda do Epi Info 3.5.1 (Centers for Diseases Control and Prevention, Atlanta, Estados Unidos). Foram descritas as frequências absolutas e percentuais e investigadas as possíveis associações entre variáveis pelo teste do Qui‐quadrado ou exato de Fisher, as possíveis correlações pelo coeficiente de Pearson e comparação entre medianas pelo teste de Mann‐Whitney/Wilcoxon, sendo considerado significativo o p menor do que 0,05.
ResultadosPacientes incluídosOs critérios de inclusão foram preenchidos por 65 dentre as 89 crianças com toxoplasmose congênita que iniciaram acompanhamento no Ambulatório de Infecções Congênitas no período indicado. Não foram incluídos 24 pacientes: em 14 deles a suspeita diagnóstica ocorreu pelo surgimento de sintomas; oito não possuíam sorologia com 12 meses de idade ou mais;e dois atendiam aos primeiros critérios, mas não possuíam pesquisa de Toxo‐IgM no primeiro mês de vida.
Dos 65 pacientes incluídos, 28 foram detectados por triagem materna (15 no período pré‐natal e 13 no momento do parto) e 37 por triagem neonatal. O número de pacientes excluídos para cada objetivo do estudo, conforme os critérios mencionados na metodologia, está descrito adiante.
Manifestações clínicasEntre os 65 pacientes incluídos, 40 (61,5%, intervalo de confiança [IC] 95% 49,3‐72,7%) apresentaram alguma alteração clínica dentro do primeiro ano de vida, considerando apenas retinocoroidite e calcificações cerebrais (sem incluir outras anormalidades do sistema nervoso central, como dilatação ventricular). Em 25 (38,4%) foram detectadas calcificações cerebrais e retinocoroidite, 10 (15,3%) apresentavam somente calcificações, quatro somente retinocoroidite e um paciente apresentou retinocoroidite e não realizou exame de imagem; para fins estatísticos, esse paciente foi somado aos que apresentaram somente retinocoroidite, perfazendo cinco (7,7%) nesta categoria (fig. 1). Portanto, em 35 pacientes (53,8%, IC95% 41,6‐65,6%) foram visualizadas calcificações cerebrais, e em 30 (46,1%, IC95% 34,3‐58,3%) foi detectada retinocoroidite dentro do primeiro ano de vida.
Positividade da Toxo‐IgM no período neonatalPara o cálculo da prevalência de positividade da Toxo‐IgM no recém‐nascido, foram excluídos os 37 pacientes identificados por triagem neonatal. Entre os 28 pacientes cuja suspeita surgiu pela sorologia materna, 20 tiveram Toxo‐IgM positiva no primeiro dia de vida e confirmada com mais de uma semana (71,4%, IC95% 52,8‐85,7%), enquanto oito tiveram Toxo‐IgM negativa no primeiro dia (28,6%, IC95% 14,2‐47,1%). Em três deles, a Toxo‐IgM tornou‐se positiva após a segunda semana, com positivação da Toxo‐IgG logo após. As mães desses pacientes tinham evidências de infecção toxoplásmica ocorrida poucos dias antes do parto. Portanto, dos 28 pacientes, cinco nunca apresentaram Toxo‐IgM positiva (17,9%, IC95% 6,8‐35,2%), enquanto 23 tiveram Toxo‐IgM positiva no período neonatal (82,1%, IC 95%: 64,7‐93,1%) (fig. 1).
Neste estudo, não foram identificados casos de falsa positividade da Toxo‐IgM.
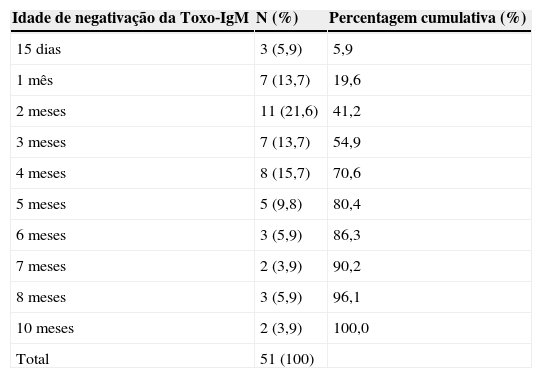
Época de negativação da Toxo‐IgMOs 23 pacientes detectados pela sorologia materna que apresentaram Toxo‐IgM positiva (já excluídos os cinco que nunca apresentaram positividade), mais os 37 detectados por triagem neonatal, somam 60 recém‐nascidos com Toxo‐IgM positiva no primeiro mês de vida. Para o estudo da época de negativação da Toxo‐IgM, tiveram de ser excluídos, adicionalmente, nove pacientes, nos quais não foi possível identificar o mês de negativação devido ao intervalo entre o primeiro teste negativo e o último positivo ser maior do que dois meses (fig. 1). Assim, em 51 pacientes foi possível demonstrar o mês em que a Toxo‐IgM se tornou negativa (tabela 1).
Idade da negativação da imunoglobulina M anti‐Toxoplasma gondii em 51 lactentes com toxoplasmose congênita confirmada e que apresentavam positividade para esses anticorpos dentro do primeiro mês de vida
| Idade de negativação da Toxo‐IgM | N (%) | Percentagem cumulativa (%) |
|---|---|---|
| 15 dias | 3 (5,9) | 5,9 |
| 1 mês | 7 (13,7) | 19,6 |
| 2 meses | 11 (21,6) | 41,2 |
| 3 meses | 7 (13,7) | 54,9 |
| 4 meses | 8 (15,7) | 70,6 |
| 5 meses | 5 (9,8) | 80,4 |
| 6 meses | 3 (5,9) | 86,3 |
| 7 meses | 2 (3,9) | 90,2 |
| 8 meses | 3 (5,9) | 96,1 |
| 10 meses | 2 (3,9) | 100,0 |
| Total | 51 (100) |
Toxo‐IgM, Imunoglobulina M anti‐Toxoplasma gondii testada por método imunoenzimático de captura.
Nenhuma das mães dos pacientes identificados por triagem neonatal ou triagem materna no momento do parto havia recebido tratamento para toxoplasmose. Entre as 15 mães cuja toxoplasmose foi diagnosticada no pré‐natal, 12 haviam recebido algum tipo de tratamento antes do parto. Considerando os 28 pacientes detectados por triagem materna, constatamos que, entre as 12 mães que receberam tratamento, três recém‐nascidos (25%) nunca tiveram Toxo‐IgM positiva, enquanto que de 16 mães que não receberam tratamento, dois recém‐nascidos (12%) apresentaram a mesma característica (odds ratio 2,33; IC95% 0,28‐22,25) p=0,4.
Tratamento do lactenteExcluindo‐se os cinco lactentes que nunca apresentaram IgM positiva, o início do tratamento foi mais precoce naqueles cuja identificação foi feita por triagem materna do que nos que foram detectados por triagem neonatal. Nos primeiros, a mediana da idade de início do tratamento foi de 5,5 dias de vida (intervalo interquartil 4‐23, mínimo 1, máximo 52), enquanto nos últimos a mediana foi de 45 dias (intervalo interquartil 31‐62, mínimo 17, máximo 275), p=0,0003. Entretanto, comparando os grupos com identificação por triagem materna ou neonatal em relação à época de negativação da Toxo‐IgM, não se encontrou diferença significativa. Naqueles com suspeita diagnóstica por triagem materna, a idade mediana da negativação foi de três meses (intervalo interquartil 2‐6, mínimo 1, máximo 10), enquanto nos detectados por triagem neonatal a idade mediana de negativação foi de quatro meses (intervalo interquartil 2‐6, mínimo 0, máximo 10), p=0,3752.
Considerando os 51 lactentes em que foi possível identificar a época de negativação da Toxo‐IgM, a regressão linear não mostrou correlação entre a idade do início do tratamento e a idade da negativação, ambas em dias de vida (coeficiente de correlação de Pearson=0,03).
Em um dos cinco pacientes que nunca apresentaram IgM positiva, o início do tratamento foi no segundo dia de vida, mas em quatro deles o início foi mais tardio (entre um e quatro 4 meses). Em seis dos pacientes cuja negativação da Toxo‐IgM ocorreu até o primeiro mês de vida, a única amostra positiva foi a coletada na triagem neonatal de rotina. Essas mães e seus recém‐nascidos não haviam recebido qualquer tipo de tratamento para toxoplasmose. Em quatro deles, que eram assintomáticos à primeira avaliação clínica, assim como em outros dois pacientes (parte dos cinco que nunca apresentaram Toxo‐IgM positiva), o tratamento foi iniciado com base no aumento da Toxo‐IgG após o terceiro mês de vida.
Outras variáveisNão houve associação das outras variáveis estudadas (presença de manifestações clínicas e idade gestacional) com a positividade ou negatividade da Toxo‐IgM ao nascer, ou com a idade da sua negativação.
DiscussãoAlém de avaliar a taxa de positividade para Toxo‐IgM em recém‐nascidos com toxoplasmose congênita confirmada, este estudo demonstrou, pela primeira vez por meio de um delineamento de coorte, a idade em que esses anticorpos, quando presentes no período neonatal, tornam‐se negativos, o que se verificou muitas vezes bem cedo. Consideramos essas informações importantes para o correto manejo dos casos em que se suspeita de toxoplasmose congênita, pois nesses lactentes a investigação clínica deve ser completa e o monitoramento não pode ser interrompido, mesmo na ausência da Toxo‐IgM no soro.
Em relação à proporção entre positividade e negatividade para Toxo‐IgM em recém‐nascidos com toxoplasmose congênita, os dados de literatura são bastante discrepantes, em parte por causa das diferentes sensibilidades dos métodos utilizados e em parte por características populacionais.7–14 Para se obter acurácia na pesquisa de Toxo‐IgM, é preciso usar um método de captura, com alta sensibilidade e especificidade.1 No estado de Goiás, Rodrigues et al.14 avaliaram 28 recém‐nascidos com toxoplasmose congênita em relação à positividade dos anticorpos IgM específicos. Utilizando dois métodos imunoenzimáticos de captura, verificaram que 16 (57%, IC 95% 38‐74%) tinham Toxo‐IgM negativa.14 Um estudo francês mostrou que de 103 pacientes com toxoplasmose congênita, 31 (30%, IC 95% 21‐39%) tinham Toxo‐IgM negativa no primeiro mês de vida, também por método imunoenzimático de captura.10 A taxa de positividade encontrada no presente estudo é das mais altas, quando comparada a estes e outros dados publicados,7–15 mas ainda assim ficou evidente que até um terço dos recém‐nascidos com toxoplasmose congênita na população estudada podem ser negativos para Toxo‐IgM, mesmo utilizando um método de alta sensibilidade.16
Fatores que podem influenciar a presença ou ausência da Toxo‐IgM no recém‐nascido incluem concentração de anticorpos maternos e tratamento durante a gestação. Já foi demonstrado que o tratamento da gestante diminui a taxa de positividade da Toxo‐IgM no recém‐nascido.8,17 Embora o presente estudo tenha encontrado uma odds ratio de 2,33 a favor do efeito do tratamento materno sobre a negatividade da Toxo‐IgM no recém‐nascido, o intervalo de confiança não mostrou significância estatística, portanto, não podemos descartar nem confirmar este efeito na população estudada. Bessières et al.12 não encontraram diferença na positividade da Toxo‐IgM no recém‐nascido ao compararem dois tipos de tratamento materno (espiramicina ou pirimetamina mais sulfadoxina).
Dentre os recém‐nascidos, três deles cujas mães haviam tido infecção muito recente, e que apresentaram sorologia negativa no dia do nascimento, soroconverteram depois. O risco de passarem despercebidas as infecções de final de gestação já foi apontado na literatura.18 Quando a infecção materna é muito recente, o recém‐nascido deve ser testado novamente em duas semanas, caso a sorologia feita ao nascer seja negativa.
Este estudo de coorte confirma que o período em que a Toxo‐IgM permanece positiva nos lactentes com toxoplasmose congênita é bem restrito: mais da metade dos lactentes com Toxo‐IgM positiva no período neonatal já a apresentavam negativa aos três meses de idade. Gilbert et al.13 e Olariu et al.15 também demonstraram que a positividade para Toxo‐IgM diminui com a idade; entretanto, o delineamento daqueles estudos foi transversal, calculando a taxa de negatividade em grupos de lactentes por idade, sem acompanhamento longitudinal.
Observamos que, em 20% dos recém‐nascidos, a Toxo‐IgM já era negativa com um mês, idade em que os testes séricos confirmatórios estão sendo realizados na maioria dos pacientes com Toxo‐IgM positiva na triagem neonatal. Apesar de não estar incluída no programa nacional, a triagem neonatal para toxoplasmose congênita é uma realidade em nosso país, onde a maioria dos planos de saúde já a autorizam.19–21 Pelo menos seis pacientes desta coorte talvez fossem diagnosticados somente após meses ou anos, quando do surgimento de sintomas, se o teste de triagem neonatal tivesse sido considerado falso‐positivo pela negatividade precoce da Toxo‐IgM, sem que fosse indicada a investigação clínica completa e a monitorização da Toxo‐IgG. Impõe‐se recomendar aos pediatras que não considerem a negatividade da Toxo‐IgM no lactente como prova de ausência da infecção congênita. Esses lactentes devem ser submetidos à investigação clínica completa e, quando esta for normal, ao monitoramento mensal da Toxo‐IgG, que não deve ser interrompido até a negativação total ou confirmação do diagnóstico. Outros testes, como a pesquisa de IgA específica (que, agregada à pesquisa de Toxo‐IgM, aumenta um pouco a sensibilidade) e os exames de biologia molecular, podem ser realizados para tentar confirmar o diagnóstico o mais cedo possível.1,10,11,15
Embora seja bem conhecido que o tratamento do lactente deprime os níveis de Toxo‐IgG,1,2 este estudo indicou que não ocorre o mesmo com a Toxo‐IgM. As análises realizadas não mostraram influência do tratamento do lactente sobre a duração da Toxo‐IgM.
Alguns dados clínicos foram levantados com intenção de investigar a sua relação com a dinâmica da Toxo‐IgM no lactente. Embora não tendo o objetivo de ser um estudo de prevalência de manifestações clínicas na toxoplasmose congênita e estando sujeito aos vieses inerentes aos critérios de inclusão empregados, julgamos que o fato de não incluir pacientes com suspeita diagnóstica pelo surgimento de sintomas e utilizar um critério rigoroso de confirmação diagnóstica torna este levantamento representativo da população estudada, fornecendo informações relevantes, desde que consideradas as suas limitações.
A prevalência de manifestações clínicas nesta amostra de pacientes (mais de 60% com retinocoroidite e/ou calcificações cerebrais) parece confirmar a maior morbidade da infecção nas crianças brasileiras e sul‐americanas em geral, quando comparadas às crianças de outros continentes, como Europa e América do Norte, onde são descritas manifestações clínicas ao nascer em cerca de 40% dos recém‐nascidos infectados.20,22–26 Vasconcelos‐Santos et al.20 encontraram uma prevalência maior de retinocoroidite: 79,8% (IC95% 73,4‐85,1%) em uma população de lactentes com toxoplasmose congênita detectados por triagem neonatal em Minas Gerais. Naquele estudo, a avaliação oftalmológica foi decisiva em 15,7% dos lactentes, que na sorologia confirmatória não mais apresentavam Toxo‐IgM positiva, situação semelhante à encontrada no presente estudo.20 Melamed et al.,27 ao examinarem 44 lactentes com toxoplasmose congênita, alguns dos quais pertencentes a esta coorte, encontraram 31 (70,4%) casos de lesão ocular, sendo 29 (65,9%) de retinocoroidite. As lesões oculares podem se tornar evidentes dentro dos meses seguintes ao do nascimento, não só pelo surgimento de novas lesões, mas pela maior facilidade em visualizar a periferia da retina. Diferenças na apresentação clínica da toxoplasmose congênita entre populações podem ser explicadas por fatores genéticos do parasita e do hospedeiro.20,28,29 Este é um motivo que agrega importância à realização de estudos em áreas geográficas diversificadas.
No estudo de Vasconcelos‐Santos et al.,20 a prevalência de calcificações cerebrais foi de 20,5%, sendo que os exames de neuroimagem incluíram radiografias e ultrassom. Outros estudos que também detectaram menor prevalência de calcificações cerebrais do que este geralmente incluíram entre os exames de neuroimagem as radiografias de crânio, reconhecidamente com sensibilidade muito baixa para detectar calcificações.26,30 No presente estudo, os exames de neuroimagem foram realizados por tomografia computadorizada e/ou ultrassom, característica que foi levada em conta quando da inclusão de parte desta mesma coorte em estudos comparativos com crianças europeias, quando foi constatado que a maioria dos pacientes brasileiros havia sido submetida à tomografia computadorizada de crânio, fato que pode aumentar a detecção das calcificações.15,24,31
Este estudo não encontrou associação entre positividade da Toxo‐IgM no recém‐nascido e manifestações clínicas de toxoplasmose congênita, assim como os de outros autores.1,11,13,15 A predominância de Toxo‐IgM negativa em crianças sintomáticas seria esperada, porque há maior tendência à negatividade em recém‐nascidos nos quais a infecção fetal ocorreu em épocas mais precoces da gestação, os quais tendem a ser mais gravemente acometidos e apresentar alterações aparentes ao exame físico.
Wallon et al.,11 Gilbert et al.13 e Bessières et al.12 demonstraram que a detecção da Toxo‐IgM nos recém‐nascidos foi menor nos casos de soroconversão materna no primeiro e segundo trimestres. Existem dois motivos possíveis para que a idade gestacional da infecção materna influencie a presença da Toxo‐IgM no recém‐nascido: em primeiro lugar, na infecção mais precoce o tempo entre infecção placentária e fetal é mais longo, permitindo maior passagem de anticorpos maternos para o feto e inibindo a produção fetal dos mesmos. Em segundo lugar, a infecção mais precoce daria tempo para a Toxo‐IgM fetal ter atingido o seu pico na vida intrauterina e já ser negativa por ocasião do nascimento. Nos estudos europeus é possível analisar o momento da infecção materna porque as rotinas de pré‐natal incluem sorologia mensal, o que não acontece no Brasil, onde geralmente não se consegue identificar exatamente o trimestre da soroconversão. Nos Estados Unidos, onde não é feita sorologia pré‐natal de rotina, também existe esta limitação.15
Concluímos que, mesmo quando testados por métodos sorológicos de grande sensibilidade, até um terço dos bebês com toxoplasmose congênita pode ser negativo para Toxo‐IgM ao nascimento. Nos casos de infecção materna muito próxima do parto, os recém‐nascidos podem positivar a sorologia para toxoplasmose alguns dias ou semanas após o nascimento. Na maioria dos recém‐nascidos ou lactentes com Toxo‐IgM positiva, o período de positividade é bastante fugaz. Crianças infectadas que apresentaram Toxo‐IgM positiva na triagem neonatal já podem se apresentar negativas por ocasião dos testes confirmatórios, o que não deve ser encarado, em princípio, como falsa positividade do teste de triagem. É importante não interromper o monitoramento dos lactentes com suspeita de toxoplasmose congênita por apresentarem Toxo‐IgM negativa.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Lago EG, Oliveira AP, Bender AL. Presence and duration of anti‐Toxoplasma gondii immunoglobulin M in infants with congenital toxoplasmosis. J Pediatr (Rio J). 2014;90:363–9.
Instituição e local do estudo: Hospital São Lucas, Pontifícia Universidade Católica do Rio Grande do Sul, Porto Alegre, Rio Grande do Sul.