To determine eight parameters of oxidative stress markers in erythrocytes from children with sickle cell disease and compare with the same parameters in erythrocytes from healthy children, since oxidative stress plays an important role in the pathophysiology of sickle cell disease and because this disease is a serious public health problem in many countries.
MethodsBlood samples were obtained from 45 children with sickle cell disease (21 males and 24 females with a mean age of 9 years; range: 3–13 years) and 280 blood samples were obtained from children without hemoglobinopathies (137 males and 143 females with a mean age of 10 years; range: 8–11 years), as a control group. All blood samples were analyzed for methemoglobin, reduced glutathione, thiobarbituric acid reactive substances, percentage of hemolysis, reactive oxygen species, and activity of the enzymes glucose 6‐phosphate dehydrogenase, superoxide dismutase, and catalase. Data were analyzed using Student's t‐test and were expressed as the mean±standard deviation. A p‐value of <0.05 was considered significant.
ResultsSignificant differences were observed between children with sickle cell disease and the control group for the parameters methemoglobin, thiobarbituric acid reactive substances, hemolysis, glucose 6‐phosphate dehydrogenase activity, and reactive oxygen species, with higher levels in the patients than in the controls.
ConclusionsOxidative stress parameters in children's erythrocytes were determined using simple laboratory methods with small volumes of blood; these biomarkers can be useful to evaluate disease progression and outcomes in patients.
Determinar parâmetros de estresse oxidativo em eritrócitos de crianças com doença falciforme e compará‐los com os mesmos parâmetros em eritrócitos de crianças saudáveis, pois o estresse oxidativo desempenha um importante papel na fisiopatologia da doença falciforme, considerada um sério problema de saúde pública em muitos países.
MétodosForam obtidas amostras de sangue de 45 crianças com doença falciforme (21 meninos e 24 meninas com média de 9 anos, variação de 3 a 13) e 280 amostras de sangue de crianças sem hemoglobinopatias (137 meninos e 143 meninas com média de 10 anos, variação de 8 a 11), como grupo controle. Em todas as amostras foram determinados meta‐hemoglobina, glutationa reduzida, substâncias reativas ao ácido tiobarbitúrico, porcentagem de hemólise, espécies reativas de oxigênio e atividade das enzimas glucose6‐fosfato desidrogenase, superóxido dismutase e catalase. Os dados foram analisados com o teste t de Student e foram expressos como média±desvio padrão. Um valor de p<0,05 foi considerado significativo.
ResultadosForam observadas diferenças significativas entre as crianças com doença falciforme e o grupo controle para os parâmetros meta‐hemoglobina, substâncias reativas ao ácido tiobarbitúrico, porcentagem de hemólise, espécies reativas de oxigênio e atividade da enzima glucose6‐fosfato desidrogenase, com níveis aumentados nos pacientes.
ConclusõesFoi possível determinar parâmetros de estresse oxidativo em eritrócitos de crianças, com técnicas laboratoriais simples e pequenos volumes de sangue. Esses biomarcadores podem ser úteis na avaliação da progressão e dos resultados de tratamentos da doença.
A doença falciforme é uma das doenças hematológicas mais comuns do mundo e é um problema de saúde pública grave em muitos países, incluindo o Brasil.1 Há mais de 2 milhões de brasileiros portadores do gene da doença falciforme e estima‐se que essa doença tenha uma incidência de um em cada 1.000 nascidos vivos. Em 2001, um decreto do Ministério da Saúde incluiu triagem de hemoglobinopatias nos programas de triagem preexistentes.2
A doença falciforme foi caracterizada como uma doença multissistêmica associada a episódios de doença aguda e dano progressivo em órgãos, que começa na infância e é responsável principalmente por uma expectativa de vida reduzida nos pacientes afetados.3 As taxas de morbidez e mortalidade ainda são altas em pacientes com a doença falciforme. No Brasil, até 25% das crianças afetadas faleceram durante seus primeiros 5 anos de vida, porém o diagnóstico precoce e o tratamento podem reduzir essas taxas e melhorar sua qualidade de vida.4
A hemoglobina falciforme resulta de uma substituição de ácido glutâmico por valina na sexta posição da cadeia β globina.5 A variação ostensivamente mínima é a origem da hemoglobina S e é responsável pelas alterações significativas na estabilidade e na solubilidade da molécula.6 A tendência de a hemoglobina S desoxigenada se submeter a polimerização está na base de inúmeras expressões das síndromes falciformes com hemólise intravascular.7 A hemoglobina plasmática livre pode iniciar a peroxidação lipídica e o heme, que prontamente se dissocia da meta‐hemoglobina, pode contribuir significativamente para o estresse oxidativo,8 que pode desempenhar um papel significativo na fisiopatologia da disfunção microvascular relacionada à doença falciforme, na vaso‐oclusão e no desenvolvimento de lesões nos órgãos.9 Os biomarcadores do estresse oxidativo podem, portanto, ser potencialmente úteis, tanto para identificar pacientes com alto risco de dano oxidativo quanto para avaliar os efeitos de terapias antioxidantes.10
O objetivo deste trabalho foi avaliar os parâmetros do estresse oxidativo em eritrócitos de crianças com doença falciforme, incluindo percentuais de hemólise, meta‐hemoglobina, glutationa reduzida, substâncias reativas ao ácido tiobarbitúrico, atividade da glucose‐6‐fosfato desidrogenase, espécies reativas de oxigênio e as enzimas antioxidantes catalase e superóxido dismutase.
MétodosSubstâncias químicasÁcido metafosfórico, 2‐mercaptoetanol, pirogalol, hidrocloreto de 2,2‐azobis (2‐amidinopropano) (AAPH), ácido etilendiaminotetracético (EDTA) e ácido 5,5‐ditiobis 2‐nitrobenzoico (DTNB) foram obtidos da Sigma‐Aldrich (Saint Louis, MO, EUA). Fosfatos de sódio e de potássio, saponina, ácido tricloroacético e ácido tiobarbitúrico foram fornecidos pela Vetec Ltda. (Rio de Janeiro, RJ, Brasil). Citrato de sódio, tris (hidroximetil) aminometano e metanol foram obtidos da Merck (Darmstadt, Alemanha). A atividade da G6‐PD foi determinada com o PD410 dos Laboratórios Randox (Antrim, Reino Unido). Todos os solventes orgânicos eram de alta qualidade e passaram por dupla destilação e todas as outras substâncias químicas eram de grau analítico.
Amostras de sangueForam obtidas amostras de sangue de 45 crianças diagnosticadas com doença falciforme (21 meninos e 24 meninas com média de 9 anos; faixa: 3‐13) no Departamento de Hematopediatria do Hospital das Clínicas da Universidade Federal do Paraná (UFPR). Um grupo de controle consistia em 280 crianças sem hemoglobinopatias (137 meninos e 143 meninas com média de 10 anos; faixa: 8‐11), participantes do projeto de extensão universitário intitulado “Incidência de anemias e parasitoses em crianças com idade escolar nas escolas municipais da região metropolitana de Curitiba – Paraná – Brasil”, da UFPR. O uso de seres humanos foi aprovado pelo Comitê de Ética em Pesquisa Envolvendo Seres Humanos do Hospital de Clínicas da UFPR. Foi obtido o consentimento informado dos pais ou responsáveis de todas as crianças. As crianças com qualquer alteração hematológica foram excluídas.
Foi coletada uma amostra de sangue venoso de 5mL de cada paciente em tubos revestidos de K3‐EDTA. Foram separadas alíquotas (200μL) de sangue total para determinação da atividade da G6‐PD. Então, as amostras foram centrifugadas a 3.000g por 10 minutos. O plasma e a camada leucoplaquetária (buffy coat) foram removidos por aspiração e os eritrócitos foram lavados com tampão fosfato‐salino (PBS) (NaCl, 150mmol/L; NaH2PO4, 1,9mmol/L; e Na2HPO4, 8,1mmol/L) três vezes. Por fim, os glóbulos vermelhos foram suspensos em solução PBS e água para obter suspensões com hematócritos de 10% e 40% para a solução PBS e 40% para a solução de água. A concentração de hemoglobina foi medida em todas as suspensões. Nem todas as análises foram medidas em cada amostra devido aos volumes limitados disponíveis.
Parâmetros hematológicosO hemograma completo foi determinado com o contador eletrônico de células Pentra 80 (Horiba Medical, Japão).
Concentração de meta‐hemoglobinaA concentração de meta‐hemoglobina foi determinada de acordo com um método com base em Naoum et al.11 adaptado a pequenos volumes. As alíquotas (100μL) de suspensões de eritrócitos a 10% foram hemolizadas com 100μL de saponina a 1% e estabilizadas em 1.000μL de 60mmol/L de tampão de fosfato; então, a absorbância foi determinada a 630nm (para metemoglobina) e 540nm (para oxi‐hemoglobina). A concentração de metemoglobina foi expressa em termos percentuais em relação à concentração de hemoglobina.
Determinação da glutationa reduzidaA concentração de glutationa reduzida (GSH) foi determinada por um método anteriormente descrito por Beutler,12 ao avaliar a redução do ácido 5,5′‐ditiobis(2‐nitrobenzoico) (DTNB) por compostos de sulfidrila a partir da formação de um produto aniônico de coloração amarela cuja absorbância foi medida em 412nm. Foram usadas alíquotas de 50μL de suspensão de células vermelhas a 40% no PBS. A concentração de GSH foi expressa em μmol/gHb.
Peroxidação lipídicaA peroxidação lipídica de membranas de células vermelhas foi avaliada com base em Cesquini et al.13 Foram adicionadas alíquotas (600μL) de uma suspensão de glóbulos vermelhos a 10% a 250μL de ácido tricloroacético a 25% e 600μL de ácido tiobarbitúrico a 1%, fervidas por 15 minutos a 100°C e resfriadas por 5 minutos a 0°C. Então, a absorbância das substâncias reativas ao ácido tiobarbitúrico (TBARS) formadas foi lida a 532nm com o uso de ¿=156/(mmole.cm) e as concentrações foram expressas em nmol/gHb.
Medição da hemóliseA hemólise da hemácia foi feita conforme descrito por Banerjee et al.,14 adaptada a microplacas por meio da mistura de uma suspensão de glóbulos vermelhos a 10% com PBS com quantidades variáveis de soluções de AAPH (obtiveram‐se as concentrações finais de 50, 100 e 150mmol/L). A mistura da reação foi incubada por 3 horas a 37°C, com agitação. A extensão da hemólise foi determinada por espectrofotometria por meio da medição da absorbância do hemolisado a 540nm em um leitor de microplacas (Thermo Scientific, Thermo Plate, EUA). Glóbulos vermelhos em uma solução de 200mmol/L de AAPH foram o controle de 100% de hemólise.
Atividade da glucose‐6‐fosfato desidrogenase (G6‐PD)Alíquotas (200μL) de sangue total antes do isolamento de eritrócitos foram lavadas com PBS de 2mL três vezes. A atividade da G6‐PD foi determinada com o analisador automático Cobas Mira (Roche, Mannheim, Alemanha) com o kit comercial PD410 (Randox, Antrim, Reino Unido) conforme descrito no manual do fabricante.
Atividade da superóxido dismutaseA atividade enzimática teve como base um método adaptado a partir da auto‐oxidação de pirogalol de Beutler.12 Alíquotas de 200μL de glóbulos vermelhos embaladas foram hemolisadas com 300μL de água deionizada fria e foi preparado um extrato de clorofórmio e etanol. A mistura foi centrifugada a 2300g por 10min. Quantidades variáveis do extrato sobrenadante límpido (0, 20, 40, 60, 80, 100 e 300μL) foram adicionadas a uma solução de tris‐hidrocloreto (tris‐HCl) e água. Após 10min, 20μL de uma solução de pirogalol a 1mmol/L foram adicionados a cada tubo e a absorbância foi aferida a 412nm em uma microplaca. A quantidade de extrato necessária para inibir a auto‐oxidação do pirogalol em 50% é usada para determinar o nível de atividade enzimática.
Atividade da catalaseA atividade enzimática foi determinada por meio de um método adaptado de Beutler,12 a partir da medida da taxa de decomposição do peróxido de hidrogênio pela catalase por espectrofotometria a 240nm. Alíquotas de 50μL de uma suspensão de glóbulos vermelhos a 40% foram adicionadas a 450μL de uma solução hemolisante de β‐mercaptoetanol (0,7mmol/L) e EDTA (0,27mol/L). Essa solução foi diluída em PBS na proporção 1:100 e 10μLda solução final foram adicionados a 990μLda solução de peróxido de hidrogênio. A diminuição da absorbância do sistema foi aferida por 10min.
Espécies reativas de oxigênio intracelularEspécies reativas de oxigênio foram determinadas de acordo com um método com base em López‐Revuelta et al.,15 adaptado a pequenos volumes de amostras de sangue em microplacas. Eritrócitos (995μL de uma suspensão de PBS a 10% v/v) foram incubados com 5μL de diclorodihidrofluoresceína diacetato (DCFDA, 10mol/L) a 37°C por 30 minutos. Essa suspensão foi diluída em 9,0mL de PBS e 37,5μL dessa solução foram, então, adicionados a 112,5μL de PBS em placas de 96 poços. As espécies reativas de oxigênio foram determinadas por meio de um fluorímetro GloMax®‐Multi Microplate Multimode Reader (Promega Corporation, EUA). Nessas condições, o DCFDA foi hidrolisado a 2′,7′‐diclorodihidrofluoresceína (DCFH2), que, então, foi disponibilizado para oxidação pelas espécies reativas de oxigênio (ERO) para produzir 2,7‐diclorofluoresceína (DCF). A fluorescência foi determinada a 530nm após excitação a 495nm. A formação de espécies reativas de oxigênio foi expressa como unidades de fluorescência (UF)/gHb.
Análise estatísticaFoi feita com o software Statistica 8.0 (StatSoft, EUA). Não foi identificado valor atípico. O teste de Kolmogorov‐Smirnov foi usado para avaliar a normalidade e todos os parâmetros foram distribuídos normalmente. Os dados foram expressos como média±desvio padrão e comparados entre grupos que usam o teste t de Student; um valor de p<0,05 foi considerado significativo.
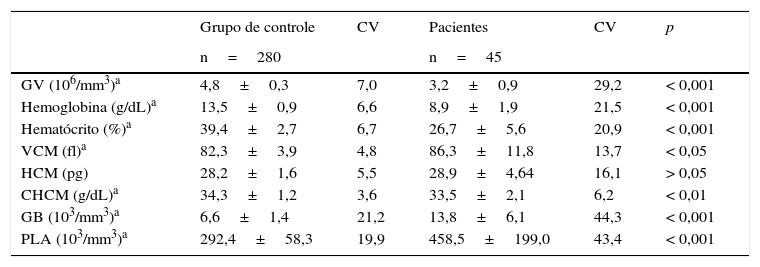
ResultadosOs dados provenientes de hemogramas de crianças saudáveis e pacientes com doença falciforme estão ilustrados na tabela 1. Foram observadas as diferenças estatisticamente significativas para todos os parâmetros, exceto para a hemoglobina corpuscular média (HCM) (p<0,05).
Valores hematológicos em crianças saudáveis (grupo de controle) e em pacientes com doença falciforme
| Grupo de controle | CV | Pacientes | CV | p | |
|---|---|---|---|---|---|
| n=280 | n=45 | ||||
| GV (106/mm3)a | 4,8±0,3 | 7,0 | 3,2±0,9 | 29,2 | < 0,001 |
| Hemoglobina (g/dL)a | 13,5±0,9 | 6,6 | 8,9±1,9 | 21,5 | < 0,001 |
| Hematócrito (%)a | 39,4±2,7 | 6,7 | 26,7±5,6 | 20,9 | < 0,001 |
| VCM (fl)a | 82,3±3,9 | 4,8 | 86,3±11,8 | 13,7 | < 0,05 |
| HCM (pg) | 28,2±1,6 | 5,5 | 28,9±4,64 | 16,1 | > 0,05 |
| CHCM (g/dL)a | 34,3±1,2 | 3,6 | 33,5±2,1 | 6,2 | < 0,01 |
| GB (103/mm3)a | 6,6±1,4 | 21,2 | 13,8±6,1 | 44,3 | < 0,001 |
| PLA (103/mm3)a | 292,4±58,3 | 19,9 | 458,5±199,0 | 43,4 | < 0,001 |
GV, glóbulos vermelhos; VCM, volume corpuscular médio; HCM, hemoglobina corpuscular média; CHCM, concentração de hemoglobina corpuscular média; GB, glóbulos brancos; PLA, plaquetas; CV, coeficiente de variação de Pearson (%). Os dados são apresentados como média±desvio padrão.
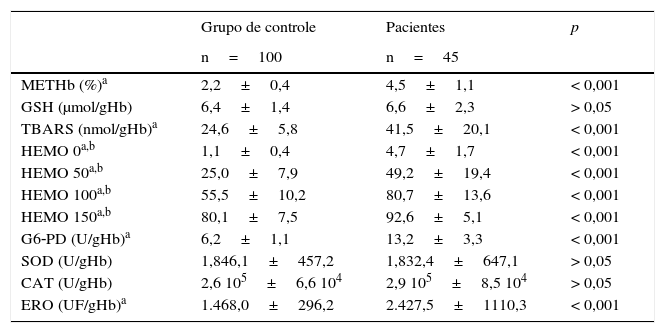
Os dados provenientes de parâmetros de estresse oxidativo estão ilustrados na tabela 2, que compara os pacientes com doença falciforme e crianças saudáveis. Foram observadas as diferenças estatisticamente significativas para meta‐hemoglobina, TBARS, percentual de hemólise, atividade da G6‐PD e espécies reativas de oxigênio (p<0,05).
Parâmetros de estresse oxidativo em crianças normais (grupo de controle) e em pacientes com doença falciforme
| Grupo de controle | Pacientes | p | |
|---|---|---|---|
| n=100 | n=45 | ||
| METHb (%)a | 2,2±0,4 | 4,5±1,1 | < 0,001 |
| GSH (μmol/gHb) | 6,4±1,4 | 6,6±2,3 | > 0,05 |
| TBARS (nmol/gHb)a | 24,6±5,8 | 41,5±20,1 | < 0,001 |
| HEMO 0a,b | 1,1±0,4 | 4,7±1,7 | < 0,001 |
| HEMO 50a,b | 25,0±7,9 | 49,2±19,4 | < 0,001 |
| HEMO 100a,b | 55,5±10,2 | 80,7±13,6 | < 0,001 |
| HEMO 150a,b | 80,1±7,5 | 92,6±5,1 | < 0,001 |
| G6‐PD (U/gHb)a | 6,2±1,1 | 13,2±3,3 | < 0,001 |
| SOD (U/gHb) | 1,846,1±457,2 | 1,832,4±647,1 | > 0,05 |
| CAT (U/gHb) | 2,6 105±6,6 104 | 2,9 105±8,5 104 | > 0,05 |
| ERO (UF/gHb)a | 1.468,0±296,2 | 2.427,5±1110,3 | < 0,001 |
METHb, meta‐hemoglobina; GSH, glutationa reduzida; TBARS, substâncias reativas ao ácido tiobarbitúrico; HEMO, hemólise; G6‐PD, glucose 6‐fosfato desidrogenase; SOD, superóxido dismutase; CAT, catalase; ERO, espécies reativas de oxigênio. Os dados são apresentados como média±desvio padrão.
Os eritrócitos normais sofrem estresse oxidativo devido à produção de espécies reativas de oxigênio que resultam do metabolismo de oxigênio. Contudo, isso é restaurado de forma eficiente pelos sistemas antioxidantes altamente poderosos da célula, sem qualquer efeito problemático. O estresse oxidativo ocorre como resultado de um desequilíbrio entre a produção de espécies reativas de oxigênio e as defesas antioxidantes.16
Na doença falciforme, o estresse oxidativo poderá ser resultado de níveis elevados de meta‐hemoglobina S, que é menos estável do que a meta‐hemoglobina A e leva à hemólise intravascular,17 à lesão de isquemia‐reperfusão, à inflamação crônica e a uma maior auto‐oxidação da hemoglobina falciforme.18,19 Muitos antioxidantes potenciais são de interesse com relação à doença falciforme20 e vários estudos demonstraram aumentos significativos em marcadores de estresse e comportamentos diferentes em sistemas de defesa antioxidante em pacientes com doença falciforme quando comparados com indivíduos saudáveis.21
Nossos resultados para as amostras de sangue confirmam várias características da doença falciforme já conhecidas, como a anemia hemolítica,21 comprovada por baixos níveis de hemoglobina,7 e o aumento nos níveis dos glóbulos brancos e das plaquetas.6
Conforme demonstrado anteriormente,8 os níveis de meta‐hemoglobina aumentam em indivíduos com a doença falciforme. Existe uma transferência de elétrons na interação de ligação entre o heme e o oxigênio (O2) na hemoglobina oxigenada. Quando a hemoglobina está desoxigenada, o ferro heme normalmente continua no estado ferroso.20 Nessa troca, quando ocorre a auto‐oxidação da hemoglobina, as alterações resultam em meta‐hemoglobina, com o ferro heme no estado férrico.8 As alterações na função ou na estrutura dos eritrócitos podem levar a um fluxo maior de meta‐hemoglobina, que pode levar ao estresse oxidativo.15
O aumento do estresse oxidativo intra e extraeritrocitário induz a peroxidação lipídica e a instabilidade da membrana.14 As TBARS são um dos biomarcadores existentes e essa avaliação é uma quantificação indireta dos processos de peroxidação lipídica, o que faz disso um bom indicador de estímulos pró‐oxidantes. De acordo com os resultados registrados anteriormente,19,20,22 observamos níveis significativamente mais elevados de TBARS em pacientes com a doença falciforme do que nos controles.
Os eritrócitos falciformes rígidos e deformados têm uma vida útil reduzida e são submetidos a hemólise tanto intravascular quanto extravascular.23 Observamos percentuais mais elevados de hemólise em eritrócitos de crianças com a doença falciforme do que no grupo de controle, tanto em suspensões de base de eritrócitos quanto em suspensões incubadas com um agente oxidante.
A G6‐PD é uma enzima importante relacionada à defesa antioxidante em eritrócitos.20 Observamos uma atividade mais elevada dessa enzima em pacientes com a doença falciforme do que no grupo de controle. Foi registrado anteriormente que os eritrócitos de pacientes com a doença falciforme apresentam um percentual cada vez maior de reticulócitos, ao passo que a atividade da G6‐PD nos reticulócitos é normal, mas cai exponencialmente conforme as células vermelhas envelhecem.24
As células falciformes geram espontaneamente cerca de duas vezes mais espécies reativas de oxigênio do que os glóbulos vermelhos normais.25 Em conformidade com os achados de George et al.,26 também demonstramos níveis elevados de espécies reativas de oxigênio em eritrócitos falciformes.
A glutationa reduzida (GSH) está presente em altas concentrações em eritrócitos e atua sozinha ou por meio da glutationa peroxidase como principal fonte redutora para manter a integridade da célula.17 As medições de GSH e de sua forma oxidada glutationa dissulfeto (GSSG) foram consideradas indicadores úteis de estresse oxidativo in vivo.27 A maior parte dos estudos em adultos com doença falciforme relatou alguns déficits na síntese endógena de GSH, provavelmente devido a seu consumo por meio do aumento na produção de oxidantes.26,28 Embora Rusanova et al.22 tenham apresentado altos níveis de GSH em pacientes pediátricos com doença falciforme, no presente estudo não encontramos diferença nos níveis de GSH entre crianças com doença falciforme e o grupo de controle.
A superóxido dismutase pode converter o superóxido em peróxido de hidrogênio e a catalase pode remover o peróxido de hidrogênio excedente.16 Segundo Silva et al.,20 o aumento na geração de pró‐oxidantes em doença falciforme resulta em uma deficiência de antioxidantes. Contudo, existem algumas discrepâncias entre estudos sobre superóxido dismutase e níveis de catalase nessa doença, alguns estudos observam o aumento da atividade e outros observam a diminuição dos níveis.29 Um aumento na atividade dessas enzimas possivelmente constitui um mecanismo de defesa em resposta ao aumento do estresse oxidativo19 ou pode ser consequência de um aumento no conteúdo de reticulócitos em amostras de sangue de pacientes com doença falciforme. Contudo, uma diminuição nos níveis das enzimas estava relacionada à gravidade da doença nos pacientes.20,22 Esses achados aparentemente contraditórios podem dever‐se às diferenças na extensão do estresse oxidativo, da gravidade da doença, do polimorfismo enzimático e do cofator enzimático.29 Nossos resultados não mostraram diferença entre as atividades dessas enzimas em crianças com doença falciforme e em crianças saudáveis, de acordo com Cho et al.,30 com relação à catalase. Esses resultados podem dever‐se à grande variabilidade individual encontrada nos pacientes.
Em vista de evidências que sugerem que um excesso de estresse oxidativo tem implicações na fisiopatologia da doença falciforme, a avaliação de parâmetros de estresse oxidativo nesses pacientes poderá fornecer informações úteis sobre o uso de medicações atuais e poderá levar ao desenvolvimento de novas estratégias terapêuticas.10,19,20 O monitoramento do estresse oxidativo envolve a observação de diferentes parâmetros associados a biomarcadores pró‐oxidantes e antioxidantes.27 Contudo, o uso de um biomarcador isolado e a medição de antioxidantes individuais provavelmente não são índices úteis de estado oxidativo. O equilíbrio oxidante‐antioxidante envolve reações bioquímicas que exigem a avaliação de muitos resultados.26
Este estudo avaliou oito marcadores de estresse oxidativo, incluindo parâmetros pró‐oxidantes e antioxidantes. Os resultados indicam a presença de um estado hiperoxidativo em crianças com doença falciforme, que pode ser observado por seus níveis elevados de metemoglobina, TBARS, hemólise, espécies reativas de oxigênio e atividade da G6‐PD. Foram usadas técnicas simples para determinar esses parâmetros com pequenos volumes de sangue. Os parâmetros que apareceram alterados em crianças com doença falciforme podem ser úteis em avaliações de progressão da doença e tratamentos.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Hermann PB, Pianovski MA, Henneberg R, Nascimento AJ, Leonart MS. Erythrocyte oxidative stress markers in children with sickle cell disease. J Pediatr (Rio J). 2016;92:394–9.