The aim of this study was to compare two different empiric treatments for late‐onset neonatal sepsis, vancomycin and oxacillin, in a neonatal intensive care unit with a high prevalence of coagulase‐negative Staphylococcus.
MethodsA cross‐sectional study was conducted in an neonatal intensive care unit from 2011 to 2014. Data from the medical records of at‐risk newborns were collected daily. Infections were defined according to the National Health Surveillance Agency criteria. Data analysis was performed using an internal program.
ResultsThere was a significant reduction in the number of Staphylococcus aureus infections (p=0.008), without endocarditis, meningitis, or lower respiratory tract infection, as well as a reduction in the frequency of deaths related to S. aureus infection. There were no significant changes in the incidence of Gram‐negative bacterial or fungal infections. An increase in coagulase‐negative Staphylococcus infections was observed (p=0.022). However, there was no measured increase in related morbidity and mortality. There was a reduction in the median number of days of treatment with oxacillin from 11.5 to 6 days (p<0.001) and an increase of one day in the median number of days of treatment with vancomycin (p=0.046).
ConclusionsModification of the empiric treatment regimen for neonatal late‐onset sepsis with use of oxacillin showed a significant reduction in S. aureus infections, as well as a reduction in the frequency of infections with major organ system involvement and mortality due to infection with this microorganism. As a result, oxacillin can be considered as an effective treatment for late‐onset sepsis, making it possible to avoid broad‐spectrum antibiotics.
Comparar dois períodos com diferentes esquemas empíricos para tratamento de sepse neonatal tardia, incluindo vancomicina ou oxacilina respectivamente, em unidade neonatal de referência com alta prevalência de Staphylococcus coagulase negativo.
MétodosEstudo transversal, feito em unidade neonatal de referência, de 2011 a 2014. Os dados foram coletados diariamente por vigilância ativa em prontuário de recém‐nascidos de risco. As infecções foram notificadas conforme critérios definidos pela Agência Nacional de Vigilância Sanitária. O banco de dados e a análise foram feitos em programa interno.
ResultadosOcorreu redução significativa da notificação de infecções por Staphylococcus aureus (p=0,008), sem notificações de endocardite, meningite e infecções de vias aéreas inferiores, além de redução na frequência de óbitos pelo microrganismo e sem alteração significativa nas incidências de infecções por bactérias Gram negativas e fungos. Houve aumento de infecções S. aureus coagulase negativo (p=0,022), mas sem aumento de morbidade e mortalidade. Ocorreu redução na mediana do tempo de uso de oxacilina, de 11,5 para 6 dias (p<0,001), com aumento de mediana de um dia de uso de vancomicina (p=0,046).
ConclusõesA modificação do esquema empírico com uso de oxacilina revelou redução significativa das infecções por S. aureus, além da redução na frequência de infecção de foco profundo e mortalidade pelo microrganismo. Considera‐se que oxacilina pode ser usada como esquema de tratamento de sepse neonatal tardia para se evitar o uso de antibióticos de largo espectro.
Os microrganismos mais prevalentes na sepse neonatal tardia descritos na literatura internacional são os Staphylococcus coagulase negativo (SCN).1–6 Embora as taxas de sepse confirmada em laboratório devido a esses microrganismos variem de 30% a 60%,1 também foram relatadas taxas mais elevadas. Esses microrganismos representam 77,9% da sepse neonatal tardia em países industrializados e 46,5% em regiões em desenvolvimento.2 Contudo, as infecções causadas por esses microrganismos comensais normalmente são questionadas devido a dificuldades na confirmação e diferenças nos critérios de notificação.1,7
Também deve ser considerado que os SCN são microrganismos minimamente invasivos que colonizam neonatos após o nascimento e normalmente estão presentes nos microbiomas de diferentes partes do corpo. Eles têm o efeito benéfico de estimular a resposta imune inata e melhorar a defesa contra outros patógenos.2 Contudo, os mecanismos de defesa podem ser inadequados em recém‐nascidos, aumentar sua susceptibilidade a infecção por esses microrganismos.3 Por outro lado, embora sejam considerados microrganismos responsáveis pela sepse em recém‐nascidos, apresentam evolução insidiosa e baixa morbidez e mortalidade.2,5,8–11
Sabe‐se que o perfil de resistência dos SCN pode exceder 90% com relação à isoxazolilpenicilina.3 Como resultado, a vancomicina tem sido considerada o tratamento padrão.1,12 Entretanto, a restrição à vancomicina como terapia empírica para sepse neonatal tardia tem sido indicada na literatura.9–11,13
O objetivo deste estudo é comparar, epidemiologicamente, dois tratamentos empíricos diferentes para sepse tardia em uma unidade de terapia intensiva neonatal (UTIN) com alta prevalência de SCN e S. aureus sensível à oxacilina.
MétodosEste estudo prospectivo observacional foi feito no Hospital das Clínicas da Universidade Federal de Minas Gerais (HC/UFMG), de janeiro de 2011 a dezembro de 2014. O HC/UFMG, hospital universitário, é um recurso para gerenciamento de alto risco obstétrico em Belo Horizonte e no Estado de Minas Gerais.
A população‐alvo consistiu em todos os recém‐nascidos na UTIN considerados em risco de sepse tardia. Os fatores de risco incluíam peso inferior a 1.500g, presença de um cateter venoso central (CVC), uso de ventilação mecânica (VM), cirurgia e tratamento com agentes antimicrobianos. Esses neonatos em risco foram acompanhados diariamente pela equipe especializada da Comissão de Controle de Infecção Hospitalar (CCIH). Os dados foram coletados por vigilância ativa, análise de prontuários médicos e discussão com a equipe médica. As infecções foram relatadas de acordo com a legislação nacional,14 com critérios de infeção definidos pela Agência Nacional de Vigilância Sanitária (Anvisa),15 com base na Rede Nacional de Segurança na Assistência à Saúde (NHSN).7,16
Os critérios de inclusão consideraram todos os recém‐nascidos tratados com oxacilina ou vancomicina como tratamento empírico para sepse tardia, relatada após 48 horas de vida, conforme definido pela Anvisa.15 “Sepse” e “infecção da corrente sanguínea” foram usados como sinônimos.
Um tamanho da amostra foi calculado considerando a prevalência de infecções por SCN e S. aureus confirmada por laboratório a uma taxa de quase 30% e 15% respectivamente, com base em uma população de 300 pacientes em risco por ano.
Um programa interno da CCIH foi usado na análise estatística. A análise descritiva incluiu a frequência de pacientes em risco, a frequência de pacientes com infecção hospitalar (IH), a frequência de IH, a incidência cumulativa de IH (número de IH a cada 100 pacientes em risco) e a densidade de incidência de IH (número de IH a cada 1.000 pacientes‐dia). A densidade de incidência de IH também foi estratificada de acordo com a faixa de peso e a topografia da infecção. A densidade de infecção de infecções relacionadas ao dispositivo foi medida, incluindo infecções associadas ao CVC, à VM e à sonda vesical de demora (SVD).
A frequência de microrganismos foi descrita em grupos (SCN, S. aureus, bactérias gram negativas e fungos) e de acordo com a frequência de agentes antimicrobianos usados na cobertura empírica ou específica das Staphylococcus spp. (oxacilina e vancomicina). Em geral, esses agentes antimicrobianos são empírica ou especificamente usados no tratamento de infecções com Staphylococcus spp. Outros agentes antimicrobianos não foram descritos, pois não são relevantes para este estudo.
O isolamento microbiológico em amostras de pacientes foi feito pelo método automatizado (VITEK®2, BioMérieux Inc, EUA) e o teste de susceptibilidade, pela disco‐difusão em ágar (Kirby Bauer). O perfil de sensibilidade de microrganismos foi definido de acordo com a CCIH do hospital e com base no Instituto de Padrões Clínicos e Laboratoriais (CLSI).
Para a análise comparativa, foram definidos dois períodos: janeiro de 2011 a dezembro de 2012 (Período 1) e janeiro de 2013 a dezembro de 2014 (Período 2). Durante o Período 1, a vancomicina foi usada no regime de tratamento empírico de sepse tardia e a oxacilina foi usada durante o Período 2.
A mortalidade (mortes em relação ao número total de pacientes em risco) e a letalidade (mortes em relação ao número total de pacientes com IH) foram comparadas em ambos os períodos e se levou em consideração o SCN ou o S. aureus. O óbito foi considerado associado à infecção se ocorrido durante ou em até 15 dias do tratamento com o antibiótico do estudo.
A morbidez foi definida como uma infecção com envolvimento dos principais sistemas de órgãos, como endocardite, infecção do trato respiratório inferior (pneumonia, traqueíte ou bronquite) ou infecção do sistema nervoso central com isolamento desses microrganismos, bem como vários dias de tratamento antimicrobiano com oxacilina ou vancomicina.
A análise estatística foi feita por um estatístico por meio do Statistical Package for Social Sciences® (SPSS Inc., versão 15.0, EUA) e do EpiInfo® v7.0 (CDC, EUA). A análise descritiva incluiu frequência, percentual, média, desvio padrão, mediana e faixa. A análise comparativa foi feita por meio do teste qui‐quadrado ou do teste de Fisher para obter variáveis categóricas e do teste t de Student ou de Mann‐Whitney para obter variáveis quantitativas, de acordo com a análise de variância por meio do teste de Levine. A razão de chance foi usada para calcular a medida relativa de eventos entre os dois períodos do estudo e um intervalo de confiança de 95% (IC de 95%) foi usado como medida de precisão do evento estimado. A relevância estatística foi considerada quando p<0,05.
Outras estratégias preventivas e de redução de infecções foram usadas continuamente na UTIN pela equipe da CCIH. Este estudo foi aprovado pelo Conselho de Revisão Institucional do Comitê de Ética em Pesquisa da UFMG.
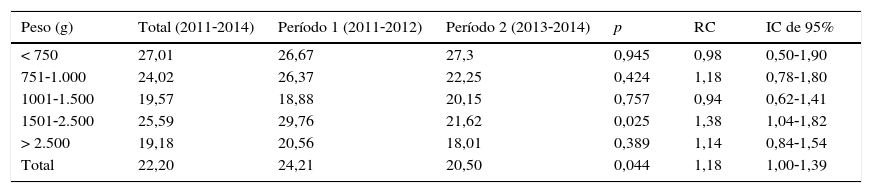
ResultadosAo longo do período do estudo, 1.229 pacientes em risco foram acompanhados e totalizaram 26.260 pacientes‐dia; 367 pacientes apresentaram 583 episódios de IH, com densidade de incidência de 22,20 episódios de IH em 1.000 pacientes‐dia. A tabela 1 apresenta a densidade de incidência de IH por faixa de peso ao nascer, com redução significativa em infecções entre pacientes de 2.500g a 1.501g durante o Período 2. Houve uma redução significativa no número total de infecções relatadas (p=0,044; RC: 1,18; IC de 95% 1‐1,39) (tabela 1).
Incidênciaa de densidade de infecções hospitalares por faixa de peso ao nascer, Unidade de Terapia Intensiva Neonatal, HC/UFMG, 2011‐2014
| Peso (g) | Total (2011‐2014) | Período 1 (2011‐2012) | Período 2 (2013‐2014) | p | RC | IC de 95% |
|---|---|---|---|---|---|---|
| < 750 | 27,01 | 26,67 | 27,3 | 0,945 | 0,98 | 0,50‐1,90 |
| 751‐1.000 | 24,02 | 26,37 | 22,25 | 0,424 | 1,18 | 0,78‐1,80 |
| 1001‐1.500 | 19,57 | 18,88 | 20,15 | 0,757 | 0,94 | 0,62‐1,41 |
| 1501‐2.500 | 25,59 | 29,76 | 21,62 | 0,025 | 1,38 | 1,04‐1,82 |
| > 2.500 | 19,18 | 20,56 | 18,01 | 0,389 | 1,14 | 0,84‐1,54 |
| Total | 22,20 | 24,21 | 20,50 | 0,044 | 1,18 | 1,00‐1,39 |
Dos pacientes em risco durante o Período 1 e o Período 2, 296 (54,81%) e 355 (52,98%) eram do sexo masculino, respectivamente. Não houve diferença estatística no que diz respeito ao sexo (p=0,564; RC: 1,08; IC de 95% 0,85‐1,36), porém 19 recém‐nascidos não tinham sexo definido.
A incidência acumulada de IH foi de 47,44% de pacientes em risco, com uma redução significativa do primeiro para o segundo período do estudo: de 53,8 para 42,4% (p<0,001).
Considerando as infecções relacionadas a dispositivos, não houve diferença significativa na incidência da densidade de infecções por dispositivo‐dia entre os dois períodos de estudo. A densidade de infecção da corrente sanguínea relacionada ao CVC foi de 17,29 infecções por 1.000 dias de CVC e variou de 15,39 a 19,09 (p=0,117; RC: 0,81; IC de 95% 0,62‐1,06). A densidade de pneumonia relacionada à ventilação mecânica foi de 1,93 infecções por 1.000 dias de VM e variou de 2,09 a 1,79 (p=0,789; RC: 1,17; IC de 95% 0,38‐3,62). A densidade de infecção do trato urinário relacionada à SVD foi de 6,05 por 1.000 dias de SVD e variou de 8,46 a 4,33 (p=0,243; RC: 1,96; IC de 95% 0,62‐6,16).
A frequência dos episódios de IH tratada com ambos os antibióticos foi comparada entre os dois períodos e a implantação do novo protocolo foi considerada eficaz. Houve uma redução significativa no uso de vancomicina, de 175 para 97 episódios de IH tratada com vancomicina (p<0,001; RC: 1,98; IC de 95% 1,52‐2,60), e houve um aumento significativo de 30 para 132 episódios de IH tardia tratada com oxacilina (p<0,001; RC: 4,68; IC de 95% 3,07‐7,17).
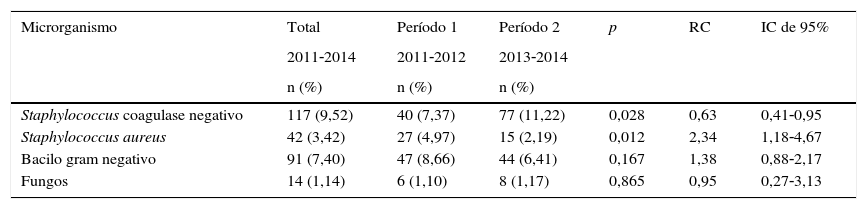
Considerando a frequência dos microrganismos isolados em casos de IH em pacientes de alto risco, houve uma redução significativa de IH devido ao S. aureus quando a oxacilina era parte do regime empírico inicial (p=0,012) e um aumento na IH devido ao SCN (p=0,028), porém não foram observadas alterações significativas na proporção de bactérias gram negativas ou fungos (tabela 2). Todas as S. aureus isoladas de amostras de pacientes com IH no Período 1 eram sensíveis a oxacilina. Durante o Período 2, apenas uma amostra apresentou um perfil resistente a oxacilina no teste de sensibilidade. Isso revela que a prevalência de S. aureus resistente a oxacilina nessa UTIN foi calculada em 2,4% (n=1/42).
Frequência de microrganismos isolados em infecções hospitalares por paciente em risco, Unidade de Terapia Intensiva Neonatal, HC/UFMG, 2011‐2014
| Microrganismo | Total | Período 1 | Período 2 | p | RC | IC de 95% |
|---|---|---|---|---|---|---|
| 2011‐2014 | 2011‐2012 | 2013‐2014 | ||||
| n (%) | n (%) | n (%) | ||||
| Staphylococcus coagulase negativo | 117 (9,52) | 40 (7,37) | 77 (11,22) | 0,028 | 0,63 | 0,41‐0,95 |
| Staphylococcus aureus | 42 (3,42) | 27 (4,97) | 15 (2,19) | 0,012 | 2,34 | 1,18‐4,67 |
| Bacilo gram negativo | 91 (7,40) | 47 (8,66) | 44 (6,41) | 0,167 | 1,38 | 0,88‐2,17 |
| Fungos | 14 (1,14) | 6 (1,10) | 8 (1,17) | 0,865 | 0,95 | 0,27‐3,13 |
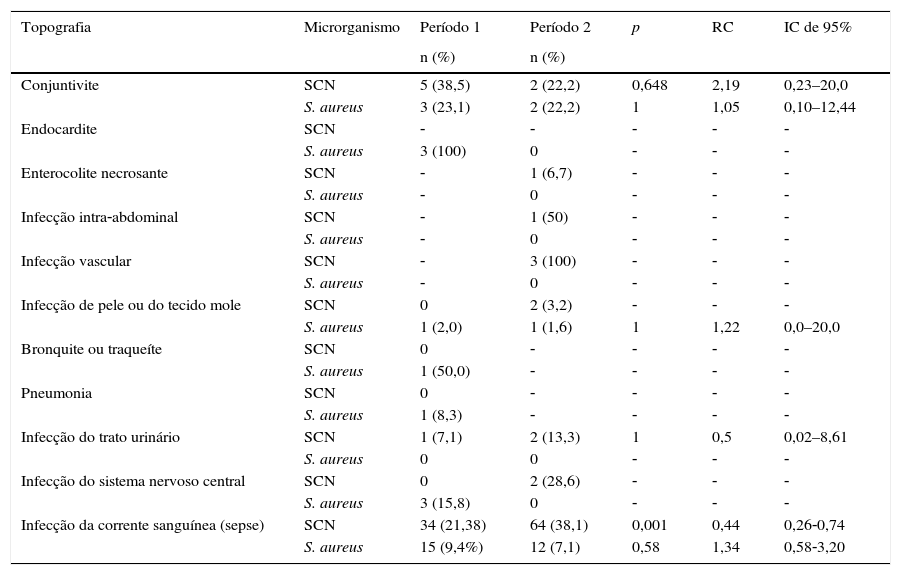
A tabela 3 mostra IH por topografia, considerando infecções relacionadas a S. aureus e SCN. No Período 2, não observamos infecção com o envolvimento dos principais sistemas de órgãos, como endocardite, infecção do trato respiratório inferior ou infecção do sistema nervoso central com isolamento de S. aureus; foram relatadas apenas conjuntivite, infecção da pele e infecção da corrente sanguínea por esse microrganismo.
Infecções hospitalares por S. aureus e Staphylococcus coagulase negativo (SCN) por topografia, Unidade de Terapia Intensiva Neonatal, HC/UFMG, 2011‐2014
| Topografia | Microrganismo | Período 1 | Período 2 | p | RC | IC de 95% |
|---|---|---|---|---|---|---|
| n (%) | n (%) | |||||
| Conjuntivite | SCN | 5 (38,5) | 2 (22,2) | 0,648 | 2,19 | 0,23–20,0 |
| S. aureus | 3 (23,1) | 2 (22,2) | 1 | 1,05 | 0,10–12,44 | |
| Endocardite | SCN | ‐ | ‐ | ‐ | ‐ | ‐ |
| S. aureus | 3 (100) | 0 | ‐ | ‐ | ‐ | |
| Enterocolite necrosante | SCN | ‐ | 1 (6,7) | ‐ | ‐ | ‐ |
| S. aureus | ‐ | 0 | ‐ | ‐ | ‐ | |
| Infecção intra‐abdominal | SCN | ‐ | 1 (50) | ‐ | ‐ | ‐ |
| S. aureus | ‐ | 0 | ‐ | ‐ | ‐ | |
| Infecção vascular | SCN | ‐ | 3 (100) | ‐ | ‐ | ‐ |
| S. aureus | ‐ | 0 | ‐ | ‐ | ‐ | |
| Infecção de pele ou do tecido mole | SCN | 0 | 2 (3,2) | ‐ | ‐ | ‐ |
| S. aureus | 1 (2,0) | 1 (1,6) | 1 | 1,22 | 0,0–20,0 | |
| Bronquite ou traqueíte | SCN | 0 | ‐ | ‐ | ‐ | ‐ |
| S. aureus | 1 (50,0) | ‐ | ‐ | ‐ | ‐ | |
| Pneumonia | SCN | 0 | ‐ | ‐ | ‐ | ‐ |
| S. aureus | 1 (8,3) | ‐ | ‐ | ‐ | ‐ | |
| Infecção do trato urinário | SCN | 1 (7,1) | 2 (13,3) | 1 | 0,5 | 0,02–8,61 |
| S. aureus | 0 | 0 | ‐ | ‐ | ‐ | |
| Infecção do sistema nervoso central | SCN | 0 | 2 (28,6) | ‐ | ‐ | ‐ |
| S. aureus | 3 (15,8) | 0 | ‐ | ‐ | ‐ | |
| Infecção da corrente sanguínea (sepse) | SCN | 34 (21,38) | 64 (38,1) | 0,001 | 0,44 | 0,26‐0,74 |
| S. aureus | 15 (9,4%) | 12 (7,1) | 0,58 | 1,34 | 0,58‐3,20 |
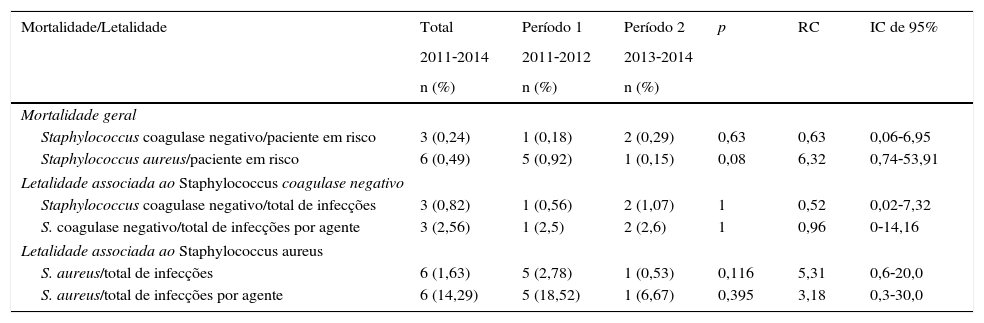
A mortalidade e a letalidade foram calculadas comparando casos de óbito devido a IH causada por S. aureus ou SCN entre os dois períodos (tabela 4). A mortalidade foi considerada o número de óbitos associados a essas infecções em relação ao número total de óbitos. A letalidade foi considerada o número de óbitos associados a essas infecções em relação ao número total de casos de IH por cada microrganismo. Não houve variações significativas, porém houve apenas um óbito associado a S. aureus durante o Período 2 (quando a terapia empírica incluía a oxacilina), em comparação com cinco óbitos no Período 1. Nenhuma diferença estatística foi observada na mortalidade associada à infecção por SCN, com um número menor de óbitos associados.
Mortalidade e letalidade de pacientes com IH por Staphylococcus spp., Unidade de Terapia Intensiva Neonatal, HC/UFMG, 2011‐2014
| Mortalidade/Letalidade | Total | Período 1 | Período 2 | p | RC | IC de 95% |
|---|---|---|---|---|---|---|
| 2011‐2014 | 2011‐2012 | 2013‐2014 | ||||
| n (%) | n (%) | n (%) | ||||
| Mortalidade geral | ||||||
| Staphylococcus coagulase negativo/paciente em risco | 3 (0,24) | 1 (0,18) | 2 (0,29) | 0,63 | 0,63 | 0,06‐6,95 |
| Staphylococcus aureus/paciente em risco | 6 (0,49) | 5 (0,92) | 1 (0,15) | 0,08 | 6,32 | 0,74‐53,91 |
| Letalidade associada ao Staphylococcus coagulase negativo | ||||||
| Staphylococcus coagulase negativo/total de infecções | 3 (0,82) | 1 (0,56) | 2 (1,07) | 1 | 0,52 | 0,02‐7,32 |
| S. coagulase negativo/total de infecções por agente | 3 (2,56) | 1 (2,5) | 2 (2,6) | 1 | 0,96 | 0‐14,16 |
| Letalidade associada ao Staphylococcus aureus | ||||||
| S. aureus/total de infecções | 6 (1,63) | 5 (2,78) | 1 (0,53) | 0,116 | 5,31 | 0,6‐20,0 |
| S. aureus/total de infecções por agente | 6 (14,29) | 5 (18,52) | 1 (6,67) | 0,395 | 3,18 | 0,3‐30,0 |
A morbidez também foi avaliada considerando a duração do tratamento antimicrobiano. Houve uma redução significativa na duração do tratamento com oxacilina no Período 2, com redução do tempo médio de 11,5 para 6 dias (p<0,001). A duração do tratamento com vancomicina aumentou apenas 1 dia, variou de 8 dias no Período 1 para 9 dias no Período 2 (p=0,046).
DiscussãoApós a introdução do tratamento empírico com oxacilina no regime terapêutico para sepse tardia, observamos uma redução significativa nos casos de IH causados por S. aureus sensível à oxacilina (p=0,012). A incidência da densidade das infecções também diminuiu significativamente e ficou evidente principalmente em pacientes com peso entre 1.501 e 2.500g. Um estudo anterior17 já mostrou um número maior de pacientes nessa faixa de peso com risco de infecções na corrente sanguínea confirmadas em laboratório, devido, provavelmente, ao perfil dessa UTIN, já que se trata de um Centro de Medicina Fetal. Esses pacientes têm internações prolongadas e estão em risco de necessidade de cirurgia, CVC e VM, que poderão aumentar o risco de infecção.
Apesar do aumento nos casos de infecção relacionada a SCN, não observamos aumento na mortalidade e na morbidez avaliada. Isso indica que esse microrganismo pode ser considerado menos patogênico e apresenta evolução insidiosa em comparação com o S. aureus, conforme relatado na literatura.1,2,12
Também deve ser indicado que a infecção por SCN poderá ser questionada e os critérios de diagnóstico exigem no mínimo duas hemoculturas com o mesmo microrganismo.7,15 Além disso, outros estudos demonstram que é possível acompanhar os resultados clínicos, aguardar por resultados da cultura e também adiar a administração de agentes antimicrobianos em pacientes com suspeita de infecção por SCN.9–11,18
Após a modificação do regime de tratamento empírico para incluir o uso de oxacilina, houve um aumento nas infecções relacionadas ao SCN. Entretanto, não foi detectada diferença estatística em percentuais de infecção associada a bactérias gram negativas e fungos. Foi considerado que não houve interferência negativa no perfil da flora e, consequentemente, no perfil de exposição do paciente. Adicionalmente, foi atingida uma redução estatística geral de IH. Deve ser enfatizado que um número menor de infecções está diretamente relacionado ao uso menor de agentes antimicrobianos. Conforme relatado por Pinto et al.,6 os critérios para reduzir a sepse incluem reduzir, de forma significativa, o uso de vancomicina e carbapenema, bem como a quantidade de agentes antimicrobianos usada, apesar de esses autores não apresentarem um perfil da flora.
Conforme publicado em outros relatórios,9,11 este estudo revelou que o tratamento empírico com oxacilina ainda reduziu significativamente a duração do tratamento (p<0,001) em mais de 50% dos dias, com aumento de um único dia com a vancomicina no Período 2. A redução no número de dias de uso de oxacilina pode, provavelmente, ser associada ao uso empírico ou específico adequado, pois a oxacilina tem melhor atividade antimicrobiana e eficácia terapêutica em infecções sensíveis por S. aureus. É importante ressaltar que o S. aureus tem um perfil sensível à oxacilina nessa UTIN, o que justifica a alteração da terapia empírica.
Em um estudo nacional de Bentlin et al.,19 que investigou práticas relacionadas à prevalência da sepse tardia em neonatos prematuros, os autores observaram que centros que usam terapia empírica com oxacilina e aminoglicosídeos apresentam menor incidência de sepse tardia, devido, provavelmente, a um tratamento mais eficaz.
Considerando a recomendação de isoxazolilpenicilinas associadas à gentamicina como tratamento empírico de sepse neonatal tardia, um estudo de Chiu et al.9 também mostrou uma redução significativa no uso de vancomicina e um aumento no uso de oxacilina sem diferença significativa na morbidez e na mortalidade neonatais conforme avaliado pela incidência da sepse tardia, meningite e óbito. Contudo, esses autores não compararam pacientes com IH relacionada a S. aureus e SCN confirmadas em laboratório como neste estudo, o que mostra uma redução significativa nos episódios de infecções relacionadas a S. aureus, com um número menor de casos de infecções com envolvimento dos principais sistemas de órgãos, como endocardite, infecção do trato respiratório inferior e infecção do sistema nervoso central.
Além de uma redução estatística no número geral de IH, bem como IH devido a S. aureus suscetível, também foi observado um número menor de infecções com envolvimento dos principais sistemas de órgãos, foi observada a redução da mortalidade associada a esse microrganismo e foi demonstrada uma redução significativa nos dias de duração do tratamento e internação. Esses achados podem ser considerados adequados para evitar a morbidez associada à sepse e a exposição a outros eventos adversos. Conforme relatado por Kaufman,20 a precisão no diagnóstico e a redução do uso de agentes antimicrobianos são importantes na prevenção de infecções em geral e, especificamente, da mortalidade neonatal relacionada à sepse.
Um estudo multicêntrico com 348 UTINs11 avaliou o uso imediato de vancomicina (< 1 dia) e o uso postergado (1 a 3 dias) no primeiro episódio de sepse tardia associada a SCN. Os autores relataram que não houve diferença nas taxas de mortalidade em 7 ou 30 dias após o início do tratamento ou na alta. Adicionalmente, pacientes que iniciaram o uso de vancomicina apresentaram imediatamente uma duração significativamente maior de tratamento, com mediana de 2 dias adicionais. Em outro estudo multicêntrico conduzido pelo mesmo grupo,18 não houve diferença na mortalidade ao se compararem os recém‐nascidos com infecção por SCN possível, provável ou confirmada. Além disso, os autores relataram que os pacientes com infecções associadas ao SCN apresentaram mortalidade significativamente menor do que os pacientes com hemoculturas negativas, considerando que a mortalidade mais elevada poderia ser atribuída a outros microrganismos não isolados em hemoculturas. Deve ser considerado que um agente antimicrobiano poderá ser usado desnecessariamente, conforme as possíveis ou prováveis infecções por SCN forem superestimadas.
Cotten et al.,21 em um estudo de coorte multicêntrico, constataram em uma análise multivariada que a duração prolongada da terapia inicial em dias estava associada ao óbito de neonatos de extremo baixo peso, principalmente se o tratamento com agentes antimicrobianos ultrapassasse cinco dias, com aumento das chances por dia de uso de antimicrobianos. Também deve ser considerado que a mortalidade aumenta quando a terapia empírica é inadequada, um fator que pode aumentar a duração do tratamento.
Um estudo anterior na mesma UTIN revelou alta mortalidade de pacientes com sepse por S. aureus confirmada por laboratório.5 Neste estudo, observamos uma redução na frequência de óbitos devido a IH relacionada a S. aureus no Período 2 (1 óbito) em comparação ao Período 1 (5 óbitos). Essa redução tendia a ser significativa (p=0,08). O único óbito associado a S. aureus no Período 2 foi de um paciente com várias malformações e possível trissomia do cromossomo 13. Devido à gravidade clínica da doença do paciente, foram feitos testes para triagem da infecção. Contudo, o tratamento com oxacilina foi iniciado quando os resultados da hemocultura foram divulgados, dois dias após o teste. O óbito poderá estar associado à doença de base e à demora no uso de um agente antimicrobiano adequado.
Este estudo identificou apenas um e dois casos de óbito devido a IH relacionada a SCN nos Períodos 1 e 2, respectivamente, sem relevância estatística. A literatura também informa que a mortalidade associada a infecção por SCN está relacionada a 1% dos casos.5,10 Karlowicz et al.10 investigaram causas de sepse tardia fulminante e observaram que, mesmo quando os casos de infecção por SCN foram associados a óbito, os pacientes apresentavam outras comorbidades ou as culturas produziram mais de um microrganismo, o que sugere contaminação. Mackhoul et al.8 avaliaram fatores de risco de mortalidade precoce após sepse neonatal tardia e relataram que os pacientes com infecções causadas por SCN apresentavam um risco menor de óbito em comparação com pacientes com infecções causadas por outros microrganismos.
Em um estudo feito por Hemels et al.13 usou‐se cefazolina associada a gentamicina como tratamento empírico para sepse neonatal tardia devido a SCN. A resposta clínica foi observada em 87% dos pacientes tratados e a sensibilidade à cefazolina foi observada em 88% das cepas analisadas. Nenhuma diferença foi observada no tempo de internação (0,77 dias) ou na mortalidade (p=0,33) entre pacientes tratados com sepse devido a cepas de SCN sensíveis ou resistentes. Esses autores sugerem que outros antibióticos betalactâmicos poderão ser úteis no tratamento de IH em recém‐nascidos e reduzir a necessidade de uso de vancomicina.
Considerando o uso racional de antibióticos, o uso da vancomicina deveria ser restrito em unidades com alta prevalência de S. aureus resistente a vancomicina, em casos sem resposta clínica ou laboratorial em até 48‐72 horas, apesar do uso de um betalactâmico como a oxacilina, e em casos definidos de SCN resistente a oxacilina sem resposta clínica e que não seja considerado comensal.1,22 Essas recomendações seguem as diretrizes do Centro de Controle e Prevenção de Doenças a fim de evitar aumento significativo de cepas de Enterococcus spp e de outras bactérias resistentes a vancomicina.23 A restrição do uso de agentes antimicrobianos com base na gestão é importante para reduzir a interferência no microbioma, na seleção de microrganismos resistentes e em manifestações atópicas e outras complicações em neonatos prematuros, como enterocolite e óbito.24
Concluindo, este estudo mostrou que não houve pioria dos resultados em recém‐nascidos ao se usarem betalactâmicos antiestafilocócicos para tratar sepse tardia, considerando que as taxas de mortalidade e morbidez relacionadas a infecções por SCN não aumentaram e que também houve uma melhoria nas taxas de infecções relacionadas à S. aureus. Assim, a gestão de antimicrobianos com o uso da oxacilina pode ser recomendada na sepse neonatal tardia de acordo com o perfil epidemiológico de cada UTIN, que deve estar relacionada a outras práticas de prevenção de infecções eficazes a fim de evitar o uso de agentes antimicrobianos de amplo espectro.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Romanelli RM, Anchieta LM, Silva AC, de Jesus LA, Rosado V, Clemente WT. Empirical antimicrobial therapy for late‐onset sepsis in a neonatal unit with high prevalence of coagulase‐negative Staphylococcus. J Pediatr (Rio J). 2016;92:472–8.
Estudo feito na Faculdade de Medicina, Universidade Federal de Minas Gerais, Belo Horizonte, MG, Brasil.