To explore the effect of erythromycin on hyperoxia‐induced lung injury.
MethodsOne‐day‐old preterm offspring Sprague‐Dawley (SD) rats were randomly divided into four groups: group 1, air + sodium chloride; group 2, air + erythromycin; group 3, hyperoxia + sodium chloride; and group 4, hyperoxia + erythromycin. At one, seven, and 14 days of exposure, glutathione (GSH) and interleukin‐1 beta (IL‐1 beta) were detected by double‐antibody sandwich enzyme‐linked immunosorbent assay (ELISA), and bicinchoninic acid (BCA) was used to detect GSH protein. γ‐glutamine‐cysteine synthetase (γ‐GCS) mRNA was detected by reverse transcription‐polymerase chain reaction (RT‐PCR).
ResultsCompared with group 1, expressions of GSH and γ‐GCS mRNA in group 3 were significantly increased at one and seven days of exposure (p<0.05), but expression of γ‐GCS mRNA was significantly reduced at 14 days; expression of IL‐1 beta in group 3 was significantly increased at seven days of exposure (p<0.05), and was significantly reduced at 14 days. Compared with group 3, expressions of GSH and γ‐GCS mRNA in group 4 were significantly increased at one, seven, and 14 days of exposure (p<0.05), but expressions of GSH showed a downward trend at 14 days; expression of IL‐1 beta in group 4 was significantly reduced at one and seven days of exposure (p<0.05).
ConclusionsChanges in oxidant‐mediated IL‐1 beta and GSH are involved in the development of hyperoxia‐induced lung injury. Erythromycin may up‐regulate the activity of γ‐GCS, increasing the expression of GSH, inhibiting the levels of oxidant‐mediated IL‐1 beta and alleviating hyperoxia‐induced lung injury via an antioxidant effect.
Explorar o efeito da eritromicina sobre lesões pulmonares induzidas por hiperóxia.
MétodosUma prole de ratos Sprague‐Dawley (SD) prematuros com um dia de vida foi dividida aleatoriamente em quatro grupos: grupo 1 ar + cloreto de sódio, grupo 2 ar + eritromicina, grupo 3 hiperóxia + cloreto de sódio e grupo 4 hiperóxia + eritromicina. Com um, sete e 14 dias de exposição, foram detectadas Glutationa (GSH) e Interleucina‐1 beta (IL‐1 beta) pelo ensaio imunossorvente ligado à enzima (ELISA), e o ácido bicinconinico (BCA) foi utilizado para detectar a proteína GSH. O mRNA da γ‐glutamil‐cisteina‐sintetase (γ‐GCS) foi detectado por reação em cadeia da polimerase via transcriptase reversa (RT‐PCR).
ResultadosComparadas ao grupo 1, as expressões do mRNA da GSH e da γ‐GCS no grupo 3 aumentaram significativamente com um e sete dias de exposição (p<0,05), porém a expressão de mRNA da γ‐GCS diminuiu significativamente aos 14 dias; a expressão de IL‐1 beta no grupo 3 aumentou significativamente aos 7 dias de exposição (p<0,05) e diminuiu significativamente aos 14 dias. Comparadas ao grupo 3, as expressões do mRNA da GSH e da γ‐GCS no grupo 4 aumentaram significativamente com um, sete e 14 dias de exposição (p<0,05), porém as expressões de GSH mostraram uma tendência de queda aos 14 dias; a expressão de IL‐1 beta no grupo 4 foi reduzida significativamente com um e sete dias de exposição (p<0,05).
ConclusõesAs variações de IL‐1 beta e GSH mediadas por oxidantes estão envolvidas no desenvolvimento de lesão pulmonar induzida por hiperóxia. A eritromicina poderá regular positivamente a atividade da γ‐GCS, aumentando a expressão de GSH, inibindo os níveis de interleucina‐1beta mediada por oxidante e aliviando a lesão pulmonar induzida por hiperóxia por meio de um efeito antioxidante.
Com o rápido desenvolvimento da tecnologia de saúde materna e da perinatologia, a taxa de sobrevida de neonatos prematuros tem aumentado, principalmente em neonatos com peso muito baixo ao nascer (VLBWI).1 Entretanto, os pulmões de neonatos prematuros normalmente são imaturos e estão em contato direto com o oxigênio, sendo um dos órgãos mais sensíveis à toxicidade do oxigênio. Ademais, neonatos prematuros precisam receber várias terapias de oxigênio por um longo período após o nascimento. Infelizmente, sem dúvidas, isso agrava o estresse oxidativo nos pulmões imaturos de neonatos prematuros e pode causar lesão pulmonar aguda e crônica.2
A lesão pulmonar induzida por hiperóxia é a principal causa de doenças respiratórias crônicas desde a infância até a vida adulta, e se tornou um dos problemas mais difíceis na unidade de terapia intensiva neonatal. Contudo, a etiologia e a patogênese não são totalmente compreendidas.3 Atualmente, a maioria dos pesquisadores acredita que o tecido pulmonar imaturo diretamente exposto ao ambiente hiperóxico resulta em estresse oxidativo, que tem um papel crucial no desenvolvimento de lesão pulmonar induzida por hiperóxia.4,5 O estresse oxidativo pode perturbar o equilíbrio entre oxidantes e antioxidantes e é um dos principais fatores patogênicos.6 A GSH é um importante antioxidante intracelular e possui um papel fundamental na manutenção da integridade e na prevenção de danos oxidativos nas células epiteliais alveolares.7 A γ‐GCS é a enzima que limita a taxa de síntese proteica da GSH e regula os níveis intracelulares da GSH.8 A IL‐1 beta está presente na fase inicial da displasia broncopulmonar (DBP) em neonatos prematuros e poderá ter um papel importante no desenvolvimento da DBP. Contudo, a patogênese exata da DBP permanece obscura e os tratamentos clinicamente efetivos continuam limitados.
O efeito não antibacteriano da eritromicina atraiu gradualmente a atenção da maioria dos pesquisadores.9 Ela apresenta muitas funções fisiológicas importantes, incluindo: atividade antibacteriana eficaz, efeitos anti‐inflamatórios não específicos na asma, regulação imunológica, aderência química induzida, motilidade gastrointestinal promovida e efeito antitumoral.10 A eritromicina trata de maneira efetiva muitas doenças inflamatórias infecciosas não bacterianas crônicas, algumas das quais apresentam reações redox não balanceadas.11 Entretanto, a maneira como os níveis de expressão de GSH, γ‐GCS e IL‐1 beta são afetados no tecido pulmonar exposto à hiperóxia continua indefinida. No presente estudo, exploramos o efeito da eritromicina sobre a lesão pulmonar induzida por hiperóxia em ratos prematuros e estudamos os níveis de expressão de GSH, γ‐GCS e IL‐1 beta em tecidos pulmonares de ratos prematuros.
Materiais e métodosModelos animais experimentais12 e agrupamentoO Centro de Animais Experimentais do Centro de Pesquisa em Medicamentos Tradicionais de Grupos Étnicos Minoritários Chineses da Universidade Central para Nacionalidades, Pequim, China, forneceu Ratos SD adultos (com peso entre 200‐250g, incluindo 100 fêmeas e 35 machos). O primeiro dia de gestação foi registrado ao detectar esperma na região vaginal de ratas fêmeas por meio de análise microscópica. No 21° dia de gestação (período=22 dias), os fetos foram retirados por meio de uma histerectomia. Os ratos SD prematuros com um dia de vida foram divididos aleatoriamente em quatro grupos (oito filhotes em cada grupo): o grupo 1 recebeu ar (21% O2) + cloreto de sódio; o grupo 2 recebeu ar + eritromicina; o grupo 3, hiperóxia + cloreto de sódio; e o grupo 4, hiperóxia + eritromicina. Os ratos nos grupos com ar foram expostos a ar ambiente, enquanto os que estavam em grupos com hiperóxia foram expostos a concentrações de O2 superiores a 85% e de CO2 inferiores a 0,5%, com temperaturas mantidas a 25‐26°C e 60‐70% de umidade, e os níveis de oxigênio e CO2 na câmara foram monitorados continuamente com analisadores de gás.12 Na veia caudal dos ratos prematuros, foram injetados cloreto de sódio (0,15mL/kg) nos grupos que receberam cloreto de sódio e eritromicina (50mg/kg) nos grupos que receberam eritromicina. Com um, sete e 14 dias de exposição, oito filhotes de cada grupo foram anestesiados e sacrificados. A proteína foi extraída do pulmão esquerdo, e o pulmão direito foi congelado e armazenado a ‐70°C em um refrigerador para RT‐PCR.
O estudo foi aprovado por decisão do comitê de ética e gestão de bem‐estar de animais experimentais do hospital da criança de Xangai, Universidade Jiao Tong, Xangai, China.
Detecção de GSH e IL‐1 beta no homogenato do tecido pulmonar pelo teste ELISAOs tecidos pulmonares foram coletados e as proteínas totais extraídas utilizando um kit de extração de proteínas. A concentração de proteínas foi mensurada utilizando o método Bradford (Laboratório Bio‐Rad, CA, EUA). A GSH e a IL‐1 beta foram detectadas no homogenato do tecido pulmonar por kits do teste ELISA obtidos da Nanjing Jiancheng Biological Technology Co. Ltd., Nanquim, China, e da Wuhan Huamei Cusabio Biological Technology Co. Ltd., Wuhan, China, respectivamente.
Para permitir que todos os reagentes alcançassem a temperatura ambiente e organizar e rotular o número necessário de fileiras, 100μL de reagentes foram adicionados a poços de placas de poliestireno do ELISA, e os poços foram minuciosamente lavados com tampão fosfato‐salino (PBS) contendo 0,1% de Tween‐20 (PBS‐Tween) (Bio‐Rad Laboratories, CA, USA) após cada etapa de incubação. Para preparar todos os reagentes, incluindo padrões de trabalho e amostras, 100μL dos padrões, controles ou amostras foram adicionados aos poços e incubados por duas horas a 37°C. Após a lavagem dos poços, 100μL de anticorpos policlonais de GSH (ou IL‐1 beta) de cabra antirrato foram adicionados a cada poço (incubação por 30min a 37°C). Após uma extensa lavagem, 100μL de imunoglobulina G (IgG) de coelhos anticabra foram adicionados à cada poço por uma hora a 37°C. Após a incubação da solução de substrato e da solução de paragem, a leitura da densidade óptica de cada poço foi feita em 30 minutos, utilizando uma leitora de microplacas ajustada para 450nm.
Detecção de concentrações proteicas de GSH em homogenatos do tecido pulmonar por ácido bicinconínico (BCA)Após o protocolo padrão para o Kit de Ensaio de Proteína Micro BCA (Beijing Baitaike Biological Technology Co., Pequim, China), a solução de trabalho é: Misturar um volume do reagente C com 25 volumes do reagente B e, então, adicionar 26 volumes do reagente A à mistura C/B. O valor do pH da solução de trabalho foi 11,16±0,06, medido com um pHmetro Orion 310 (Thermo Scientific, MA, USA). O padrão de proteínas completamente dissolvidas (5mg/mL), 10μL diluídos em 100μL, de forma que a concentração final fosse 0,5mg/ml, seria o padrão de diluição de acordo com 0, 1, 2, 4, 8, 12, 16, 20μL, respectivamente, para a placa de 96 poços, adicionar água ultrapura até 20μL, amostras de 10μL e 200μL de BCA adicionados à solução de trabalho, batendo gentilmente na placa para garantir a mistura e resfriando as amostras de 37°C até a temperatura ambiente por 30‐60 minutos. Cada medição foi feita em duplicata. Todas as absorbâncias foram corrigidas pela réplica em branco correspondente. A absorbância da solução em branco foi 0,048±0,006. A absorbância em 562nm foi medida por um espectrofotômetro utilizando cuvetes de vidro com comprimento do percurso óptico de 0,1cm.
Expressão de mRNA da γ‐GCS detectada por RT‐PCRO RNA total foi extraído utilizando o Sistema de Isolamento do RNA Total RNAgent (Promega Corporation, WI, USA), de acordo com as instruções do fabricante. A pureza e a produção de RNA total foram determinadas espectrofotometricamente com a medição da absorbância de uma alíquota a 260nm e 280nm. O RNA (4μg) foi transcrito reversamente em 50μL de DNA complementar (cDNA) utilizando o sistema de Transcriptase Reversa M‐MLV (Jingmei Biotech Ltd, Shenzhen, China). As primeiras sequências foram projetadas pela Shanghai Biology Engineering Co., China, de acordo com a literatura: γ‐GCS, transcrição: 5’‐TTGGCAGCCTT CCTGATTTC‐3’, transcrição reversa: 5’‐AACTTCTCCACAACCCTCTG‐3’, tamanho do produto: 78 pb; β‐actina, transcrição: 5’‐AAC GCAGCTCAGTAACAGTC‐3’, transcrição reversa: 5’‐ATCCGT AAA AGCCTCTATGC‐3’ tamanho do produto: 280 pb. As misturas de reação da PCR com γ‐GCS e β‐actina foram submetidas à incubação por cinco minutos a 94°C, seguida de 35 ciclos de 94°C por 45 segundos, 50°C por um minuto e 72°C por 30 segundos. Uma extensão final foi realizada a 72°C por dez minutos. Os produtos da PCR foram separados por eletroforese em gel de agarose a 2%, tingidos com brometo de etídio (0,5μg/mL), sendo observados utilizando um transiluminador UV e avaliados através de um sistema de imagem com gel GSD‐8000 (UVP Co., Cambridge, Reino Unido), ao comparar a intensidade das faixas do produto objeto de análise com a intensidade de β‐actina utilizada como padrão interno.
Análise estatísticaOs dados foram analisados utilizando o pacote de software estatístico SPSS, versão 16.0 (IBM, Armonk, NY, EUA). Todos os dados foram apresentados em média±desvio‐padrão. As diferenças estatísticas entre os grupos foram testadas pela análise de variância (ANOVA) e os dados entre dois grupos foram analisados utilizado o teste q. Um valor de p inferior a 0,05 foi considerado estatisticamente significativo.
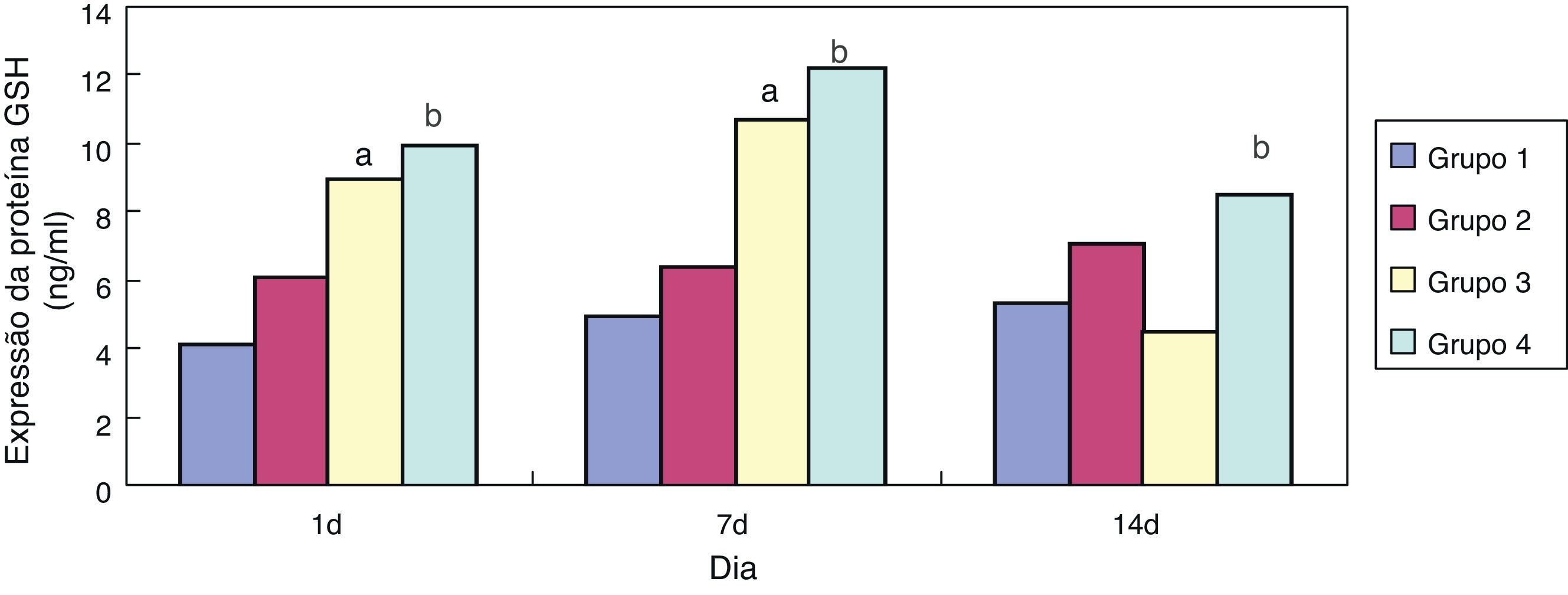
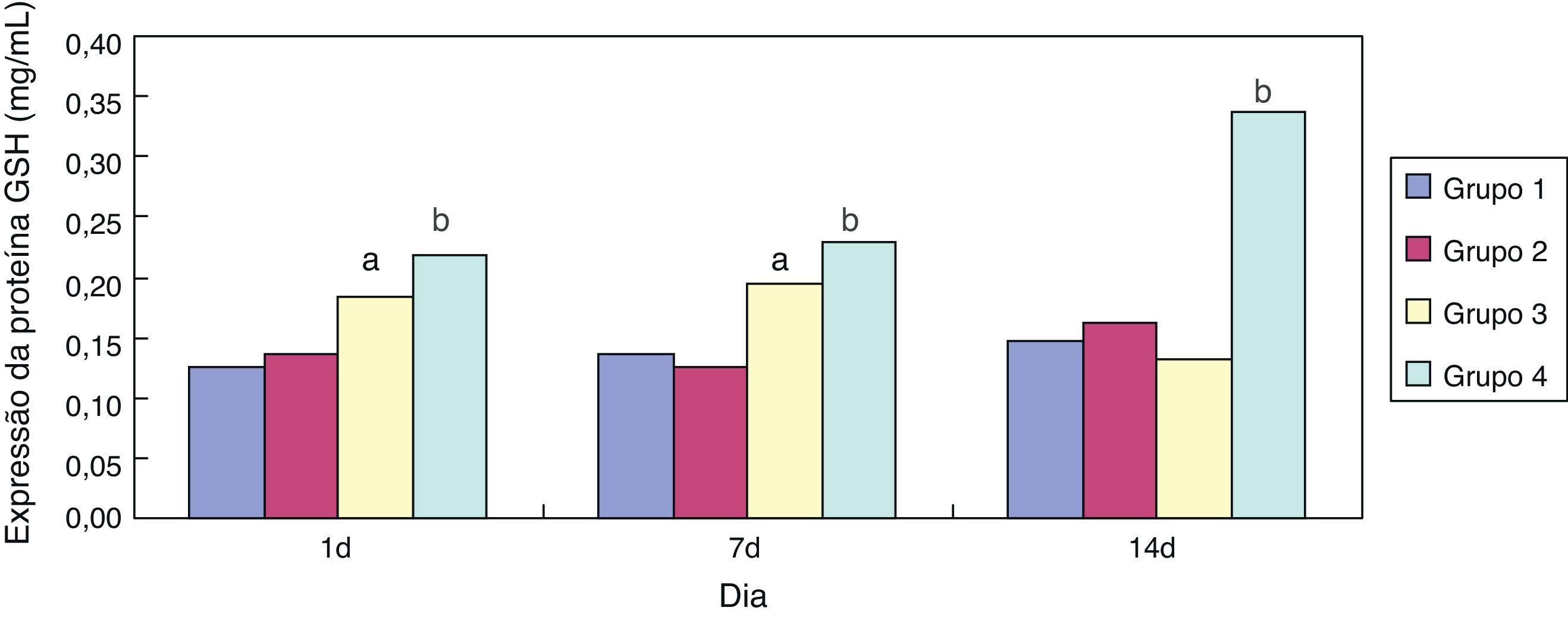
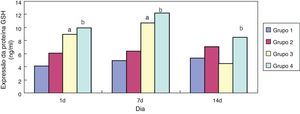
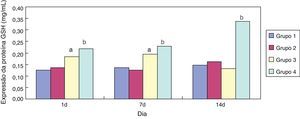
ResultadosEfeito da eritromicina sobre a GSH em tecido pulmonar exposto à hiperóxiaEm comparação ao grupo 1, a expressão de GSH no grupo 3 aumentou significativamente (p<0,05) com um e sete dias de exposição, porém não mostrou nenhuma redução significativa (p>0,05) aos 14 dias. Em comparação ao grupo 3, a expressão de GSH no grupo 4 aumentou significativamente com um, sete e 14 dias de exposição (p<0,05); a tendência geral diminuiu após 14 dias (figs. 1 e 2).
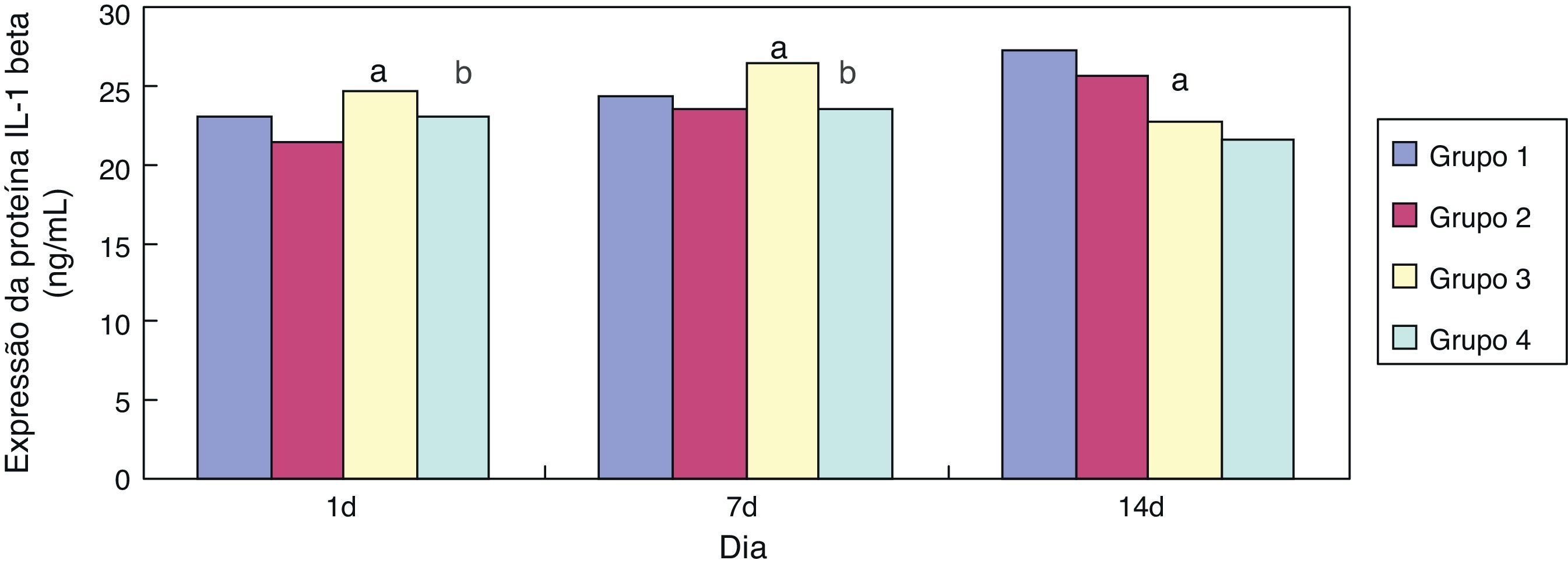
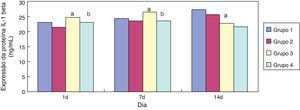
Em comparação ao grupo 1, a expressão de IL‐1 beta no grupo 3 aumentou significativamente (p<0,05) aos sete dias de exposição; sua expressão diminuiu significativamente (p<0,05) aos 14 dias de exposição. Em comparação ao grupo 3, a expressão de IL‐1 beta no grupo 4 diminuiu significativamente com um e sete dias de exposição (p<0,05) (fig. 3).
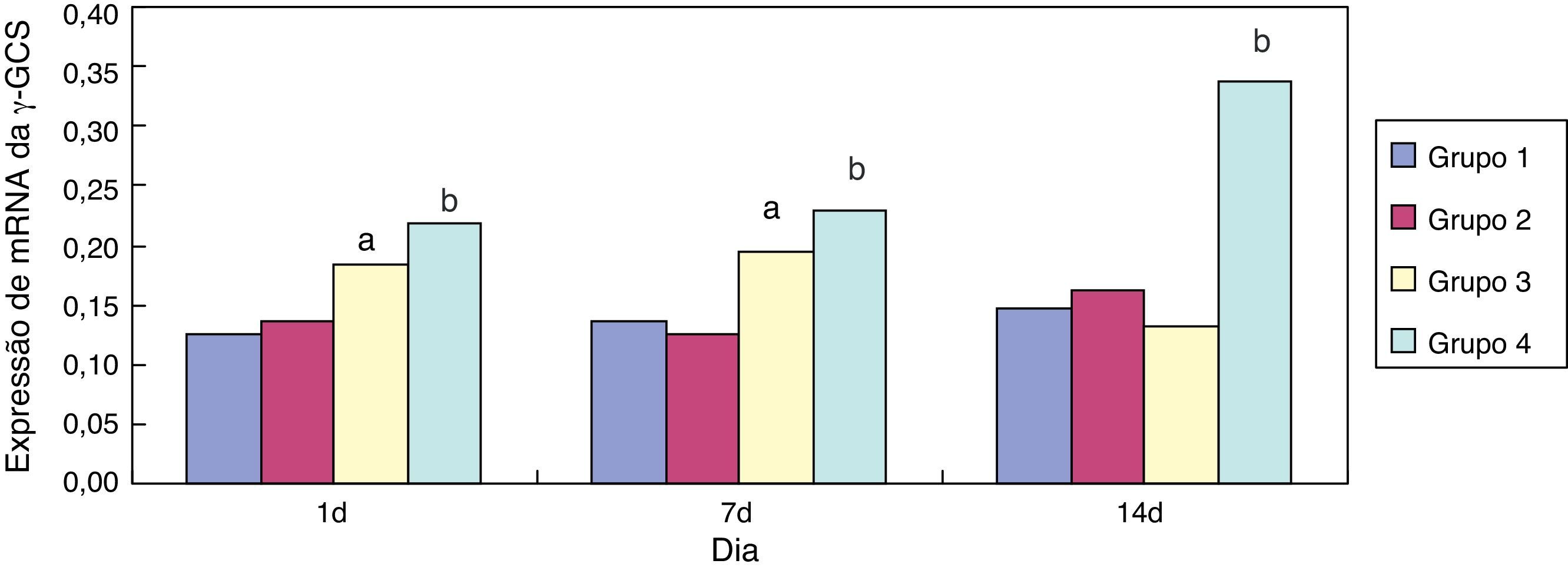
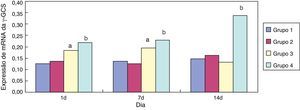
Efeito da eritromicina sobre a γ‐GCS em tecido pulmonar exposto à hiperóxiaEm comparação ao grupo 1, a expressão de mRNA da γ‐GCS no grupo 3 aumentou significativamente (p<0,05) com um e sete dias de exposição; sua expressão diminuiu significativamente (p<0,05) aos 14 dias de exposição. Em comparação ao grupo 3, a expressão de mRNA da γ‐GCS no grupo 4 diminuiu significativamente com um, sete e 14 dias de exposição (p<0,05) (fig. 4). A intervenção de eritromicina regulou positivamente a atividade do mRNA da γ‐GCS, particularmente nos tecidos pulmonares expostos à hiperóxia.
DiscussãoCom base nas características histológicas, o desenvolvimento do pulmão de fetos de ratos pode ser dividido em quatro períodos: embrionário (0 ∼ 13 d), glandular (14 ∼ 18 d), fase canalicular (19 ∼ 20 d) e sacular (21 ∼ 22 d). O período sacular durante o desenvolvimento do pulmão humano corresponde a 28‐34 semanas de idade gestacional, idade de nascimento da maioria dos neonatos prematuros. O desenvolvimento pós‐natal do pulmão dos ratos é dividido em três períodos: período de expansão (1‐4 dias após o nascimento), período alveolar (4‐13 dias após o nascimento) e período de crescimento balanceado (14‐21 dias após o nascimento). Dessa forma, os diferentes pontos de tempo representam as diferentes etapas de desenvolvimento pulmonar em neonatos prematuros após o nascimento, respectivamente.
A patogênese e a prevenção da DBP em neonatos prematuros fez avanços significativos recentemente; contudo, a patogênese exata da DBP continua incerta, e o tratamento efetivo ainda é significativamente restrito.13 Os antibióticos macrolídeos (AM) contêm a estrutura química de carbono 12‐22 e pertencem àqueles de carbono com anel de lactona. A Eritromicina A pode inibir a secreção de citocinas pró‐inflamatórias, como o fator de necrose tumoral‐α e a IL‐1 beta.14 Ademais, ela é um antibiótico de largo espectro e possui atividade antibacteriana contra bactérias gram‐positivas e algumas gram‐negativas, bactérias anaeróbicas, Legionella, Chlamydia, micoplasma e Rickettsia.15 A prática clínica de longo prazo e estudos farmacológicos detalhados mostraram que os AM não apresentam apenas efeitos antibacterianos, mas possuem também propriedades de regulação não específicas anti‐inflamatórias, antialérgicas e imunes.16 O principal papel dos antibióticos em algumas doenças inflamatórias pulmonares crônicas poderá estar relacionado à inibição da explosão oxidativa de neutrófilos e a liberação de mediadores inflamatórios. Além disso, os AM são eficazes na prevenção e tratamento de algumas doenças respiratórias, incluindo asma, fibrose pulmonar, panbronquiolite difusa e algumas doenças inflamatórias não infecciosas, como doenças do sangue, doenças de pele e câncer, e essas funções não possuem relação alguma com as atividades antibacterianas.17
A glutationa é um tripeptídeo que contém material sulfônico, composto de glicina, ácido glutâmico e cistina. A γ‐GCS é a enzima que limita a taxa da síntese de GSH, que regula os níveis de GSH intracelular.18 A GSH é ativada pelo sistema de oxidação/redução in vivo, que fornece o redutor para a cistina e inibe a produção de várias substâncias do corpo no processo de oxidação das espécies reativas de oxigênio (ROS), inativando a atividade da peroxidase da membrana e inibindo as ROS, reduzindo, assim, as ROS. A maioria dos pesquisadores reconheceu que as ROS causadas por estresse oxidativo possuem um papel importante no desenvolvimento da lesão pulmonar induzida por hiperóxia.19 Diversos estudos identificaram que experimentos in vivo e in vitro mostram que, como um importante antioxidante, a GSH desempenhou um papel de destaque na manutenção da integridade das células epiteliais das vias aéreas, resistindo à lesão e à inflamação pulmonares.20
No presente estudo, em comparação ao grupo exposto a ar + cloreto de sódio, a expressão de GSH nos tecidos pulmonares de ratos prematuros aumentou significativamente após a intervenção com eritromicina nos dias 1, 7 e 14 no grupo exposto a eritromicina + cloreto de sódio (p<0,05). Sua expressão aumentou significativamente no dia 1 e no dia 7 após a exposição à hiperóxia no grupo exposto à hiperóxia + cloreto de sódio, e diminuiu significativamente no dia 14. A expressão de GSH no grupo exposto a hiperóxia + eritromicina aumentou significativamente após a intervenção com exposição à hiperóxia e eritromicina nos dias 1, 7 e 14, porém apresentou uma tendência de queda significativa no dia 14. A detecção da expressão de GSH por BCA confirmou os resultados do ELISA. Após a exposição à hiperóxia nos dias 1 e 7, a expressão de GSH aumentou significativamente. O corpo pode apresentar algum mecanismo de autoproteção e pode resistir a uma lesão causada por hiperóxia. Conforme as ROS intracelulares aumentam, os grupos sulfúricos de cisteína na GSH apresentam uma forte atividade de afinidade e podem ser utilizados como alvos eletrofílicos que se combinam com as ROS. Eles também possuem uma função na eliminação das ROS e na peroxidação lipídica, evitando, assim, dano na membrana da célula alveolar. Contudo, a exposição à hiperóxia fez com que a proteína GSH nas células epiteliais alveolares fosse gravemente danificada por estresse oxidativo no dia 14, e a expressão de GSH não apresentou diminuição significativa.
A γ‐glutamil‐cisteina‐sintetase é a enzima que limita a taxa de síntese proteica da GSH, que regula os níveis intracelulares da GSH.21 Este estudo mostrou que a intervenção de eritromicina pode inibir a regulação positiva dos níveis de proteína da GCS nos tecidos pulmonares por meio da exposição à hiperóxia nos dias 1 e 7 (p<0,05). A intervenção da eritromicina não apresentou influência óbvia sobre a exposição à hiperóxia no dia 14, porém a expressão de mRNA da γ‐GCS aumentou significativamente nos dias 7 e 14 (p<0,05), o que pode estar relacionado às proteínas regulatórias relevantes após a transcrição de mRNA da γ‐GCS devido ao dano por exposição à hiperóxia, resultando na inibição, pela eritromicina, da regulação positiva dos níveis de proteína da GCS por meio de exposição à hiperóxia.
Reações infecciosas e inflamatórias são fatores fundamentais na patogênese da DBP em neonatos prematuros, fato confirmado por meio de estudos clínicos e animais.22 Foi relatado que a IL‐1 beta, como uma citocina pró‐inflamatória, possui uma posição central na patogênese da DBP e um importante papel patogênico em lesões pulmonares agudas e crônicas em neonatos prematuros.23 No presente estudo, descobrimos que, em comparação aos grupos expostos a ar, a expressão da IL‐1 beta no tecido pulmonar de ratos prematuros dos grupos expostos à hiperóxia aumentou significativamente no dia 7 e diminuiu no dia 14. Ademais, comparada aos grupos expostos a cloreto de sódio, a expressão da IL‐1 beta diminuiu significativamente nos grupos expostos à eritromicina nos dias 1 e 7. Por outro lado, a expressão de GSH nos tecidos pulmonares aumentou após a intervenção da eritromicina nos dias 1, 7 e 14. Esses resultados mostraram que o principal papel da eritromicina pode estar relacionado à inibição da explosão oxidativa de neutrófilos e à liberação de mediadores inflamatórios. Assim, um dos principais mecanismos dos AM ao tratar a DBP em neonatos prematuros pode ser a inibição da explosão oxidativa de neutrófilos e a liberação de mediadores inflamatórios.
Em resumo, a eritromicina pode inibir o surto oxidativo de granulócitos neutros no tecido pulmonar, melhorar a função antioxidante da GSH, inibir a liberação da citocina inflamatória IL‐1 beta e, por isso, possui um importante papel na redução do estresse oxidativo no desenvolvimento de lesão pulmonar induzida por hiperóxia, o que poderá estabelecer uma nova base teórica para o tratamento clínico de lesão pulmonar induzida por hiperóxia.
FinanciamentoEste trabalho foi financiado pelo Comitê de Ciência e Tecnologia de Xangai (Número do Projeto: 134119a0500).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Cai C, Qiu G, Gong X, Chen Y, Zhao H. Effects of erythromycin on γ‐glutamyl cysteine synthetase and interleukin‐1β in hyperoxia‐exposed lung tissue of premature newborn rats. J Pediatr (Rio J). 2014;90:493–9.