To summarize the main clinical entities associated with fever without source (FWS) in infants, as well as the clinical management of children with occult bacteremia, emphasizing laboratory tests and empirical antibiotics.
SourcesA non‐systematic review was conducted in the following databases–PubMed, EMBASE, and SciELO, between 2006 and 2015.
Summary of the findingsThe prevalence of occult bacteremia has been decreasing dramatically in the past few years, due to conjugated vaccination against Streptococcus pneumoniae and Neisseria meningitidis. Additionally, fewer requests for complete blood count and blood cultures have been made for children older than 3 months presenting with FWS. Urinary tract infection is the most prevalent bacterial infection in children with FWS. Some known algorithms, such as Boston and Rochester, can guide the initial risk stratification for occult bacteremia in febrile infants younger than 3 months.
ConclusionsThere is no single algorithm to estimate the risk of occult bacteremia in febrile infants, but pediatricians should strongly consider outpatient management in fully vaccinated infants older than 3 months with FWS and good general status. Updated data about the incidence of occult bacteremia in this environment after conjugated vaccination are needed.
Listar as principais entidades clínicas associadas a quadros de febre sem sinais localizatórios (FSSL) em lactentes, bem como o manejo dos casos de bacteremia oculta com ênfase na avaliação laboratorial e na antibioticoterapia empírica.
Fonte dos dadosFoi feita revisão não sistemática da literatura nas bases de dados PubMed, Embase e Scielo de 2006 a 2015.
Síntese dos dadosA ocorrência de bacteremia oculta vem diminuindo sensivelmente em lactentes com FSSL, principalmente devido à introdução da vacinação conjugada contra Streptococcus pneumoniae e Neisseria meningitidis nos últimos anos. Juntamente disso, uma redução constante na solicitação de hemogramas e hemoculturas em lactentes febris acima de três meses vem sendo observada. A infecção do trato urinário é a infecção bacteriana mais prevalente no paciente febril. Algoritmos consagrados, como o de Boston e Rochester, podem guiar a decisão clínica inicial para estimar o risco de bacteremia em lactentes entre um e três meses de vida.
ConclusõesNão há esquema padronizado para a estimativa do risco de bacteremia oculta em lactentes febris, porém deve‐se considerar fortemente o manejo ambulatorial de lactentes acima de três meses com FSSL em bom estado geral e com esquema vacinal completo. São necessários dados atualizados sobre a incidência de bacteremia oculta em crianças vacinadas em nosso meio.
A febre sem sinais localizatórios (FSSL) é um dos principais desafios diagnósticos para o pediatra de serviços de emergência. Aproximadamente 20% das crianças febris não têm um diagnóstico etiológico inicialmente definido e cerca de 20% das consultas de emergência em crianças entre dois e 24 meses são devidas a febre.1,2 Nesse cenário, torna‐se fundamental o rápido diagnóstico de crianças com possíveis infecções bacterianas graves (IBG) e que necessitam de antibioticoterapia imediata. IBGs incluem sepse/choque séptico, bacteremia oculta (BO), meningite bacteriana, pneumonia, infecção do trato urinário, gastroenterite bacteriana, osteomielite e artrite séptica.3
A avaliação do lactente febril é ainda mais preocupante, tendo em vista a relativa imaturidade do sistema imunológico nos primeiros três meses de vida. Fatores que podem aumentar o risco de IBG em lactentes incluem reduzida atividade macrofágica e de opsonização, além de menor atividade neutrofílica.4 Enquanto é consenso que a introdução precoce de antibioticoterapia leva a um desfecho favorável em crianças com FSSL que estejam em mau estado geral e toxemiadas, ainda é motivo de muita discussão o manejo de crianças em bom estado geral, nas quais o risco de IBG, e particularmente BO, é muito baixo.5
Apesar de vários autores terem estudado combinações de parâmetros clínicos e laboratoriais para estratificação do risco de IBG em lactentes febris, não há até o momento exame isolado ou conjunto de exames capaz de detectar com ótima sensibilidade lactentes com IBG.6 Este artigo tem como objetivos descrever as principais condições clínicas associadas a FSSL em lactentes, bem como analisar os métodos de avaliação laboratorial da febre nessa faixa etária.
Principais entidades associadas à FSSLInfecções viraisSão causas comuns de FSSL em lactentes e, apesar da ausência de evidências de infecções bacterianas, muitos pacientes são tratados com antibióticos nesse cenário. Vírus e bactérias interagem com diferentes padrões de reconhecimento de receptores em leucócitos circulantes e desencadeiam respostas imunes específicas diferentes.7 Em estudo que envolveu 75 crianças com FSSL,8 um ou mais vírus foram detectados por meio de reação de cadeia de polimerase em 76% dos casos; dentre as crianças com febre e um provável foco definido, essa porcentagem ficou em 40% e nas crianças afebris do grupo controle, em 35% dos casos. Os vírus mais encontrados foram adenovírus, herpesvírus tipo 6, enterovírus e parechovírus.
Bacteremia ocultaÉ definida como hemocultura positiva em paciente com quadro de FSSL.6 A prevalência de BO vem sofrendo dramática queda nos últimos anos, graças à vacinação conjugada bacteriana. Na era pré‐vacinal, a prevalência de BO era de 2,4‐11,6% em crianças com FSSL e o pneumococo era principal responsável (50‐90% dos casos).9,10 Na faixa de uma semana a três meses de vida, a Escherichia coli representa 56% dos casos de bacteremia e o Streptococcus do grupo B é o segundo agente mais prevalente, com 21% dos casos.11
Recente estudo de coorte retrospectivo12 avaliou 201 episódios de BO por pneumococo em lactentes com mediana de idade de 20,5 meses. Os casos devidos ao sorotipo PCV7 caíram de 82,2% para 19,5% após a vacinação. A maioria dos casos após o período vacinal era devida ao sorotipo PCV19A. A recente introdução da vacina antipneumocócica 13‐valente seguramente reduzirá esses achados.
Uma amostra de hemocultura frequentemente é solicitada em lactentes febris com suspeita de BO. Em estudo prospectivo multicêntrico recente,13 houve crescimento bacteriano em 1,5% das 65.169 hemoculturas, O pneumococo é o germe mais frequentemente isolado (27,3% dos casos); neste estudo, 47,1% das crianças tinham menos de um ano de vida.
Estudos também confirmam que ocorre redução significativa da solicitação de hemograma em lactentes febris quando o calendário vacinal está completo. Zeretzke et al.14 avaliaram lactentes entre seis e 24 meses com FSSL acima de 39 graus e verificaram que, antes da implantação de protocolo para checagem do status vacinal dos lactentes, 100% eram submetidos à coleta de hemograma. Essa taxa era reduzida em 58% quando o status de vacinação antipneumocócica e antimeningocócica era completo.
Infecção do trato urinário (ITU)Trata‐se da infecção bacteriana mais prevalente no lactente febril, corresponde a 5‐7% dos casos de FSSL.15 Nos últimos anos, vários autores têm estudado a presença de fatores que aumentam o risco de ITU em determinados grupos de pacientes. Entretanto, apesar desses números, a ITU em lactentes com FSSL é provavelmente subdiagnosticada, uma vez em que a maioria dos pacientes se apresenta com sintomas pouco específicos e comuns a várias outras infecções agudas. A ocorrência de ITU na infância é associada com diversas complicações renais em longo prazo, como hipertensão, pré‐eclâmpsia e insuficiência renal; cicatrizes renais podem estar presentes em aproximadamente 15% das crianças após um primeiro episódio de ITU.16,17
Em 2011, a Academia Americana de Pediatria publicou diretrizes atualizadas a respeito do diagnóstico, tratamento e investigação complementar de pacientes com ITU, de modo a reduzir as chances de cicatrizes renais e lesão renal futura.18 Neste artigo, foi descrito um algoritmo inicial de investigação para estimar o risco de ITU em crianças febris entre dois e 24 meses, baseado em características clínicas e demográficas.19 O maior fator de risco em meninos febris foi a ausência de circuncisão prévia. Nos meninos, recomenda‐se a investigação para ITU se um ou mais dos seguintes fatores de risco estiverem presentes (risco de ITU de 1‐2%) – etnia branca, temperatura acima de 39 graus Celsius, febre por mais de 24 horas e ausência de outros focos de infecção. Em meninas, os fatores incluem etnia branca, idade abaixo de 12 meses, temperatura acima de 39 graus, febre por mais de 48 horas e ausência de foco aparente de infecção.
O diagnóstico de ITU requer a presença de leucocitúria e ao menos 50.000 colônias/mL de um único uropatógeno em amostra de urina colhida adequadamente. Recomenda‐se a coleta apenas por sondagem vesical em crianças sem controle esfincteriano, devido ao alto risco de contaminação e resultados falsamente positivos em crianças com urina coletada por saco coletor. A punção suprapúbica deve ser reservada para casos de exceção e vem sendo cada vez menos usada na prática clínica. Entretanto, a análise do sedimento urinário (exame de urina I) e/ou a fita urinária são muito usadas na emergência para o rápido diagnóstico de ITU. Recente revisão sistemática concluiu não haver diferenças significativas entre as informações obtidas pelos dois métodos e recomendou o tratamento inicial de crianças de risco para ITU se houver leucocitúria ou alterações na fita urinária (esterase leucocitária positiva e/ou nitrito positivo) até a confirmação obtida pela urocultura.20
Diagnóstico laboratorialÉ consenso que a probabilidade da ocorrência de bacteremia oculta e IBG diminuiu drasticamente após a introdução da vacinação conjugada no calendário vacinal. Dessa maneira, o acompanhamento ambulatorial de crianças com FSSL pode ser uma opção segura e menos onerosa naquelas de baixo risco para IBG.6
Após a introdução da vacinação conjugada contra Haemophilus influenzae tipo B, o risco de BO diminuiu para 1,5‐3%; após a vacinação antipneumocócica heptavalente, esse risco caiu ainda mais, para 0,5‐1%.21 O aumento da cobertura vacinal para outros sorotipos de Streptococcus pneumoniae com a vacina 13‐valente pode reduzir ainda mais esses números, de modo que lactentes em bom estado geral provavelmente não necessitarão de avaliação laboratorial para estimar o risco de BO.5,22,23 Em recente análise de 591 crianças entre três e 36 meses com FSSL, que estavam em bom estado geral à admissão e foram submetidas à avaliação laboratorial com hemograma, proteína C reativa (PCR) ou procalcitonina, apenas 1% apresentou BO. Metade dos casos foi devida à BO por Streptococcus pneumoniae e nenhuma dessas crianças havia sido imunizada contra pneumococo.1 Baseado nesses achados acima descritos, houve mudanças nos últimos anos em relação ao manejo de lactentes com FSSL.24
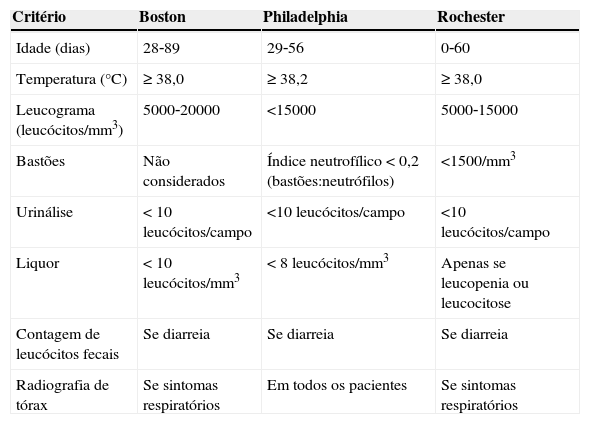
Em 1993, Baraff et al.25 publicaram diretrizes para avaliação de lactentes com FSSL entre três e 36 meses; tais recomendações foram revisadas em 2008 com a inclusão do urinálise em lactentes de risco para ITU (como, por exemplo, em meninos não circuncisados) e o questionamento da utilidade da avaliação laboratorial com hemograma em crianças com calendário vacinal completo e em bom estado geral.23 A neutropenia (contagem de neutrófilos abaixo de 1.500/mm3), considerada fator de risco para BO em lactentes com FSSL de acordo com os critérios de Rochester (tabela 1), vem sendo recentemente estudada em pacientes não oncológicos. Em recente estudo caso‐controle com pacientes acima de três meses de vida com FSSL, a neutropenia não foi fator de risco para BO, o que coloca em dúvida a indicação imediata de antibióticos em lactentes com FSSL neutropênicos.26 Em lactentes entre quatro e 12 semanas de vida, algoritmos classicamente usados, como os de Boston, Baraff e Rochester, ajudam na decisão inicial sobre a antibioticoterapia e conduta, conforme descrito na tabela 1. Pacientes que apresentam os critérios laboratoriais descritos abaixo podem ser considerados de baixo risco para BO e terem seu manejo ambulatorial com retorno em 24 horas para reavaliação.
Principais algoritmos usados na estratificação de risco de lactentes com FSSL até 90 dias de vida
| Critério | Boston | Philadelphia | Rochester |
|---|---|---|---|
| Idade (dias) | 28‐89 | 29‐56 | 0‐60 |
| Temperatura (°C) | ≥ 38,0 | ≥ 38,2 | ≥ 38,0 |
| Leucograma (leucócitos/mm3) | 5000‐20000 | <15000 | 5000‐15000 |
| Bastões | Não considerados | Índice neutrofílico < 0,2 (bastões:neutrófilos) | <1500/mm3 |
| Urinálise | < 10 leucócitos/campo | <10 leucócitos/campo | <10 leucócitos/campo |
| Liquor | < 10 leucócitos/mm3 | < 8 leucócitos/mm3 | Apenas se leucopenia ou leucocitose |
| Contagem de leucócitos fecais | Se diarreia | Se diarreia | Se diarreia |
| Radiografia de tórax | Se sintomas respiratórios | Em todos os pacientes | Se sintomas respiratórios |
Com o passar dos anos, particularmente após a introdução das vacinas bacterianas conjugadas, a solicitação de hemograma na avaliação do lactente febril vem diminuindo sistematicamente. Estudo recente revelou que 58,6% dos pacientes com FSSL avaliados em serviços de emergência, até três anos de idade e bom estado geral, não tinham exame solicitado; de fato, em apenas 20% dos pacientes hemograma foi feito.27
A obtenção de hemoculturas é limitada pela baixa positividade do exame e pelo tempo decorrido até os resultados. Lactentes com FSSL e bacteremia têm maior risco para o desenvolvimento de infecções focais como meningite (aproximadamente 10%); desse modo, a identificação de uma hemocultura positiva de maneira precoce pode evitar complicações bacterianas graves.28 O número aceitável de hemoculturas contaminadas (por exemplo, com espécies de Staphylococcus coagulase‐negativos) é de 3‐4% e pode acarretar internações, gastos e antibioticoterapias desnecessárias.29
Vários autores tentam elaborar escores para o diagnóstico de IBGs e, assim, evitar o uso desnecessário de antibioticoterapia empírica para crianças com FSSL. O recém‐descrito Lab‐score usa parâmetros associados de maneira independente com a ocorrência de IBGs, com pesos diferentes de acordo com a razão de chances obtida por cada variável na análise univariada do estudo original. Baseado na determinação combinada de procalcitonina e da proteína C reativa, além dos resultados da análise da fita urinária, o escore pode ter resultados de 0 a 9; um ponto de corte de 3 apresentou 94% de sensibilidade e 78% de especificidade para diagnóstico de IBGs em crianças entre sete dias e 36 meses.30 O uso adequado dessa ferramenta pode reduzir em até 26,5% a prescrição de antibióticos em crianças com FSSL, conforme demonstrado em recente ensaio clínico.3
Tradicionalmente, de acordo com os critérios de Baraff, lactentes com FSSL e mais de 15.000 leucócitos/mm3 no hemograma teriam risco aumentado para BO. Entretanto, evidências recentes demonstram o limitado valor diagnóstico do leucograma para evidenciar IBG em lactentes febris.31 A proteína C reativa (PCR) apresenta sensibilidade discretamente melhor do que o leucograma para esse propósito, mas também tem limitações para indicar isoladamente antibioticoterapia no paciente febril. Recentemente, a procalcitonina (PCT) vem sendo estudada e apontada como marcador confiável de IBG em crianças febris. Esse fato é comprovado na diferenciação entre meningite bacteriana e viral e entre pielonefrite e cistite.32,33 Os níveis de PCT se correlacionam com a invasividade da infecção bacteriana e têm uma cinética mais favorável, com elevação já nas primeiras seis horas de febre, quando comparada com o PCR. Esse achado pode ter particular importância em lactentes jovens febris, pois têm maior chance de IBG e normalmente são levados ao serviço de emergência nas primeiras horas de febre.34
Em estudo com 1.112 lactentes com FSSL, IBG foi diagnosticada em 2,1% dos casos. Os valores de PCT acima de 0,5ng/mL foram os únicos fatores independentes de risco para IBG, com razão de chances de 21,69. Em outro trabalho com 868 lactentes com FSSL em bom estado geral à admissão, a sensibilidade da PCT para o mesmo valor de corte de 0,9ng/mL foi de 86,7% com especificidade de 90,5%, quando comparada com o PCR, cujo valor de corte de 91mg/L apresentou sensibilidade de 33,3% e especificidade de 95,9%.35
Tratamento da BO em lactentes febrisDe acordo com os dados apresentados acima, não é possível a recomendação de um protocolo isolado para a avaliação e tratamento do lactente febril.6 O manejo do quadro febril no recém‐nascido não é escopo deste artigo, mas envolve conduta agressiva com a coleta de todas as culturas, incluindo líquor, além de internação e antibioticoterapia parenteral até os resultados finais.
Para lactentes entre quatro e 12 semanas de vida com quadro de FSSL, recomenda‐se a coleta de hemograma, hemocultura e marcadores inflamatórios, como a PCR e a PCT, além de urinálise com amostra obtida por sondagem vesical ou punção suprapúbica, para casos de exceção. Recomenda‐se internação em casos de ITU, com prescrição de cefuroxima (150mg/kg/dia) ou ceftriaxone (50‐100mg/kg/dia); em lactentes febris com risco para BO, de acordo com os critérios mencionados na tabela 1, recomenda‐se a coleta de líquor e internação com ceftriaxone (50‐100mg/kg/dia) até resultado das culturas, se não houver meningite. É fundamental reavaliação em 24 horas dos pacientes com quadro de FSSL e que serão manejados ambulatorialmente, se não forem de risco para BO.
Em lactentes entre três e 36 meses de vida, o impacto da vacinação conjugada, como descrito anteriormente, torna desnecessária a coleta de hemograma e hemocultura em pacientes que se apresentam em bom estado geral. A coleta de urina deve ser considerada pelos fatores mencionados acima, especialmente em meninas febris com menos de 24 meses e meninos não circuncisados abaixo de 12 meses com FSSL.18 Não se devem obter radiografias de tórax de maneira rotineira em pacientes nessa faixa etária e que não apresentam sinais ou sintomas respiratórios, mesmo que frustros. Lactentes em mau estado geral e/ou toxemiados devem incluir em sua investigação, além de hemograma, hemocultura, PCR ou PCT, coleta de líquor e internação com ceftriaxone, nas mesmas doses acima mencionadas, até resultados de culturas e/ou resolução do quadro febril.
ConclusõesA febre continua a ser importante causa de consultas em serviços de emergência em crianças até três anos e ainda é frequente a solicitação de múltiplos exames laboratoriais para avaliação inicial, bem como antibioticoterapia mesmo em crianças sem risco para BO e sem infecção bacteriana presumida. Com o passar dos últimos anos, principalmente devido à introdução da vacinação conjugada no calendário vacinal brasileiro, é possível que, a exemplo de países nos quais essa vacinação é mais antiga, ocorra uma redução drástica na prevalência de BO em lactentes febris. Tendo em vista as recomendações atuais, não deve ser rotineira a coleta de hemograma e hemocultura em lactentes acima de três meses com quadro febril e em bom estado geral. São necessários estudos em nosso meio para confirmar a redução nos casos de BO em lactentes na era pós‐vacinal.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Mekitarian Filho E, de Carvalho WB. Current management of occult bacteremia in infants. J Pediatr (Rio J). 2015;91:S61–6.