Management of patent ductus arteriosus is still controversial. This study aimed to describe the impact of a more conservative approach on treatment rates and on main outcomes of prematurity, especially in preterm infants with <26 weeks of gestation.
MethodClinical charts review of infants ≤30 weeks with patent ductus arteriosus between 2009 and 2016 at two centers. In 2011, the authors changed patent ductus arteriosus management: in first period (2009–2011), patients who failed medical treatment underwent surgical closure; in second period (2012–2016), only those with cardiopulmonary compromise underwent surgical ligation. Medical treatment, surgical closure, mortality, and survival‐without‐morbidity were compared.
ResultsThis study included 188 patients (27±2 weeks, 973±272 grams); 63 in P1 and 125 in P2. In P2, significantly lower rates of medical treatment (85.7% P1 versus 56% P2, p<0.001) and surgical closure (34.5% P1 versus 16.1% P2, p<0.001) were observed. No differences were found in chronic lung disease (28.8% versus 13.9%, p=0.056), severe retinopathy of prematurity (7.5% versus 11.8%, p=0.403), necrotizing enterocolitis (15.5% versus 6.9%, p=0.071), severe intraventricular hemorrhage (25.4% versus 18.4%, p=0.264), mortality (17.5% versus 15.2%, p=0.690) or survival‐without‐morbidity adjusted OR=1.10 (95% CI: 0.55–2.22); p=0.783. In P2, 24.5% patients were discharged with patent ductus arteriosus. The subgroup born between 23 and 26 weeks (n=82) showed significant differences: lower incidence of chronic lung disease (50% versus 19.6%, p=0.019) and more survival‐without‐morbidity (20% versus 45.6%, p=0.028) were found.
ConclusionA conservative approach in preterm infants with patent ductus arteriosus can avoid medical and surgical treatments, without a significant impact in survival‐without‐morbidity. However, two‐thirds of preterm infants under 26 weeks are still treated.
O tratamento da persistência do canal arterial ainda é controverso. Nosso objetivo foi descrever o impacto de uma abordagem mais conservadora em nossas taxas de tratamento e nos principais desfechos da prematuridade, especialmente em prematuros com<26 semanas de gestação.
MétodoRevisão de prontuários de lactentes com≤30 semanas e persistência do canal arterial entre 2009‐2016 em dois centros. Em 2011, mudamos o manejo da persistência do canal arterial: no primeiro período (2009‐2011), os pacientes que não apresentaram sucesso com o tratamento clínico foram submetidos a fechamento cirúrgico; no segundo período (2012‐2016), apenas aqueles com comprometimento cardiopulmonar foram submetidos ao fechamento cirúrgico. Comparamos o tratamento clínico, fechamento cirúrgico, mortalidade e sobrevida sem morbidade.
ResultadosForam incluídos 188 pacientes (27±2 semanas, 973±272 gramas); 63 em P1 e 125 em P2. Em P2, foram observadas taxas significativamente mais baixas de tratamento clínico (85,7% no P1 versus 56% no P2, p<0,001) e fechamento cirúrgico (34,5% no P1 versus 16,1% no P2, p<0,001). Não foram encontradas diferenças em relação à doença pulmonar crônica (28,8% versus 13,9%, p=0,056), retinopatia grave da prematuridade (7,5% versus 11,8%, p=0,403), enterocolite necrosante (15,5% versus 6,9%, p=0,071), hemorragia intraventricular grave (25,4% versus 18,4%, p=0,264), mortalidade (17,5% versus 15,2%, p=0,690) ou OR ajustado pela sobrevida sem morbidade=1,10 (IC95%: 0,55‐2,22); p=0,783. Em P2, 24,5% dos pacientes receberam alta com persistência do canal arterial. O subgrupo nascido entre 23 a 26 semanas (n=82) apresentou diferenças significativas, foram encontradas menor incidência de doença pulmonar crônica (50% versus 19,6%, p=0,019) e maior sobrevida sem morbidade (20% versus 45,6%, p=0,028).
ConclusãoUma abordagem conservadora em prematuros com persistência do canal arterial pode evitar tratamentos clínicos e cirúrgicos, sem um impacto significativo na sobrevida sem morbidade. No entanto, dois terços dos prematuros com menos de 26 semanas ainda são tratados.
O fechamento do canal arterial é frequentemente atrasado em prematuros, com uma incidência estimada de patência do canal arterial em idades gestacionais abaixo de 30 semanas de até 60%.1 A probabilidade de patência é inversamente proporcional à idade gestacional do neonato.2 Embora a persistência do canal arterial (PCA) tenha sido historicamente associada ao aumento da morbidade e mortalidade em recém‐nascidos prematuros,3 a relação de causa e efeito entre essas condições desfavoráveis ainda não está bem estabelecida. A PCA pode ser apenas um intermediário entre as alterações hemodinâmicas que ocorrem nas primeiras semanas de vida do bebê prematuro.4
Nas últimas décadas, muitos prematuros foram tratados profilática ou ativamente com inibidores da ciclo‐oxigenase ou com fechamento cirúrgico. Portanto, a real importância da PCA e sua evolução natural são difíceis de determinar. O tratamento conservador da PCA tem se tornado cada vez mais comum em prematuros,5 mas ainda há controvérsias em relação à avaliação e ao manejo da PCA, o que resulta em substancial heterogeneidade na prática clínica.6,7 As principais razões para essa abordagem são o fato de que os tratamentos da PCA estão relacionados a efeitos colaterais e quase 30% dos prematuros com peso ao nascer<1.000 gramas alcançam o fechamento espontâneo do canal na primeira semana de vida.2 Além disso, a melhoria em longo prazo associada ao tratamento da PCA ainda precisa ser comprovada.6 Ainda é incerto se uma abordagem mais conservadora pode afetar prematuros em longo prazo e especialmente aqueles nascidos com 23 a 26 semanas de gestação. Levamos em conta esses fatos e em 2011 adotamos uma abordagem mais conservadora para a PCA.
Este estudo foi desenvolvido para avaliar as diferenças no tratamento recebido e nos desfechos da prematuridade devido a uma mudança na prática antes e depois da adoção de um novo protocolo de tratamento da PCA e analisar seu impacto na mortalidade e nos principais desfechos, especialmente em prematuros nascidos com menos de 26 semanas de gestação.
Os objetivos do nosso estudo foram:
- 1.
Avaliar as diferenças no tratamento recebido devido a uma mudança na prática como desfecho principal.
- 2.
Avaliar as diferenças nos principais desfechos devido a uma mudança na prática como desfechos secundários.
- 3.
Analisar o impacto de uma abordagem mais conservadora no tratamento da PCA no subgrupo mais imaturo de recém‐nascidos extremamente prematuros (nascidos com menos de 27 semanas de gestação).
Revisamos os prontuários médicos de recém‐nascidos prematuros com ≤ 30 semanas de gestação ao nascimento, diagnosticados com PCA. Revisamos os pacientes internados nas unidades de terapia intensiva neonatal terciária do Hospital Sant Joan de Déu e do Parc Taulí Hospital de janeiro de 2009 a dezembro de 2016. Os dados maternos, perinatais e neonatais foram coletados dos prontuários médicos. Pacientes que morreram antes de três dias de vida, aqueles com doença cardíaca congênita e pacientes oriundos de outras instituições foram excluídos. Foi obtida aprovação ética para coleta de dados.
De acordo com a definição da Vermont Oxford Network (VON),8 a PCA foi definida na presença de pelo menos um dos seguintes achados: shunt da esquerda para a direita ou shunt no canal bidirecional no eco Doppler e/ou sopro sistólico ou contínuo; e pelo menos dois dos seguintes achados: precórdio hiperdinâmico, sopro cardíaco, aumento da amplitude de pulso, congestão vascular pulmonar, cardiomegalia ou ambos. Os cardiologistas de ambos os centros fizeram um estudo Doppler colorido do fluxo do canal em duas dimensões no eixo paraesternal e projeções supraesternais em todos os pacientes. Determinamos o diâmetro transcanal, fluxo diastólico anterógrado pulmonar, razão átrio esquerdo: Aorta, fluxo diastólico retrógrado aórtico e fluxo transcanal. Não fizemos alterações na triagem para PCA entre os períodos.
O principal resultado da sobrevida sem morbidade foi um desfecho composto definido pela ausência de qualquer um dos desfechos secundários na alta hospitalar: doença pulmonar crônica (DPC), definida como uso suplementar de oxigênio na idade pós‐menstrual de 36 semanas; grau de retinopatia da prematuridade (ROP) grave >2 ou maior, de acordo com a classificação internacional;8 grau de enterocolite necrosante (ECN)> 2 de acordo com a classificação de Bell9 e grau de hemorragia peri‐intraventricular (HPIV) grave> 2 de acordo com a classificação de Papile.10
Uma classificação de estadiamento da PCA foi usada para decidir se os pacientes deveriam receber tratamento ou não. Essa classificação, que varia de leve a grave, baseia‐se predominantemente na gravidade e na repercussão do shunt no canal nos sistemas cardiovascular, respiratório e gastrointestinal.11 O tratamento clínico foi feito com ibuprofeno intravenoso na dose padrão e o tratamento cirúrgico envolveu o fechamento clássico ou o uso de um clipe.
Estratégias adicionais também foram aplicadas para modular o fluxo no canal. Ajustamos a ventilação não invasiva a uma pressão positiva mais alta no fim da expiração (6‐8cm H2O). Fizemos um balanço de fluidos preciso (135‐150mL/kg/dia) para garantir uma ingestão de energia ideal (pelo menos 120kcal/kg/dia). Evitamos a administração de volume rápido em bólus. Corrigimos a anemia para um hematócrito‐alvo> 35%. Na presença de qualquer sinal de insuficiência cardíaca ou edema pulmonar na radiografia de tórax, foi considerado o uso de diuréticos. Em julho de 2011, mudamos nosso protocolo para uma abordagem mais conservadora da PCA, conforme descrito abaixo.
No primeiro período, ou P1 (2009‐2011): o tratamento clínico com ibuprofeno era administrado se o paciente tivesse uma PCA de acordo com a definição de VON.8 O fechamento cirúrgico era feito após o insucesso de dois ciclos de tratamento farmacológico, se o paciente ainda precisasse de suporte respiratório (invasivo ou não invasivo) e se a PCA medisse mais de 2mm no ultrassom.
No segundo período, ou P2 (2012‐2016): tratamento clínico com ibuprofeno era administrado se o paciente apresentasse qualquer um dos seguintes sinais clínicos de PCA: dessaturação frequente (> 6 vezes/dia) não relacionada a outra condição, necessidade de suporte respiratório (invasivo ou não invasivo), hipotensão sistêmica (pressão arterial média inferior ao percentil 3 para a idade corrigida), acidose metabólica (pH <7,10) e hemorragia pulmonar (evidência de secreção de líquido sanguinolento proveniente do trato respiratório superior ou do tubo endotraqueal e novos infiltrados na radiografia de tórax) e uma PCA de mais de 2mm na ultrassonografia após a primeira semana de vida. O fechamento cirúrgico da PCA foi feito após o insucesso de dois ciclos de tratamento farmacológico na presença de PCA> 3mm e comprometimento cardiopulmonar definido como duas tentativas malsucedidas de desmame do respirador ou necessidade continuada de suporte inotrópico atribuída à presença da PCA. Além disso, o fechamento cirúrgico foi adiado até a terceira ou quarta semana de vida, sempre que possível. Não usamos tratamento clínico profilático.
Em ambos os períodos, registramos o tamanho da persistência do canal arterial no momento do diagnóstico (em milímetros, com Doppler colorido), idade pós‐natal (em dias) no início do tratamento clínico e tratamento cirúrgico, se feito. Morte antes de 36 semanas de idade pós‐menstrual e desfecho composto de sobrevida sem morbidade foram examinados. A ausência de fluxo transcanal na ultrassonografia com Doppler foi considerada como marcador de fechamento. A PCA na alta hospitalar foi considerada quando a presença de um shunt da esquerda para a direita com diâmetro maior do que 1,5mm foi detectada na ultrassonografia com Doppler. Esses pacientes foram acompanhados por cardiologistas pediátricos e a data do fechamento definitivo foi registrada (fechamento espontâneo ou cirúrgico). Se o fechamento cirúrgico fosse necessário, o tipo de dispositivo usado era registrado. Finalmente, uma análise estratificada foi feita para analisar o impacto de uma abordagem mais conservadora nos neonatos mais prematuros (23‐26 semanas).
Os fatores de risco perinatais e neonatais para PCA e desfechos foram resumidos por meio de estatística descritiva (distribuição de frequência para dados categóricos e média e desvio‐padrão ou mediana e intervalo interquartil para dados contínuos). A análise univariada incluiu o teste do qui‐quadrado e o teste exato de Fisher, conforme apropriado, para comparações categóricas e o teste t de Student ou de Mann‐Whitney para variáveis contínuas. Um modelo de regressão logística ajustado foi usado para avaliar a mudança no manejo da PCA na sobrevida sem morbidade. Todos os testes de hipóteses foram bilaterais e valores de p <0,05 foram considerados estatisticamente significativos. Todos os dados foram analisados com o software SPSS (IBM Corporation, Statistical Package for the Social Sciences, versão 20.0, EUA).
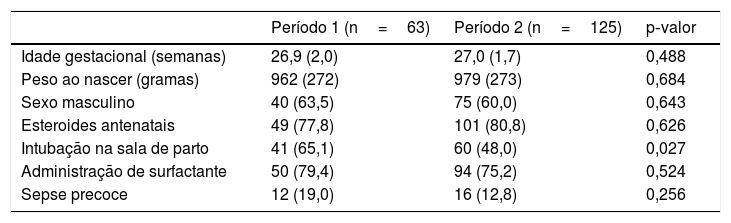
ResultadosA amostra do estudo incluiu 188 lactentes (61% do sexo masculino) com média de idade gestacional (± DP) de 27 (± 1,8) semanas e peso médio ao nascer de 973 (± 272) gramas; desses, 82 (43,6%) nasceram com ≤ 26 semanas de gestação. Considerando toda a coorte, 80% receberam pelo menos uma dose de esteroides pré‐natais, 54% necessitaram de intubação na sala de parto, 77% receberam surfactante e 15% foram diagnosticados com sepse precoce. Não encontramos diferenças significativas na comparação dos dois períodos em relação aos principais fatores de risco perinatais e clínicos, exceto pela necessidade de intubação na sala de parto (65,1% no P1 versus 48% no P2; p=0,027) (tabela 1).
Características clínicas dos pacientes e prevalência dos principais fatores de risco perinatais e neonatais para PCA
| Período 1 (n=63) | Período 2 (n=125) | p‐valor | |
|---|---|---|---|
| Idade gestacional (semanas) | 26,9 (2,0) | 27,0 (1,7) | 0,488 |
| Peso ao nascer (gramas) | 962 (272) | 979 (273) | 0,684 |
| Sexo masculino | 40 (63,5) | 75 (60,0) | 0,643 |
| Esteroides antenatais | 49 (77,8) | 101 (80,8) | 0,626 |
| Intubação na sala de parto | 41 (65,1) | 60 (48,0) | 0,027 |
| Administração de surfactante | 50 (79,4) | 94 (75,2) | 0,524 |
| Sepse precoce | 12 (19,0) | 16 (12,8) | 0,256 |
Valores são n (%) ou média (desvio‐padrão).
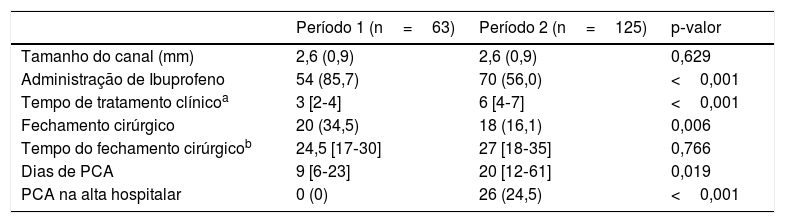
Não houve diferenças no tamanho do canal ao diagnóstico quando os dois períodos foram comparados. No P2, menos pacientes receberam ibuprofeno (número necessário para causar dano=3 [IC95%: 2,5‐6,2]) e foram tratados tardiamente (6° dia) e menos pacientes tiveram fechamento cirúrgico (número necessário para causar dano=5 [IC95%: 3,1‐20,3]). Os pacientes tratados no P2 eram mais imaturos (26,6± 1,5 semanas vs. 27,7±1,9 semanas, p <0,001) e apresentavam taxas mais altas de DPC (23,3% vs. 6,4%, p=0,017) e ROP grave (19% vs. 2%, p=0,007), mas esses resultados não foram significativos ao serem ajustados para a idade gestacional. Uma diminuição no tratamento clínico (77% em 2011 versus 40% em 2015) e cirúrgico (18% em 2011 versus 10% em 2015) foi observada ao longo do tempo.
No P2, os pacientes tiveram mais dias de PCA e 26 pacientes (24,5%) receberam alta hospitalar com canal patente (tabela 2). Desses, apenas dois pacientes nascidos antes de 26 semanas de gestação necessitaram de fechamento transcateter do canal durante o acompanhamento (um aos 4 anos e outro aos 10 meses). O fechamento da PCA ocorreu antes dos 12 meses de vida em 90% dos pacientes que tiveram alta hospitalar com um canal patente, com uma patência mediana de 157 dias (122‐241). Nenhum dos pacientes que receberam alta hospitalar com PCA desenvolveu hipertensão pulmonar durante o seguimento.
Tratamento da PCA e duração de sua administração. Dias de PCA e PCA na alta hospitalar
| Período 1 (n=63) | Período 2 (n=125) | p‐valor | |
|---|---|---|---|
| Tamanho do canal (mm) | 2,6 (0,9) | 2,6 (0,9) | 0,629 |
| Administração de Ibuprofeno | 54 (85,7) | 70 (56,0) | <0,001 |
| Tempo de tratamento clínicoa | 3 [2‐4] | 6 [4‐7] | <0,001 |
| Fechamento cirúrgico | 20 (34,5) | 18 (16,1) | 0,006 |
| Tempo do fechamento cirúrgicob | 24,5 [17‐30] | 27 [18‐35] | 0,766 |
| Dias de PCA | 9 [6‐23] | 20 [12‐61] | 0,019 |
| PCA na alta hospitalar | 0 (0) | 26 (24,5) | <0,001 |
Valores são n (%), média (desvio‐padrão) ou mediana [p25‐p75].
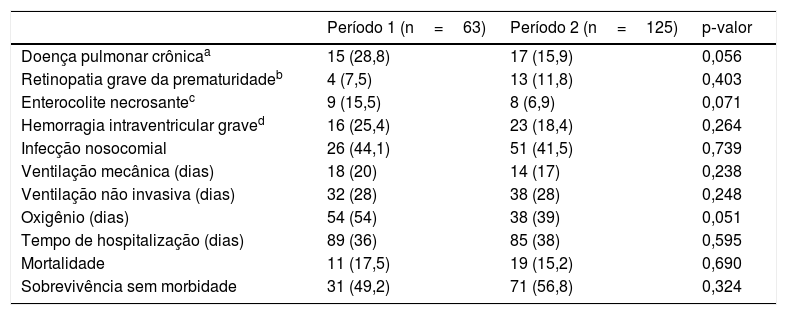
Não foram encontradas diferenças significativas entre os períodos nos principais desfechos, seja na necessidade e duração do suporte respiratório, taxa de infecção nosocomial ou tempo de internação (tabela 3). Não foram encontradas diferenças nas taxas de mortalidade (17,5% versus 15,2%; p=0,690). Sobrevivência sem morbidade foi semelhante nos dois períodos quando ajustada para idade gestacional e necessidade de intubação na sala de parto, OR ajustado=1,10 (IC95%: 0,55‐2,22); p=0,783.
Principais desfechos em ambos os períodos
| Período 1 (n=63) | Período 2 (n=125) | p‐valor | |
|---|---|---|---|
| Doença pulmonar crônicaa | 15 (28,8) | 17 (15,9) | 0,056 |
| Retinopatia grave da prematuridadeb | 4 (7,5) | 13 (11,8) | 0,403 |
| Enterocolite necrosantec | 9 (15,5) | 8 (6,9) | 0,071 |
| Hemorragia intraventricular graved | 16 (25,4) | 23 (18,4) | 0,264 |
| Infecção nosocomial | 26 (44,1) | 51 (41,5) | 0,739 |
| Ventilação mecânica (dias) | 18 (20) | 14 (17) | 0,238 |
| Ventilação não invasiva (dias) | 32 (28) | 38 (28) | 0,248 |
| Oxigênio (dias) | 54 (54) | 38 (39) | 0,051 |
| Tempo de hospitalização (dias) | 89 (36) | 85 (38) | 0,595 |
| Mortalidade | 11 (17,5) | 19 (15,2) | 0,690 |
| Sobrevivência sem morbidade | 31 (49,2) | 71 (56,8) | 0,324 |
Valores são n (%) ou média (desvio‐padrão).
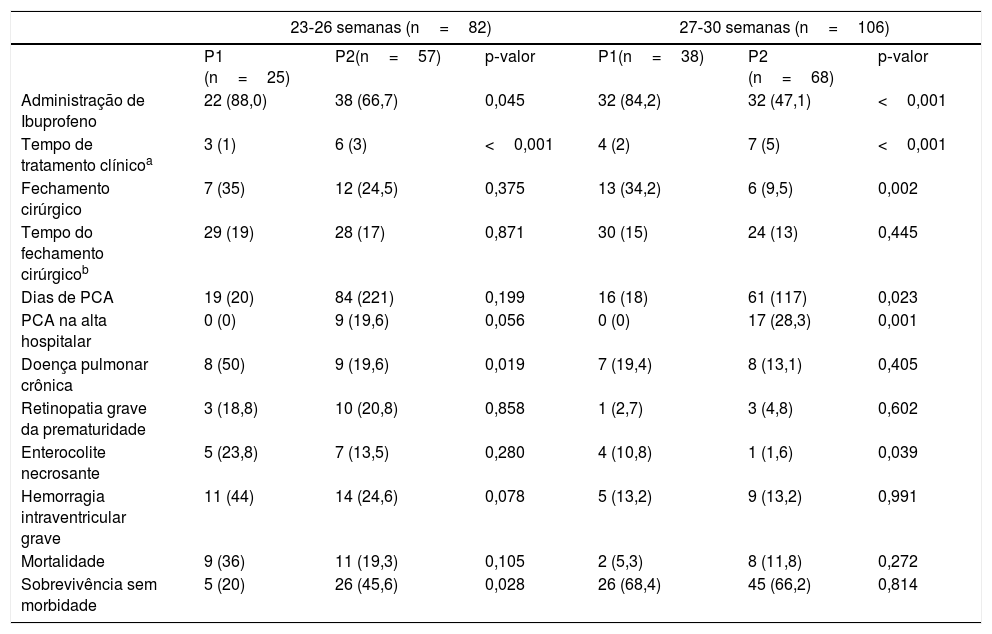
Em uma análise de subgrupo feita para avaliar o impacto de uma abordagem mais conservadora nos neonatos mais prematuros (23‐26 semanas versus 27‐30 semanas), observamos que os pacientes nascidos com 23 a 26 semanas de idade gestacional também receberam menos tratamento clínico (88% versus 66,7%, p <0,045) e tratamento cirúrgico (35% versus 24,5%; p=0,375), embora nenhum tenha sido estatisticamente significativo. Foram encontradas diferenças na incidência de DPC (50% vs. 19,6%) e sobrevida sem morbidade (20% vs. 45,6%) embora não tenham alcançado significância estatística quando ajustadas pela ventilação mecânica> 24 horas, com OR ajustado=2,24 (IC95%: 0,68‐7,35); p=0,186 (tabela 4).
Tratamento da PCA e principais desfechos em cada período de acordo com a idade gestacional
| 23‐26 semanas (n=82) | 27‐30 semanas (n=106) | |||||
|---|---|---|---|---|---|---|
| P1 (n=25) | P2(n=57) | p‐valor | P1(n=38) | P2 (n=68) | p‐valor | |
| Administração de Ibuprofeno | 22 (88,0) | 38 (66,7) | 0,045 | 32 (84,2) | 32 (47,1) | <0,001 |
| Tempo de tratamento clínicoa | 3 (1) | 6 (3) | <0,001 | 4 (2) | 7 (5) | <0,001 |
| Fechamento cirúrgico | 7 (35) | 12 (24,5) | 0,375 | 13 (34,2) | 6 (9,5) | 0,002 |
| Tempo do fechamento cirúrgicob | 29 (19) | 28 (17) | 0,871 | 30 (15) | 24 (13) | 0,445 |
| Dias de PCA | 19 (20) | 84 (221) | 0,199 | 16 (18) | 61 (117) | 0,023 |
| PCA na alta hospitalar | 0 (0) | 9 (19,6) | 0,056 | 0 (0) | 17 (28,3) | 0,001 |
| Doença pulmonar crônica | 8 (50) | 9 (19,6) | 0,019 | 7 (19,4) | 8 (13,1) | 0,405 |
| Retinopatia grave da prematuridade | 3 (18,8) | 10 (20,8) | 0,858 | 1 (2,7) | 3 (4,8) | 0,602 |
| Enterocolite necrosante | 5 (23,8) | 7 (13,5) | 0,280 | 4 (10,8) | 1 (1,6) | 0,039 |
| Hemorragia intraventricular grave | 11 (44) | 14 (24,6) | 0,078 | 5 (13,2) | 9 (13,2) | 0,991 |
| Mortalidade | 9 (36) | 11 (19,3) | 0,105 | 2 (5,3) | 8 (11,8) | 0,272 |
| Sobrevivência sem morbidade | 5 (20) | 26 (45,6) | 0,028 | 26 (68,4) | 45 (66,2) | 0,814 |
Valores são n (%) ou média (desvio‐padrão).
O manejo mais conservador da PCA em nossa população mostrou uma redução de 30% no tratamento clínico e de 20% no tratamento cirúrgico, sem alterações na mortalidade ou na sobrevida sem morbidade.
A evidência científica sobre o tratamento da PCA é ampla e às vezes contraditória; ainda hoje essa condição vê diversas abordagens.12 Em prematuros com <32 semanas de idade gestacional, taxas mais baixas de tratamento clínico (cerca de 20%) e fechamento cirúrgico (< 10%) foram relatadas anteriormente.11,13–15 Chock et al. descreveram taxas semelhantes às nossas; no período 1, 18% dos lactentes tinham tratamento conservador versus 39% no período 2 (p <0,01).16 Em contrapartida, Bixler et al. encontraram taxas mais baixas de tratamento clínico: entre 20 e 38% de uso de indometacina ou ibuprofeno para tratamento de PCA em lactentes com <28 semanas de gestação em 2015 e 3 a 10% de fechamento da PCA em lactentes com <28 semanas de gestação em 2015.13 Assim, a taxa de tratamento clínico de 56% e a taxa de ligadura cirúrgica de 16% ainda podem ser consideradas altas; nossa população tem uma ampla faixa de idade gestacional, com 43,6% dos bebês com <27 semanas de idade gestacional. Talvez diferentes abordagens pessoais entre os neonatologistas de nossos centros tenham influenciado esses resultados; algumas reticências, especialmente durante os primeiros meses após a mudança no protocolo, podem ter ocorrido. Infelizmente, não supervisionamos a adesão ao protocolo nem planejamos um período de washout.
Um achado relevante neste estudo que vale a pena ressaltar é que a cirurgia foi evitada em um de cada cinco pacientes.
Um dos nossos objetivos foi também explorar o tratamento nos pacientes mais imaturos (23‐27 semanas). Apesar da mudança em nosso protocolo para uma abordagem mais conservadora, ainda tratamos dois terços dos pacientes com inibidores da ciclo‐oxigenase e 24,5% deles, cirurgicamente. Lee et al. relataram uma taxa de fechamento cirúrgico de 43% em pacientes com peso ao nascer <750g e de 24% em pacientes com peso entre 715 e 1.000g.17 Weisz et al. também relataram uma taxa de 24% de fechamento cirúrgico de PCA em bebês extremamente prematuros.18
Um atraso significativo na administração da primeira dose de ibuprofeno foi observado, de três dias de vida em P1 a seis dias em P2. Em um estudo de coorte populacional de bebês nascidos antes de 27 semanas de gestação do estudo Express (Extremely Preterm Infants in Sweden Study), os autores descobriram que um início tardio do tratamento clínico estava associado a um menor risco de doença pulmonar crônica.19 Não detectamos um atraso significativo na cirurgia como outros autores,12,16 provavelmente porque o fechamento cirúrgico já foi feito em torno da terceira ou quarta semana de vida no P1.
A questão do papel da PCA nos desfechos respiratórios, neurológicos e gastrointestinais tem sido amplamente discutida:6,18,20,21 um shunt hemodinamicamente significativo da esquerda para a direita pode resultar em maior fluxo sanguíneo pulmonar e comprometimento da perfusão de órgãos vitais. Alguns autores levantam a hipótese de que os resultados adversos historicamente associados à PCA podem também estar ligados à prematuridade em si ou a alguma outra condição coexistente, como infecção intrauterina ou inflamação.22 Benitz concluiu que não há evidências claras de que o tratamento ativo seja benéfico para bebês prematuros, porque ele não melhora claramente a mortalidade ou morbidades, como doença pulmonar crônica, enterocolite necrosante, hemorragia peri‐intraventricular e retinopatia.23 Chock et al. compararam recém‐nascidos de muito baixo peso ao nascer diagnosticados com PCA em dois períodos diferentes e não encontraram aumento nos desfechos clínicos adversos.16 Diferenças estatisticamente significantes entre P1 e P2 nos principais desfechos classicamente relacionados à prematuridade não foram demonstradas, como podemos observar na tabela 3.
Uma redução não significativa na incidência global de enterocolite necrosante grave de 15,5% para 6,9% foi encontrada. Uma redução significativa na incidência de enterocolite necrosante grave de 10,8% para 1,6% foi encontrada em pacientes entre 27 e 30 semanas de gestação entre os períodos. Em 2011, leite de doadoras foi introduzido em nossos hospitais, de modo que a redução na NEC poderia se relacionar mais com esse fato do que diretamente com o tratamento da PCA. Ainda assim, um menor uso de inibidores da ciclooxigenase no P2 pode ter exercido um papel nesse caso.5,20
Classicamente, acredita‐se que o shunt do canal tenha uma influência negativa no desenvolvimento pulmonar. Mohamed et al. não encontraram diferenças na doença pulmonar crônica entre dois períodos de tratamento de PCA24 e Slaughter et al. não identificaram alterações na mortalidade ou displasia broncopulmonar moderada a grave em prematuros com <29 semanas de gestação após tratamento clínico para PCA.25 Por outro lado, Bixler et al. observaram redução progressiva em todas as principais morbidades, com exceção da displasia broncopulmonar, em uma grande população de lactentes com <30 semanas de gestação de 2006 a 2015.11 No P2, observou‐se redução na incidência de doença pulmonar crônica e sobrevida sem morbidade, principalmente nos pacientes mais prematuros. A melhoria pré‐natal e pós‐natal dos cuidados em recém‐nascidos prematuros nos últimos anos, inclusive menos intubação na sala de parto e estratégias ventilatórias protetoras, provavelmente teve impacto sobre esses resultados.
Detectamos um aumento não significativo, mas preocupante, de 5,3% para 11,8% na mortalidade no período conservador em pacientes entre 27 a 30 semanas de gestação. Revisando os prontuários desses lactentes, dois deles nascidos com 27 semanas de gestação morreram na primeira semana de vida devido à instabilidade respiratória e hemodinâmica no contexto de hemorragia peri‐intraventricular bilateral grave. Outros quatro pacientes morreram de causas relacionadas a infecções congênitas ou nosocomiais.
Com o tratamento conservador da PCA, os neonatologistas precisam enfrentar novos desafios.26 A PCA pode ser entendida como um tipo de condição crônica durante a internação hospitalar.27 Foi demonstrado em nosso estudo que houve um aumento notável na duração da patência do canal arterial. Isso pode estar levando, na prática clínica, a um tratamento respiratório, política de fluidos, alimentação enteral, critérios de transfusão de sangue e subsequente monitoramento clínico e ecocardiográfico precisos. Neste estudo, um número notável de pacientes recebeu alta hospitalar com PCA. Uma questão a considerar é como a manutenção de um shunt prolongado da esquerda para a direita pode afetar a perfusão cerebral e o status de crescimento. Mais estudos de acompanhamento são necessários para se verificar quais serão os desfechos em longo prazo do desenvolvimento neurológico desses bebês.28
Reconhecemos algumas limitações no presente estudo. Como é um estudo clínico retrospectivo, não podemos testar a causalidade das relações ou determinar se as mudanças na prática entre os períodos afetaram os resultados. Não houve período de washout entre os períodos; é provável que nem todos os neonatologistas tenham feito a mudança imediata e completa para uma abordagem conservadora. Até mesmo comparamos o tamanho da PCA entre os grupos; não pareamos as coortes em termos da significância hemodinâmica da PCA, o que poderia ter sido muito interessante. O tamanho da amostra dos subgrupos mais imaturos pode ter limitado o poder de detectar diferenças estatisticamente significativas.
Em conclusão, neste estudo mostramos que uma abordagem conservadora e mais tolerante em recém‐nascidos de muito baixo peso com PCA pode, em alguns casos, evitar tratamentos clínicos e cirúrgicos e seus potenciais efeitos colaterais, sem alterações relevantes na mortalidade e na sobrevida sem morbidade. Nos pacientes mais jovens, as taxas de tratamentos clínicos e cirúrgicos para PCA ainda são altas, mas um maior número desses pacientes sobrevive e com menos morbidades associadas. Um grupo significativo de pacientes recebeu alta hospitalar com um canal permeável, sem aparentes resultados indesejáveis, mas o acompanhamento em longo prazo ainda é necessário.
Esta pesquisa não recebeu recurso financeiro específico de agências de financiamento dos setores público, comercial ou sem fins lucrativos.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Borràs‐Novell C, Riverola A, Aldecoa‐Bilbao V, Izquierdo M, Domingo M, Iriondo M. Clinical outcomes after more conservative management of patent ductus arteriosus in preterm infants. J Pediatr (Rio J). 2020;96:177–83.