To assess the effect of maternal breast milk supplementation on the development of exclusively breast‐fed very low birth weight preterm infants at 12 months of corrected age.
MethodsA randomized clinical trial with 53 infants followed‐up after discharge from the neonatal unit until a corrected gestational age of 12 months. Newborns in the intervention group were breastfed exclusively with maternal milk and received 2g of a multinutrient supplement (Pré‐Nan®, Nestlé, Vevey, Switzerland) added to expressed breast milk twice a day until a corrected age of 4 to 6 months. The control group was exclusively breastfed without supplementation. After monthly follow‐up, developmental assessment was performed using the Bayley III Scale.
ResultsThere was no statistically significant difference on the Bayley III Scale between the intervention and control groups in any of the assessed domains: motor, cognitive, and communication. However, scores in the three domains were always higher in the group that received the supplement. There were a similar number of cases of developmental delay in both groups: seven (28%) in the group that received the supplement and nine (33.3%) in the group that was exclusively breastfed.
ConclusionsThe results failed to show an association between post‐discharge multinutrient supplementation and development in the assessed infants.
Avaliar o efeito da suplementação do aleitamento materno exclusivo com aditivo multicomponente no desenvolvimento de lactentes nascidos pré‐termo de muito baixo peso aos 12 meses de idade gestacional corrigida.
MétodoEnsaio clínico randomizado com 53 lactentes, acompanhados da alta hospitalar na Unidade Neonatal até o 12° mês de idade gestacional corrigida. Aqueles alocados no grupo intervenção permaneciam em aleitamento materno exclusivo e recebiam dois gramas de suplemento multicomponente em pó (Pré‐Nan®, Nestlé, Vevey, Suíça), adicionados ao leite ordenhado duas vezes ao dia, por quatro a seis meses de idade gestacional corrigida. O grupo controle permanecia em aleitamento materno exclusivo sem suplementação. Após acompanhamento mensal, foi feita avaliação do desenvolvimento por meio da Escala de Bayley III.
ResultadosNa comparação do desenvolvimento pela Escala de Bayley III entre os grupos intervenção e controle, não houve diferença estatística significativa nos domínios estudados: motor, cognitivo e linguagem. Porém, os valores dos escores foram sempre maiores no grupo intervenção do que no grupo controle nos três domínios. O atraso de desenvolvimento se distribuiu de forma similar nos grupos: sete casos (28%) no grupo intervenção e nove (33,3%) no grupo controle.
ConclusõesOs resultados não mostraram associação entre suplementação multicomponente pós‐alta e desenvolvimento dos lactentes analisados pela Escala de Bayley III.
O cérebro em desenvolvimento é particularmente vulnerável a deficiências nutricionais por causa da trajetória rápida de vários processos neurológicos, como formação de sinapses e mielinização. É regulado por nutrientes como proteínas, energia, gorduras, minerais e fatores de crescimento.1‐3
A deficiência desses elementos pode refletir posteriormente e evoluir com disfunção cerebral associada a alterações futuras de desenvolvimento infantil.2 Dessa forma, a nutrição adequada, principalmente nos recém‐nascidos pré‐termo (RNPT), é de grande importância para evitar, dentre outros danos, atrasos de desenvolvimento neurológico.4‐6
Apesar de o leite materno (LM) ser considerado alimento ideal no período neonatal, promover a maturação gastrointestinal, gerar benefícios imunológicos e levar ao aumento do nível de ácido docosahexanoico, importante componente para o desenvolvimento cerebral,5,7‐9 seu uso exclusivo em determinadas situações pode acarretar deficiências de nutrientes e desmineralização óssea.10,11
O período de internação de RNPT, especialmente aqueles de muito baixo peso, compõe uma dessas situações que fazem com que a suplementação do leite humano para essas crianças seja atualmente uma prática bem estabelecida no período intra‐hospitalar e promova melhor ganho de peso, aumento do comprimento e perímetro cefálico em curto prazo e melhores índices de desenvolvimento em médio e longo prazos.12‐14
Apesar de os benefícios da suplementação do leite humano para RNPT internados estarem bem documentados na literatura, ainda não há consenso sobre a efetividade dessa prática após a alta hospitalar.6,10,15 Recentemente o Comitê de Nutrição da Sociedade Europeia de Gastroenterologia Pediátrica, Hepatologia e Nutrição (ESPGHAN Committee on Nutrition) recomendou que bebês alimentados exclusivamente com leite materno e que tivessem recebido alta hospitalar com peso abaixo do normal para sua idade pós‐conceptual recebessem aditivos para suprir suas necessidades nutricionais.16
Nos últimos anos alguns autores vêm tentando esclarecer essa questão verificando a efetividade da suplementação pós‐alta em estudos com delineamento experimental. Em revisão sistemática, Young et al.17 selecionaram somente os ensaios randomizados de O’Connor et al.18 e Zachariassen et al.19 Esses mostraram bons resultados da suplementação em algumas situações específicas, como maiores medidas de comprimento durante o período de estudo e maiores perímetros cefálicos nos RNPT com peso ao nascer abaixo de 1250g. Apesar disso, os autores da revisão concluíram que ainda não há consenso sobre a melhor forma de alimentar RNPT nessa nova fase de sua vida de modo a proporcionar melhores resultados em seu crescimento.
Quanto aos efeitos da suplementação do leite materno sobre o desenvolvimento pós‐alta, Aimone et al.,20 ao estudar a mesma população de O’Connor et al.,19 mostraram tendência a melhor ganho de peso e maiores circunferências da cabeça em crianças do grupo suplementado em relação aos do grupo controle após 12 semanas. Ao serem avaliados aos 18 meses de idade gestacional corrigida (IGC) os bebês do grupo intervenção obtiveram melhores escores na Escala Bayley II nos domínios da linguagem e motor, porém sem significância estatística.
Diante da falta de evidências nessa área, o presente estudo se propôs a investigar se crianças egressas de Unidade de Terapia Intensiva Neonatal (UTIN), nascidas prematuras e de muito baixo peso que se alimentam de leite materno suplementado com aditivo multicomponente apresentam melhores escores de desenvolvimento neuropsicomotor quando comparadas com aquelas que fazem uso de leite materno não suplementado.
MétodosEnsaio clínico randomizado feito de dezembro de 2010 até outubro de 2013 com 53 RNPT com peso de nascimento menor do que 1.500 g que estiveram internados na UTIN do Hospital Universitário Unidade Materno‐Infantil da Universidade Federal do Maranhão e que tiveram alta em aleitamento materno exclusivo. Após a alta, todas as crianças que cumpriram esses critérios foram acompanhadas até 12 meses de IGC. Não foram incluídos no estudo aqueles que apresentaram condições que poderiam interferir no desenvolvimento neuropsicomotor (DNPM): malformações importantes, hidrocefalia, cromossomopatias, hidropsia fetal, infecções congênitas, uso materno de drogas ilícitas, tabaco, álcool e de corticoides de forma contínua, gemelaridade, sequelas de enterocolite necrosante e paralisia cerebral.
Antes da alta as mães eram orientadas a oferecer o seio a seus filhos, em livre demanda, e dar prioridade ao leite posterior. Sete a dez dias após a alta em aleitamento materno exclusivo, as díades retornavam para primeira avaliação. Caso continuassem em aleitamento materno exclusivo (AME), era feita a randomização. Esse processo se justifica por causa do grande número de mães que abandonam o AME, logo após a alta, ao se deparar com as situações da vida real no domicílio.
Foram gerados números aleatórios para alocação das crianças nos grupos controle ou intervenção. Para a randomização, usou‐se envelope opaco e selado. Por questões éticas, não foi possível usar placebo e haver cegamento das mães e dos profissionais.
Para o cálculo do tamanho amostral foram usados os valores obtidos em estudo‐piloto. Para isso assumiu‐se o valor médio (90 pontos) obtido para o domínio linguagem da Escala de Bayley III do grupo controle aos 12 meses de IGC e escore do grupo intervenção 10 pontos maior, com desvio padrão de 12 pontos nos dois grupos. Assumindo‐se também um poder de 80 e probabilidade de erro tipo 1 de 0,05, calculou‐se, como necessários, 23 bebês em cada grupo.
A intervenção consistiu em suplementação do leite materno por de quatro a seis meses e era feita como se demonstra a seguir.
Após a randomização, demonstrava‐se às mães do grupo intervenção como proceder para adição do suplemento ao leite materno. Eram retirados 10ml de leite por meio de ordenha manual e acrescentados 2g de pó da fórmula PRÉ‐NAN® (Nestlé). Para isso era usado copo de plástico graduado de 50ml. Após homogeneização, a mistura era oferecida à criança. O procedimento era feito antes de duas mamadas do dia, uma no turno da manhã e outra à tarde. O acréscimo significou aumento de 20kcal por dia. Em média esse acréscimo foi suficiente para elevar a taxa calórica da criança no momento da alta (considerando‐se 1,8 a 2 kg de peso na alta) para cerca de 140 Kcal/kg/dia.21 Além disso, correspondia também ao aumento diário de 2,12g de carboidratos, 1,04g de gorduras, 0,56g de proteínas, 1,04g de gorduras totais, 0,44 g de gorduras saturadas, 0,164g de ácido linoleico, 19,6mg de ácido alfa linolênico, 10,76g de sódio, 30,4mg de cálcio, 0,4 mg de ferro, 24,2 mg de potássio, 1,6mg de taurina e vitaminas.
Os lactentes tiveram acompanhamento mensal do estado geral, nutricional e desenvolvimento em ambulatório de seguimento e incentivo ao aleitamento materno. A Escala de Bayley III foi aplicada para a avaliação do DNPM aos 12 meses de idade gestacional corrigida. A avaliação foi feita por terapeuta ocupacional com treinamento específico com equipe autorizada, em sala adequadamente equipada para aplicação do teste. O avaliador não era informado sobre o grupo ao qual a criança pertencia.
Para a verificação da efetividade da randomização, foram comparadas características dos lactentes estudados até a randomização, em ambos os grupos. Variáveis comparadas: peso, sexo, idade gestacional, perímetro cefálico (PC), comprimento ao nascimento, peso na randomização, peso em relação à idade gestacional (PIG/AIG), tempo de internação e escore de gravidade (Snappe II – Score for Neonatal Acute Physiology, Perinatal Extension, Version II).22 Não foi aplicado teste de hipótese na comparação dessas variáveis, em concordância com as normas do Consolidated Standards of Reporting Trials (Consort Statement).23
Os escores dos domínios motor, cognitivo e de linguagem avaliados pela Escala de Bayley III ao completarem 12 meses de IGC também foram descritos.
Foram calculadas as médias dos escores de cada domínio do desenvolvimento.
Usou‐se análise multivariada (regressão linear simples) apesar da randomização, uma vez que algumas variáveis coletadas antes dela não se apresentavam balanceadas entre os dois grupos. Dentre elas, foram usadas no modelo as variáveis peso de nascimento e sexo, variáveis com importante influência no desenvolvimento futuro do RNPT.24,25 Apesar de não se mostrarem balanceadas, as variáveis Snappe II e tempo de internação não foram usadas no modelo por ser consideradas colineares com o peso de nascimento. Além disso, como o desfecho foi medido vários meses após o fim da intervenção, elementos presentes nesse período poderiam influenciar no resultado final.
Apenas uma variável pós‐randomização foi escolhida para compor o modelo por sua importância para desenvolvimento da criança: “mãe como principal cuidador da criança” (categorias sim/não). Sabe‐se que unidade familiar é um dos principais fatores de promoção de desenvolvimento da criança.26 Resegue et al.27 dão especial enfoque à presença materna no cuidado das crianças nos primeiros anos de vida e consideram a privação materna fator de risco para atraso no desenvolvimento infantil.
A escolaridade materna também foi entendida como essencial para o desenvolvimento,26 porém, tendo sido coletada antes da randomização, não mostrou diferença importante na sua distribuição nos dois grupos.
Análise de regressão linear simples foi feita, a princípio, de forma não ajustada apenas com as variáveis grupo (intervenção ou controle) e pontuação na Escala de Bayley III para os três domínios de desenvolvimento (motor, cognitivo e linguagem). Em seguida fez‐se uma segunda análise de regressão linear simples, ajustada pelas variáveis sexo, peso ao nascer e mãe como principal cuidador da criança.
A variável correspondente aos escores da Escala de Bayley III nos três domínios teve sua normalidade verificada pelo teste de Shapiro‐Wilk.
A tabulação dos dados foi feita no programa EpiInfo 3.5 (Epi InfoTM, Centers for Disease Control and Prevention, Atlanta, EUA) e as análises estatísticas foram feitas no Stata 11 (StataCorp. 2009. Stata Statistical Software: Release 11. College Station, TX: StataCorp LP).
A pesquisa teve aprovação por meio do Parecer n° 302/10 do Conselho de Ética em Pesquisa do Hospital Universitário da Universidade Federal do Maranhão. O presente estudo consiste num ensaio clínico randomizado que seguiu as normas internacionais estabelecidas pelo Consolidated Standards of Reporting Trials (Consort Statement).23 O estudo foi registrado no Registro Brasileiro de Ensaios Clínicos (Rebec) do Ministério da Saúde do Brasil sob o n° U1111‐1131‐8413. Baseou‐se no projeto de pesquisa “Fortificação multicomponente do leite humano para nutrição, crescimento e desenvolvimento de recém‐nascidos prematuros egressos de UTI‐Neonatal”, edital Ministério da Saúde, Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), e Fundação de Amparo à Pesquisa do Estado do Maranhão (Fapema), n.° 477848/2007‐9.
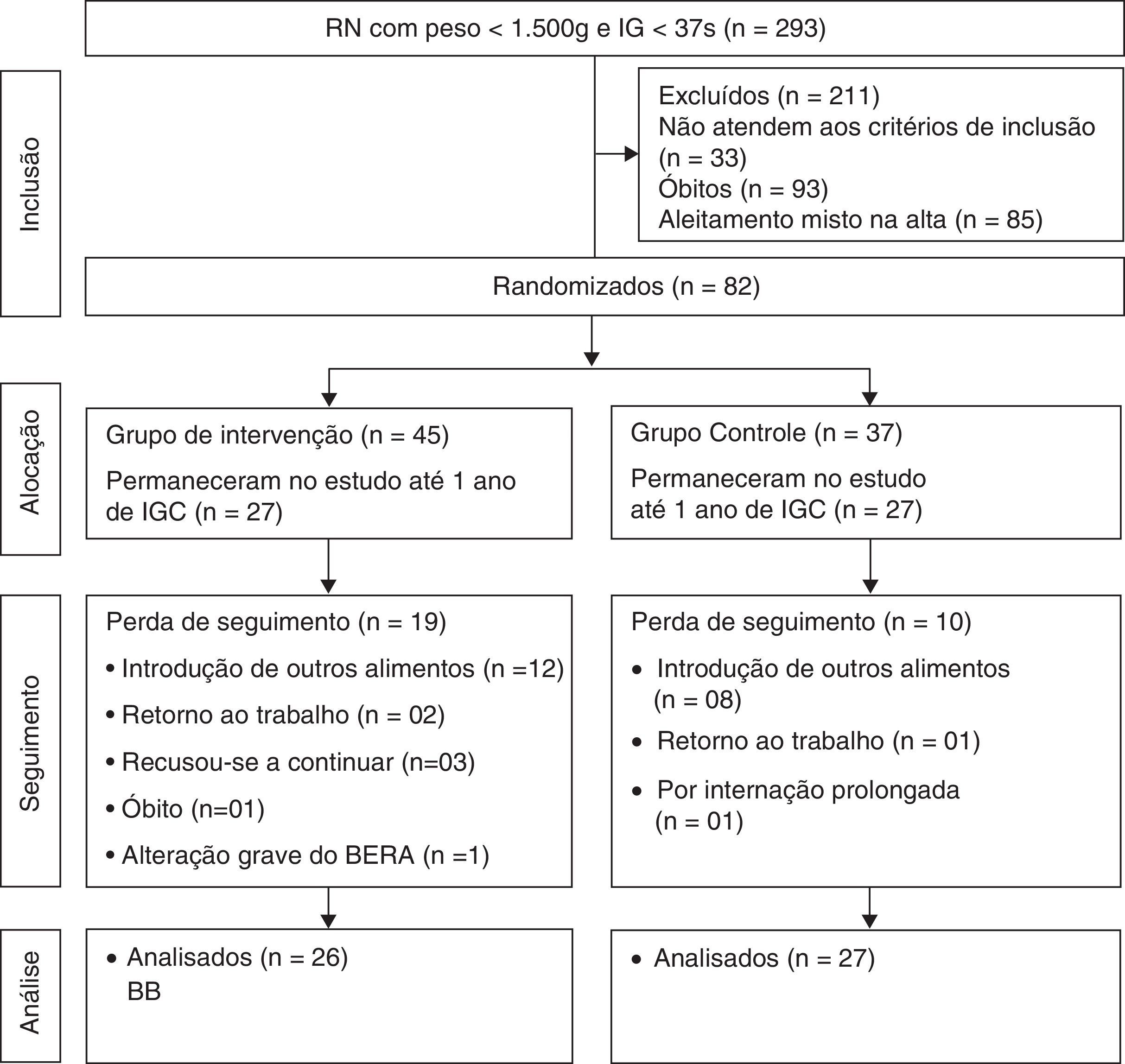
ResultadosNo período de estudo nasceram 293 crianças pré‐termo com menos de 1.500g. Não preencheram os critérios de inclusão 118 recém‐nascidos (RN) e houve 93 óbitos. A randomização foi feita em 82 recém‐nascidos. Da randomização até o fim da intervenção 29 crianças foram perdidas para o seguimento. A maioria das perdas se deu pela dificuldade da mãe de manter o aleitamento materno exclusivo durante o período de intervenção. Essas perdas foram estatisticamente semelhantes nos dois grupos (p=0,12). Foram analisadas 53 crianças pela Escala de Bayley III para avaliação do desenvolvimento. A média de duração da intervenção foi semelhante entre os grupos controle e intervenção: 5,84±0,54meses; 5,64±0,73meses; (p=0,42).
Das crianças analisadas, 27 eram do grupo controle e 26 do grupo intervenção (fig. 1).
Fluxograma da randomização de lactentes nascidos pré‐termo após a alta hospitalar.23
RN, recém‐nascido; IG, idade gestacional; IGC, idade gestacional corrigida; BERA, Brain Evoked Response Audiometry.
Das crianças que concluíram a intervenção, 20 (37,7%) eram meninos e 33(62,3%) meninas; a maioria dos lactentes tinha mães entre 20 e 30 anos (60,4%) com oito a 11 anos de estudo (69,2%) e pais que viviam em união consensual (60,4%).
A renda familiar predominante foi de um a três salários mínimos (49%), porém com alto percentual de famílias que viviam com até um salário mínimo (32%). Das mães que participaram do estudo, apenas 25% desenvolviam atividade remunerada quando seu bebê completou um ano de IGC.
A mãe foi o principal cuidador da criança em 73,6% dos casos. Apenas 18,9% das famílias tinham mais de uma criança que moravam no mesmo domicílio. A maioria das casas (88,9%) tinha revestimento de piso, o que possibilitava que a criança brincasse no chão. Um pouco mais da metade da população (52,8%) tinha brinquedos educativos (encaixe, empilhar).
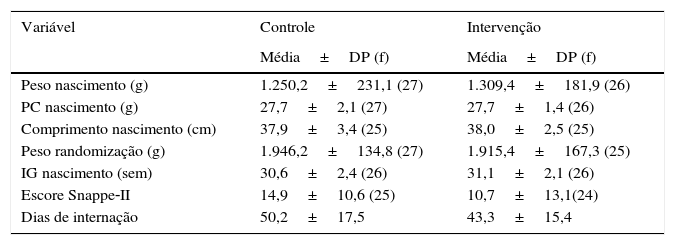
Na análise das características pré‐randomização os lactentes dos grupos controle e intervenção mostraram perfil semelhante, exceto quanto às variáveis peso de nascimento, Snappe II, tempo de internação e sexo (tabela 1).
Distribuição das características perinatais de lactentes nascidos pré‐termo e de muito baixo peso. São Luís, 2010‐2014
| Variável | Controle | Intervenção |
|---|---|---|
| Média±DP (f) | Média±DP (f) | |
| Peso nascimento (g) | 1.250,2±231,1 (27) | 1.309,4±181,9 (26) |
| PC nascimento (g) | 27,7±2,1 (27) | 27,7±1,4 (26) |
| Comprimento nascimento (cm) | 37,9±3,4 (25) | 38,0±2,5 (25) |
| Peso randomização (g) | 1.946,2±134,8 (27) | 1.915,4±167,3 (25) |
| IG nascimento (sem) | 30,6±2,4 (26) | 31,1±2,1 (26) |
| Escore Snappe‐II | 14,9±10,6 (25) | 10,7±13,1(24) |
| Dias de internação | 50,2±17,5 | 43,3±15,4 |
| % (f) | % (f) | |
|---|---|---|
| RN PIG | 38,5 (10) | 38,5 (10) |
| Sexo masculino | 33,3(09) | 42,3 (11) |
| Escolaridade materna<8 anos | 50 (21) | 50 (21) |
DP, desvio padrão; f, frequência; PC, perímetro cefálico; IG, idade gestacional; Snappe‐II, Score for Neonatal Acute Physiology, Perinatal Extension, Version II; RN, recém‐nascido; PIG, pequeno para a idade gestacional.
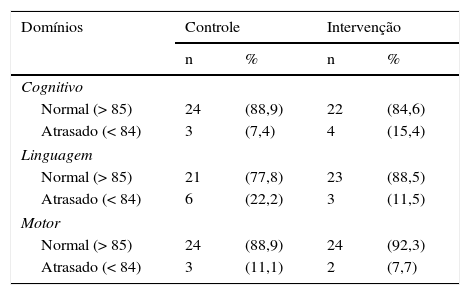
Os resultados da avaliação feita pela Escala de Bayley III nos três domínios de desenvolvimento aos 12 meses de IGC em 53 crianças são demonstrados na tabela 2. Em 16 casos (30,8%) foi evidenciado algum atraso do DNPM, nove (33,3%) no grupo controle e sete (28%) no grupo intervenção.
Classificação da normalidade nos três domínios de desenvolvimento avaliados pela Escala de Bayley III. São Luís, 2010‐2014
| Domínios | Controle | Intervenção | ||
|---|---|---|---|---|
| n | % | n | % | |
| Cognitivo | ||||
| Normal (> 85) | 24 | (88,9) | 22 | (84,6) |
| Atrasado (< 84) | 3 | (7,4) | 4 | (15,4) |
| Linguagem | ||||
| Normal (> 85) | 21 | (77,8) | 23 | (88,5) |
| Atrasado (< 84) | 6 | (22,2) | 3 | (11,5) |
| Motor | ||||
| Normal (> 85) | 24 | (88,9) | 24 | (92,3) |
| Atrasado (< 84) | 3 | (11,1) | 2 | (7,7) |
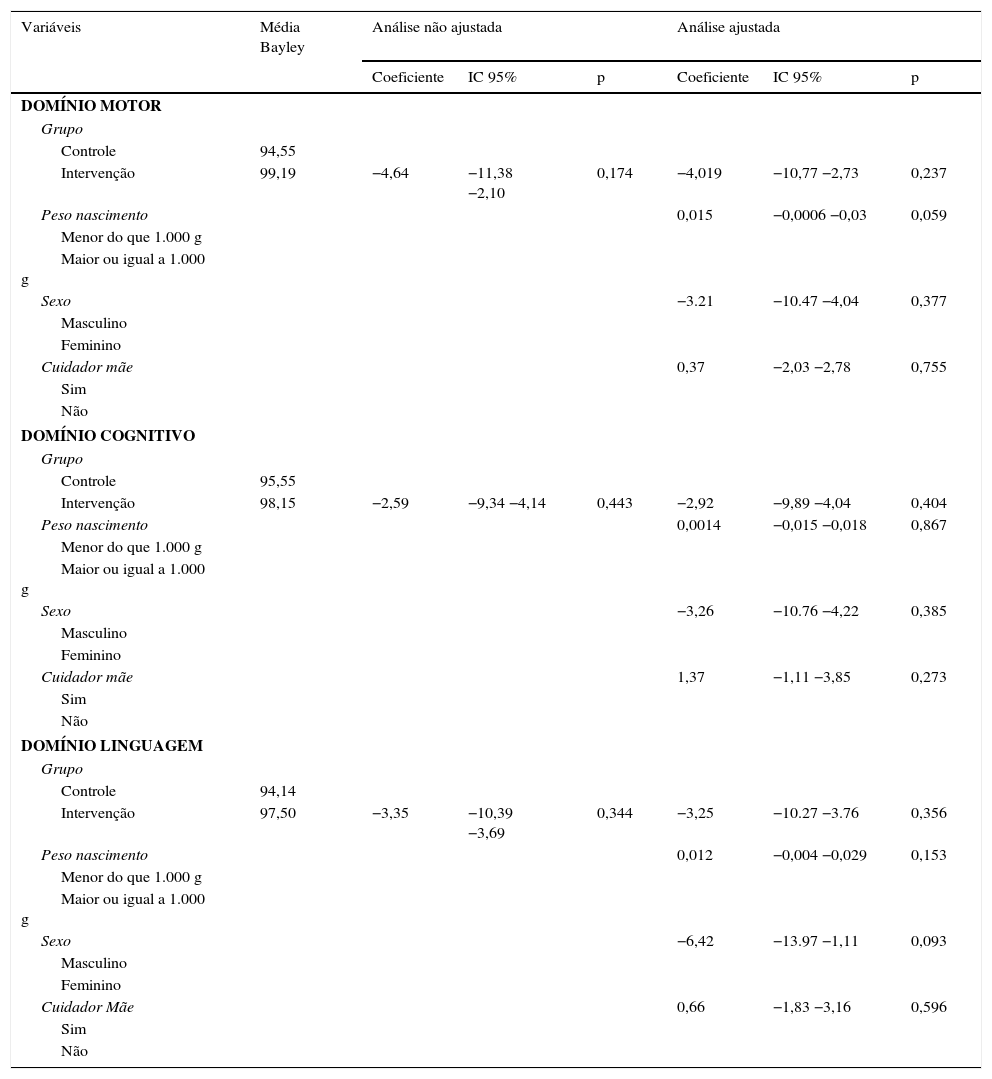
Na análise por regressão linear simples, em nenhum dos modelos correspondentes aos três domínios foram observadas associações estatisticamente significativas, apesar de os valores médios do Escore da Escala de Bayley entre as crianças suplementadas terem sido sempre maiores do que os das não suplementadas (tabela 3).
Análises ajustada e não ajustada da relação entre suplementação do leite materno e desenvolvimento avaliado pela Escala de Bayley III para os domínios motor, cognitivo e linguagem. São Luís, 2010‐2014
| Variáveis | Média Bayley | Análise não ajustada | Análise ajustada | ||||
|---|---|---|---|---|---|---|---|
| Coeficiente | IC 95% | p | Coeficiente | IC 95% | p | ||
| DOMÍNIO MOTOR | |||||||
| Grupo | |||||||
| Controle | 94,55 | ||||||
| Intervenção | 99,19 | −4,64 | −11,38 −2,10 | 0,174 | −4,019 | −10,77 −2,73 | 0,237 |
| Peso nascimento | 0,015 | −0,0006 −0,03 | 0,059 | ||||
| Menor do que 1.000 g | |||||||
| Maior ou igual a 1.000 g | |||||||
| Sexo | −3.21 | −10.47 −4,04 | 0,377 | ||||
| Masculino | |||||||
| Feminino | |||||||
| Cuidador mãe | 0,37 | −2,03 −2,78 | 0,755 | ||||
| Sim | |||||||
| Não | |||||||
| DOMÍNIO COGNITIVO | |||||||
| Grupo | |||||||
| Controle | 95,55 | ||||||
| Intervenção | 98,15 | −2,59 | −9,34 −4,14 | 0,443 | −2,92 | −9,89 −4,04 | 0,404 |
| Peso nascimento | 0,0014 | −0,015 −0,018 | 0,867 | ||||
| Menor do que 1.000 g | |||||||
| Maior ou igual a 1.000 g | |||||||
| Sexo | −3,26 | −10.76 −4,22 | 0,385 | ||||
| Masculino | |||||||
| Feminino | |||||||
| Cuidador mãe | 1,37 | −1,11 −3,85 | 0,273 | ||||
| Sim | |||||||
| Não | |||||||
| DOMÍNIO LINGUAGEM | |||||||
| Grupo | |||||||
| Controle | 94,14 | ||||||
| Intervenção | 97,50 | −3,35 | −10,39 −3,69 | 0,344 | −3,25 | −10.27 −3.76 | 0,356 |
| Peso nascimento | 0,012 | −0,004 −0,029 | 0,153 | ||||
| Menor do que 1.000 g | |||||||
| Maior ou igual a 1.000 g | |||||||
| Sexo | −6,42 | −13.97 −1,11 | 0,093 | ||||
| Masculino | |||||||
| Feminino | |||||||
| Cuidador Mãe | 0,66 | −1,83 −3,16 | 0,596 | ||||
| Sim | |||||||
| Não | |||||||
A comparação do DNPM avaliado pela Escala de Bayley III entre os grupos controle e intervenção não mostrou diferença estatística significativa nos domínios estudados: motor, cognitivo e linguagem. Os valores dos escores foram sempre maiores no grupo intervenção do que no controle nos três domínios.
Apenas um estudo semelhante ao presente ensaio foi identificado na literatura até o momento. Ambos estudaram populações semelhantes compostas por RNPT, egressos de UTIN, com médias de peso de nascimento de 1.279g (presente estudo) e 1.287g20 em AME na alta hospitalar, e tiveram como objetivo a suplementação multinutriente para fornecer mais energia e maior aporte proteico. No entanto, o modo como a suplementação foi administrada diferiu entre eles. Diferentemente do presente estudo, Aimone et al.20 adicionaram fortificante em cerca de metade da ingestão diária de leite materno, o que representou 10% a mais de energia e 20% a mais de proteína. Nos dois estudos o leite materno foi obtido por ordenha da própria mãe. No presente ensaio foi usada fórmula para pré‐termo fracionada (Pré‐Nan®, Nestlé, Vevey, Suíça), diferentemente do estudo citado, que usou fortificante multinutriente em pó do leite humano (Similac HM fortifier, Abbott Nutrition®, Ohio, EUA).
Nos dois ensaios não houve influência da fortificação na duração do aleitamento materno exclusivo.
O estudo de Aimone et al.20 avaliou o desenvolvimento aos 18 meses de IGC por meio da escala de Bayley II e não encontrou diferenças estatisticamente significativas entre os grupos. Encontraram, porém, associações limítrofes nos domínios linguagem (0,053) e motor (0,067). Foram encontrados percentuais semelhantes de crianças com desempenho atrasado nos dois grupos.
O presente estudo corrobora tais resultados, pois ao ser feita avaliação do DNPM de lactentes aos 12 meses de IGC foram encontradas médias do Escore da Escala de Bayley III semelhantes nos dois grupos, nos três domínios avaliados, sem diferença estatística significativa. Assim como no trabalho de Aimone et al.,20 atraso de desenvolvimento se distribuiu de forma similar nos grupos.
Alguns fatores podem ter contribuído para esse resultado. A não correção mensal da suplementação pode ter diminuído relativamente o efeito das quatro gramas de suplemento no desenvolvimento do lactente. Outro ponto que pode ter concorrido para a redução da diferença entre os grupos, que é característico dos trabalhos de intervenção com seguimento, é que, apesar do cuidadoso e sistemático acompanhamento das díades, é praticamente impossível garantir que a frequência correta da administração do suplemento do leite materno de uso domiciliar tenha sido obedecida.
Uma terceira possibilidade refere‐se ao fato de que provavelmente os lactentes de ambos os grupos tenham ingerido quantidades semelhantes de calorias e nutrientes, pois aqueles que não recebiam o suplemento supostamente mamariam por mais tempo e retirariam maior quantidade de leite posterior. Já aqueles do grupo suplementado tenderiam a se saciar mais precocemente e mamar por menos tempo do que o grupo controle.
Por fim, apesar de o cálculo amostral inicial ter indicado que a quantidade de indivíduos era suficiente para detectar diferença entre os grupos, é possível que se tenha superestimado a dimensão dessas diferenças. São necessárias amostras maiores para detectá‐las.
Os pontos fortes deste estudo incluem o desenho experimental com cegamento do avaliador do DNPM e o fato de ter sido encontrado na literatura apenas um trabalho que testava hipótese similar.
O presente estudo enfrentou alguns obstáculos. As dificuldades do seguimento e a introdução de outros alimentos fez com que não fosse possível acompanhar um maior número de crianças. A possibilidade de vieses devido ao longo tempo entre o fim da intervenção e a avaliação do desenvolvimento e os diferentes percentuais de perdas nos dois grupos foram minimizados pelo uso de análise ajustada.
Diante dos resultados do presente estudo, conclui‐se que no atual estágio de conhecimento, ainda não há evidência de associação entre suplementação multicomponente pós‐alta e desenvolvimento de lactentes pré‐termo de muito baixo peso ao nascer.
FinanciamentoFonte financiadora de equipamento e material usados na pesquisa: Ministério da Saúde, Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e Fundação de Amparo à Pesquisa do Estado do Maranhão (Fapema), n°477848/2007‐9.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: da Cunha RD, Lamy Filho F, Rafael EV, Lamy ZC, Queiroz AL. Breast milk supplementation and preterm infant development after hospital discharge: a randomized clinical trial. J Pediatr (Rio J). 2016;92:136–42.
Estudo vinculado à Universidade Federal do Maranhão (UFMA), São Luís, MA, Brasil.