To capture evidence of the efficacy and safety of pharmacological analgesia for uncomplicated acute sickle‐cell pain in pediatric patients compared to placebo.
Sources of dataSearches for key evidence were performed from March 1 to 31, 2018, for randomized controlled trials of pharmacological analgesia compared to placebo for uncomplicated acute sickle‐cell pain in a pediatric sample. The authors searched ten scientific databases including, among others, PubMed, MEDLINE, Embase, and Clinicaltrials.gov for this systematic review and meta‐analysis.
Summary of the findingsFour trials (n=227) were selected by the inclusion criteria (intranasal fentanyl, intravenous magnesium, arginine, and inhaled nitric oxide). The quality of evidence ranged from low to moderate for each outcome. Meta‐analysis of changes in the ladder of pain score (p=0.72), length‐of‐stay in hospital (p=0.65), and amount of narcotics used during the study (p=0.10) showed non‐statistically significant differences and a lack of amelioration provided by pharmaceutical analgesics in treatment group. The adverse events reported that more participants in the intervention arm underwent pain, with statistically significant differences at the drug delivery site in studies using intranasal fentanyl and intravenous magnesium (p=0.03).
ConclusionsPharmacological analgesia appears to be uncertain in improving the intensity and providing relief of acute pain crisis in pediatric patients with sickle‐cell anemia. With respect to clinical advantage, no decisive deduction about the clinical efficacy may be made regarding these medications in acute sickle‐cell pain management in the pediatric age group.
Obter evidências da eficácia e segurança da analgesia farmacológica para dor falciforme aguda não complicada em pacientes pediátricos em comparação com placebo.
Fontes de dadosUma busca de evidências‐chave foi feita de 1° a 31 de março de 2018 por ensaios clínicos randomizados controlados de analgesia farmacológica em comparação com placebo para dor aguda falciforme não complicada em uma amostra de pacientes pediátricos. Os autores pesquisaram dez bases de dados científicos que envolveram, entre outras, PubMed, Medline, Embase e Clinicaltrials.gov para esta revisão sistemática e metanálise.
Resumo dos dadosQuatro ensaios (n=227) foram considerados para critérios de inclusão (fentanil intranasal, magnésio intravenoso, arginina e óxido nítrico inalado). As evidências de qualidade variaram de baixas a moderadas para cada desfecho. A metanálise de alterações na escala de dor (p=0,72), o tempo de internação hospitalar (p=0,65) e a quantidade de analgésicos usados durante o estudo (p=0,10) mostraram diferença não estatisticamente significativa e a ausência de melhoria resultante do uso do fármaco analgésico no grupo de tratamento. Os eventos adversos relatados mostraram que no braço de intervenção mais participantes sofreram dor com diferença estatisticamente significativa no local de aplicação do fármaco com o uso de fentanil intranasal e magnésio intravenoso (p=0,03).
ConclusõesA analgesia farmacológica parece ter um efeito incerto na melhoria da intensidade e alívio da crise de dor aguda em pacientes pediátricos com doença falciforme. Em relação à vantagem clínica, ainda é incerta a eficácia clínica desses medicamentos no tratamento da dor aguda falciforme no grupo etário pediátrico.
A doença falciforme (DF) é uma doença eritrocitária hereditária e engloba uma unidade de doença que é a hemoglobinopatia de origem molecular comum em todo o mundo.1–3 Os genótipos mais comuns da DF incluem o estado homozigoto (HbSS) e heterozigotos compostos, como o traço falciforme, hemoglobina‐C (HbSC) ou beta (β)‐talassemia (talassemia HbSβ+ e Hbβ0).4–7A mudança para polímero sob o estado de hemoglobina desoxigenada definiu a condição que induz a formação da célula falciforme; pode ocorrer a crise vaso‐oclusiva (CVO), o marcador de DF, que causa a obstrução dos leitos microvasculares e leva à isquemia tecidual.8–10 A crise de dor aguda é uma característica importante da expressão externa de CVO, varia de dor leve a grave e debilitante, que pode continuar por horas a semanas. Muito frequentemente, essa é a razão para procurar atendimento médico no departamento de emergência (DE) em aproximadamente 70% das crianças com anemia falciforme e que resulta no aumento das taxas de re‐hospitalização.11–17A incidência de crise aguda dolorosa tende a aumentar durante toda a infância e é maior na adolescência. Os primeiros anos de vida são, no entanto, o momento crítico do início da crise de dor aguda.4,18 Apesar do profundo conhecimento da dor aguda falciforme, o alívio continua a ser um grande desafio em crianças.
Até agora, a terapia para o controle da dor na CVO não demonstrou eficiência.19 Geralmente, o alívio sintomático da crise da dor aguda não complicada na doença falciforme depende do uso de anti‐inflamatórios não esteroidais (AINEs), opioides, hidratação, analgésicos comuns, medicamentos adjuvantes e a tendência recente de uso de um anestésico dissociativo. De modo geral, acredita‐se que os derivados de opiáceos sejam os analgésicos padrão‐ouro usados no manejo da dor falciforme secundária à CVO.13,20,21 Em caso de dor não controlada por opiáceos intravenosos em altas doses, um anestésico dissociativo como a cetamina pode ser usado como uma das opções.21 A revisão de intervenção de Dunlop, baseada em nove ensaios clínicos randomizados (ECRs), concluiu que a maioria dos estudos não atingiu seus objetivos e é impossível fazer uma metanálise relevante devido à insuficiência de dados, pequeno tamanho da amostra e inconsistências nos métodos e relatos. Assim, os autores julgaram que as evidências para intervenções analgésicas nas crises de dor na doença falciforme foram restritas.22 Em 2015, Archer et al. delinearam os limites dos opioides que melhor controlam o quadro nociceptivo em relação à fisiopatologia, destacaram a crise vaso‐oclusiva e seus efeitos inflamatórios.23 Diversas abordagens foram relatadas em relação ao avanço profundo da compreensão da fisiopatogenia subjacente à crise de dor falciforme.11,24,25 Portanto, acredita‐se ser necessário um novo tipo de terapia para administrar na crise de dor.
O fentanil intranasal é uma escolha adequada de opioide em comparação com a via de administração de opiáceos parenterais, a fim de atingir os alvos diretos para atenuar a dor de forma rápida e eficiente, evitar o uso de opioides intramusculares ou intravenosos.18,20 Além disso, a mucosa nasal é uma área ampla, com rico plexo vascular e uma via rápida para a administração de medicamentos sem passar pela degradação gastrointestinal ou pelo metabolismo hepático.20 Com base nos avanços do conhecimento fisiopatológico das CVO, esses três componentes, magnésio intravenoso, arginina e óxido nítrico inalatório, trouxeram luz à curiosidade científica na literatura por seu papel crítico na regulação do endotélio e da síndrome inflamatória durante a crise falciforme.26–36
Assim, presumimos que era um momento adequado para fazer uma revisão sistemática e metanálise de ECRs para avaliar a eficiência e a segurança desses fármacos com objetivos analgésicos. Esta revisão de metanálise foi feita para reunir um extenso número de ensaios experimentais, avaliar a mudança na escala de escore de dor, o tempo de internação hospitalar e a quantidade de analgésicos usados durante o estudo em uma amostra pediátrica com crises vaso‐oclusivas agudas não complicadas na doença falciforme.
MétodosEstratégia de pesquisa do estudoNesta revisão sistemática e metanálise, buscamos os estudos e as referências de dois artigos.23,37As pesquisas foram feitas independentemente de onde os estudos foram conduzidos, sem restrições de linguagem e limitados a seres humanos. O plano de estudos obedeceu às diretrizes do Preferred Reporting Items for Systematic Reviews and Meta‐Analyses (Prisma) para metanálise de estudos de intervenção.38
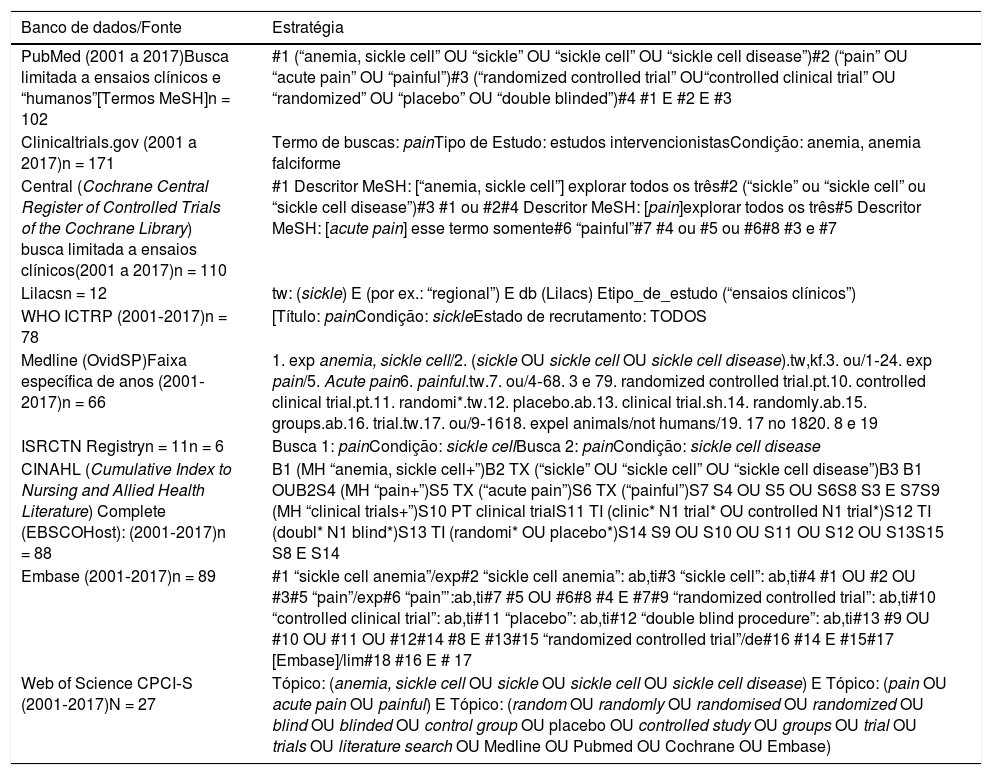
A busca foi feita em dez bancos de dados científicos de 1° a 31 de março de 2018, de estudos publicados entre 1° de janeiro de 2001 e 31 de dezembro de 2017: Medline (OvidSP), Embase, PubMed, Central, Lilacs, ISRCTN Registry, CINAHL (EBSCOHost), Web of Science (CPCI‐S) para ECRs. Para estudos em andamento, procuramos em Clinicaltrials.gov e WHO‐ICTRP. Para cada banco de dados, uma estratégia de pesquisa abrangente foi expandida, com o uso dos operadores booleanos e controlada pelos termos MeSH. Alguns dos termos de busca, como detalhado na tabela 1, incluíram: anemia, sickle cell, pain, acute pain, randomized controlled trial, placebo, clinical trial e double blind. Além disso, para pesquisas posteriores, usamos o Google scholar e procuramos manualmente em outras bibliografias a partir de estudos considerados como referência fornecida a outros estudos ou perdidos na pesquisa eletrônica principal. Apenas os artigos publicados sob revisão por pares foram considerados para o nosso trabalho de pesquisa.
Estratégia de busca eletrônica
| Banco de dados/Fonte | Estratégia |
|---|---|
| PubMed (2001 a 2017)Busca limitada a ensaios clínicos e “humanos”[Termos MeSH]n = 102 | #1 (“anemia, sickle cell” OU “sickle” OU “sickle cell” OU “sickle cell disease”)#2 (“pain” OU “acute pain” OU “painful”)#3 (“randomized controlled trial” OU“controlled clinical trial” OU “randomized” OU “placebo” OU “double blinded”)#4 #1 E #2 E #3 |
| Clinicaltrials.gov (2001 a 2017)n = 171 | Termo de buscas: painTipo de Estudo: estudos intervencionistasCondição: anemia, anemia falciforme |
| Central (Cochrane Central Register of Controlled Trials of the Cochrane Library) busca limitada a ensaios clínicos(2001 a 2017)n = 110 | #1 Descritor MeSH: [“anemia, sickle cell”] explorar todos os três#2 (“sickle” ou “sickle cell” ou “sickle cell disease”)#3 #1 ou #2#4 Descritor MeSH: [pain]explorar todos os três#5 Descritor MeSH: [acute pain] esse termo somente#6 “painful”#7 #4 ou #5 ou #6#8 #3 e #7 |
| Lilacsn = 12 | tw: (sickle) E (por ex.: “regional”) E db (Lilacs) Etipo_de_estudo (“ensaios clínicos”) |
| WHO ICTRP (2001‐2017)n = 78 | [Título: painCondição: sickleEstado de recrutamento: TODOS |
| Medline (OvidSP)Faixa específica de anos (2001‐2017)n = 66 | 1. exp anemia, sickle cell/2. (sickle OU sickle cell OU sickle cell disease).tw,kf.3. ou/1‐24. exp pain/5. Acute pain6. painful.tw.7. ou/4‐68. 3 e 79. randomized controlled trial.pt.10. controlled clinical trial.pt.11. randomi*.tw.12. placebo.ab.13. clinical trial.sh.14. randomly.ab.15. groups.ab.16. trial.tw.17. ou/9‐1618. expel animals/not humans/19. 17 no 1820. 8 e 19 |
| ISRCTN Registryn = 11n = 6 | Busca 1: painCondição: sickle cellBusca 2: painCondição: sickle cell disease |
| CINAHL (Cumulative Index to Nursing and Allied Health Literature) Complete (EBSCOHost): (2001‐2017)n = 88 | B1 (MH “anemia, sickle cell+”)B2 TX (“sickle” OU “sickle cell” OU “sickle cell disease”)B3 B1 OUB2S4 (MH “pain+”)S5 TX (“acute pain”)S6 TX (“painful”)S7 S4 OU S5 OU S6S8 S3 E S7S9 (MH “clinical trials+”)S10 PT clinical trialS11 TI (clinic* N1 trial* OU controlled N1 trial*)S12 TI (doubl* N1 blind*)S13 TI (randomi* OU placebo*)S14 S9 OU S10 OU S11 OU S12 OU S13S15 S8 E S14 |
| Embase (2001‐2017)n = 89 | #1 “sickle cell anemia”/exp#2 “sickle cell anemia”: ab,ti#3 “sickle cell”: ab,ti#4 #1 OU #2 OU #3#5 “pain”/exp#6 “pain”’:ab,ti#7 #5 OU #6#8 #4 E #7#9 “randomized controlled trial”: ab,ti#10 “controlled clinical trial”: ab,ti#11 “placebo”: ab,ti#12 “double blind procedure”: ab,ti#13 #9 OU #10 OU #11 OU #12#14 #8 E #13#15 “randomized controlled trial”/de#16 #14 E #15#17 [Embase]/lim#18 #16 E # 17 |
| Web of Science CPCI‐S (2001‐2017)N = 27 | Tópico: (anemia, sickle cell OU sickle OU sickle cell OU sickle cell disease) E Tópico: (pain OU acute pain OU painful) E Tópico: (random OU randomly OU randomised OU randomized OU blind OU blinded OU control group OU placebo OU controlled study OU groups OU trial OU trials OU literature search OU Medline OU Pubmed OU Cochrane OU Embase) |
Dois autores da revisão (MIS e SS) pesquisaram independentemente os bancos de dados. Também identificaram independentemente, entre os estudos recuperados, quais eram pertinentes e examinaram os textos completos para decidir sua elegibilidade de acordo com os critérios. Quaisquer discrepâncias sobre a inclusão de artigos de texto completo foram elucidadas e resolvidas por consenso com todos os investigadores.
Critérios de inclusãoPara serem considerados, os ensaios clínicos precisavam ter pelo menos dez participantes em cada grupo e em qualquer cenário clínico; precisavam ser estudos randomizados, duplo‐cegos, controlados com placebo, juntamente com desenho de estudo em paralelo ou de grupo único e/ou estudo piloto e cujo tipo de intervenções tinham finalidade analgésica. A população do estudo era de pacientes pediátricos entre três e ≤ 21 anos, com três genótipos de DF, limitados a HbSS, HbSC e HbS‐β talassemia, que tiveram um episódio de dor aguda não complicada de CVO. Foram excluídos ensaios clínicos não randomizados e ECRs que relataram a combinação de elegibilidade de participantes ambos pediátricos e adultos, estudos em animais e estudos que forneceram resultados em participantes com crise grave de dor falciforme complicada (por exemplo, síndrome torácica aguda, sequestro esplênico agudo e acidente vascular encefálico) e dor falciforme crônica, estudos apenas com resumos disponíveis e com comparação ativa de fármacos e duplo‐cegos. Portanto, excluímos sete estudos: três não ECRs,39–41 um estudo com poucos participantes disponíveis,42 um que incluiu apenas dois genótipos,43 um que avaliou dor crônica44 e um com comparação ativa.45 Os estudos incluídos delinearam duas das seguintes medidas de desfecho: avaliação do escore de dor, tempo de internação, análise cumulativa do consumo de analgésicos e eventos adversos (as definições de medidas de desfecho são relatadas na tabela 2). Efetivamente, excluímos os estudos relacionados à terapia modificadora da doença (por exemplo, hidroxiureia) da DF, que é benéfica para as CVO. Foram excluídos também os estudos que abordaram intervenções, particularmente transfusões sanguíneas regulares, coloides, reposição de fluidos e anticoagulantes que são usados para impedir as crises da DF e para minimizar a frequência da dor ao impedir a deformação falciforme. Não foram incluídos na revisão estudos que usaram intervenções de terapia analgésica agressiva com tratamento sistêmico (administração oral, subcutânea, epidural e intramuscular) com o uso de opioides fortes, opioides fracos (codeína e dextropropoxifeno) e agentes não opioides (paracetamol e AINEs).
Definições de medidas de desfecho
| Medidas de desfecho | Definições |
|---|---|
| Mudança no nível do escore de dor | Em todos os estudos foram usados apenas dois tipos de escala de dor, cada uma com 0 para “sem dor” e 10 para “muita dor”; a diminuição da dor pelo escore de dor < 6cm na escala visual analógica de dor (EVA) ou < 6° número (Escala de Dor Facial) |
| Tempo de internação primariamente no hospital (horas) | Registrado como o número de horas desde o início da primeira medicação do estudo até o momento da alta hospitalar |
| Quantidade de analgésicos usados durante o estudo | Quantidade cumulativa de opioides intravenosos parenterais usada durante o estudo |
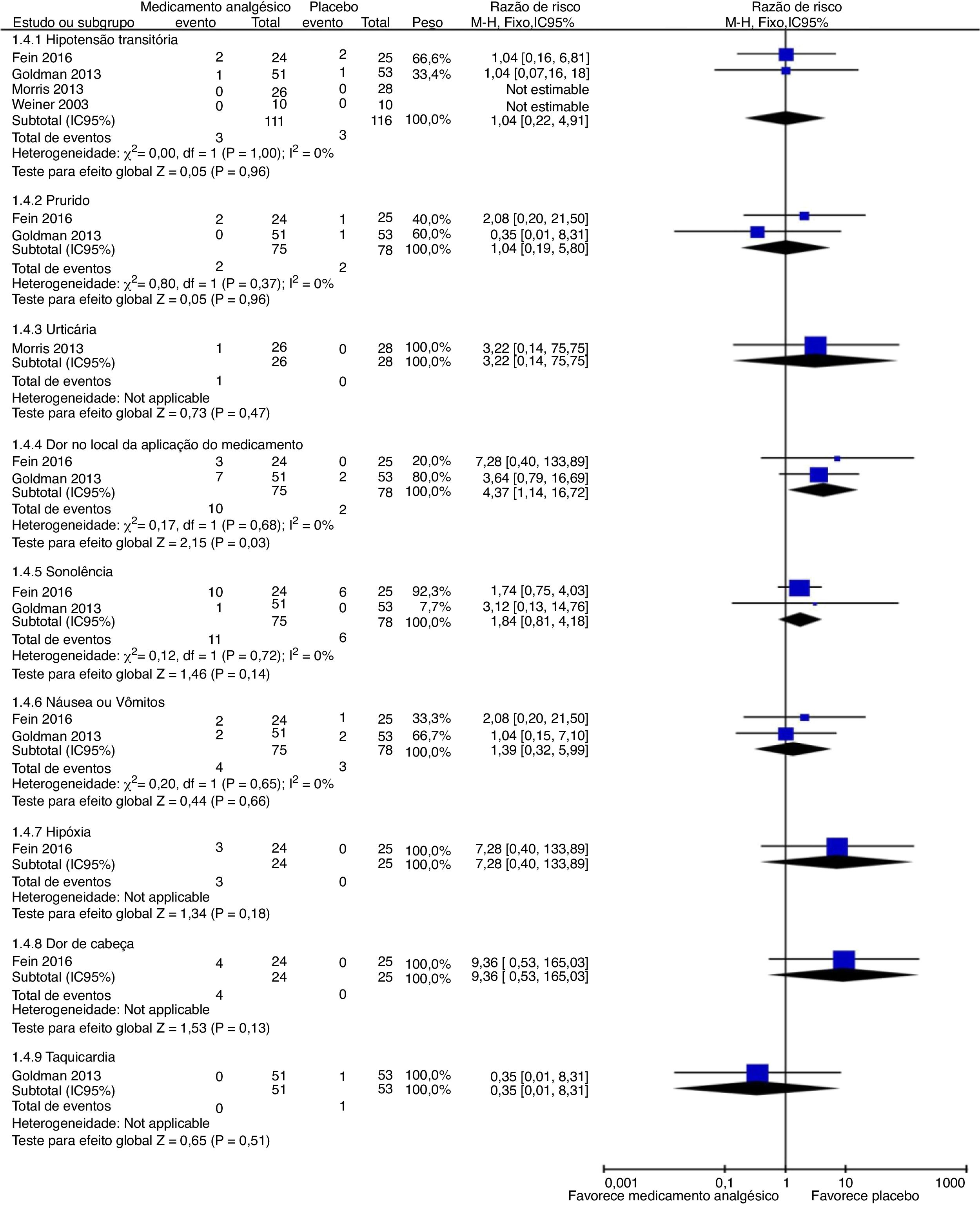
| Proporção com eventos adversos menores | Inclui hipotensão transitória, prurido, urticária, dor no local de administração do medicamento, sonolência, náusea ou vômito, hipóxia, dor de cabeça, taquicardia, durante o estudo. |
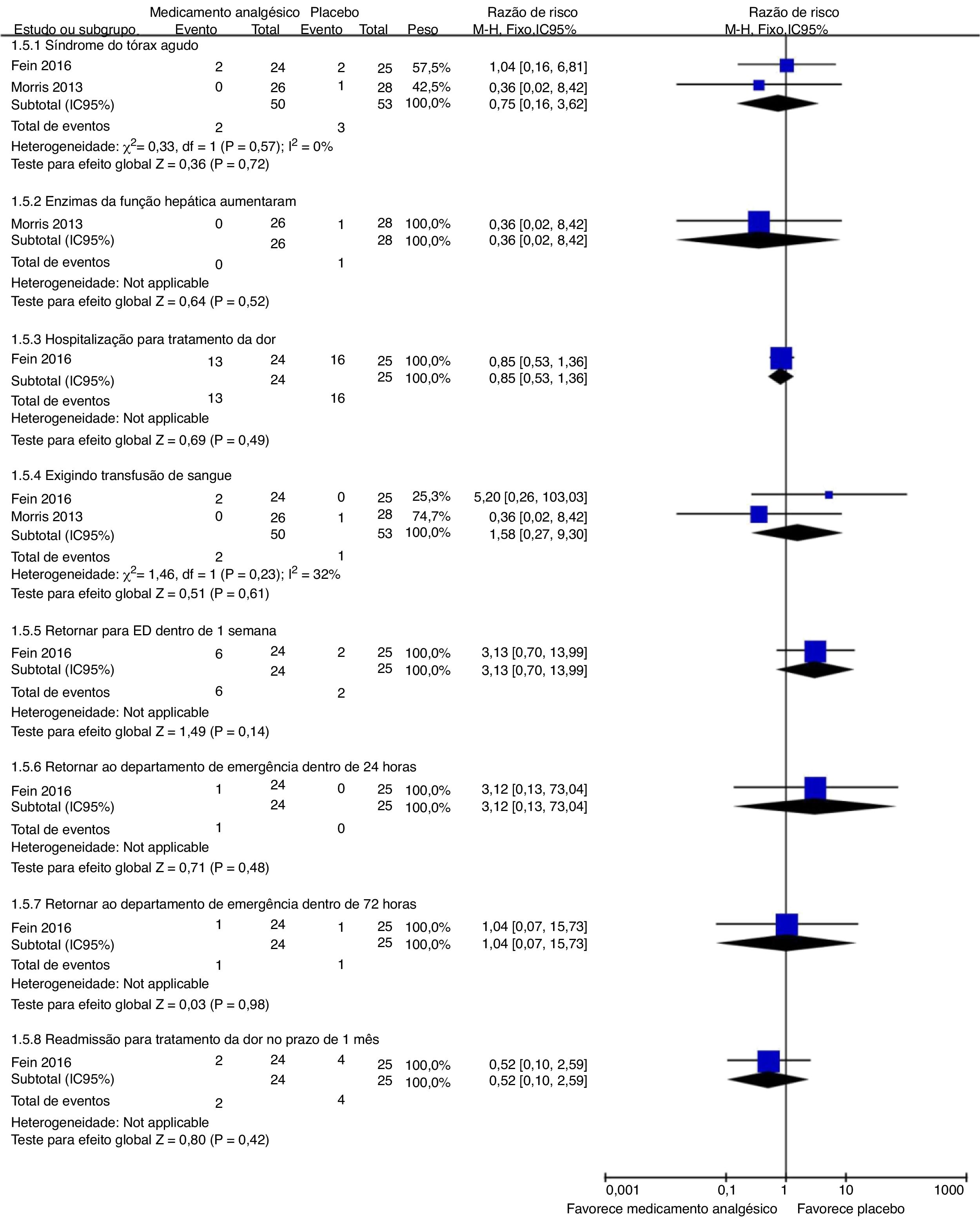
| Proporção com eventos adversos graves | Incidência ocorrida durante o estudo com deterioração clínica aguda, inclusive complicações graves de um CVO com transfusão de glóbulos vermelhos, síndrome torácica aguda, enzimas de função hepática aumentadas, hospitalização para tratamento da dor, retorno ao departamento de emergência em uma semana, 24 horas e 72 horas, e re‐hospitalização para controle da dor em um mês |
Um autor (MIS) fez a extração de dados dos estudos incluídos que foram revisados por todos os investigadores (SS e DZ) e todas as discrepâncias também foram resolvidas com todos os autores através de consenso. Um investigador (MIS) extraiu os detalhes gerais de cada estudo de acordo com o Cochrane Handbook for Systematic Reviews of Interventions,46 que foi subsequentemente conferido por todos os autores da revisão. O formulário incluiu o primeiro autor e ano de publicação, local, cenário e desenho do estudo, características dos participantes, descrição das intervenções e resultados do estudo (desfechos pré‐especificados).
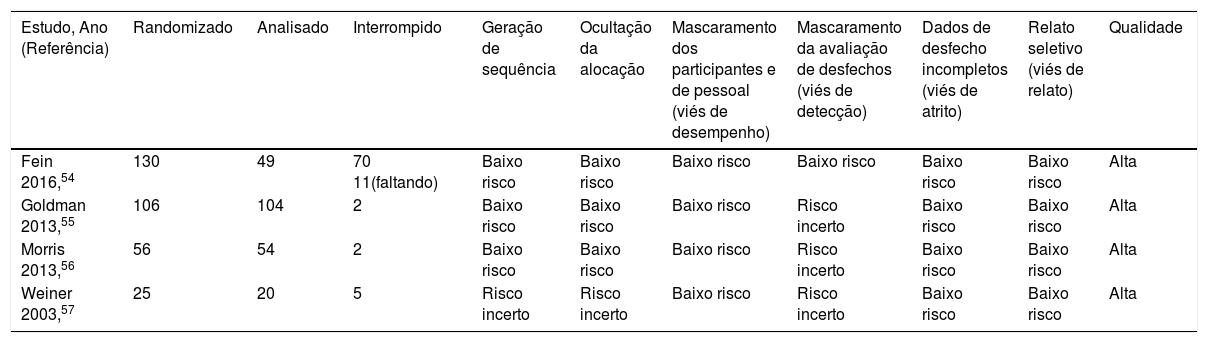
Avaliação de qualidade e risco de viésO risco de viés para a qualidade metodológica dos ensaios elegíveis foi determinado e avaliado por um dos autores da revisão (MIS), seguido de revisão por todos os pesquisadores com o uso de cada domínio de viés relevante de acordo com as ferramentas de avaliação do Cochrane Risk Assessment Tools for Randomized Study Designs.47 Cada estudo foi avaliado como baixo, alto ou incerto risco de viés de seleção (geração de sequência aleatória e ocultação de alocação), viés de desempenho (mascaramento dos participantes e pessoal), viés de detecção (mascaramento da avaliação de desfechos), viés de atrito (dados de desfecho incompletos), viés de relato (relato seletivo) e outro vieses (tabela 3, mais detalhes no material suplementar). Quaisquer discrepâncias foram resolvidas por consenso de todos os investigadores. Como recomendado pela Cochrane Collaboration, a metodologia Grade (Grading of Recommendation Assessment, Development and Evaluation)48 foi usada para classificar a qualidade da evidência para o desfecho individual com o uso dos cinco domínios principais, inclusive limitação do desenho ou execução do estudo (risco de viés); inconsistência, desvio e imprecisão de resultados e publicação de viés. Assim, tabulamos essa qualidade de evidência como muito baixa, baixa, moderada ou alta para cada desfecho.
Avaliação de qualidade do estudo individual
| Estudo, Ano (Referência) | Randomizado | Analisado | Interrompido | Geração de sequência | Ocultação da alocação | Mascaramento dos participantes e de pessoal (viés de desempenho) | Mascaramento da avaliação de desfechos (viés de detecção) | Dados de desfecho incompletos (viés de atrito) | Relato seletivo (viés de relato) | Qualidade |
|---|---|---|---|---|---|---|---|---|---|---|
| Fein 2016,54 | 130 | 49 | 70 11(faltando) | Baixo risco | Baixo risco | Baixo risco | Baixo risco | Baixo risco | Baixo risco | Alta |
| Goldman 2013,55 | 106 | 104 | 2 | Baixo risco | Baixo risco | Baixo risco | Risco incerto | Baixo risco | Baixo risco | Alta |
| Morris 2013,56 | 56 | 54 | 2 | Baixo risco | Baixo risco | Baixo risco | Risco incerto | Baixo risco | Baixo risco | Alta |
| Weiner 2003,57 | 25 | 20 | 5 | Risco incerto | Risco incerto | Baixo risco | Risco incerto | Baixo risco | Baixo risco | Alta |
A partir de cada medida de desfecho, extraímos diretamente a média (desvio‐padrão [DP] ou a calculamos da mediana e dos intervalos interquartis (IIQ) com o uso do método de Hozo et al.49 Registramos os desfechos contínuos como diferença média (DM) junto com intervalos de confiança de 95% (IC95%), nos quais os desfechos são medidos com a mesma escala entre os estudos (tempo de internação primariamente no hospital) e como diferença média padronizada (DMP). Os estudos usaram diferentes escalas ou unidades para medir dados idênticos (mudança na escala do escore de dor e quantidade de analgésicos usados durante o estudo). Além disso, o número de eventos de cada estudo dividido em dois braços (categorizado pelo mesmo investigador em menor e grave) e o resumo estatístico apresentado em resultados dicotômicos como taxa de risco (RR) e IC95% foram extraídos. Fizemos contato com os principais autores das revisões e dos estudos identificados para solicitar quaisquer dados não publicados ou ausentes. Derivamos estimativas agrupadas de DMP, DM e IC95% a partir da média (DP) com modelos de efeitos aleatórios ponderados por variância inversa (VI) nos quais a heterogeneidade foi moderada. Em contraste, usamos modelos de efeitos fixos, nos quais a heterogeneidade foi considerada como não importante ou nula. Calculamos as estimativas resumidas gerais de RR e IC95% com modelos de efeitos fixos ponderados por Mantel‐Haenszel para eventos durante o estudo. Para determinar a avaliação da heterogeneidade entre os efeitos da intervenção, usamos o teste de qui‐quadrado (χ2) de Cochrane, juntamente com o valor de p < 0,10 para avaliar as análises dos subgrupos. Também usamos uma medida opcional da heterogeneidade estatística com o método de inconsistência (I2) que expressa entre 0% e 100% e a tabulamos como não significativa (I2 < 50%), moderada (I2 ≥ 50%), ou significativa (I2 ˃ 80%).50,51
Fizemos análises para explorar o impacto das intervenções analgésicas com fármacos versus controle sobre a DMP da mudança na escala de dor para a crise de dor aguda falciforme não complicada, na DM de tempo de internação hospitalar e na DMP da quantidade de fármacos usada durante o estudo. Fizemos análises de subgrupos para considerar os diversos eventos adversos ocorridos nos dois braços durante o estudo.
A publicação de vieses avaliados para produzir gráficos de funil e análises de sensibilidade não pôde ser investigada, uma vez que identificamos um número pequeno de estudos (menos de 10).50,52 Além disso, não teríamos alcançado uma revisão de metanálise se a heterogeneidade identificada fosse de 80% ou mais. Todas as análises foram feitas com o software Review Manager (RevMan) [Computer program] versão 5.3. Copenhagen: The Nordic Cochrane Centre, The Cochrane Collaboration, 2014).53
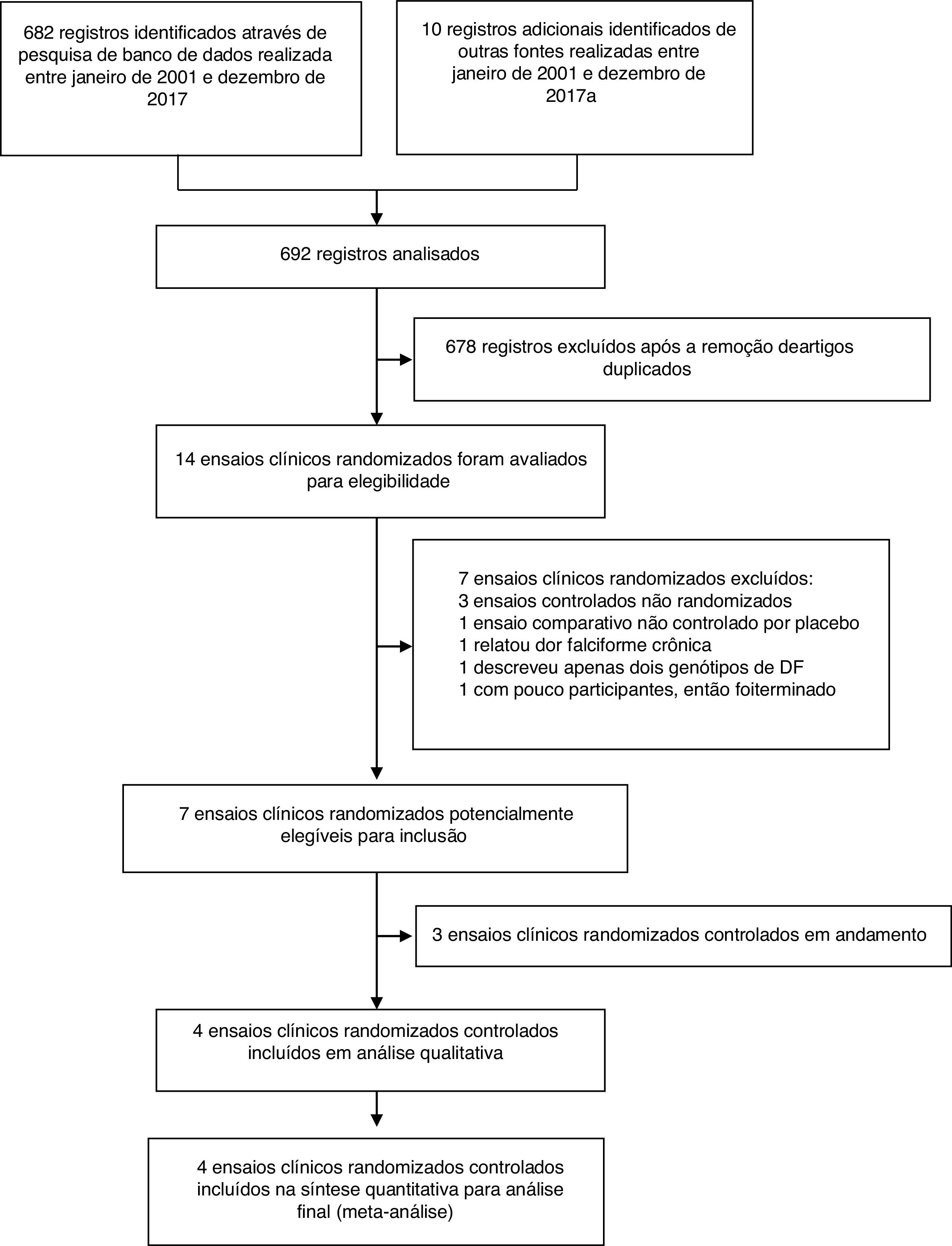
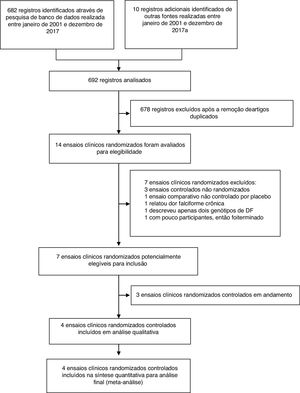
ResultadosNossas principais evidências de pesquisas iniciais recuperaram 692 registros, dos quais 14 potencialmente relevantes foram selecionados para revisão de texto completo. Desses, foram considerados quatro ensaios clínicos randomizados que preencheram os critérios de inclusão (fig. 1).
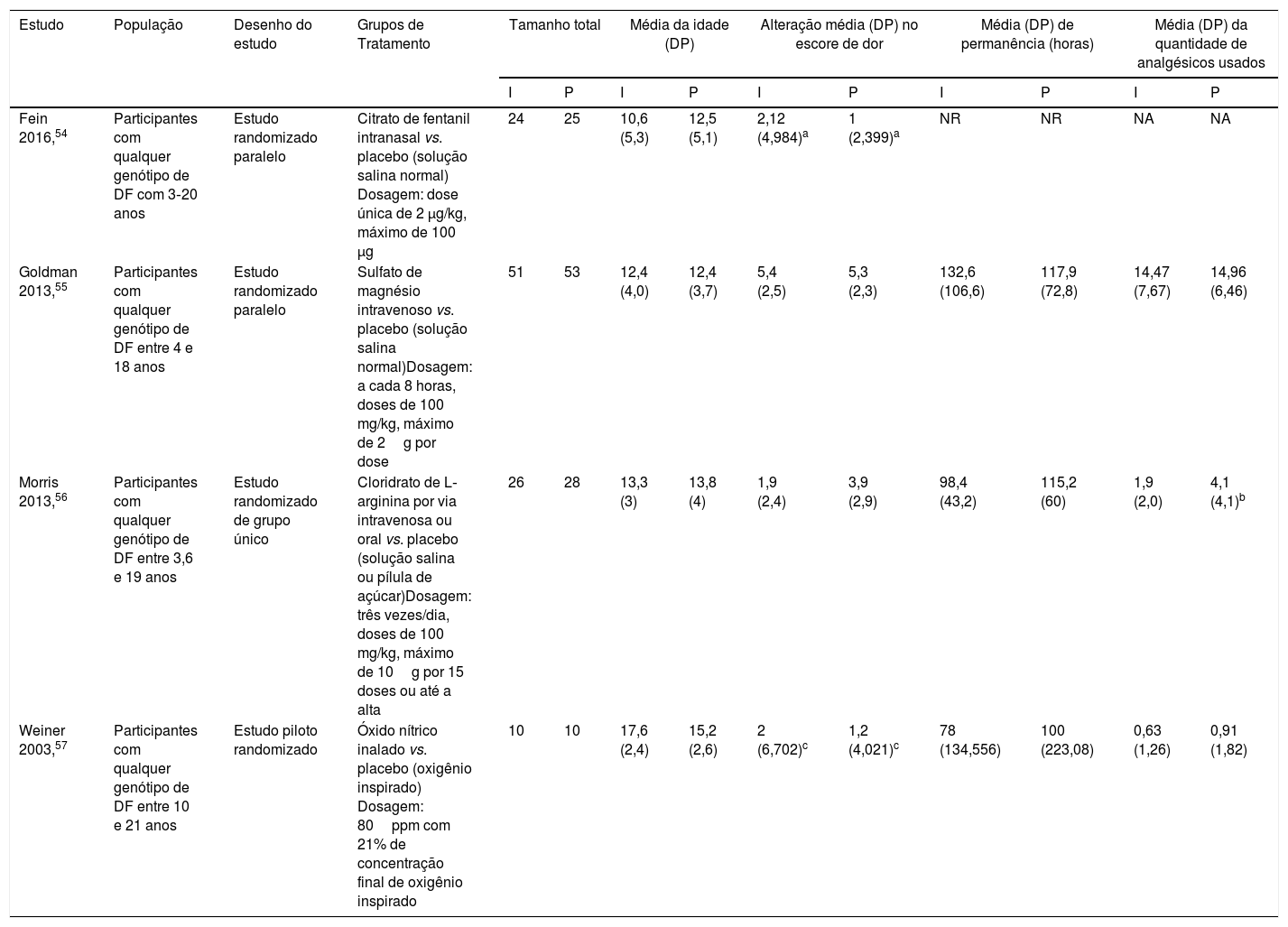
Características dos estudosO resumo das características dos estudos está descrito na tabela 4 e no material suplementar. Além disso, esses estudos foram publicados de 2003 a 2016. Quatro estudos incluíram 227 participantes;54–57 entre eles, 111 incluídos no grupo de intervenção e 116 no grupo placebo.
Principais características e resumo dos resultados dos estudos incluídos na metanálise
| Estudo | População | Desenho do estudo | Grupos de Tratamento | Tamanho total | Média da idade (DP) | Alteração média (DP) no escore de dor | Média (DP) de permanência (horas) | Média (DP) da quantidade de analgésicos usados | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| I | P | I | P | I | P | I | P | I | P | ||||
| Fein 2016,54 | Participantes com qualquer genótipo de DF com 3‐20 anos | Estudo randomizado paralelo | Citrato de fentanil intranasal vs. placebo (solução salina normal) Dosagem: dose única de 2 μg/kg, máximo de 100 μg | 24 | 25 | 10,6 (5,3) | 12,5 (5,1) | 2,12 (4,984)a | 1 (2,399)a | NR | NR | NA | NA |
| Goldman 2013,55 | Participantes com qualquer genótipo de DF entre 4 e 18 anos | Estudo randomizado paralelo | Sulfato de magnésio intravenoso vs. placebo (solução salina normal)Dosagem: a cada 8 horas, doses de 100 mg/kg, máximo de 2g por dose | 51 | 53 | 12,4 (4,0) | 12,4 (3,7) | 5,4 (2,5) | 5,3 (2,3) | 132,6 (106,6) | 117,9 (72,8) | 14,47 (7,67) | 14,96 (6,46) |
| Morris 2013,56 | Participantes com qualquer genótipo de DF entre 3,6 e 19 anos | Estudo randomizado de grupo único | Cloridrato de L‐arginina por via intravenosa ou oral vs. placebo (solução salina ou pílula de açúcar)Dosagem: três vezes/dia, doses de 100 mg/kg, máximo de 10g por 15 doses ou até a alta | 26 | 28 | 13,3 (3) | 13,8 (4) | 1,9 (2,4) | 3,9 (2,9) | 98,4 (43,2) | 115,2 (60) | 1,9 (2,0) | 4,1 (4,1)b |
| Weiner 2003,57 | Participantes com qualquer genótipo de DF entre 10 e 21 anos | Estudo piloto randomizado | Óxido nítrico inalado vs. placebo (oxigênio inspirado) Dosagem: 80ppm com 21% de concentração final de oxigênio inspirado | 10 | 10 | 17,6 (2,4) | 15,2 (2,6) | 2 (6,702)c | 1,2 (4,021)c | 78 (134,556) | 100 (223,08) | 0,63 (1,26) | 0,91 (1,82) |
I, intervenção; NA, não aplicável; NR, não relatado; P, placebo; vs., versus.
Em estudos para inclusão em metanálise, encontramos três ensaios clínicos randomizados, com intervenção e uso de fármacos que têm um papel crucial para intervir no mecanismo patológico das CVO, inclusive magnésio intravenoso, arginina e óxido nítrico, e um ECR com fentanil intranasal que é um derivado opioide. Todos os ECRs foram comparados com um braço de tratamento com placebo e esses fármacos foram posteriormente investigados. Havia dois estudos com desenho paralelo,54,55 um desenho de grupo único56 e um desenho de estudo‐piloto.57 Todos os ensaios incluídos foram de indivíduos admitidos no DE devido a um episódio agudo de crise de dor causada por CVO com o uso da escala de mensuração da dor de pequena duração do tratamento. Três dos estudos incluídos foram feitos nos Estados Unidos54,56,57 e somente um foi feito no Canadá.55
O número total de participantes em estudos incluídos não foi diferente nos braços de intervenção (111) e placebo (116) e o número total de participantes em cada ensaio ficou entre 20 e 104. Todos os estudos focaram em episódios agudos imprevisíveis e não complicados de crise de dor na doença falciforme, com fenótipos identificados como HbSS, HbSC e HbSβ‐talassemia. Dos 227 participantes envolvidos, 149 (65,6%) tinham HbSS, 61 (26,9%) HbSC e apenas 17 (7,5%) tinham HbSβ‐talassemia, 115 (50,66%) eram do sexo masculino e 112 (49,34%) do feminino. Quarenta e nove participantes eram elegíveis e foram incluídos para análise no ensaio de fentanil intranasal, 104 no ensaio de magnésio intravenoso, 54 no ensaio de arginina e apenas 20 no ensaio de óxido nítrico. Em dois grupos (tratamento e controle), em todos os estudos, a menor média (DP) de idade dos participantes variou de 10,6 (5,3) à maior média (DP) de 17,6 (2,4) anos. A divisão dos participantes em cada um dos braços (intervenção e placebo) em todos os ensaios foi quase igual (24‐25) no ensaio de fentanil intranasal, 51‐53 no ensaio de magnésio intravenoso, 26‐28 no ensaio com arginina e 10‐10 no ensaio de óxido nítrico.54–57
Risco de viésA ferramenta de avaliação Cochrane Risk of Bias Assessment para estudos individuais está exposta na tabela 3 e no material suplementar. Além disso, a qualidade das evidências oferecidas para cada desfecho, de acordo com a abordagem Grade, foi classificada de “baixa” a “moderada” (tabela 5). Consideramos os três ensaios clínicos randomizados controlados de baixo risco de viés de seleção, já que o método de randomização foi relatado com o uso das tabelas em bloco e a sequência foi criada por meio de pesquisa da farmácia.54–56 Julgamos que um estudo tinha risco de viés de seleção incerto, já que o estudo não descreveu adequadamente o método de randomização e tinha informações insuficientes de ocultação de alocação (material suplementar).57 Todos os quatro estudos foram classificados como de baixo risco de viés de desempenho, atrito e de relato, porque todos relataram em seus estudos a descrição de estudo duplo‐cego e os tratamentos com placebo não eram discerníveis da intervenção do estudo. Todos os participantes analisados foram incluídos para os dados finais. Um relato de todas as medidas de desfechos pretendidos pré‐especificados foi obtido a partir do registro do estudo online.54–57 Três ensaios tinham um risco incerto de detecção, porque no registro do estudo não havia detalhes claros para julgar e nenhuma declaração de informação complementar foi dada para os avaliadores de resultados que foram submetidos ao mascaramento.55–57 Um estudo foi considerado de baixo risco de detecção, pois os avaliadores de desfechos foram submetidos ao mascaramento, como declarado no registro do estudo.54 Além disso, todos os estudos tinham um alto risco de outras possíveis fontes de vieses; a razão foi o tamanho da amostra alvo prevista no protocolo do estudo não ter sido atingida (material suplementar).
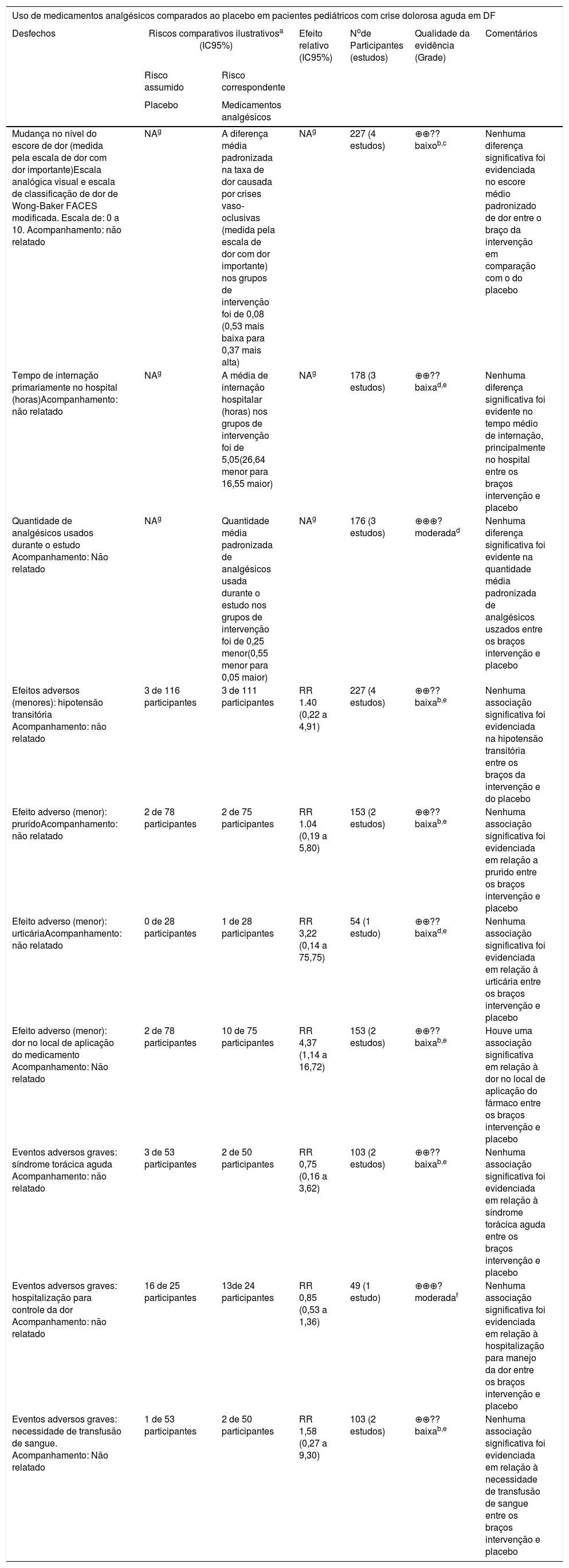
Uso de medicamentos analgésicos comparados ao placebo em pacientes pediátricos com crise dolorosa aguda em DF. Resumo dos achados
| Uso de medicamentos analgésicos comparados ao placebo em pacientes pediátricos com crise dolorosa aguda em DF | ||||||
|---|---|---|---|---|---|---|
| Desfechos | Riscos comparativos ilustrativosa (IC95%) | Efeito relativo (IC95%) | Node Participantes (estudos) | Qualidade da evidência (Grade) | Comentários | |
| Risco assumido | Risco correspondente | |||||
| Placebo | Medicamentos analgésicos | |||||
| Mudança no nível do escore de dor (medida pela escala de dor com dor importante)Escala analógica visual e escala de classificação de dor de Wong‐Baker FACES modificada. Escala de: 0 a 10. Acompanhamento: não relatado | NAg | A diferença média padronizada na taxa de dor causada por crises vaso‐oclusivas (medida pela escala de dor com dor importante) nos grupos de intervenção foi de 0,08 (0,53 mais baixa para 0,37 mais alta) | NAg | 227 (4 estudos) | ⊕⊕?? baixob,c | Nenhuma diferença significativa foi evidenciada no escore médio padronizado de dor entre o braço da intervenção em comparação com o do placebo |
| Tempo de internação primariamente no hospital (horas)Acompanhamento: não relatado | NAg | A média de internação hospitalar (horas) nos grupos de intervenção foi de 5,05(26,64 menor para 16,55 maior) | NAg | 178 (3 estudos) | ⊕⊕?? baixad,e | Nenhuma diferença significativa foi evidente no tempo médio de internação, principalmente no hospital entre os braços intervenção e placebo |
| Quantidade de analgésicos usados durante o estudo Acompanhamento: Não relatado | NAg | Quantidade média padronizada de analgésicos usada durante o estudo nos grupos de intervenção foi de 0,25 menor(0,55 menor para 0,05 maior) | NAg | 176 (3 estudos) | ⊕⊕⊕? moderadad | Nenhuma diferença significativa foi evidente na quantidade média padronizada de analgésicos uszados entre os braços intervenção e placebo |
| Efeitos adversos (menores): hipotensão transitória Acompanhamento: não relatado | 3 de 116 participantes | 3 de 111 participantes | RR 1.40 (0,22 a 4,91) | 227 (4 estudos) | ⊕⊕?? baixab,e | Nenhuma associação significativa foi evidenciada na hipotensão transitória entre os braços da intervenção e do placebo |
| Efeito adverso (menor): pruridoAcompanhamento: não relatado | 2 de 78 participantes | 2 de 75 participantes | RR 1.04 (0,19 a 5,80) | 153 (2 estudos) | ⊕⊕?? baixab,e | Nenhuma associação significativa foi evidenciada em relação a prurido entre os braços intervenção e placebo |
| Efeito adverso (menor): urticáriaAcompanhamento: não relatado | 0 de 28 participantes | 1 de 28 participantes | RR 3,22 (0,14 a 75,75) | 54 (1 estudo) | ⊕⊕?? baixad,e | Nenhuma associação significativa foi evidenciada em relação à urticária entre os braços intervenção e placebo |
| Efeito adverso (menor): dor no local de aplicação do medicamento Acompanhamento: Não relatado | 2 de 78 participantes | 10 de 75 participantes | RR 4,37 (1,14 a 16,72) | 153 (2 estudos) | ⊕⊕?? baixab,e | Houve uma associação significativa em relação à dor no local de aplicação do fármaco entre os braços intervenção e placebo |
| Eventos adversos graves: síndrome torácica aguda Acompanhamento: não relatado | 3 de 53 participantes | 2 de 50 participantes | RR 0,75 (0,16 a 3,62) | 103 (2 estudos) | ⊕⊕?? baixab,e | Nenhuma associação significativa foi evidenciada em relação à síndrome torácica aguda entre os braços intervenção e placebo |
| Eventos adversos graves: hospitalização para controle da dor Acompanhamento: não relatado | 16 de 25 participantes | 13de 24 participantes | RR 0,85 (0,53 a 1,36) | 49 (1 estudo) | ⊕⊕⊕? moderadaf | Nenhuma associação significativa foi evidenciada em relação à hospitalização para manejo da dor entre os braços intervenção e placebo |
| Eventos adversos graves: necessidade de transfusão de sangue. Acompanhamento: Não relatado | 1 de 53 participantes | 2 de 50 participantes | RR 1,58 (0,27 a 9,30) | 103 (2 estudos) | ⊕⊕?? baixab,e | Nenhuma associação significativa foi evidenciada em relação à necessidade de transfusão de sangue entre os braços intervenção e placebo |
Paciente ou população: pacientes pediátricos com DF.
Locais: grande hospital infantil urbano quaternário (Emergência pediátrica (EP), Montefiore, Nova York, Estados Unidos); EP (Toronto, Canadá), Children's Hospital Research Center (Oakland, Califórnia, EUA); hospital universitário acadêmico urbano, de atendimento terciário (Estados Unidos).
Intervenção: medicamentos analgésicos.
Comparação: Placebo
IC, intervalo de confiança; NA, não aplicável; RR, razão de risco.
Graus de evidência do Grade Working Group
Alta qualidade: É muito improvável que pesquisas posteriores mudem nossa confiança na estimativa do efeito.
Qualidade moderada: É provável que mais pesquisas tenham um impacto importante em nossa confiança na estimativa do efeito e possam alterar a estimativa.
Baixa qualidade: É muito provável que pesquisas futuras tenham um impacto importante em nossa confiança na estimativa do efeito e possam alterar a estimativa.
Qualidade muito baixa: estamos muito incertos sobre a estimativa.
A base para o risco assumido (por exemplo, a mediana do risco do grupo controle entre os estudos) é fornecida em notas de rodapé. O risco correspondente (e seu intervalo de confiança de 95%) baseia‐se no risco assumido no grupo de comparação e no efeito relativo da intervenção (e seu IC 95%).
Evidência rebaixada em um nível devido à séria limitação do risco de viés: o mascaramento da avaliação do desfecho não foi claramente descrito em alguns estudos e o tamanho da amostra pretendido para os estudos não foi atingido.
Evidência diminuída devido à inconsistência moderada: a análise de estudos representa uma heterogeneidade moderada. A heterogeneidade foi explicada pelas diferenças nos resultados (diminuição do efeito do tratamento com o tempo). A qualidade da evidência foi rebaixada em um nível, de alto para moderado.
Rebaixamos a qualidade da evidência em um nível, devido ao sério risco de viés. O método de mascaramento da avaliação do desfecho não foi claramente relatado; então, rebaixamento de um nível, do original alto.
Evidência rebaixada em um nível por imprecisão: intervalos de confiança de 95% amplos do efeito dos desfechos da intervenção.
Devido ao número insuficiente de ensaios incluídos na revisão de metanálise (menos de 10), a implantação do gráfico de funil para explorar o risco de viés de publicação e análises de sensibilidade não foi possível.
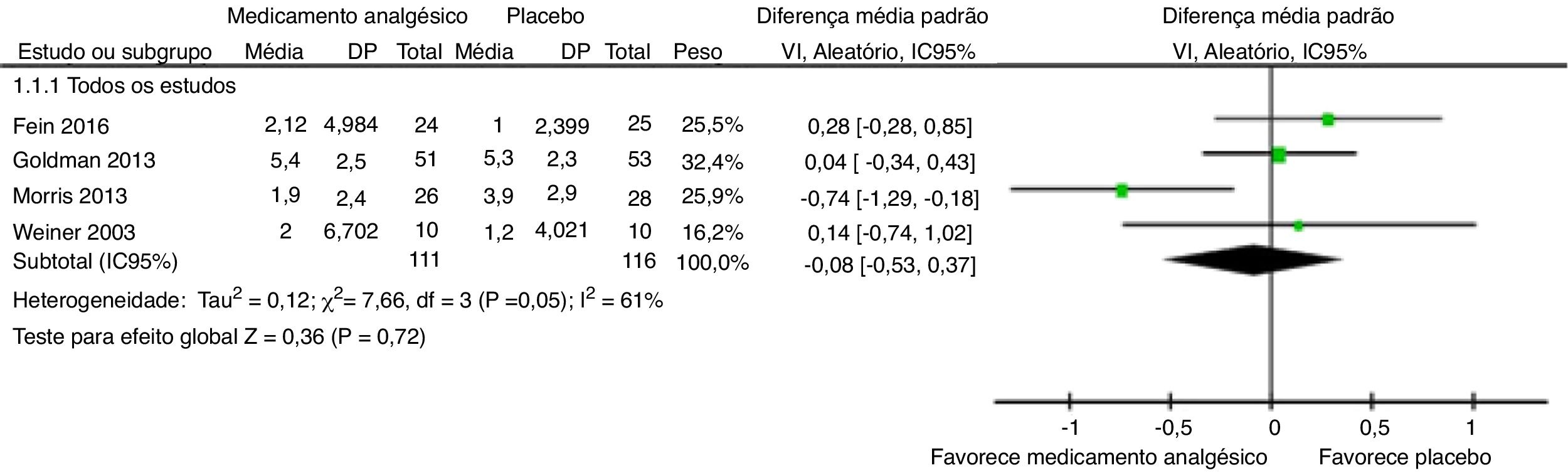
Mudança na escala do escore de dorNa comparação das mudanças na escala de dor, no agrupamento dos quatro estudos (a avaliação da intensidade da dor foi feita por EVA ou outras ferramentas apropriadas à idade, por exemplo a Face Pain Scale) uma metanálise de efeitos aleatórios ponderados por VI (fig. 2) indicou que a estimativa da diferença média padronizada não foi significativa entre o fármaco analgésico e os braços de controle (DMP ‐0,08, IC95% ‐0,53, 0,37); p = 0,72. Houve heterogeneidade moderada (I2 > 50%) entre as estimativas dos estudos no desfecho da mudança na classificação da dor (Chi2 = 7,66, p = 0,05, I2 = 61%). A qualidade das evidências foi baixa (tabela 5).
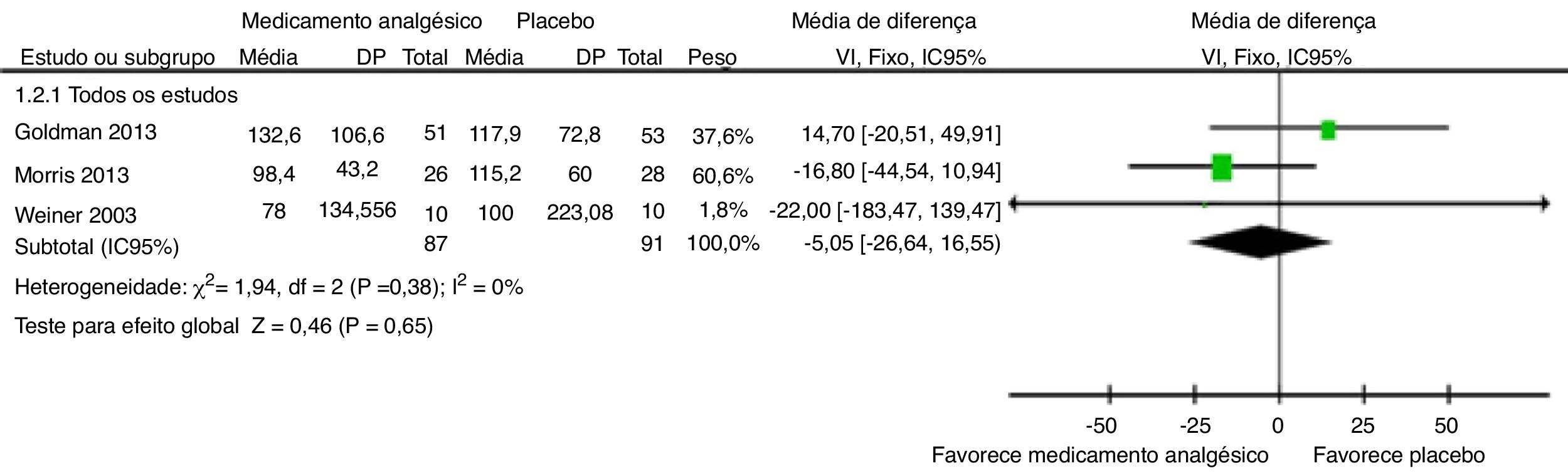
Tempo de permanência no hospitalPara os três estudos que forneceram o tempo de internação hospitalar por episódio agudo não complicado de crise de dor falciforme,55–57 a estimativa da diferença média agrupada calculada com metanálise de efeitos fixos ponderados por variável independente (VI) (fig. 3) indicou que não houve diferença estatisticamente significante entre os grupos droga analgésica e controle (DM ‐5,05 horas, IC 95% ‐26,64, 16,55); p = 0,65. A qualidade das evidências foi baixa (tabela 5), sem evidência de heterogeneidade para o desfecho tempo de permanência hospitalar entre os três estudos (Chi2 = 1,94, p = 0,38, I2 = 0%).
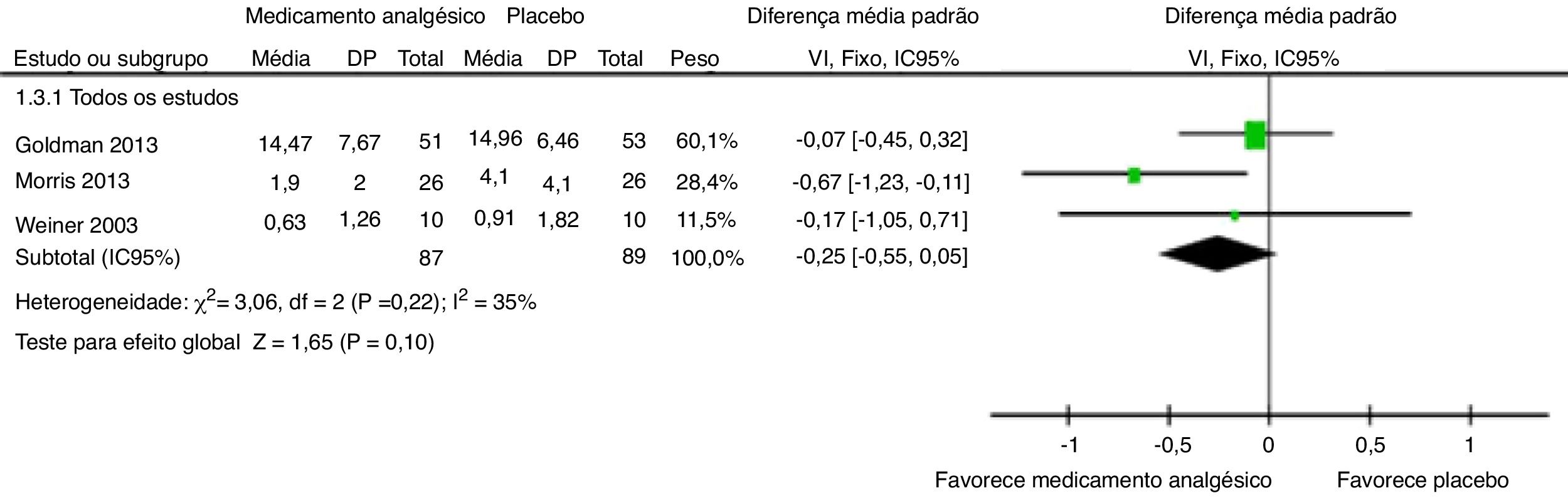
Quantidade de narcóticos usados durante o estudoOs mesmos três ensaios55–57 relataram a diferença média padronizada agrupada estimada, calculada com metanálise de efeitos fixos ponderados por VI (DMP ‐0,25, IC95% ‐0,55, 0,05); p = 0,10 (fig. 4). Uma diferença não estatisticamente significante entre o fármaco analgésico e os braços de controle para a quantidade de analgésicos usados ao longo do estudo foi examinada junto com ausência de heterogeneidade importante (Chi2=3,06, p = 0,22, I2 = 35%). A qualidade das evidências foi moderada (tabela 5). Essa análise de desfechos foi relatada por um estudo (fentanil intranasal) como evento.54 Cinco (20%) participantes do grupo placebo receberam morfina parenteral em comparação com um (4%) participante no grupo intervenção. Em outro estudo (arginina),56 dois participantes nos braços placebo foram removidos da análise da quantidade de consumo de opioides devido aos registros de analgésicos incompletos. Então, o número de participantes no braço placebo no desfecho quantidade total de uso de opioides para este estudo diminuiu de 28 para 26. Mas esses participantes estavam envolvidos em todas as outras análises de desfechos.
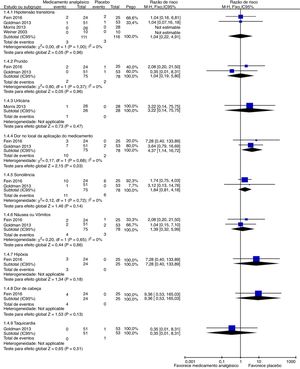
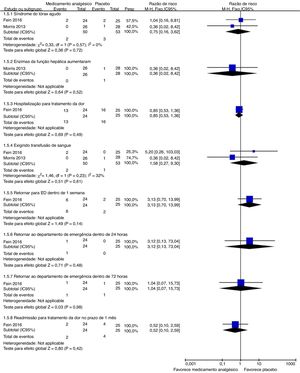
Eventos adversosNossos resultados de análises de subgrupos são mostrados nas figuras 5 e 6. Cada ensaio tinha sua maneira de descrever e tabular diferentes números de eventos adversos. Portanto, planejamos exibir dados de eventos para a proporção de indivíduos que apresentassem eventos adversos menores (hipotensão transitória, prurido, urticária, dor no local de administração do medicamento, sonolência, náusea ou vômito, hipóxia, cefaleia e taquicardia) e eventos adversos graves (síndrome torácica aguda, aumento das enzimas hepáticas, hospitalização para tratamento da dor, necessidade de transfusão sanguínea, retorno ao pronto‐socorro dentro de 24 horas, 72 horas ou uma semana e readmissão para controle da dor em um mês) durante o estudo. Para a proporção de indivíduos que apresentaram eventos adversos menores representada pela dor no local de administração do medicamento, uma diferença estatisticamente significativa (p = 0,03) foi demonstrada para a coalescência de dados de dois estudos (citrato de fentanil intranasal e magnésio intravenoso)54,55 sem heterogeneidade importante (Chi2 = 0,17, p = 0,68, I2 = 0%). A qualidade das evidências foi baixa (tabela 5).
DiscussãoOs resultados desta revisão sistemática e metanálise mostram que a maioria dos estudos que relatou a classificação dos escores de dor concluiu que havia uma evidência não significativa de melhoria na escala do escore de dor na crise aguda de dor falciforme. Apenas três estudos relataram o tempo de permanência hospitalar e a quantidade de analgésicos usados durante o estudo, encontraram uma redução não significativa sobre essas medidas de desfecho. Em relação aos eventos adversos, para os indivíduos que experimentaram efeitos colaterais menores, o achado evidenciou meramente uma associação significativa de dor no local de administração do fármaco nos estudos com magnésio intravenoso e citrato de fentanil intranasal. Esses analgésicos farmacológicos têm impactos inadequados no tratamento da crise de dor falciforme aguda, não complicada e isolada, em coortes pediátricas.
Já que os derivados opioides são chamados de padrão‐ouro para o manejo da crise de dor na doença falciforme, sua ação é limitada apenas a um efeito nociceptivo, mas não mostram uma ação relevante dentro da importante cascata gerada pelas CVO associadas à síndrome inflamatória. Assim, a ampliação da pesquisa em andamento se expande para reconhecer novas perspectivas de tratamento.20,23 Diante dessas inovações, o conhecimento fisiopatológico das CVO esclareceu a curiosidade científica na literatura. Esses três componentes (magnésio endovenoso, arginina e óxido nítrico inalado) revolucionaram, portanto, essa compreensão profunda, além de promover novas abordagens terapêuticas,9,10,25,43,58mas exigem mais evidências.
Que seja de nosso conhecimento, este presente estudo é a investigação mais recente que mostra as lacunas desses efeitos farmacológicos na faixa etária pediátrica com crise aguda de dor falciforme. Além disso, três dos ensaios incluídos (magnésio intravenoso, arginina e óxido nítrico inalado) usaram a intervenção com propriedade não analgésica, mas com finalidade analgésica, que está ligada aos mecanismos fisiopatológicos da dor na doença falciforme causada pelas CVO. Os resultados desta metanálise são consistentes com a metanálise anterior feita por Dunlop et al.;22 houve lacunas na vantagem cruzada dos testes de tratamento na diminuição das crises de dor aguda na doença falciforme, bem como no consumo de opioides e tempo de internação hospitalar. Entretanto, sua metanálise incluiu nove ensaios clínicos randomizados (seis controlados por placebo e três entre tratamentos) e incluiu crianças e adultos sem combiná‐los. Suas descobertas mostraram o alívio completo da crise aguda de dor falciforme em todos os participantes, mas provaram claramente que nenhum dos testes de intervenção é capaz de tratar completamente esse estado de crise e, além disso, as bases de evidências eram inadequadas.
O teste de heterogeneidade dos estudos incluídos em todos os desfechos da eficácia desses tratamentos em pacientes pediátricos com crise aguda de dor falciforme não foi substancial (I2 > 80%). Houve risco moderado de heterogeneidade estatística ao longo da metanálise da mudança na escala do escore de dor. Essa heterogeneidade pode ser explicada pelas diferentes ferramentas e métodos usados na avaliação da dor, como a EVA ou Faces Pain Scale, e o pequeno número de amostras dos estudos incluídos. A ausência do risco de heterogeneidade estatística na metanálise do tempo de internação hospitalar é contabilizado pelo uso, em todos os estudos, de métodos semelhantes ou semelhantes para estimar o tempo de internação hospitalar; além disso, minimiza a inconstância desse resultado. Além disso, o risco não importante de heterogeneidade estatística na quantidade de analgésicos usada é parcialmente consistente com o nível moderado da qualidade das evidências.
Na metanálise, evitamos incluir estudos que recrutaram e combinaram diferentes faixas etárias e compararam os tratamentos, o que diminui o risco de viés. Com quatro estudos de pequena escala sobre o tratamento agudo da crise de dor falciforme não complicada, que contribuíram com dados de 227 pacientes registrados, nosso estudo apresenta evidências insuficientes, enfatiza o manejo substancial na faixa etária pediátrica com crise de dor na célula falciforme. Além disso, um estudo multicêntrico, randomizado, controlado por placebo e com magnésio intravenoso, forneceu um relato apenas na doença falciforme, inclusive os fenótipos HbSS e HbSβ0, com resultados inadequados e triviais sobre o tempo de internação e redução dos opioides usados.43Além disso, houve grandes barreiras durante a pesquisa bibliográfica, como estudos que avaliaram o manejo dos episódios agudos de dorna doença falciforme que terminaram prematuramente, devido à escassez de participantes disponíveis nos ensaios.42,58,59 Os eventos adversos foram divididos em proporção de indivíduos com eventos menores e maiores para esta metanálise, com dados excessivamente diversificados para permitir um exame agrupado distinto. Em contraste, fomos capazes de agrupar dois estudos que mostravam que o magnésio intravenoso e o citrato de fentanil intranasal geraram dor no local de administração do fármaco. O evento do magnésio intravenoso foi consistente com outro estudo que mostrou calor no local de administração para o braço de tratamento.43
Os pontos fortes de pertinência desta revisão sistemática e metanálise incluem o fato de que o estudo forneceu a mais recente avaliação da eficiência e segurança do tratamento da crise dolorosa falciforme aguda não complicada na faixa etária pediátrica. Também identificamos três estudos em andamento,60–62 que se concentram meramente em participantes de três a 22 anos. Um deles define a posição ideal da cetamina intranasal que demonstrou um efeito salutar de analgesia em estudos subsequentes de pacientes pediátricos em medicina pré‐hospitalar, medicina de emergência e oncologia.62,63 Estudos anteriores confirmam que a cetamina também provoca analgesia clinicamente substancial na dor falciforme, além de reduzir o consumo de opiáceos.21,64,65 Um estudo que comparou o benefício analgésico do fentanil intranasal com a cetamina intranasal deduziu que ambos fornecem analgesia equivalente.66 Qualquer intervalo de confiança em nosso estudo revelou‐se amplo, indicou e destacou, assim, o significado e a magnitude da busca, a busca nesse domínio para gerenciar totalmente a crise e reconhecer o motivo adicional dessa importante diferença. A metanálise de outros desfechos, além da mudança na escala de escore de dor, mostrou uma heterogeneidade sem importância estatística, embora esses resultados não tenham sido suficientemente estatisticamente fortes. Não obstante, a análise pelo método Grade da qualidade para quase todos os desfechos evidencia um baixo nível de força de evidência devido à presença de vieses, inconsistência e imprecisão; exceto pela quantidade de analgésicos usados, cuja qualidade é um nível moderado de evidência.
Esta revisão de metanálise tem algumas limitações que podem ser focadas no trabalho de pesquisa prospectivo. A maioria dos estudos envolvidos nesta revisão originou‐se em áreas de baixa carga de DF, embora nossa extensa estratégia de pesquisa científica tenha identificado vários estudos pertinentes. Assim, a maior parte dos estudos elegíveis tem tamanho de amostra inadequado, portanto pode ter promovido o efeito dos fatores de confusão na redução da precisão na estimativa do tamanho do efeito, na diminuição da significância dos achados e na diminuição do poder dos ensaios. Alguns estudos incluídos foram feitos em um único centro, o que pode ter resultado em fatores de confusão pelo tamanho insuficiente da amostra. A maioria dos ECRs que exploraram a crise de dor falciforme recrutou e combinou três grupos etários (crianças, adultos jovens, idosos) e não forneceu dados exclusivos da faixa etária de cada participante, cujo uso teria envolvido muitos estudos desta revisão. As avaliações e os métodos das escalas de dor, seja sua intensidade ou alívio, usados nos estudos incluídos na revisão de metanálise não foram padronizados; por exemplo, dois ensaios usaram dois tipos de medidas de dor.55,56 Portanto, a comparação entre os ensaios e o agrupamento de dados foi um desafio, e não uma tarefa de facilitação. Entretanto, essas circunstâncias podem afetar os resultados da análise. Devido ao número insuficiente de estudos elegíveis na nossa revisão da metanálise, a implantação do gráfico de funil para explorar o risco de viés de publicação e análises de sensibilidade não foi viável.
ConclusãoNeste estudo, os tratamentos farmacológicos analgésicos pareceram ter resultados incertos na melhoria da intensidade da dor e no alívio da crise de dor aguda em populações pediátricas com DF. Assim, nenhuma dedução decisiva sobre a eficiência clínica desses analgésicos farmacológicos foi feita. Mais ERCs são necessários para demonstrar as evidências da força de cada estudo. Isso pode fornecer mais informações sobre esses medicamentos analgésicos, a fim de melhorar a redução do tempo de internação primariamente no hospital e a redução da quantidade de consumo de analgésicos. Estudos bem desenhados, e com muitos participantes, são necessários para demonstrar as diferenças substanciais. Estudos futuros devem garantir um maior tamanho de amostra e o equilíbrio de cada fenótipo de DF nos estudos, para evitar a superestimação de resultados nas próximas pesquisas. Um estudo de centro único deve ser estendido a um estudo multicêntrico, a fim de fornecer participantes e poder de estudo suficientes. Os pesquisadores precisam de mais avaliações para expandir seus estudos em cenários e panoramas baseados na DF.
FinanciamentoBolsas de estudos do Chinese National Natural Science Fund, no 81170005 e 81670007.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Ao professor Yi Guo e à Sra. Loraine S. Castellano pelas contribuições, pelos incentivos e pelo apoio. Ao Dr. Ali A. Salama e à Dra. Elsam Koshy pelo imenso apoio na revisão do artigo.
Como citar este artigo: Saramba MI, Shakya S, Zhao D. Analgesic management of uncomplicated acute sickle‐cell pain crisis in pediatrics: a systematic review and meta‐analysis. J Pediatr (Rio J). 2020;96:142–58.