To restate the epidemiological importance of Shigella in acute diarrhea with blood, providing an overview of the treatment and stressing the need for the correct indication of antibiotic therapy.
Sources of Data: A search was carried out in the Medline and Scopus databases, in addition to the World Health Organization scientific documents and guidelines, identifying review articles and original articles considered relevant to substantiate the narrative review.
Synthesis of DataDifferent pathogens have been associated with acute diarrhea with blood; Shigella was the most frequently identified. The manifestations of shigellosis in healthy individuals are usually of moderate intensity and disappear within a few days. There may be progression to overt dysentery with blood and mucus, lower abdominal pain, and tenesmus. Conventional bacterial stool culture is the gold standard for the etiological diagnosis; however, new molecular tests have been developed to allow the physician to initiate targeted antibacterial treatment, addressing a major current concern caused by the increasing resistance of Shigella. Prevention strategies include breastfeeding, hygiene measures, health education, water treatment, and the potential use of vaccines.
ConclusionsAcute diarrhea is an important cause of mortality in children under 5 years and shigellosis is the leading cause of acute diarrhea with blood worldwide. The current concern is the increase in microbial resistance to the recommended antibiotics, which brings an additional difficulty to therapeutic management. Although no vaccine is yet available against Shigella, several candidates are undergoing clinical trials, and this may be the most cost‐effective preventative measure in future.
Reiterar a importância epidemiológica da Shigella na diarreia aguda com sangue, fornecer uma visão geral do tratamento e ressaltar a necessidade da correta indicação da antibioticoterapia.
Fontes dos dadosRealizada pesquisa nos bancos de dados Medline e Scopus, além de documentos científicos e diretrizes da Organização Mundial da Saúde, com a identificação de artigos de revisão e artigos originais considerados relevantes para fundamentar a revisão do tipo narrativa.
Síntese dos dadosDiferentes patógenos têm sido associados à diarreia aguda com sangue, a Shigella é o mais frequente. As manifestações da shigelose em indivíduos saudáveis são geralmente de intensidade moderada e desaparecem em poucos dias. Pode haver progressão para disenteria franca com sangue e muco, dor em abdome inferior e tenesmo. A coprocultura bacteriana convencional é o padrão‐ouro para o diagnóstico etiológico, porém novos testes moleculares foram desenvolvidos, os quais permitem ao médico iniciar tratamento antibacteriano direcionado, sanar uma grande preocupação atual, devido à crescente resistência da Shigella. Estratégias de prevenção incluem aleitamento, medidas de higiene, educação em saúde, tratamento da água e o potencial uso de vacinas.
ConclusõesA diarreia aguda é uma importante causa de mortalidade em crianças com menos de cinco anos e a shigelose é a principal causa de diarreia aguda com sangue em todo o mundo. A preocupação atual é o aumento da resistência microbiana aos antibióticos preconizados, o que traz uma dificuldade adicional ao manejo terapêutico. Embora ainda não exista vacina disponível para Shigella, várias candidatas estão em fase de testes clínicos, podem futuramente ser a medida preventiva mais custo‐efetiva.
A diarreia aguda (DA) é uma importante causa de mortalidade em crianças com menos de cinco anos. Embora a mortalidade por diarreia nessa faixa etária tenha tido uma redução de mais de 30% nos últimos 15 anos, a DA continua a ser a segunda causa de óbito.1 Apesar da queda na mortalidade, a morbidade em países em desenvolvimento, especialmente na África subsaariana e no sul da Ásia, continua a ser bastante elevada.2
A DA (também nominada como gastroenterite, enterite aguda ou enteroinfecção) deve ser suspeitada quando há uma diminuição, e início abrupto, da consistência das fezes e/ou um aumento da frequência evacuatória associado ou não a início súbito de vômitos; eventualmente com a presença de sangue. Na maioria das crianças, a DA tipicamente dura menos de sete dias e não mais de 14.3 Nos textos médicos, com frequência, o termo disenteria aparece como sinonímia de DA com sangue (fezes sanguinolentas).4 Outros, caracterizam a disenteria como presença de fezes com sangue e/ou muco, associada a febre e cólicas abdominais.5
Diferentes patógenos têm sido isolados na DA com sangue, a Shigella é o enteropatógeno isolado com maior frequência em todo o mundo, com uma maior incidência nos países em desenvolvimento. Crianças menores de cinco anos são as mais acometidas, representam em torno de 70% de todos os casos de diarreia por Shigella e 60% dos óbitos.6
Um estudo multicêntrico publicado por Kotloff et al. em 2013, o Global Enteric Multicenter Study (GEMS), identificou através de cultura das fezes, entre 22 patógenos intestinais, rotavírus, Shigella, ETEC (Escherichia coli enterotoxigênica) e criptosporidium como responsáveis por 70% dos casos de diarreia em menores de quatro anos.7 Posteriormente, as amostras do estudo foram reanalisadas com PCR quantitativo e a incidência de doença diarreica atribuída à Shigella foi maior do que o dobro da avaliação inicial. Além de ser a principal causa da DA com sangue, a Shigella foi também o segundo patógeno isolado em crianças com diarreia aquosa, o que reitera a necessidade de estar alerta para esse patógeno, mesmo na ausência de sangue.8
Nesta revisão da literatura, de caráter narrativo, a ênfase será dada aos aspectos terapêuticos da DA com sangue presumivelmente associada à Shigella, considerou‐se que a Shigella é o enteropatógeno isolado com maior frequência das fezes de crianças com DA com sangue em regiões onde a DA é endêmica.
Shigella: aspectos epidemiológicosOs grupos mais afetados, além das crianças de regiões endêmicas de países em desenvolvimento, são crianças em creches e escolas de países desenvolvidos, viajantes para países em desenvolvimento e, identificado há alguns anos, um novo grupo de risco, os homossexuais masculinos. A Shigella tem alta transmissibilidade, com pequena quantidade de unidades formadoras de colônia (UFC), 10 a 18 a depender do sorotipo, é capaz de desencadear infecção.9
O contato fecal‐oral é a principal forma de transmissão. Outras formas de transmissão menos comum são alimentos e água contaminados e, identificada mais recentemente, a importância da mosca doméstica como vetor da doença, sugeriu‐se redução importante nas infecções por Shigella, em áreas com alta densidade de moscas, após o controle adequado dessas.9,10
Descoberta em 1897 pelo microbiologista japonês Kiyoshi Shiga, durante uma epidemia de disenteria no Japão com alta mortalidade, a Shigella, inicialmente denominada Shiga bacillus, compreende um gênero antigenicamente diverso, composto por quatro espécies, também chamadas de grupos ou subgrupos: Shigella flexneri, Shigella sonnei, Shigella dysenteriae e Shigella boydii. O bacilo isolado por K. Shiga foi posteriormente identificado como a S. dysenteriae tipo 1, que causa doença mais grave e prolongada, com produção da citotoxina Shiga.9
A S. dysenteriae, pouco isolada nas duas últimas décadas, foi relacionada a quatro pandemias, entre 1960 e 1990, com alto índice de mortalidade.9 A S. boydii ocasiona doença mais leve e está comumente restrita a países africanos e ao sudeste da Ásia.11 Historicamente, S. sonnei tem sido descrita como endêmica em países desenvolvidos e a S. flexneri, nos países em desenvolvimento, com baixas condições de higiene, por mecanismos ainda não totalmente explicados.9 Nos últimos anos, porém, tem sido percebida uma mudança no padrão de distribuição da Shigella, com aumento importante da S. sonnei também em países em desenvolvimento. Algumas hipóteses foram descritas para justificar essa mudança.11
A primeira e principal delas é o fato de populações de locais com baixas condições de higiene serem imunes à S. sonnei pela exposição à água contaminada com Pleisiomonas shigelloides, uma enterobactéria que contém um antígeno O idêntico ao da S. sonnei, principal alvo do sistema imune durante a infecção pela Shigella. Com a melhoria das condições de higiene e tratamento adequado da água em alguns países em desenvolvimento, diminuiria o contato com a P. shigelloides, o que tornaria os indivíduos mais suscetíveis à S. sonnei.12,13 Uma segunda hipótese seria o fato de a S. sonnei ser fagocitada por uma ameba de vida livre, Acanthamoebae castellanii, que encontra um ambiente intracelular, protegida do processo de tratamento e cloração da água, enquanto à S. flexneri é letal à A. castellanii, não pode usar esse mesmo mecanismo para sua disseminação.14 Por fim, a S. sonnei tem maior capacidade de mobilizar material genético de outras enterobactérias do que a S. flexneri, adquire maior resistência a antibióticos e, consequentemente, maior potencial de sobrevivência.11
Estudo feito na cidade de Belo Horizonte, com população de baixa renda, evidencia essa mudança. Das 157 crianças avaliadas, foram identificadas espécies de Shigella em 17 (aproximadamente 11%), 15 (88,2%) foram identificadas com S. sonnei e as restantes com S. flexneri. Estudo anterior feito na mesma cidade, porém com intervalo de quase três décadas, observou perfil semelhante aos de outros países em desenvolvimento, com predomínio da S. flexneri. Os autores sugerem que a melhoria nas condições de higiene e saneamento seja responsável por essa mudança epidemiológica.15
Tal fato, distribuição semelhante aos países desenvolvidos, também foi observado na cidade de Salvador, Bahia, por Diniz‐Santos et al., onde em 141 crianças com diarreia aguda e cultura positiva para Shigella 80% eram S. sonnei e 20%, S. flexneri.16
DA com sangue: aspectos clínicosNa anamnese da criança com DA com sangue devem ser investigados passado de cirurgias abdominais, exposição à radiação ou uso recente de antibióticos.17 É relevante avaliar ainda a história sexual dos adolescentes detalhadamente porque o sexo anal receptivo e o contato oral‐anal podem aumentar o risco de transmissão de patógenos fecais, particularmente Shigella, Salmonella, Campylobacter, Escherichia coli, Entamoeba histolytica e Giardia.18
Frequentemente, as primeiras manifestações da shigelose são febre, dor de cabeça, mal‐estar, anorexia e vômito, seguidas várias horas depois por diarreia aquosa e, posteriormente, pode surgir sangue nas fezes. Em indivíduos saudáveis, habitualmente a doença é de intensidade leve ou moderada e os sintomas desaparecem em poucos dias. Outras vezes, há progressão – dentro de horas a dias – para disenteria franca com fezes de pequeno volume, porém frequentes, com sangue e muco, acompanhadas de dor em abdome inferior e tenesmo. Pacientes com infecção grave podem evacuar mais de 20 vezes em um dia. Dor abdominal, muitas vezes uma característica proeminente, pode simular apendicite ou, em recém‐nascidos e lactentes jovens, intussuscepção ou enterocolite necrosante.9
Raramente, a Shigella causa infecções invasivas, como meningite, osteomielite, artrite e abscesso esplênico. A sepse por Shigella, rara em pessoas saudáveis, pode ocorrer em lactentes e em crianças desnutridas graves e tem um prognóstico ruim.19 As complicações intestinais da shigelose são incomuns e incluem prolapso retal, obstrução intestinal, megacólon tóxico e perfuração; todas essas complicações são mais associadas às infecções por S. dysenteriae tipo 1.20
São relatadas diversas manifestações extraintestinais relacionadas à diarreia por Shigella: eritema nodoso, síndrome hemolítico‐urêmica, artrite reativa, encefalopatia, glomerulonefrite e síndrome do intestino irritável pós‐infeccioso. A encefalopatia é uma das manifestações extraintestinais mais comuns da diarreia por Shigella21 e está associada a altas taxas de letalidade. As manifestações mais comuns da encefalopatia são convulsões, alteração do nível de consciência e coma. Usualmente é reversível, mas pode ser fulminante e fatal. Uma forma letal de encefalopatia conhecida como síndrome de Ekiri é caracterizada por início rápido de quadro convulsivo e coma associado a uma diarreia sanguinolenta leve.22
Outra complicação extraintestinal de curso potencialmente grave é a síndrome hemolítico‐urêmica (SHU), uma microangiopatia trombótica caracterizada por anemia hemolítica não imune, plaquetopenia e lesão renal aguda.23 Os trombos microangiopáticos afetam principalmente o rim, podem resultar em sequelas em longo prazo. Outros órgãos como o intestino, sistema nervoso central e coração também podem ser afetados. A SHU relacionada à toxina de Shiga – produzida por algumas cepas bacterianas (S. dysenteriae tipo 1; E. coli entero‐hemorrágica – EHEC; Escherichia coli produtora da toxina de shiga – STEC) – é causa frequente de lesão renal aguda na infância e constitui cerca de 90% de todos os casos de SHU nessa população.24 Testes in vitro demonstraram que uma variedade de antibióticos aumenta a produção de toxina Shiga pela E. coli e, por isso, postula‐se que o uso dessas medicações aumentaria o risco de SHU.24
Além dos seus efeitos em curto prazo, os episódios repetidos de DA estão associados a um déficit de crescimento linear,25 que predispõe as crianças a novos episódios de doenças infecciosas. Há também evidências que ligam o déficit de crescimento infantil a uma série de outros importantes resultados ao longo da vida, inclusive redução da função cognitiva, diminuição do poder aquisitivo e aumento de doenças crônicas.26
DA com sangue: diagnósticoA coprocultura bacteriana convencional ainda é o padrão‐ouro para o diagnóstico etiológico da DA por enterobactérias, entre elas a infecção pela Shigella. O seu cultivo permite a identificação da susceptibilidade aos antibióticos, o que é muito importante nesta era de aumento da resistência antimicrobiana.9 Contudo, o exame apresenta baixa sensibilidade e importantes dificuldades técnicas. O cultivo pode ser prejudicado por carga bacteriana inconsistente, perda de viabilidade bacteriana durante o transporte e armazenamento da amostra e necessita de reagentes específicos que são lábeis e, às vezes, indisponíveis. Além disso, requerem treinamento e experiência do operador.
Nos últimos 10 anos, foram desenvolvidos novos testes de diagnóstico molecular com um painel multiplex de reação em cadeia da polimerase (PCR). Eles são mais rápidos do que os testes tradicionais, têm uma sensibilidade mais alta27 e têm a possibilidade de testar simultaneamente uma ampla gama de agentes. O diagnóstico molecular permitiria ao médico iniciar uma terapia antibiótica oportuna e direcionada. Porém, existem poucos dados sobre como a disponibilidade do teste molecular afetaria a conduta clínica, o custo e os desfechos dos pacientes testados.28 Com isso, seu uso ainda está limitado a pesquisas científicas.
Portanto, na prática clínica, o diagnóstico etiológico é presuntivo, baseado na clínica e nos dados epidemiológicos. Para a maioria dos pacientes, mesmo aqueles de países desenvolvidos, que apresentam DA, nenhum teste é necessário se a apresentação for sugestiva de uma causa viral ou a gravidade for leve a moderada.28 A principal razão para a feitura da coprocultura seria garantir que o tratamento, quando necessário, seja baseado em resultados de suscetibilidade nas áreas de alto risco de shigelose multirresistente.28 Além disso, o exame poderia identificar aqueles quadros com organismos produtores de toxina Shiga, nos quais a antibioticoterapia poderia aumentar o risco de SHU, embora esse ainda seja um tópico controverso.29
O hemograma, com a contagem de leucócitos totais e diferenciais, pode ser útil e sugerir se a diarreia infecciosa é de etiologia bacteriana, viral ou parasitária. Quando a diarreia aguda é causada por bactérias invasivas, a contagem total de leucócitos e neutrófilos geralmente aumenta. Na infecção por Shigella, pode ser observadas uma reação leucemoide e monocitose, em infecções patogênicas intracelulares, como infecções por Salmonella. No entanto, são achados inespecíficos e a contagem de leucócitos periféricos não deve ser feita rotineiramente para estabelecer uma etiologia da diarreia sanguinolenta. A avaliação da presença de leucócitos nas fezes, a dosagem da calprotectina fecal e a detecção de lactoferrina também não estão recomendados.5
DA com sangue: tratamentoEm linhas gerais a abordagem terapêutica da DA – com ou sem sangue – é categorizada em pró‐absortiva, antissecretora, antimotilidade e anti‐inflamatória.30 O manejo clínico da DA para prevenir ou tratar a desidratação é predominantemente pró‐absortivo e envolve a reposição de fluidos com sais de reidratação oral (SRO) ou terapia de reidratação parenteral. O tratamento medicamentoso na DA, mesmo nos episódios com sangue, não é necessário rotineiramente, mas apenas em situações clínicas especiais.
A terapia de reidratação oral (TRO) e a terapia de reidratação venosa (TRV) podem prevenir diretamente as mortes por diarreia decorrentes da desidratação. Por isso, os programas globais para tornar a TRO amplamente disponível a baixo custo têm sido as intervenções de tratamento mais importantes para salvar vidas.31
Embora os antibióticos sejam úteis em alguns casos de diarreia bacteriana aguda, eles devem ser usados com cautela para evitar a resistência a patógenos e infecção oportunista.24 Certos organismos entéricos, como Salmonella, não devem ser tratados com antibióticos, pois podem prolongar a duração da doença32 (tabela 1).
Antibioticoterapia na DA com sangue
| Patógeno | Indicação para antibioticoterapia |
|---|---|
| Shigella spp | Shigelose comprovada ou suspeita |
| Salmonella spp (não tifoide) | A antibioticoterapia é indicada apenas para reduzir o risco de bacteremia e manifestações extraintestinais em crianças de alto risco. O uso de antibiótico pode aumentar a excreção fecal da bactéria. |
| Campylobacter spp | A antibioticoterapia é recomendada principalmente para quadros de disenteria e para diminuir a transmissão em crianças institucionalizadas. |
| E. coli produtora de toxina shiga | Antibioticoterapia não é recomendada. Pode aumentar o risco de SHU. |
SHU, síndrome hemolítica urêmica.
Mais importante ainda, os antibióticos não impedem imediatamente a perda de fluidos e eletrólitos – a causa mais comum de morte relacionada à diarreia.
Antimicrobianos na shigelose – Quando e qual indicar?O tratamento empírico está indicado para crianças imunocompetentes que apresentam febre documentada, dor abdominal e disenteria (fezes sanguinolentas de pequeno volume, diversas vezes ao dia e tenesmo); ou seja, quadro clínico sugestivo de infecção por Shigella. Também estaria indicado para os pacientes com quadro clínico de sepse por enteropatógenos após a coleta de cultura de sangue, de fezes e urina.5
Crianças menores de três meses ou com imunodeficiência, desnutrição grave, câncer, doença inflamatória intestinal (DII), acloridria, asplenia anatômica ou funcional, que fazem terapia com corticosteroides ou imunossupressores, devem receber antibióticos quando houver suspeita de gastroenterite bacteriana.33
É importante ressaltar que nenhum antibiótico específico, ou classe de antibióticos, é universalmente eficaz para a diarreia por Shigella.34 A ausência de ensaios clínicos controlados por placebo limita as conclusões sobre a eficácia global de diferentes antibióticos para o tratamento da disenteria.4
As diretrizes para o tratamento da Shigella e disenteria publicadas pela OMS em 2005, ratificadas em 2013, recomendam a ciprofloxacina como tratamento de primeira linha.35 A dose atualmente recomendada é de 15mg/kg/dia por três dias. Não há dados que apoiem o uso de uma dose mais alta (20mg/kg), pode aumentar o risco de eventos adversos.36 O tratamento de segunda linha seria com azitromicina e ceftriaxona. Esse esquema terapêutico também é recomendado pela Sociedade Brasileira de Pediatria.37
Devido à crescente resistência mundial da Shigella e aos efeitos adversos das fluoroquinolonas, as Sociedades Americana e Europeia de Infectologia indicam a azitromicina – 10mg a 20mg por quilograma de peso corporal por dia, uma vez por dia durante 3 dias – como terapia de primeira linha.5 A ceftriaxona – 50‐100mg/kg/dia EV por 3 a 5 dias – deve ser a primeira opção nos menores de três meses e em casos graves, com comprometimento sistêmico e que requerem hospitalização.5,37 Na tabela 2 estão listados antimicrobianos que não devem ser usados para tratar a shigelose.
Evidências científicas mostram que a resistência a antibióticos é um desafio crescente no manejo terapêutico da shigelose. A OMS listou explicitamente a Shigella resistente a fluoroquinolonas como uma de suas principais preocupações do atual foco internacional na resistência antimicrobiana.38 O desenvolvimento de resistência a antibióticos é comum em todas as espécies de Shigella, particularmente em S. sonnei. A S. sonnei também pode adquirir genes de resistência diretamente da E. coli através da transferência horizontal de genes.11
Atualmente, diversas pesquisas evidenciam cepas de Shigella resistentes às fluoroquinolonas. Uma revisão sistemática avaliou a mudança nos padrões de resistência à ciprofloxacina e encontrou resistência crescente nas regiões Ásia‐África (analisadas em conjunto), de 0,6% em 1998‐2000 (IC95% 0,2‐1,3%) para 29,1% em 2007‐2009 (IC 95% 0,9‐74,8%) – um aumento de 49 vezes em 12 anos. Esse aumento foi mais pronunciado em crianças do que em adultos.39 A resistência completa à ciprofloxacina (CIM ≥ 4mg/L) recentemente foi relatada em casos domésticos de S. sonnei nos EUA, Vietnã e em outros países.40,41
A OMS recomenda ceftriaxona e azitromicina para o tratamento da infecção por espécies de Shigella resistentes às fluoroquinolonas.35 No entanto, isolados resistentes à ceftriaxona e à azitromicina também foram relatados em alguns lugares. A resistência à cefalosporina também é preocupante, decorrente da produção de β‐lactamases de espectro estendido (ESBLs) que conferem resistência a todas as β‐lactamases (exceto cefamicinas e carbapenêmicos), é cada vez mais frequente, inclusive na Shigella.42 Uma revisão43 que comparou a resistência às cefalosporinas de terceira geração (ceftriaxona, cefotaxima e ceftazidima) entre 1999 e 2012 encontrou um aumento acentuado na região Ásia‐África, a resistência à ceftriaxona atingiu 14,2% (IC 95% 3,9‐29,4%) em 2012.
Há um aumento de estudos que evidenciam cepas de Shigella spp resistentes à azitromicina, inclusive pelo Centro de Controle e Prevenção de Doenças (CDC).44 Com isso, a resistência antimicrobiana da Shigella se tornou uma ameaça e uma questão de grande preocupação. Ela também pode levar à escolha inadequada de antimicrobianos para a terapia inicial e forçar os médicos a escolher antimicrobianos mais tóxicos ou mais caros. Uma revisão sistemática feita em 2010 com 1.748 pacientes pediátricos e adultos não encontrou diferenças estatisticamente significantes em relação à presença de eventos adversos entre pacientes que tomavam fluoroquinolonas, macrolídeos (inclusive azitromicina) ou β‐lactâmicos, concluiu que todas as classes de antibióticos atualmente disponíveis para o tratamento da shigelose são seguras.34 No entanto, esses antimicrobianos podem aumentar o risco de arritmias, principalmente torsades de pointes; esse efeito adverso parece estar mais presente quando há uma combinação da vulnerabilidade genética ao metabolismo deficiente de medicamentos indutores do CYP3A4 e coadministração com outros potenciadores do CYP.45
Em 2016, a FDA (Food and Drug Administration – agência federal do Departamento de Saúde e Serviços Humanos dos Estados Unidos) emitiu um comunicado que abordava especificamente o risco de neuropatia periférica associada às fluoroquinolonas orais.46 Acredita‐se que o mecanismo neurotóxico seja a inibição dos receptores GABA, que ocorre após dias de uso e, em alguns casos, pode ser permanente.47 Com relação à ciprofloxacina especificamente, o risco relativo foi de 1,93 (IC95% 1,32‐2,82), um aumento apreciável. No entanto, a pesquisa foi baseada em uma coorte de homens com idade média de 68 anos e é difícil extrapolar esses dados para a população pediátrica.48
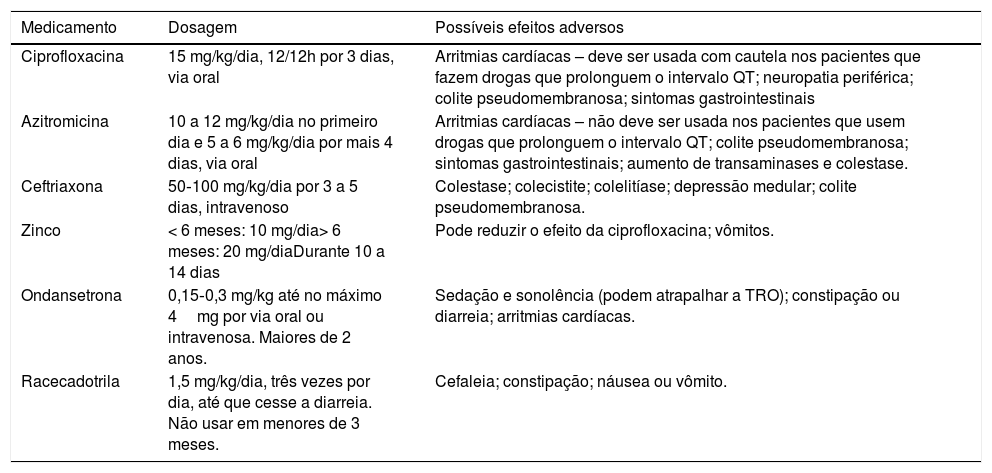
Na tabela 3 estão listados os principais medicamentos passíveis de serem usados na DA com sangue.
Medicamentos usados no manejo da diarreia com sangue
| Medicamento | Dosagem | Possíveis efeitos adversos |
|---|---|---|
| Ciprofloxacina | 15 mg/kg/dia, 12/12h por 3 dias, via oral | Arritmias cardíacas – deve ser usada com cautela nos pacientes que fazem drogas que prolonguem o intervalo QT; neuropatia periférica; colite pseudomembranosa; sintomas gastrointestinais |
| Azitromicina | 10 a 12 mg/kg/dia no primeiro dia e 5 a 6 mg/kg/dia por mais 4 dias, via oral | Arritmias cardíacas – não deve ser usada nos pacientes que usem drogas que prolonguem o intervalo QT; colite pseudomembranosa; sintomas gastrointestinais; aumento de transaminases e colestase. |
| Ceftriaxona | 50‐100 mg/kg/dia por 3 a 5 dias, intravenoso | Colestase; colecistite; colelitíase; depressão medular; colite pseudomembranosa. |
| Zinco | < 6 meses: 10 mg/dia> 6 meses: 20 mg/diaDurante 10 a 14 dias | Pode reduzir o efeito da ciprofloxacina; vômitos. |
| Ondansetrona | 0,15‐0,3 mg/kg até no máximo 4mg por via oral ou intravenosa. Maiores de 2 anos. | Sedação e sonolência (podem atrapalhar a TRO); constipação ou diarreia; arritmias cardíacas. |
| Racecadotrila | 1,5 mg/kg/dia, três vezes por dia, até que cesse a diarreia. Não usar em menores de 3 meses. | Cefaleia; constipação; náusea ou vômito. |
A OMS recomenda a terapia de rotina com 20mg de zinco por dia durante 10 dias para todas as crianças com diarreia, independentemente do tipo de diarreia. Bebês com seis meses ou menos devem receber 10mg por dia durante 10 dias.49 Múltiplos estudos feitos em países de baixa renda documentam sua eficácia na redução tanto da duração quanto da gravidade da diarreia. Esses efeitos são mais pronunciados em crianças desnutridas e na diarreia persistente.50
Uma revisão da Cochrane de 2016 analisou 33 estudos que abrangeram 10.841 crianças e concluiu que as evidências atuais não apoiam o uso de suplementação de zinco em crianças bem nutridas e em locais onde as crianças apresentam baixo risco de deficiência de zinco. Além disso, o vômito foi mais frequentemente documentado em crianças que receberam zinco do que nas que não receberam (OR 1,54, IC 95% 1,28‐1,85).50
Os antieméticos são geralmente desnecessários no tratamento da diarreia aguda bacteriana e, por alguns terem efeitos sedativos, podem dificultar a TRO.49 Podem ser administrados, principalmente nos maiores de dois anos e adolescentes, na diarreia aguda associada a vômitos incoercíveis (≥ 3 episódios, em curto tempo) para facilitar a tolerância à reidratação oral e evitar desidratação.5 A ondansetrona oral é a medicação mais estudada e, se não tolerada, a ondansetrona endovenosa estaria indicada. Ambas as apresentações são consideradas igualmente eficazes. Não há evidências para apoiar o uso de outros antieméticos.
Alguns antieméticos mais antigos, como a prometazina, apresentam efeitos colaterais extrapiramidais significativos. A principal preocupação com a ondansetrona é a arritmia cardíaca, principalmente prolongamento do intervalo QT, que pode predispor a um ritmo cardíaco potencialmente fatal, inclusive torsade de pointes.50 Por isso, a FDA recomenda monitoração com eletrocardiograma em pacientes que fazem a medicação e têm distúrbios eletrolíticos. Além disso, mais comumente, a ondansetrona aumentou significativamente a defecação nos pacientes tratados comparados com o placebo.50
Drogas antimotilidade, como a loperamida, são contraindicadas para uso em crianças pois foi demonstrado que aumentam a gravidade da doença e o número de complicações, particularmente em crianças com diarreia invasiva sanguinolenta.49 Em crianças com menos de três anos, desnutridas, moderadamente ou gravemente desidratadas, com doenças sistêmicas ou com diarreia com sangue, os eventos adversos superam os benefícios mesmo em doses baixas (< 0,25mg/kg/dia).
A racecadotrila é um inibidor da encefalinase e, assim, aumenta os níveis das encefalinas endógenas. Essas inibem potencialmente a secreção intestinal de água e eletrólitos com um efeito pequeno sobre a motilidade.51 A maioria dos ensaios clínicos com a racecadotrila não foi feita em pacientes com diarreia aguda bacteriana (como a shigelose) e vários estudos relataram especificamente a eficácia em populações positivas para rotavírus.51 Não há consenso, portanto, para a sua indicação na diarreia aguda com sangue.
Os probióticos são microrganismos vivos que, quando consumidos em quantidades adequadas, trazem efeitos benéficos à saúde do indivíduo. No entanto, os efeitos são específicos para cada cepa e precisam ser analisados em estudos humanos. Há relatos de que diferentes cepas probióticas, inclusive L. reuteri ATCC 55730, L. rhamnosus GG, L. casei DN‐114 001 e Saccharomyces boulardi, são úteis na redução da gravidade e duração da diarreia infecciosa aguda em crianças.49 É importante salientar que as evidências existentes sobre benefícios na gastroenterite viral são mais convincentes do que as evidências em infecções bacterianas ou parasitárias. Há carência de estudos em países subdesenvolvidos. Ainda não há consenso sobre o benefício de seu uso na DA aquosa, bem como na DA com sangue. Devido aos efeitos modestos dos probióticos e seu elevado custo, a OMS não recomenda seu uso em ambientes com recursos limitados, principalmente em países em desenvolvimento.49
Outros medicamentos em estudoA Shigella diminui a concentração de um peptídeo antibacteriano produzido pelo hospedeiro – catelicidina. Em modelos animais, esse mecanismo foi revertido pelo tratamento com o butirato de sódio, por via oral, e resultou em melhoria da doença. Um estudo randomizado em crianças com shigelose grave concluiu que a ingestão de banana verde cozida (um substrato para a produção de butirato por bactérias intestinais) melhorou significantemente a doença em comparação com uma dieta de controle baseada em arroz.52
Outros estudos pesquisam o papel do receptor extracelular sensível ao cálcio (CaSR). Esse receptor funciona principalmente para manter a homeostase do cálcio intestinal. A ativação do receptor diminuiria os nucleotídeos cíclicos celulares e reverteria todas as quatro mudanças patológicas que ocorrem na diarreia: secreção excessiva, má absorção, aumento da motilidade intestinal e uma resposta inflamatória aumentada. Estudos clínicos iniciais produziram resultados positivos, demonstraram que a ativação do CaSR associado aos SRO seria seguro, acessível e possivelmente mais eficaz do que o padrão‐ouro atual. O tratamento baseado no CaSR é considerado promissor para o manejo da diarreia infantil, no entanto ainda não há evidências científicas da sua eficácia na DA com sangue.30
DA associada à Shigella: prevençãoEstratégias de prevenção da doença diarreica aguda incluem aleitamento materno exclusivo por seis meses, medidas que visam à melhoria de infraestrutura para assegurar saneamento básico e consumo de água limpa e potável, educação em saúde com foco em medidas de higiene, além de vacinas.53 Na shigelose, especialmente, o destino adequado das fezes e a lavagem das mãos após manipulação delas têm papel muito importante na prevenção, dada sua alta transmissibilidade e a principal via de contaminação ser pessoa a pessoa.54
Apesar de ainda não dispormos de vacina para Shigella, mesmo com esforços nesse sentido há mais de 60 anos, no momento existem 13 candidatas em desenvolvimento, com quase metade dessas em testes clínicos, em fase 1 ou 2 e uma em fase 3. Estudos e consórcios para desenvolvimento de uma vacina para Shigella foram impulsionados por novos financiamentos pelo reconhecimento, renovado nos últimos anos, da morbidade e letalidade da shigelose.55,56
É esperado que, com várias estratégias inovadoras baseadas no melhor entendimento dos mecanismos de virulência e da resposta imune à Shigella observado nas últimas décadas, em breve uma vacina eficaz esteja disponível.56 No entanto, apesar dos avanços, ainda não é consenso que a resposta imune se reflita em proteção efetiva, não se dispõe de um modelo animal adequado para essa avaliação. A maioria das candidatas em estudo no momento é vacina celular atenuada, híbrida (com outros vetores vivos, por exemplo E. coli), glicoconjugada e de subunidade.55,56
Algumas outras questões biológicas e técnicas, no entanto, irão definir a aplicabilidade de uma vacina para Shigella. A vacina precisa ser adequada, eficaz e conferir proteção duradoura, o que pode ser um desafio biológico quando considerados os distintos grupos de risco para a doença: crianças até cinco anos de países em desenvolvimento, com status imunológico de vulnerabilidade e, em contraste, viajantes imunocompetentes de países desenvolvidos. Além disso, frente à necessidade de uso em escala global, estabilidade, fácil administração, com menor número de aplicações possível, e custo irão determinar o uso de uma vacina para Shigella nas regiões mais pobres do planeta e com maior necessidade.55,56
ConclusãoA DA com sangue ainda apresenta uma alta prevalência, principalmente em regiões onde as condições ambientais são desfavoráveis e água de qualidade e saneamento básico ainda não são disponíveis para uma boa parte da população. No caso específico da Shigella, em que a transmissão se faz principalmente pessoa a pessoa, as medidas de higiene alimentar e pessoal, em especial a lavagem das mãos, têm grande importância ao quebrar o ciclo de contaminação fecal‐oral. A melhoria das condições ambientais é um passo fundamental para reduzir a sua incidência.
Outro aspecto importante é a condução adequada do episódio diarreico agudo para evitar as complicações de curto e médio prazo: a desidratação e a repercussão sobre o estado nutricional.
A maioria das vezes o processo infeccioso causa doença leve ou moderada e se autolimita em até cinco a sete dias. O manejo adequado para prevenir ou tratar a desidratação, a oferta adequada de alimentos e o não uso de medicamentos são a base para o tratamento.
Em casos selecionados, há indicação para o uso de antibióticos. A preocupação atual é o aumento da resistência microbiana aos antibióticos preconizados, o que traz uma dificuldade adicional ao manejo terapêutico. Medicamentos sintomáticos têm indicação restrita e não consensual.
Ainda não há vacinas comercialmente disponíveis, mas existem vários estudos em andamento. Em regiões subdesenvolvidas, investir na melhoria das condições ambientais e em programas de educação em saúde é de grande importância para o controle da DA com sangue.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.