To compare serum concentrations of specific IgE and mean papule diameters induced in the immediate skin reactivity test with cow's milk and its fractions with results of the oral challenge test, and to establish cutoff points capable of predicting clinical reactivity to cow's milk in patients treated at a referral service.
MethodsOne hundred and twenty‐two children (median of 17 months) with a history of immediate reactions to cow's milk and presence of specific IgE for cow's milk and/or its fractions (positive skin and/or IgE serum tests) were submitted to open oral challenge test with cow's milk.
ResultsThe oral challenge test was positive in 59.8% of the children, 49% of whom were males. Serum levels of specific IgE, as well as mean cow's milk papule diameters, were significantly higher in allergic patients (medians: 3.39kUA/L vs. 1.16kUA/L, 2.5mm vs. 0mm). The optimal cutoff points (Youden's index) of serum IgE specific for cow's milk and its fractions capable of predicting cow's milk reactivity (positive oral challenge test) were: 5.17kUA/L for cow’s milk, 0.95kUA/L for α‐lactalbumin, 0.82kUA/L for β‐lactoglobulin, and 0.72kUA/L for casein, whereas for papule diameters the cutoff points were 3.5mm for cow's milk and 6.5mm, 9.0mm, and 3.0mm for the α‐lactalbumin, β‐lactoglobulin, and casein fractions, respectively.
ConclusionsThe cutoff points capable of predicting clinical reactivity to cow's milk were: 5.17kUA/L for serum‐specific IgE and 3.5mm for papule diameter measurement, values considered discriminatory for the diagnosis of cow's milk allergy.
Comparar concentrações séricas de IgE específica e diâmetros médios das pápulas induzidas no teste cutâneo de leitura imediata com leite de vaca e suas frações com resultados do teste de provocação oral e estabelecer pontos de corte, capazes de predizer reatividade clínica ao leite de vaca em pacientes atendidos em um serviço de referência.
MétodosCento e vinte e duas crianças (mediana 17 meses), com história de reações imediatas ao leite de vaca e presença de IgE específicas para leite de vaca e/ou frações (testes cutâneos e/ou IgE sérica positivos) foram submetidas ao teste de provocação oral aberto com leite de vaca.
ResultadosO teste de provocac¸ão oral foi positivo em 59,8% das crianças, 49% eram do sexo masculino. Os níveis séricos de IgE específica, assim como os diâmetros médios das pápulas para leite de vaca, foram significantemente maiores nos alérgicos (medianas: 3,39kUA/L vs. 1,16 kUA/L; 2,5mm vs. 0mm). Os “pontos de corte ótimos” (Índice de Youden) das IgE séricas específicas para o leite de vaca e suas frações capazes de predizer a reatividade ao leite de vaca (teste de provocação oral positivo) foram: 5,17kUA/L para o leite de vaca, 0,95 kUA/L para α‐lactoalbumina, 0,82kUA/L para β‐lactoglobulina e 0,72kUA/L para caseína e para os diâmetros de pápulas foram 3,5mm para leite de vaca e 6,5mm, 9,0mm e 3,0mm para as frações α‐lactoalbumina, β‐lactoglobulina e caseína, respectivamente.
ConclusõesOs níveis de corte capazes de predizer reatividade clínica ao leite de vaca foram: 5,17kUA/L para IgE sérica específica e 3,5mm para a medida do diâmetro da pápula, valores considerados discriminatórios para o diagnóstico da alergia ao leite de vaca.
Alergia à proteína do leite de vaca (APLV) é definida como uma reação adversa imunológica, reprodutível, a uma ou mais proteínas do leite de vaca (LV).1 Envolve a participação de imunoglobulinas do tipo IgE (IgE), de células (linfócitos T) ou de ambas.2 Acomete 2% a 3% das crianças, é considerada a alergia alimentar mais comum na infância.2
Para o diagnóstico da APLV mediada por IgE, história clínica detalhada e detecção de IgE específicas para alérgenos do LV são ferramentas importantes.3 Porém, o Teste de Provocação Oral Duplo Cego Placebo Controlado (TPODCPC), que consiste na oferta do alimento sem conhecimento médico e do paciente, continua considerado o padrão‐ ouro para o diagnóstico da APLV.4–7 No entanto, apresenta desvantagens relacionadas ao tempo necessário para sua execução, custos envolvidos, necessidade de estrutura física adequada e de equipe multidisciplinar, fatores limitantes para seu amplo uso na prática clínica.7
Foram estabelecidos diferentes valores de IgE sérica específica e de diâmetros médios de pápulas do teste cutâneo de leitura imediata (TCLI) a partir dos quais a chance de se ter sintomas, quando da feitura da TPO, seria maior do que 95%, porém os valores encontrados não foram reprodutíveis em distintas populações, admitiram‐se diferenças étnicas, de idade, de hábitos alimentares, de fenótipos clínicos e de condições técnicas para feitura do TCLI.8–15
O desejo de minimizar a execução dos TPOs, com seus riscos inerentes, aliado à indisponibilidade de um ponto de corte universal adequado para todas as populações, motivou este estudo, que tem como objetivos: comparar concentrações séricas de IgE específicas e diâmetros médios das pápulas induzidas no TCLI com LV e suas frações com resultados do TPO e estabelecer pontos de corte, capazes de predizer reatividade clínica ao LV em pacientes atendidos em um serviço de referência.
MétodosTrata‐se de um estudo de acurácia diagnóstica, observacional, prospectivo, que incluiu 122 crianças, entre cinco meses e três anos (mediana 17 meses), com suspeita clínica de APLV mediada por IgE e com provas de detecção de IgE específica para LV e/ou frações, na primeira consulta, positivas (critérios de inclusão).
Após aprovação pelo comitê de ética, as crianças admitidas consecutivamente no Serviço de Alergia Alimentar da Universidade Federal de Sergipe (UFS), entre novembro de 2008 e maio de 2014, que preenchiam os critérios de inclusão foram selecionadas. Pais e/ou responsáveis responderam questionário padronizado com história dos sintomas, condições do nascimento, tempo de aleitamento materno, época da primeira introdução do LV, volume desencadeante, intervalo de tempo entre a ingestão e o aparecimento dos sintomas, além do tempo da última reação e dos medicamentos usados.16
Foram considerados sintomas objetivos suspeitos de APLV mediada por IgE quaisquer dos descritos para: pele (hiperemia, urticária, urticária de contato e angioedema), trato respiratório (rinorreia, espirros, obstrução nasal, estridor laríngeo, rouquidão, tosse, dispneia e cianose), trato gastrintestinal (hiperemia perioral, edema de língua e/ou úvula, vômitos e diarreia) e sistema cardiovascular (taquicardia, arritmias, hipotonia, prostração e síncope), claramente observados e deflagrados até duas horas após o contato com o alimento.2,3,6,17 Como provas positivas para detecção de IgE específica para LV e frações, foram aceitos resultados de TCLI e/ou de concentrações de IgE trazidos pelos responsáveis na primeira consulta.18
Após selecionadas, crianças e mães nutrizes foram orientadas a restringir as proteínas do LV e derivados de sua dieta, por duas a quatro semanas, a não usar anti‐histamínicos uma semana antes da TPO e a deixar suas crianças em jejum por duas horas antes do procedimento.7,19,20 Impressos com instruções sobre isenção do LV e sobre leitura cuidadosa de rótulos foram entregues e questionário sobre o cumprimento dessas exigências foi aplicado antes da TPO. Também foram fornecidas orientações sobre riscos e benefícios do TPO e sobre as implicações de um resultado positivo ou negativo aos pais, que conscientizados, assinaram o termo de consentimento livre e esclarecido.21
História recente (inferior a dois anos) de anafilaxia, associada à presença de IgE específica à admissão, persistência de sintomas após período de exclusão do LV, baixa adesão às orientações sobre o preparo para o TPO e presença de processo inflamatório e/ou infeccioso no dia do procedimento foram considerados critérios de exclusão.5,7
No dia da TPO, checado o cumprimento das recomendações, as crianças eram submetidas a exame físico criterioso, seguido pelos seguintes exames: coleta de sangue periférico para determinação da concentração sérica de IgE total e de IgE específicas para o LV e frações e TCLI.
Amostra de sangue periférico foi coletada, centrifugada e o soro estocado e congelado a ‐20°C até a análise. Foram determinados os níveis de IgE total e específica a LV total, α‐lactoalbumina, β‐lactoglobulina e caseína, empregou‐se o método ImmunoCAP® (Thermo Fisher Scientific, Brasil).22 As determinações dos níveis séricos foram feitas no Laboratório de Pesquisa da Disciplina de Nutrologia do Departamento de Pediatria da Universidade Federal de São Paulo. Os resultados obtidos foram expressos em kUA/L e considerados positivos quando maiores que 0,35 kUA/L.22
Quanto ao TCLI, foram empregados os seguintes extratos: LV total (10mg/mL), α‐lactoalbumina (5%), β‐lactoglobulina (5%) e caseína (5%) (IPI‐ASAC®, Espanha), além dos controles: negativo (diluente) e positivo (histamina 1mg/mL). O surgimento de pápula com diâmetro médio maior ou igual a 3mm em relação ao controle negativo, 15 minutos após o TCLI por puntura, caracterizou o resultado como positivo.22
O TPO aberto, procedimento no qual apenas o médico tem consciência do que é ofertado ao paciente, foi executado em ambiente hospitalar, sob supervisão de equipe multidisciplinar preparada para atender qualquer reação clínica.7 O TPO aberto foi escolhido pelo fato de, em se tratando de sintomas objetivos, em crianças menores de três anos, permitir estabelecer o diagnóstico, mesmo sem a execução do TPO duplo cego controlado por placebo (TPODCPC).5
Foram ofertados 100mL de LV (diluição a 13%) administrados em doses crescentes (1, 4, 10, 15, 20, 25 e 25ml), a intervalos de 15 a 20 minutos, equivalentes a 0,03, 0,14, 0,34, 0,51, 0,68, 0,85 e 0,85g de proteína do LV, respectivamente.7,8,19,20 Em caso de recusa, usava‐se veículo palatável capaz de mascarar o sabor do LV.19
Quando reações clínicas surgiam, o teste era considerado positivo e a criança prontamente atendida, permanecia em observação até o desaparecimento das manifestações.7 As reações foram classificadas de acordo com a gravidade em leves (apenas sintomas cutâneos e/ou sintomas do trato respiratório superior), moderadas (sintomas do trato gastrointestinal ou associação de sistemas exclusive sintomas do trato respiratório inferior e/ou cardiovascular) e graves (sintomas da laringe, do trato respiratório inferior e/ou sintomas cardiovasculares).21
Se após a ingestão de todo o volume ofertado nenhuma manifestação ocorresse em até duas horas, o teste era considerado negativo, o paciente era excluído do estudo e recebia alta.
Análise dos dados obtidosOs dados coletados foram analisados com o software estatístico SPSS (Released 2008. SPSS Statistics para Windows, versão 17.0. Chicago, EUA).
Foram calculadas sensibilidade (Se), especificidade (Ep), valor preditivo positivo (VPP), valor preditivo negativo (VPN), razão de verossimilhança positiva e negativa para avaliação da acurácia dos pontos de corte das IgEs séricas específicas para LV total e frações e dos diâmetros médios da pápula do TCLI quando comparados aos resultados do TPO (padrão‐ouro).23
As curvas ROC (receiver operating characteristic) foram obtidas da relação entre Se e Ep. Com isso, foram definidos “pontos de corte ótimos”, com o objetivo de definir alergia. Para tal, foram usados dois métodos: Índice de Youden e maximização da Ep.24
Foram calculados VPP e VPN para um valor de corte de 0,35 kUA/L, baseados em referências prévias de positividade e para os “pontos de corte ótimos” na curva ROC. Foi calculado o poder amostral para que os pontos de corte apresentassem especificidade igual ou superior a 70% tal como em Champely (2017).25
Para avaliar a concordância entre as frações (α‐lactoalbumina, β‐lactoglobulina e caseína) e o leite de vaca total, usamos a medida de concordância α de Krippendorf.26 O valor 1 significa haver concordância perfeita, 0 indica ausência de concordância e valores inferiores a 0 indicam discordância sistemática.
O estudo foi aprovado pelos comitês de ética das Universidades Federais de Sergipe (UFS) e de São Paulo (Unifesp), sob respectivos números CEP/SE No CAAE – 0087.0.107.174‐08 e CEP/SP – 1440/11.
ResultadosEntre as 122 crianças submetidas ao TPO, 60 (49%) eram do sexo masculino. O grupo alérgico foi constituído por 73 pacientes (59,8%) e o controle (não alérgicos) por 49 (40,2%).
Os sintomas mais observados durante o TPO aberto foram os cutâneos com 86,3% (63/73), seguidos pelos respiratórios em 23,3% (17/73) e os gastrintestinais em 13,7% (10/73). Não houve sintomas cardiovasculares. Urticária foi a manifestação clínica mais frequente, acometeu 78% das crianças.
Os níveis séricos de IgE específica para LV e sua frações (α‐lactoalbumina, β‐lactoglobulina e caseína) foram significantemente maiores no grupo dos alérgicos em comparação com os não alérgicos (mediana 3,39 kUA/L vs. 1,16 kUA/L; 0,97 kUA/L vs. 0,09 kUA/L; 1,72 kUA/L vs. 0,44 kUA/L e 0,75 kUA/L vs. 0,36 kUA/L, respectivamente).
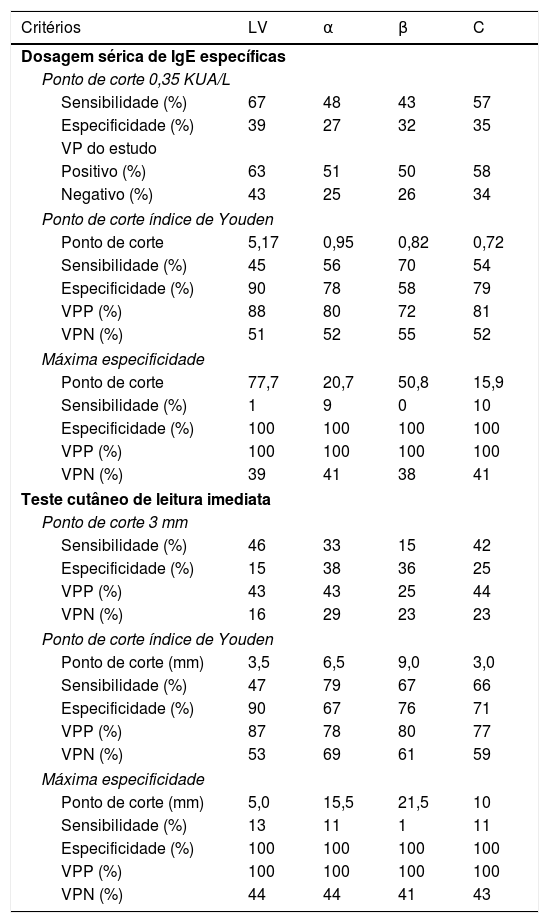
A tabela 1 descreve a acurácia de diferentes concentrações de IgE específicas e de diâmetros médios de pápulas para o LV e suas frações segundo os resultados do TPO. Para as concentrações de IgE, quando o valor de 0,35 kUA/L foi estabelecido como ponto de corte para positividade do teste, a Se para o LV total e suas frações variou de 43% a 67%, a Sp de 27% a 39% e o VPN de 25% a 43%.
Descrição dos valores de sensibilidade (Se), especificidade (Sp), Valores Preditivos Positivos (VPP), Valores Preditivos Negativos (VPN), para as concentrações de IgE específicas para leite de vaca e suas frações e para diâmetros médios de pápulas no teste cutâneo de leitura imediata no Teste de Provocação Oral Aberto, por diferentes critérios
| Critérios | LV | α | β | C |
|---|---|---|---|---|
| Dosagem sérica de IgE específicas | ||||
| Ponto de corte 0,35 KUA/L | ||||
| Sensibilidade (%) | 67 | 48 | 43 | 57 |
| Especificidade (%) | 39 | 27 | 32 | 35 |
| VP do estudo | ||||
| Positivo (%) | 63 | 51 | 50 | 58 |
| Negativo (%) | 43 | 25 | 26 | 34 |
| Ponto de corte índice de Youden | ||||
| Ponto de corte | 5,17 | 0,95 | 0,82 | 0,72 |
| Sensibilidade (%) | 45 | 56 | 70 | 54 |
| Especificidade (%) | 90 | 78 | 58 | 79 |
| VPP (%) | 88 | 80 | 72 | 81 |
| VPN (%) | 51 | 52 | 55 | 52 |
| Máxima especificidade | ||||
| Ponto de corte | 77,7 | 20,7 | 50,8 | 15,9 |
| Sensibilidade (%) | 1 | 9 | 0 | 10 |
| Especificidade (%) | 100 | 100 | 100 | 100 |
| VPP (%) | 100 | 100 | 100 | 100 |
| VPN (%) | 39 | 41 | 38 | 41 |
| Teste cutâneo de leitura imediata | ||||
| Ponto de corte 3 mm | ||||
| Sensibilidade (%) | 46 | 33 | 15 | 42 |
| Especificidade (%) | 15 | 38 | 36 | 25 |
| VPP (%) | 43 | 43 | 25 | 44 |
| VPN (%) | 16 | 29 | 23 | 23 |
| Ponto de corte índice de Youden | ||||
| Ponto de corte (mm) | 3,5 | 6,5 | 9,0 | 3,0 |
| Sensibilidade (%) | 47 | 79 | 67 | 66 |
| Especificidade (%) | 90 | 67 | 76 | 71 |
| VPP (%) | 87 | 78 | 80 | 77 |
| VPN (%) | 53 | 69 | 61 | 59 |
| Máxima especificidade | ||||
| Ponto de corte (mm) | 5,0 | 15,5 | 21,5 | 10 |
| Sensibilidade (%) | 13 | 11 | 1 | 11 |
| Especificidade (%) | 100 | 100 | 100 | 100 |
| VPP (%) | 100 | 100 | 100 | 100 |
| VPN (%) | 44 | 44 | 41 | 43 |
α, α‐lactoalbumina; β, β‐lactoglobulina; c, caseína; LV, leite de vaca.
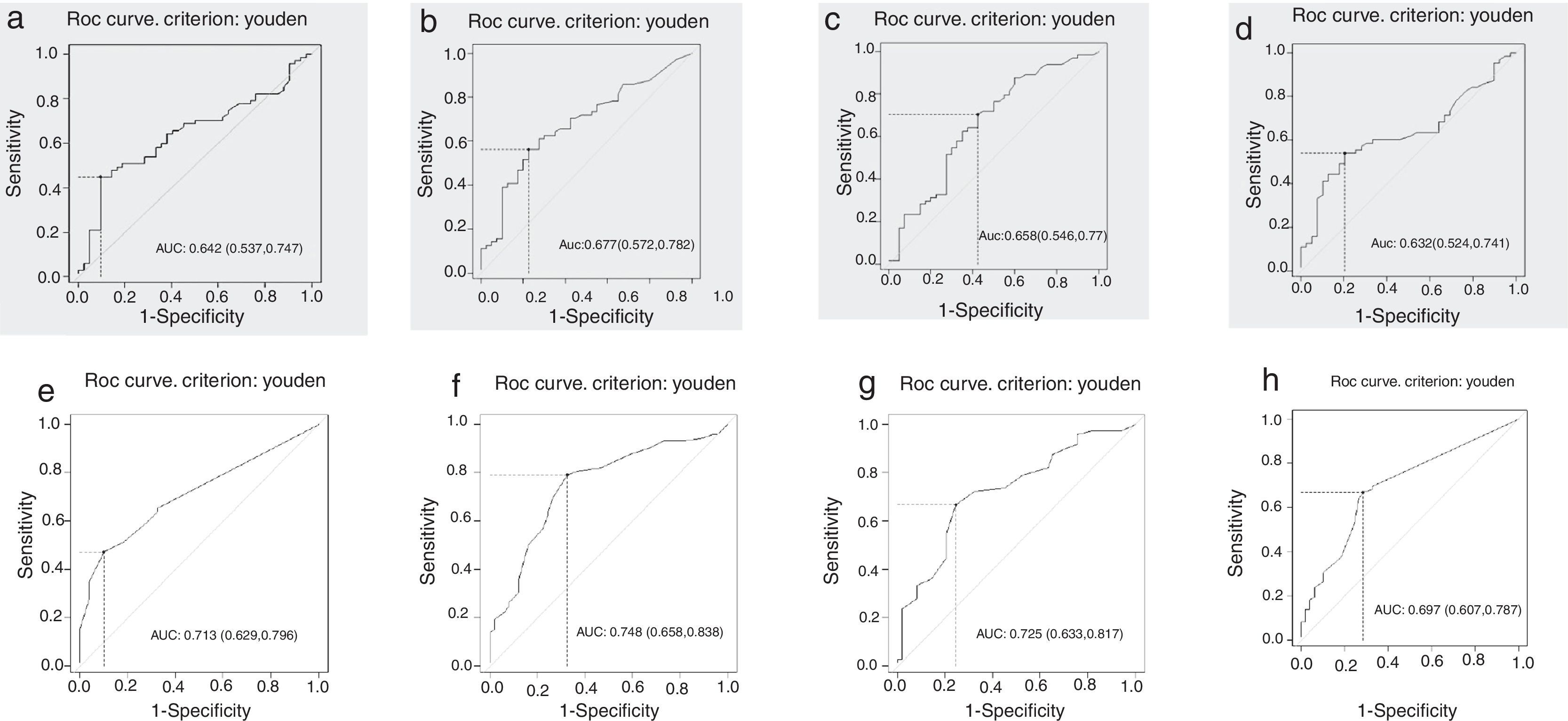
As curvas ROC construídas a partir da relação obtida entre a Se e Sp dos níveis de IgE específica se mostraram discriminatórias, com área sob a curva maior do que 0,6 para o LV e suas frações (fig. 1). De acordo com o critério proposto para o estabelecimento de um “ponto de corte ótimo”, o Índice de Youden, a concentração sérica de IgE específica considerada ótima para o LV foi 5,17 kUA/L, bem diferente da obtida com o critério da maximização da Sp (VPP = 100%), com valores de 77,7 kUA/L (tabela 1).
Curvas ROC (receiver operating characteristic) para obtenção dos níveis ótimos de IgE séricas específicas para: (a) leite de vaca total (b) α‐lactoalbumina (c) β‐lactoglobulina (d) caseína; e para diâmetros médios de pápulas do teste cutâneo de leitura imediata para: (e) leite de vaca total (f) α‐lactoalbumina (g) β‐lactoglobulina e (h) caseína, no Teste de Provocação Oral Aberto para leite de vaca e suas frações.
Para as frações, segundo o Índice de Youden, foram considerados os valores: 0,95 kUA/L para α‐lactoalbumina, 0,82 kUA/L para β‐lactoglobulina e 0,72 kUA/L para caseína (tabela 1). Quando avaliadas isoladamente, as Razões de Verossimilhança Positiva (RVP), índice que representa o quanto um resultado positivo aumenta a chance de um indivíduo ser doente, tinham pequenas acurácias diagnósticas (valores entre 2 e 5), eram nulas para β‐lactoglobulina (valor entre 1 e 2) e maiores para o LV total. A avaliação das diferentes combinações possíveis demonstrou que qualquer associação tem melhor acurácia do que o LV total isoladamente, principalmente se com a caseína (RVP = 9,53).
Os diâmetros médios das pápulas foram significantemente maiores no grupo dos alérgicos: LV ‐ mediana 2,5mm vs. 0mm, α‐lactoalbumina: 8,75mm vs. 5,5mm, β‐lactoglobulina: 9,75mm vs. 8,0mm e caseína: 3,5mm vs. 0mm. Ao avaliar o desempenho de diferentes diâmetros médios de pápulas, quando o valor de 3mm foi estabelecido como ponto de corte para positividade do TCLI, a Se para o LV total e suas frações variou de 15% a 46%, a Sp de 15% a 38% e o VPN de 16% a 29% (tabela 1).
As curvas ROC se mostraram adequadas, com área sob a curva maior do que 0,7 para o LV e suas frações, à exceção da caseína, com área de 0,697 (0,607 a 0,787), apenas discriminatória (fig. 1). O “ponto de corte ótimo”, empregando‐se o Índice de Youden, para o diâmetro médio de pápula do LV foi 3,5mm. Com a maximização da Sp (VPP = 100%), o ponto de corte para LV foi 5,0mm, 15,5mm para α‐lactoalbumina, 21,5mm para β‐lactoglobulina e 10mm para caseína (tabela 1). O uso dos componentes contribuiu para melhorar o diagnóstico dos que tinham TCLI negativo para o LV total (RVN: 0,74).
Foi calculado o poder dos pontos de corte estabelecidos, para apresentarem especificidade igual ou superior a 70%. O poder do ponto de corte da IgE sérica específica e do teste cutâneo para leite de vaca, calculado através do método de Youden, foi de 99,9% em ambos, foi considerado de alto poder.
DiscussãoNa prática clínica, novos testes diagnósticos são adotados por diferentes razões: triagem, para melhor informação, para menor custo ou como complemento aos existentes.23 Testes perfeitos não existem, mas é necessário saber como eles podem diferenciar indivíduos doentes dos saudáveis, o que é denominado acurácia do teste diagnóstico.24
Este estudo reúne vantagens por ser um estudo de acurácia diagnóstica, transversal e prospectivo que avaliou crianças com até três anos e com sintomas objetivos de APLV, o que permitiu o uso do TPO aberto como método diagnóstico, dispensou o TPODCPC, procedimento menos exequível.5,6 Em sua maioria, os estudos incluíam pacientes de faixas etárias distintas, alguns deles com adultos.8–15Todas as crianças fizeram TPO aberto independentemente dos níveis de IgE e dos diâmetros médios de pápulas, minimizou‐se viés de seleção. O tempo de dieta de exclusão antes de fazerem o TPO não interferiu nos resultados. O TPO com sintomas foi considerado positivo (alérgico) e sem sintomas, negativo (não alérgicos ou tolerantes). O desempenho apenas discriminatório das curvas ROC se deve à incerteza existente sobre o poder de previsão da alergia e/ou tolerância pelos níveis séricos de IgE específica e do diâmetro médio das pápulas para pacientes na faixa etária estudada, não anafiláticos e de localização distinta.
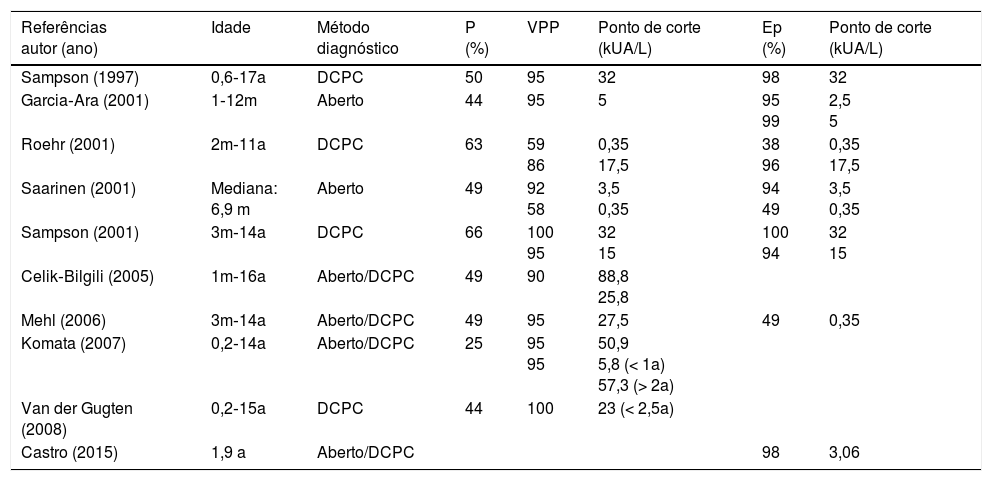
O ImmunoCAP®, técnica de detecção sérica quantitativa da IgE específica, permitiu aos pesquisadores estabelecer uma relação entre níveis de IgE e diagnóstico de alergia alimentar.3 Trabalhos publicados que propuseram e discutiram valores de ponto de corte para diagnóstico da APLV descreveram resultados distintos entre populações estudadas, apontaram para a necessidade de se estabelecerem valores para cada população específica, o que motivou este trabalho (tabela 2).8–15No Brasil, pontos de corte para as concentrações séricas de IgE específica ao LV foram estabelecidos para populações fenotipicamente distintas, em São Paulo, com resultados diferentes: 3,06 kUA/L para anafiláticos27 e 11 kUA/L para não anafiláticos.28
Valores séricos de IgE específicas (ImmunoCAP®) preditivas para o diagnóstico da alergia ao leite de vaca (reproduzido e modificado de Luyt et al.2
| Referências autor (ano) | Idade | Método diagnóstico | P (%) | VPP | Ponto de corte (kUA/L) | Ep (%) | Ponto de corte (kUA/L) |
|---|---|---|---|---|---|---|---|
| Sampson (1997) | 0,6‐17a | DCPC | 50 | 95 | 32 | 98 | 32 |
| Garcia‐Ara (2001) | 1‐12m | Aberto | 44 | 95 | 5 | 95 99 | 2,5 5 |
| Roehr (2001) | 2m‐11a | DCPC | 63 | 59 86 | 0,35 17,5 | 38 96 | 0,35 17,5 |
| Saarinen (2001) | Mediana: 6,9 m | Aberto | 49 | 92 58 | 3,5 0,35 | 94 49 | 3,5 0,35 |
| Sampson (2001) | 3m‐14a | DCPC | 66 | 100 95 | 32 15 | 100 94 | 32 15 |
| Celik‐Bilgili (2005) | 1m‐16a | Aberto/DCPC | 49 | 90 | 88,8 25,8 | ||
| Mehl (2006) | 3m‐14a | Aberto/DCPC | 49 | 95 | 27,5 | 49 | 0,35 |
| Komata (2007) | 0,2‐14a | Aberto/DCPC | 25 | 95 95 | 50,9 5,8 (< 1a) 57,3 (> 2a) | ||
| Van der Gugten (2008) | 0,2‐15a | DCPC | 44 | 100 | 23 (< 2,5a) | ||
| Castro (2015) | 1,9 a | Aberto/DCPC | 98 | 3,06 |
DCPC, duplo cego placebo controlado; Ep, especificidade; P, porcentagem; VPP, valor preditivo positivo.
Por definição, o ponto de corte é considerado bom quando combina VPP e Sp elevados. Em nosso estudo, a curva ROC mostrou que o ponto de corte ótimo para LV (isto é, o ponto em que o peso da Se é igual ao da Sp), com o Índice de Youden, foi de 5,17 kUA/L (Sp: 90% e VPP: 88%). Ao tentarmos encontrar um ponto de corte mais adequado, ou seja, com maior VPP, fixando‐se o VPP em 90% ou em 95%, o valor fornecido pela curva foi de 77,7 kUA/L (Sp e VPP de 100%) (tabela 1).
Na prática clínica, o nível mais adequado de IgE específica para se indicar ou não a TPO depende do contexto clínico. Se a provocação pode ser perigosa para o paciente, um ponto de corte baixo seria de interesse, mesmo à custa de rotulá‐lo erroneamente como alérgico. Apesar de o valor 5,17 kUA/L não apresentar Sp e VPP tão adequados, aceitar 77 kUA/L seria submeter ao TPO todas as crianças e expor, assim, muitas delas a situações de risco (tabela 1).
Alguns estudos também documentaram a utilidade do TCLI como preditor de positividade no TPO para diagnóstico da APLV.13–15 O ponto de corte ótimo estabelecido para o LV no TCLI foi de 3,5mm (Sp = 90% e VPP = 87%). Ao tentarmos encontrar um ponto de corte mais adequado, fixando‐se o VPP em 90% ou em 95%, o valor fornecido pela curva ROC foi de 5,0mm (especificidade e VPP de 100%) (tabela 1).
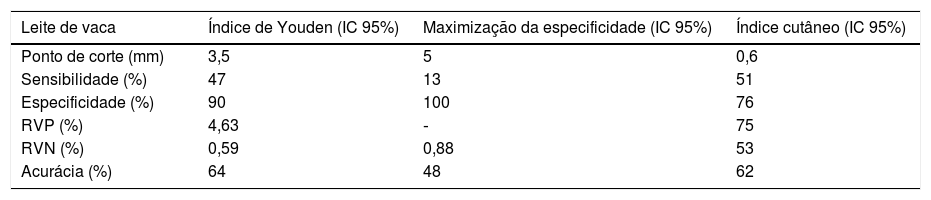
Embora não haja restrição de idade para o TCLI, admite‐se que pacientes menores de dois anos podem apresentar diâmetros menores, pelo fato de a reatividade cutânea, adquirida durante a infância, atingir seu pico máximo dos 15 aos 25 anos e declinar progressivamente.29 Por tal motivo, o índice cutâneo no TCLI, razão entre tamanho de pápula e o controle positivo, pode ser usado para predizer resultados dos testes de provocação oral.30 Ao fixar como positivo valor de 0,6, previamente estabelecido,30 e comparar a acurácia obtida com as dos pontos de corte estabelecidos pelo índice de Youden e pela maximização da Sp, obtivemos como melhor medida o valor de 3,5mm (tabela 3). Alguns autores correlacionaram seus resultados do índice cutâneo com os do TPO, no entanto nenhuma utilidade foi encontrada neste estudo.13,14,29
Acurácia dos diferentes pontos de corte do diâmetro médio da pápula para leite de vaca total nos Testes de Provocação Oral Aberto
| Leite de vaca | Índice de Youden (IC 95%) | Maximização da especificidade (IC 95%) | Índice cutâneo (IC 95%) |
|---|---|---|---|
| Ponto de corte (mm) | 3,5 | 5 | 0,6 |
| Sensibilidade (%) | 47 | 13 | 51 |
| Especificidade (%) | 90 | 100 | 76 |
| RVP (%) | 4,63 | ‐ | 75 |
| RVN (%) | 0,59 | 0,88 | 53 |
| Acurácia (%) | 64 | 48 | 62 |
IC, intervalo de confiança; RVN, razão de verossimilhança negativa; RVP, razão de verossimilhança positiva.
Se a prevalência da doença na população é alta, os resultados do VPP e do VPN sofrem interferências. Um ajuste da prevalência seria impossível pelo desconhecimento da prevalência da APLV em nossa região e no Brasil, então medidas opcionais de desempenho, como razão de verossimilhança positiva (RVP) e negativa, (RVN) foram aplicadas.
Na avaliação diagnóstica do uso dos componentes associados ao LV na avaliação de crianças com suspeita de APLV, nossos resultados concordariam com os publicados por Castro et al., que demonstraram não haver incremento na avaliação diagnóstica com o uso dos componentes em adição ao LV, isso se as tivéssemos analisado uma a uma.27 No entanto, ao avaliar diferentes combinações possíveis, demonstramos que qualquer associação tem melhor acurácia do que o LV total isoladamente. Garcia‐Ara et al. também observaram que, na validação dos seus resultados com o TPO, houve vantagem no diagnóstico quando as frações proteicas foram associadas. Além disso, a negatividade das frações excluía a APLV em muitos dos casos, pelo seu elevado VPN.8
Para avaliar se os resultados obtidos estavam associados à concordância entre as frações (α‐lactoalbumina, β‐lactoglobulina e caseína) e o LV, visto que as frações deveriam estar incluídas no componente total do LV, usamos a medida de concordância α de Krippendorf.26 A observação de níveis discretamente superiores a zero permitiu afirmar que o uso das frações, tanto para dosagens das IgE como para diâmetro da pápula no TCLI, auxilia no diagnóstico da APLV em menores de três anos.
Em conclusão, o nível de corte de IgE específica para LV em crianças de um serviço especializado mostrou‐se discriminatório para o diagnóstico de APLV com valor de 5,17 kUA/L, assim como o do diâmetro médio de pápula para LV de 3,5mm.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Franco JM, Pinheiro AP, Vieira SC, Barreto ÍD, Gurgel RQ, Cocco RR, et al. Accuracy of serum IgE concentrations and papule diameter in the diagnosis of cow's milk allergy. J Pediatr (Rio J). 2018;94:279–85.
Trabalho vinculado à Universidade Federal de São Paulo (Unifesp), Escola Paulista de Medicina, São Paulo, SP; e Universidade Federal de Sergipe, Aracaju, SE, Brasil.