To characterize varicella zoster virus‐related deaths and hospitalizations in Brazil before universal vaccination with the tetravalent (measles, mumps, rubella, and varicella) vaccine, attempting to collect baseline data on varicella morbidity and mortality in order to evaluate the impact of the varicella vaccination program.
MethodsVaricella‐associated mortality data were evaluated between 1996 and 2011 and varicella zoster virus‐associated hospitalizations between 1998 and 2013. Data were gathered from the Informatics Department of the Unified Health System, considering the International Classification of Diseases, 10th Revision, code B01. All age groups were assessed. Varicella‐specific mortality rates were calculated and seasonality of varicella‐zoster virus‐associated hospitalizations was described.
ResultsThere were 2334 varicella deaths between 1996 and 2011, 19.3% in infants aged less than 1 year and 36% in children from 1 to 4 years. In infants under 1 year, varicella mortality rates reached 3.2/100,000/year. In children aged 1–4 years, varicella mortality rates reach 1.64/100,000/year. Average annual mortality rates for varicella in Brazil are 0.88/100,000 in infants under 1 year and 0.40/100,000 in children aged 1–4 years. The total number of hospitalizations associated with varicella zoster virus was 62,246 from 2008 to 2013. Varicella‐associated hospitalizations have a seasonal distribution in children, peaking in November. In the elderly, monthly averages of herpes‐zoster‐associated hospitalizations present no significant seasonal variation.
ConclusionsVaricella is associated, in the pre‐vaccine period, to significant morbidity and mortality in Brazil. The universal vaccination program is expected to decrease the disease burden from varicella.
Caracterizar os óbitos e as internações relacionados ao vírus varicela‐zoster no Brasil antes da vacinação universal com a vacina tetravalente (sarampo, caxumba, rubéola e varicela) e tentar coletar dados de referência sobre a morbidez e a mortalidade por varicela, para avaliar o impacto do programa de vacinação contra a varicela.
MétodosOs dados de mortalidade associada à varicela foram avaliados entre 1996 e 2011 e as internações associadas ao vírus varicela‐zoster entre 1998 e 2013. Os dados foram coletados do Departamento de Informática do Sistema Unificado de Saúde, considerou‐se a Classificação Internacional de Doenças, 10ª Revisão, código B01. Todas as faixas etárias foram avaliadas. Foram calculadas as taxas de mortalidade específicas por varicela e foi descrita a sazonalidade das internações associadas ao vírus varicela‐zoster.
ResultadosHouve 2.334 óbitos por varicela entre 1996 e 2011, 19,3% em neonatos com menos de 1 ano e 36% em crianças de 1 a 4 anos. Em neonatos com menos de 1 ano, as taxas de mortalidade por varicela atingiram 3,2/100.000/ano. Em crianças de 1‐4 anos, as taxas de mortalidade por varicela atingiram 1,64/100.000/ano. As taxas de mortalidade anuais médias por varicela no Brasil são de 0,88/100.000 em neonatos com menos de 1 ano e 0,40/100.000 em crianças de 1 a 4 anos. O número total de internações associadas ao vírus varicela‐zoster foi de 62.246 de 2008 a 2013. As internações relacionadas à varicela apresentaram distribuição sazonal em crianças, com pico em novembro. Em idosos, as médias mensais de internações associadas ao herpes‐zoster não apresentaram variação sazonal significativa.
ConclusõesA varicela está associada a morbidez e mortalidade significativas no período pré‐vacinação no Brasil. O programa de vacinação universal deve diminuir a carga de doença da varicela.
A varicela (catapora) é uma doença infecciosa aguda, exantemática e contagiosa que ocorre principalmente na infância.1 Ela é causada pelo vírus varicela‐zoster (VVZ), um alfa herpesvírus da família Herpesviridae.2–4 Depois da resolução da catapora, o VVZ continua latente nos gânglios espinhais da raiz dorsal e a reativação pode surgir em qualquer fase da vida, mais frequentemente em uma idade mais avançada, e causar a herpes‐zoster.2,3,5–7
Embora normalmente seja considerada uma doença leve da infância, a varicela pode ser grave em crianças, adultos e indivíduos imunocomprometidos8 devido ao risco de disseminação viral para órgãos internos, como pulmões, fígado, cérebro, coração e rins. As complicações mais frequentes da varicela são as infecções bacterianas secundárias causadas pelo Streptococcus β‐haemolyticus do grupo A ou Staphylococcus aureus, que normalmente afetam a pele e os tecidos moles. As infecções bacterianas invasivas, como pneumonia, artrite, osteomielite, sepse e fasceíte necrotizante, podem ser fatais.1 Também podem ocorrer complicações neurológicas como ataxia cerebelar, encefalite, meningite e vasculite.9
A vacina viva atenuada contra a varicela foi elaborada no Japão em 1974.10 As vacinas contra a varicela, disponíveis em todo o mundo, têm apenas o VVZ ou são combinadas com os vírus do sarampo, da caxumba e da rubéola e formam uma vacina tetravalente (SCRV).6 Segundo Ozaki, o efeito preventivo da vacina contra a varicela foi estimado em 75%. Nos Estados Unidos, variou entre 79 e 88% com a 1° dose, em todas as formas da doença.6
Em 2013, uma parceria de desenvolvimento de produtos no Ministério da Saúde do Brasil, que envolveu a indústria farmacêutica, permitiu a produção de SCRV no Instituto de Tecnologia em Imunobiológicos (Biomanguinhos) da Fundação Oswaldo Cruz (Fiocruz, RJ, Brasil). Assim, a vacinação universal contra a varicela começou em setembro de 2013, no Brasil, por meio do Programa Nacional de Imunizações (PNI). Uma única dose de SCRV é administrada aos 15 meses e neonatos recebem a SCR (sarampo, caxumba e rubéola) aos 12 meses.
A vacinação universal provavelmente mudará a epidemiologia da varicela no Brasil, exigirá dados básicos para avaliar o impacto do programa de vacinação contra a varicela. Este estudo pretende descrever a frequência e a distribuição sazonal dos óbitos relacionados à varicela, bem como a frequência de internações relacionadas ao VVZ no período pré‐vacinação no Brasil.
Material e métodosOs dados de mortalidade relacionada à varicela e internações relacionadas ao VVZ foram coletados do Departamento de Informática do Sistema Único de Saúde (DataSUS), por meio do website http://www2.datasus.gov.br/DATASUS/index.php?area=02. Na página de Informações de Saúde, acessamos a seção Mortalidade em Estatísticas Vitais para avaliar os óbitos relacionados à varicela. Acessamos a seção Morbidade Hospitalar em Informações Epidemiológicas e Morbidade para avaliar internações relacionadas ao VVZ. Os óbitos relacionados à varicela foram verificados de acordo com a Classificação Internacional de Doenças, 10ª Revisão [CID‐10] código B01.
As internações relacionadas ao VVZ foram verificadas de acordo com uma lista de morbidez que não tem um código [CID‐10]. Os óbitos por varicela incluíram o período de 1996‐2011 e foram estudadas as internações por varicela e herpes‐zoster de 2008 a 2013. Quando a coleta de dados foi feita, o último período de registros de óbitos disponível era anterior a 2011 e o de internações, anterior a 2013. Ademais, no período anterior a 1996, os dados relacionados à idade estavam desnivelados. Consideramos internações tanto por varicela quanto herpes‐zoster porque o DataSUS não distingue registros de internações por varicela e herpes‐zoster. Avaliamos os óbitos relacionados à varicela porque a doença é mais frequente em crianças.
A mortalidade específica por varicela em faixas etárias foi calculada como o número de óbitos por varicela em neonatos com menos de 1 ano em uma população de 100.000 com menos de 1 ano e em crianças entre 1‐4 anos em uma população de 100.000 entre 1‐4 anos nas cinco macrorregiões brasileiras (Norte, Nordeste, Sul, Sudeste e Centro‐Oeste). O tamanho da população usado nos denominadores foi obtido do Instituto Brasileiro de Geografia e Estatística (IBGE) com base nos censos de 1991, 2000 e 2010 e nas respectivas projeções anuais intercensos. A sazonalidade das internações relacionadas ao VVZ foi avaliada por meio das médias e desvios padrão do número mensal de internações relacionadas ao VVZ de 2008 a 2013 em faixas etárias. Pressupusemos que as internações relacionadas ao VVZ entre neonatos com menos de 1 ano e 1‐4 anos estão predominantemente relacionadas à varicela, ao passo que as internações entre adultos com mais de 65 anos são causadas principalmente pelo herpes‐zoster. O estudo foi apresentado ao Comitê de Ética do Instituto Oswaldo Cruz e aprovado sob o número de referência CAAE 27704214.3.0000.5248.
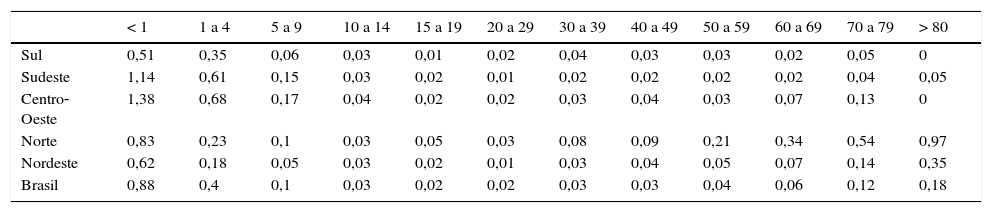
ResultadosHouve 2.334 óbitos relacionados à varicela entre 1996 e 2011 no Brasil. Desses óbitos, 19,3% (n = 450) eram neonatos com menos de 1 ano, 36% (n = 840) eram crianças de 1‐4 anos, 11,7% (n = 273) eram crianças de 5‐9 anos e 33% (n = 771) eram pacientes com mais de 9 anos. A tabela 1 mostra as taxas de mortalidade médias por varicela nas faixas etárias em distintas regiões brasileiras de 1996 a 2011. Em neonatos com menos de 1 ano, as taxas de mortalidade por varicela variam em distintas regiões brasileiras, de 0 a 3,2/100.000/ano. Em crianças de 1‐4 anos, as taxas de mortalidade por varicela variam de 0 a 1,64/100.000/ano. As taxas de mortalidade anuais médias por varicela no Brasil de 1996 a 2011 são 0,88/100.000 em neonatos com menos de 1 ano e 0,40/100.000 em crianças de 1 a 4 anos.
Taxas médias de mortalidade anual por varicela em 100.000 habitantes por faixa etária nas regiões do Brasil de 1996 a 2011
| < 1 | 1 a 4 | 5 a 9 | 10 a 14 | 15 a 19 | 20 a 29 | 30 a 39 | 40 a 49 | 50 a 59 | 60 a 69 | 70 a 79 | > 80 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Sul | 0,51 | 0,35 | 0,06 | 0,03 | 0,01 | 0,02 | 0,04 | 0,03 | 0,03 | 0,02 | 0,05 | 0 |
| Sudeste | 1,14 | 0,61 | 0,15 | 0,03 | 0,02 | 0,01 | 0,02 | 0,02 | 0,02 | 0,02 | 0,04 | 0,05 |
| Centro‐Oeste | 1,38 | 0,68 | 0,17 | 0,04 | 0,02 | 0,02 | 0,03 | 0,04 | 0,03 | 0,07 | 0,13 | 0 |
| Norte | 0,83 | 0,23 | 0,1 | 0,03 | 0,05 | 0,03 | 0,08 | 0,09 | 0,21 | 0,34 | 0,54 | 0,97 |
| Nordeste | 0,62 | 0,18 | 0,05 | 0,03 | 0,02 | 0,01 | 0,03 | 0,04 | 0,05 | 0,07 | 0,14 | 0,35 |
| Brasil | 0,88 | 0,4 | 0,1 | 0,03 | 0,02 | 0,02 | 0,03 | 0,03 | 0,04 | 0,06 | 0,12 | 0,18 |
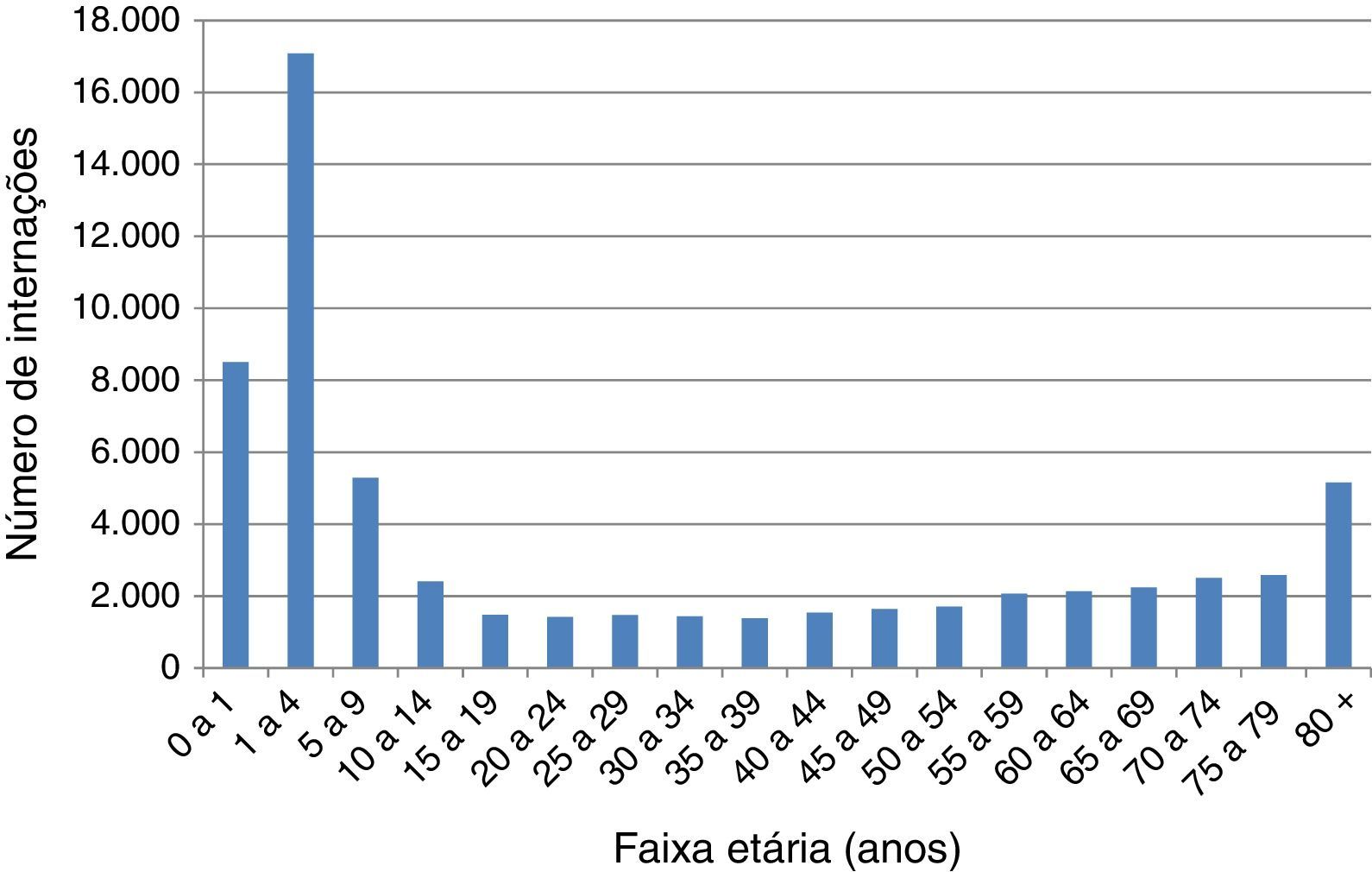
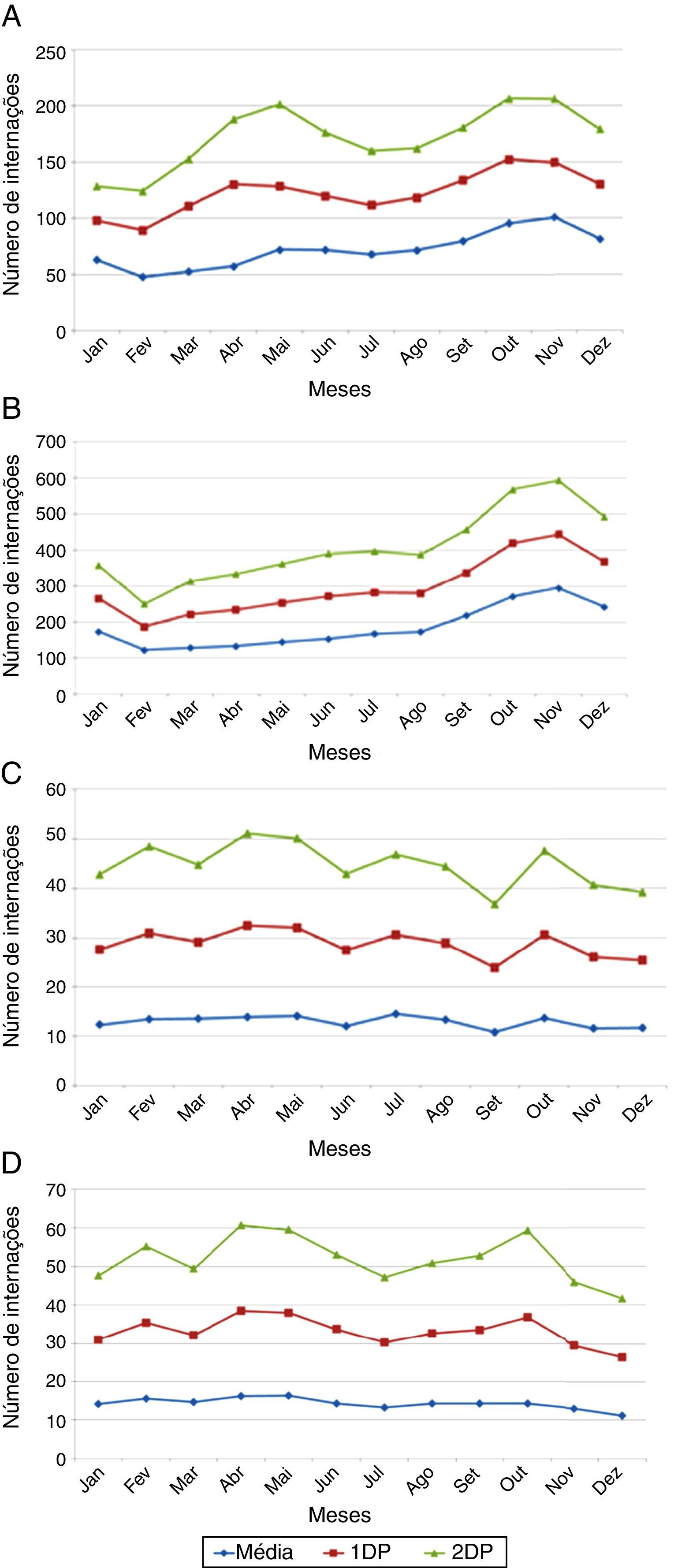
O número de internações relacionadas ao VVZ por faixa etária no período anterior à introdução da vacina SCRV no Brasil de 2008 a 2013 está representado na figura 1. A maior parte das internações ocorre em crianças com menos de 9 anos, com picos na faixa de 1‐4 anos e nos idosos com mais de 80 anos. Este estudo demonstra que a frequência de internações por herpes‐zoster varia entre 4.378, 5.084 e 5.151 casos por mês no Brasil nas faixas etárias 60‐69, 70‐79 e mais de 80 anos, respectivamente. O número total de internações associadas ao VVZ foi de 62.052 e as internações relacionadas à varicela apresentaram distribuição sazonal em crianças, com pico em novembro.
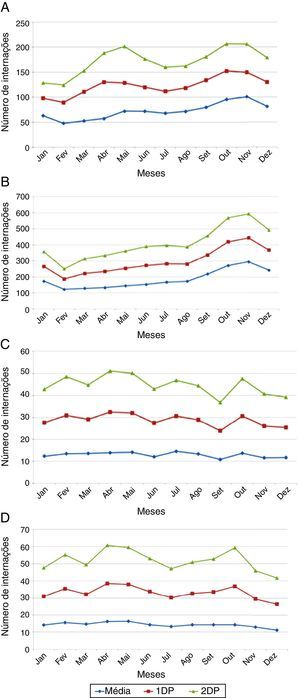
Em adultos com mais de 65 anos, as médias mensais de internações relacionadas ao herpes‐zoster não apresentaram variação. As médias e os desvios padrão dos números mensais de internações de 2008 a 2013 estão descritos na figura 2A‐D.
DiscussãoEste estudo demonstrou morbidez e mortalidade significativas por varicela no Brasil antes da introdução da SCRV no Programa Nacional de Imunizações (PNI). Os dados sugerem que a varicela não deve ser considerada uma doença benigna, pois apresenta complicações frequentes. Embora a maioria dos óbitos tenha ocorrido em crianças de 1‐4 anos, a taxa de mortalidade é mais alta em neonatos com menos de 1 ano. Os dados sugerem que o risco de uma criança falecer de varicela é duas vezes maior em neonatos com menos de 1 ano do que em crianças de 1‐4 anos. Contudo, a vacina SCRV no PNI é fornecida a crianças de 15 meses. Assim, a varicela não seria prevenida em neonatos mais novos. Em alguns países que praticam a vacinação universal contra a varicela, a vacina é administrada mais cedo, aos 12 meses, como nos Estados Unidos, no Canadá, no Japão, na China e no Uruguai.6,11–14 É importante ressaltar que a coorte de crianças imunizadas aumentará progressivamente nos próximos anos, putativamente levará à redução da circulação do VVZ entre crianças imunizadas, o que beneficiará crianças com menos de 1 ano pela imunidade coletiva, conforme descrito por Streng et al.15 Contudo, a possível reativação do VVZ em adultos representa um repositório contínuo de cepas selvagens. Nesse caso, crianças com menos de 15 meses estão suscetíveis a adquirir a infecção.
Apesar de ter havido uma redução significativa nas internações relacionadas a varicela em países que adotaram a vacinação universal, como os EUA, ainda têm sido relatados surtos, mesmo entre populações com cobertura elevada de uma dose. Nos EUA, o Comitê Consultivo de Práticas de Imunização aprovou a recomendação da vacinação de rotina de duas doses contra a varicela em 2006, que seria 10 anos após o programa de vacinação contra a varicela de uma dose ter começado nos Estados Unidos. Além disso, a 2ª dose foi recomendada não apenas para os surtos, mas também para aumentar a proteção contra a varicela.16 As consequências da falha da vacina são possivelmente graves devido à transmissão contínua de VVZ selvagem e da acumulação de jovens adultos suscetíveis.17 Consequentemente, foi considerada a necessidade de uma segunda dose da vacina contra a varicela em alguns países.18 Contudo, a elevada morbidez e mortalidade em crianças de 1‐4 anos no Brasil demonstra os possíveis impactos positivos de uma única dose de SCRV aplicada até os 15 meses.
De acordo com Goldman e King,19 houve um aumento significativo na incidência de herpes‐zoster ao longo dos anos, após a implantação da vacinação universal contra o VVZ nos EUA, simultaneamente com a diminuição da incidência de varicela. Portanto, argumentou‐se que o possível aumento na incidência de herpes‐zoster pode anular os benefícios da vacina.19,20 Esse aumento estaria relacionado à baixa circulação de VVZ selvagem em uma população vacinada, o que representa uma vacinação de reforço que aumenta a resposta imune ao VVZ e previne a reativação viral no sistema nervoso.19,21 Os dados deste estudo fornecem uma base para comparação do período pós‐vacinação.
Apesar da existência de campanhas de vacinação em vários países desenvolvidos e em desenvolvimento, resta uma pergunta: vacinar ou não crianças contra a varicela?
A varicela no Brasil não pode ser considerada uma doença benigna, pois é responsável por uma média de 155 óbitos por ano, o que representa quase um óbito a cada dois dias pela doença, gera uma média de 34 internações por dia. Na população de crianças entre 1‐4 anos, foi relatada uma média de nove internações por dia pela doença. Esse cenário nos leva a acreditar que a varicela, em países em desenvolvimento, em conjunto com fatores como pobreza, desnutrição e falta de acesso a assistência médica, frequentemente exige internação, possivelmente resulta em óbito. Além disso, os custos indiretos da doença, como licença do trabalho dos pais e despesas com cuidador, devem ser levados em consideração. O custo médio estimado da perda de um dia de trabalho de uma mãe com um filho menor de 15 anos com varicela era de US$5,90 em 2004.22
Deve‐se enfatizar que, durante 14 anos, a vacinação contra a varicela foi oferecida em clínicas de vacinação particulares amplamente usadas pela população das classes média e alta no Brasil. Contudo, houve circulação de VVZ selvagem nesse período, o que expôs a população vacinada aos reforços que impediam a perda de imunidade após a vacinação.
No período pré‐vacinação, a varicela sempre foi associada a um número significativo de óbitos e internações. A introdução do SCRV no PNI criou expectativas de um impacto positivo, principalmente sobre crianças.
As taxas de mortalidade específicas por varicela variam em diferentes anos. Essas taxas em neonatos com menos de um ano são duas vezes maiores do que as observadas em crianças de 1‐4 anos idade, embora o número absoluto seja maior na faixa de 1 a 4 anos. Isso indica que uma criança com menos de 1 ano tem o dobro do risco de falecer de catapora em comparação com uma criança de 1‐4 anos. As taxas de mortalidade específicas por varicela são mais altas nas regiões Centro‐Oeste e Sudeste. As internações relacionadas ao VVZ apresentam uma distribuição bimodal com picos em crianças com menos de 9 anos e pessoas com mais de 80 anos. Existe um padrão sazonal nas internações por varicela em crianças, com média mensal mais alta de setembro a novembro, não observado em adultos, o que pode estar relacionado à reativação não sazonal do VVZ associada ao herpes‐zoster.
A pesquisa apresenta algumas limitações por ser um estudo retrospectivo que usa dados secundários. Além disso, o diagnóstico da varicela e do herpes‐zoster é totalmente clínico e a varicela não era uma doença de notificação compulsória em qualquer dos estados brasileiros até setembro de 2013. Portanto, é possível que a doença seja subdiagnosticada, principalmente nas regiões do país nas quais o acesso a programas de saúde ainda é precário.
Como a varicela no Brasil é uma doença que leva a quase um óbito a cada dois dias e apresenta um prognóstico pior em países em desenvolvimento, concluímos que a vacinação universal contra a varicela é totalmente justificada no país. Um acompanhamento epidemiológico dos avanços nos casos de varicela e herpes‐zoster que possivelmente ocorrerão com mais frequência nos próximos anos é essencial e é vital discutir a inclusão de uma segunda dose de vacina contra a varicela no PNI.
FinanciamentoFundação Oswaldo Cruz (Fiocruz).
Conflitos de interesseCarvalho‐Costa FA é pesquisador de saúde pública na Fundação Oswaldo Cruz (Fiocruz). Os outros autores declaram não haver conflitos de interesse.
Como citar este artigo: Martino Mota A, Carvalho‐Costa FA. Varicella zoster virus related deaths and hospitalizations before the introduction of universal vaccination with the tetraviral vaccine. J Pediatr (Rio J). 2016;92:361–6.