To describe the epidemiological situation of tuberculosis in children under 19 years of age in Brazil and to review the latest publications on disease risk, diagnosis, treatment, and prevention.
Source of dataNotifiable Diseases Information System (2018), World Health Organization estimates, and PubMed articles selected using the descriptor “Tuberculosis,” delimited by type of study, period, age, and language.
Synthesis of dataIn 2018, in Brazil, 9.4% of notifications were in children under 19 years. The pulmonary form predominated in 80.1% of the cases. The cure rate was 76.8%, lethality was 0.8%, and abandonment was 10.4%. The prevalence of drug‐resistant tuberculosis (2011 to 2016) was 0.5%.It has been found that the risk of disease can reach up to 56% in children under 5 years, influenced by helminth co‐infections, malaria, chronic viral infections, live attenuated virus vaccines, and hypovitaminosis D. Exposure to a bacilliferous patient for periods shorter than 30 minutes is sufficient for the development of infection and/or disease. In Brazil, microbiological screening is recommended, but the use of the scoring system, modified in 2019, has been maintained. Studies on infection detection have supported the use of the tuberculin skin test. In the treatment, the great advance was the introduction of dispersible formulations, adjustment of the recommended doses, and shortened regimens for latent infection. Several vaccine studies (stages 1–3) are ongoing, but no BCG‐licensed substitute has been implemented yet.
ConclusionsThere has been progress in treatment, but major challenges need to be overcome to improve diagnosis, monitoring, and outcome of cases, aiming to eliminate tuberculosis.
Descrever a situação epidemiológica da tuberculose nos menores de 19 anos no Brasil e revisar as últimas publicações sobre risco de adoecimento, diagnóstico, tratamento e prevenção.
Fonte dos dadosBanco de notificação Brasil (2018), estimativas da Organização Mundial da Saúde e artigos do PubMed selecionados pelo descritor Tuberculosis, delimitaram‐se tipo de estudo, período, idade e língua.
Síntese dos dadosEm 2018, no Brasil, 9,4% das notificações foram nos menores de 19 anos. Predominou a forma pulmonar em 80,1% dos casos. A taxa de cura foi de 76,8%, letalidade 0,8% e abandono 10,4%. A prevalência de tuberculose drogarresistente (2011 a 2016) foi 0,5%. Encontrou‐se que o risco de adoecimento pode chegar até 56%, nos menores de cinco anos, influenciado por coinfecções com helmintos, malária, infecções virais crônicas, vacinas de vírus vivos atenuados e hipovitaminose D. A exposição ao doente bacilífero por períodos menores de 30 minutos é suficiente para o desenvolvimento de infecção e/ou doença. No Brasil, recomenda‐se a pesquisa microbiológica, porém mantem‐se o uso do Sistema de Pontuação, modificado em 2019. Estudos sobre detecção da infecção respaldaram o uso da prova tuberculínica. No tratamento, o grande avanço foi a introdução das formulações dispersíveis, adequação das doses preconizadas e esquemas encurtados para infecção latente. Vários estudos de vacinas (fases de 1 a 3) estão em andamento, mas ainda sem substituto licenciado para a BCG.
ConclusõesObservaram‐se progressos no tratamento, porém ainda há grandes desafios para melhorar o diagnóstico, monitoramento e desfecho dos casos em busca da eliminação da tuberculose.
Pela primeira vez na história, em setembro de 2018, a tuberculose (TB) foi tema central na reunião de alto nível da ONU, com objetivo de traçar estratégias para eliminação da doença até 2030. Nessa, salientou‐se a necessidade de aprimoramento das medidas de prevenção, diagnóstico e tratamento dessa doença, que continua com altas taxas de letalidade em nível mundial. Na faixa etária das crianças e adolescentes, reiterou‐se a importância de melhorar as ferramentas diagnósticas para diminuir o número de casos não diagnosticados, denominados missing cases, e também medicamentos mais adequados, especialmente para as crianças.1
A OMS estimou 1.000.000 de casos novos de tuberculose nos menores de 14 anos em 2017. Desses, 55% não foram diagnosticados e/ou notificados. Nos menores de 5 anos, esse percentual foi de 69%, enquanto nos demais foi de 40%. Ao avaliar os óbitos, 80% ocorreram em menores de 5 anos e em 96% desses as crianças não tiveram acesso ao tratamento anti‐TB.2
Com intuito de melhorar esses indicadores, a OMS publicou o Roadmap towards ending TB in children and adolescents. Esse orienta o estreitamento das ações dos programas de controle da TB com a rede de cuidado de saúde da criança, atenção primária à saúde, nutrição, HIV, imunização, entre outros. O objetivo é dar ênfase a novas ferramentas de prevenção, diagnóstico e tratamento, com destaque aos medicamentos dispersíveis para as crianças.2 Enfatiza também a parceria com a sociedade civil, comunidades e famílias afetadas pela TB para dar relevância e diminuir o estigma dessa doença tão antiga quanto a história da humanidade.
Diante do exposto, descreveu‐se a situação epidemiológica da TB nos menores de 19 anos, bem como as últimas publicações a respeito do risco de adoecimento, diagnóstico, tratamento da doença ativa e latente. Procurou‐se, assim, olhar a TB na infância e adolescência sob perspectivas diferentes.
MetodologiaPara descrever a situação epidemiológica da TB em menores de 19 anos foi avaliado o banco de notificação do Brasil (2017–2018), dados não publicados, e usadas estimativas feitas pela OMS.2
Foi feita uma busca no PubMed com o descritor Tuberculosis, encontraram‐se 253.156 artigos. Ao delimitar a pesquisa com artigos originais, estudos clínicos ou metanálises, publicados de 01/01/2018 a 30/06/2019, nos menores de 18 anos, humanos, em inglês, espanhol ou português, resultaram 104 artigos. Após avaliação de todos os resumos, selecionaram‐se 26 artigos que se referiam a tuberculose em crianças e adolescentes. Durante a leitura desses, incluíram‐se alguns artigos citados nessas referências e recomendações para o Controle da TB do Ministério da Saúde (MS) do Brasil e da OMS.
Esse trabalho foi aprovado pelo Comitê de Ética em Pesquisa em Seres Humanos do Complexo Hospital de Clínicas da Universidade Federal do Paraná sob n° do CAE 17876919.8.0000.0096.
Epidemiologia da TB nas crianças e nos adolescentes no BrasilEstimativas gerais da OMS mostram que o Brasil não detectou em 2017 aproximadamente 12 mil casos. Desses, 8.500 (71%) entre os menores de 14 anos, a saber, 3.500 abaixo de 4 anos e 5. 000 entre 5 e 14 anos.3 Uma das possibilidades para essa subdetecção é a dificuldade no diagnóstico. Esses dados mostram a importância de priorizar ações para essa faixa etária, expandir a descentralização e capacitar os profissionais dos serviços de atenção primária à saúde, no diagnóstico e tratamento desses casos.4
Em 2018, o Brasil notificou 75.709 casos novos de TB, entre eles 1.552 (3,3%) nos menores de 14 anos. Destaca‐se que a OMS estima que o percentual de casos nessa faixa etária seria de 10% do total de casos notificados, para os 30 países de alta carga da doença, inclusive o Brasil.3 Entretanto, são estimativas globais e não há estudos nacionais sobre esses dados, o que merece cautela na sua interpretação.
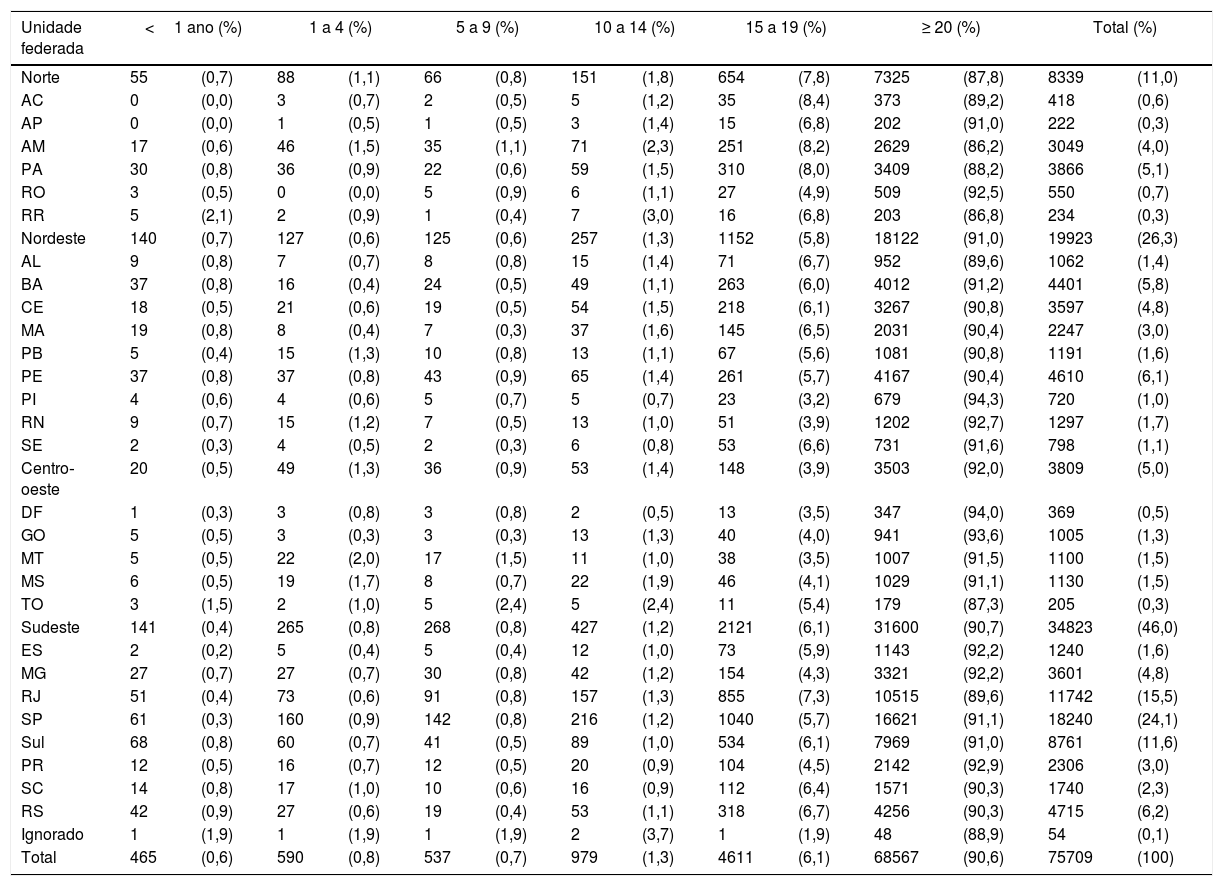
A distribuição dos casos novos notificados no Brasil (2018), conforme faixa etária e unidades federadas, encontra‐se na tabela 1.
Distribuição de casos novos de tuberculose no Brasil, conforme faixa etária e unidades federadas, 2018
| Unidade federada | <1 ano (%) | 1 a 4 (%) | 5 a 9 (%) | 10 a 14 (%) | 15 a 19 (%) | ≥ 20 (%) | Total (%) | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Norte | 55 | (0,7) | 88 | (1,1) | 66 | (0,8) | 151 | (1,8) | 654 | (7,8) | 7325 | (87,8) | 8339 | (11,0) |
| AC | 0 | (0,0) | 3 | (0,7) | 2 | (0,5) | 5 | (1,2) | 35 | (8,4) | 373 | (89,2) | 418 | (0,6) |
| AP | 0 | (0,0) | 1 | (0,5) | 1 | (0,5) | 3 | (1,4) | 15 | (6,8) | 202 | (91,0) | 222 | (0,3) |
| AM | 17 | (0,6) | 46 | (1,5) | 35 | (1,1) | 71 | (2,3) | 251 | (8,2) | 2629 | (86,2) | 3049 | (4,0) |
| PA | 30 | (0,8) | 36 | (0,9) | 22 | (0,6) | 59 | (1,5) | 310 | (8,0) | 3409 | (88,2) | 3866 | (5,1) |
| RO | 3 | (0,5) | 0 | (0,0) | 5 | (0,9) | 6 | (1,1) | 27 | (4,9) | 509 | (92,5) | 550 | (0,7) |
| RR | 5 | (2,1) | 2 | (0,9) | 1 | (0,4) | 7 | (3,0) | 16 | (6,8) | 203 | (86,8) | 234 | (0,3) |
| Nordeste | 140 | (0,7) | 127 | (0,6) | 125 | (0,6) | 257 | (1,3) | 1152 | (5,8) | 18122 | (91,0) | 19923 | (26,3) |
| AL | 9 | (0,8) | 7 | (0,7) | 8 | (0,8) | 15 | (1,4) | 71 | (6,7) | 952 | (89,6) | 1062 | (1,4) |
| BA | 37 | (0,8) | 16 | (0,4) | 24 | (0,5) | 49 | (1,1) | 263 | (6,0) | 4012 | (91,2) | 4401 | (5,8) |
| CE | 18 | (0,5) | 21 | (0,6) | 19 | (0,5) | 54 | (1,5) | 218 | (6,1) | 3267 | (90,8) | 3597 | (4,8) |
| MA | 19 | (0,8) | 8 | (0,4) | 7 | (0,3) | 37 | (1,6) | 145 | (6,5) | 2031 | (90,4) | 2247 | (3,0) |
| PB | 5 | (0,4) | 15 | (1,3) | 10 | (0,8) | 13 | (1,1) | 67 | (5,6) | 1081 | (90,8) | 1191 | (1,6) |
| PE | 37 | (0,8) | 37 | (0,8) | 43 | (0,9) | 65 | (1,4) | 261 | (5,7) | 4167 | (90,4) | 4610 | (6,1) |
| PI | 4 | (0,6) | 4 | (0,6) | 5 | (0,7) | 5 | (0,7) | 23 | (3,2) | 679 | (94,3) | 720 | (1,0) |
| RN | 9 | (0,7) | 15 | (1,2) | 7 | (0,5) | 13 | (1,0) | 51 | (3,9) | 1202 | (92,7) | 1297 | (1,7) |
| SE | 2 | (0,3) | 4 | (0,5) | 2 | (0,3) | 6 | (0,8) | 53 | (6,6) | 731 | (91,6) | 798 | (1,1) |
| Centro‐oeste | 20 | (0,5) | 49 | (1,3) | 36 | (0,9) | 53 | (1,4) | 148 | (3,9) | 3503 | (92,0) | 3809 | (5,0) |
| DF | 1 | (0,3) | 3 | (0,8) | 3 | (0,8) | 2 | (0,5) | 13 | (3,5) | 347 | (94,0) | 369 | (0,5) |
| GO | 5 | (0,5) | 3 | (0,3) | 3 | (0,3) | 13 | (1,3) | 40 | (4,0) | 941 | (93,6) | 1005 | (1,3) |
| MT | 5 | (0,5) | 22 | (2,0) | 17 | (1,5) | 11 | (1,0) | 38 | (3,5) | 1007 | (91,5) | 1100 | (1,5) |
| MS | 6 | (0,5) | 19 | (1,7) | 8 | (0,7) | 22 | (1,9) | 46 | (4,1) | 1029 | (91,1) | 1130 | (1,5) |
| TO | 3 | (1,5) | 2 | (1,0) | 5 | (2,4) | 5 | (2,4) | 11 | (5,4) | 179 | (87,3) | 205 | (0,3) |
| Sudeste | 141 | (0,4) | 265 | (0,8) | 268 | (0,8) | 427 | (1,2) | 2121 | (6,1) | 31600 | (90,7) | 34823 | (46,0) |
| ES | 2 | (0,2) | 5 | (0,4) | 5 | (0,4) | 12 | (1,0) | 73 | (5,9) | 1143 | (92,2) | 1240 | (1,6) |
| MG | 27 | (0,7) | 27 | (0,7) | 30 | (0,8) | 42 | (1,2) | 154 | (4,3) | 3321 | (92,2) | 3601 | (4,8) |
| RJ | 51 | (0,4) | 73 | (0,6) | 91 | (0,8) | 157 | (1,3) | 855 | (7,3) | 10515 | (89,6) | 11742 | (15,5) |
| SP | 61 | (0,3) | 160 | (0,9) | 142 | (0,8) | 216 | (1,2) | 1040 | (5,7) | 16621 | (91,1) | 18240 | (24,1) |
| Sul | 68 | (0,8) | 60 | (0,7) | 41 | (0,5) | 89 | (1,0) | 534 | (6,1) | 7969 | (91,0) | 8761 | (11,6) |
| PR | 12 | (0,5) | 16 | (0,7) | 12 | (0,5) | 20 | (0,9) | 104 | (4,5) | 2142 | (92,9) | 2306 | (3,0) |
| SC | 14 | (0,8) | 17 | (1,0) | 10 | (0,6) | 16 | (0,9) | 112 | (6,4) | 1571 | (90,3) | 1740 | (2,3) |
| RS | 42 | (0,9) | 27 | (0,6) | 19 | (0,4) | 53 | (1,1) | 318 | (6,7) | 4256 | (90,3) | 4715 | (6,2) |
| Ignorado | 1 | (1,9) | 1 | (1,9) | 1 | (1,9) | 2 | (3,7) | 1 | (1,9) | 48 | (88,9) | 54 | (0,1) |
| Total | 465 | (0,6) | 590 | (0,8) | 537 | (0,7) | 979 | (1,3) | 4611 | (6,1) | 68567 | (90,6) | 75709 | (100) |
Fonte: Sistema de Informação de Agravos de Notificação/Secretaria de Vigilância em Saúde/Ministério da Saúde, Brasil.
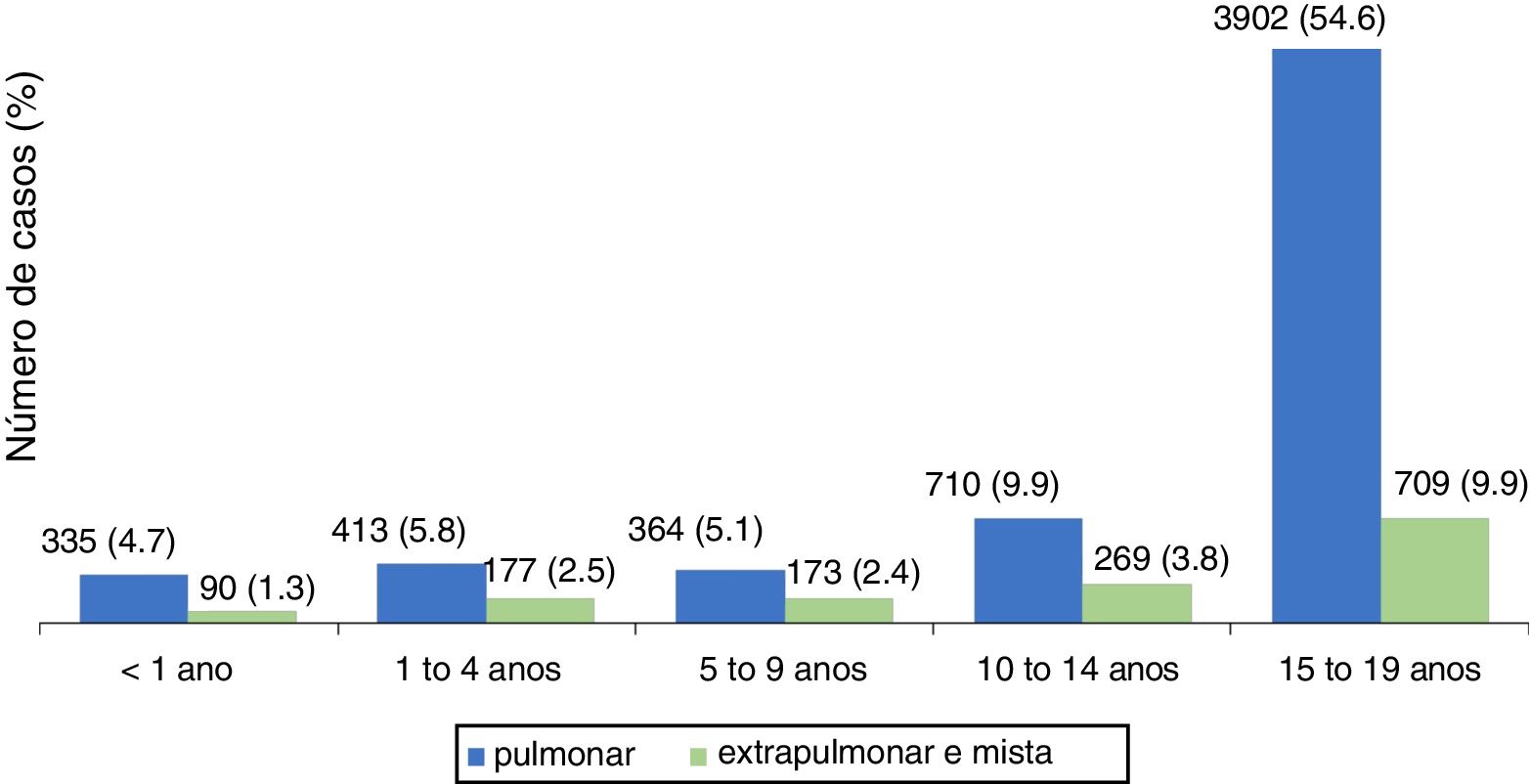
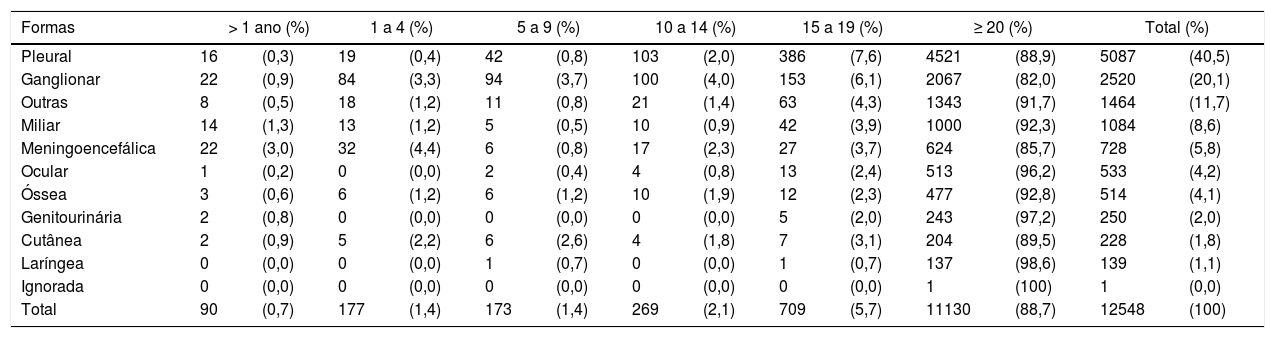
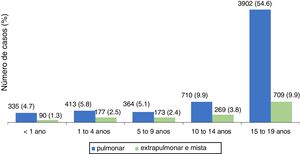
Nos menores de 19 anos, predominou a forma pulmonar, responsável por 80,1% dos casos. A figura 1 mostra a distribuição, segundo tipo de TB, por faixa etária. A distribuição das formas extrapulmonares, menos frequentes, variou conforme a idade. Nos menores de um ano, as formas meníngea e ganglionar apresentaram número de casos semelhantes, enquanto nas demais há predomínio de forma ganglionar, excluídos os adolescentes em que a forma pleural é a principal. A distribuição dos casos extrapulmonares e/ou mistos (pulmonar associado a extrapulmonar) encontra‐se na tabela 2.
Distribuição dos casos novos de tuberculose extrapulmonar e mista, por faixa etária, Brasil, 2018
| Formas | > 1 ano (%) | 1 a 4 (%) | 5 a 9 (%) | 10 a 14 (%) | 15 a 19 (%) | ≥ 20 (%) | Total (%) | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pleural | 16 | (0,3) | 19 | (0,4) | 42 | (0,8) | 103 | (2,0) | 386 | (7,6) | 4521 | (88,9) | 5087 | (40,5) |
| Ganglionar | 22 | (0,9) | 84 | (3,3) | 94 | (3,7) | 100 | (4,0) | 153 | (6,1) | 2067 | (82,0) | 2520 | (20,1) |
| Outras | 8 | (0,5) | 18 | (1,2) | 11 | (0,8) | 21 | (1,4) | 63 | (4,3) | 1343 | (91,7) | 1464 | (11,7) |
| Miliar | 14 | (1,3) | 13 | (1,2) | 5 | (0,5) | 10 | (0,9) | 42 | (3,9) | 1000 | (92,3) | 1084 | (8,6) |
| Meningoencefálica | 22 | (3,0) | 32 | (4,4) | 6 | (0,8) | 17 | (2,3) | 27 | (3,7) | 624 | (85,7) | 728 | (5,8) |
| Ocular | 1 | (0,2) | 0 | (0,0) | 2 | (0,4) | 4 | (0,8) | 13 | (2,4) | 513 | (96,2) | 533 | (4,2) |
| Óssea | 3 | (0,6) | 6 | (1,2) | 6 | (1,2) | 10 | (1,9) | 12 | (2,3) | 477 | (92,8) | 514 | (4,1) |
| Genitourinária | 2 | (0,8) | 0 | (0,0) | 0 | (0,0) | 0 | (0,0) | 5 | (2,0) | 243 | (97,2) | 250 | (2,0) |
| Cutânea | 2 | (0,9) | 5 | (2,2) | 6 | (2,6) | 4 | (1,8) | 7 | (3,1) | 204 | (89,5) | 228 | (1,8) |
| Laríngea | 0 | (0,0) | 0 | (0,0) | 1 | (0,7) | 0 | (0,0) | 1 | (0,7) | 137 | (98,6) | 139 | (1,1) |
| Ignorada | 0 | (0,0) | 0 | (0,0) | 0 | (0,0) | 0 | (0,0) | 0 | (0,0) | 1 | (100) | 1 | (0,0) |
| Total | 90 | (0,7) | 177 | (1,4) | 173 | (1,4) | 269 | (2,1) | 709 | (5,7) | 11130 | (88,7) | 12548 | (100) |
Fonte: Sistema de Informação de Agravos de Notificação/Secretaria de Vigilância em Saúde/Ministério da Saúde, Brasil.
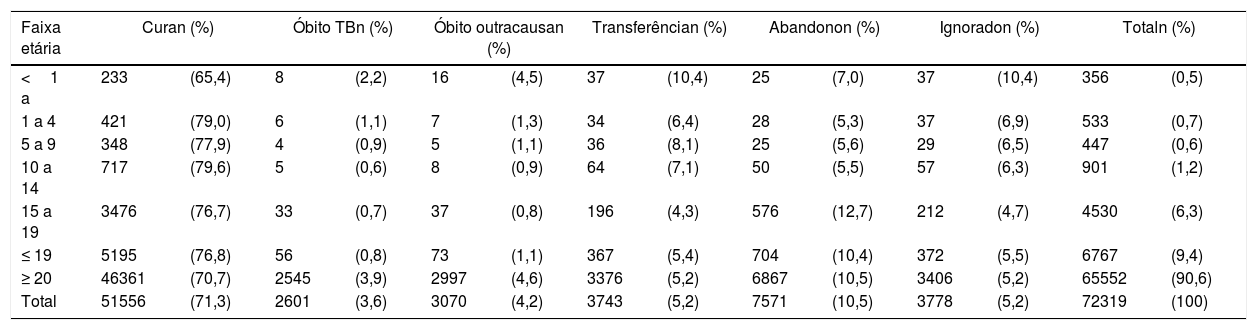
Quanto às situações de encerramento dos casos notificados em 2017, os menores de um ano apresentaram cura de 65%, abandono de 7% e letalidade de 2%. Destaca‐se que a letalidade nessa idade é o dobro quando comparada às demais faixas etárias da infância e adolescência, mostra a gravidade da doença nesse grupo. Ressalta‐se que o abandono apresentou sua maior taxa nos adolescentes, de 12,7%, inclusive acima dos maiores de 20 anos, e reflete a importância do tratamento diretamente observado (TDO) nessa população. Demais desfechos encontram‐se na tabela 3.
Desfecho do tratamento dos casos novos de tuberculose, segundo faixa etária, Brasil, 2017
| Faixa etária | Curan (%) | Óbito TBn (%) | Óbito outracausan (%) | Transferêncian (%) | Abandonon (%) | Ignoradon (%) | Totaln (%) | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| <1 a | 233 | (65,4) | 8 | (2,2) | 16 | (4,5) | 37 | (10,4) | 25 | (7,0) | 37 | (10,4) | 356 | (0,5) |
| 1 a 4 | 421 | (79,0) | 6 | (1,1) | 7 | (1,3) | 34 | (6,4) | 28 | (5,3) | 37 | (6,9) | 533 | (0,7) |
| 5 a 9 | 348 | (77,9) | 4 | (0,9) | 5 | (1,1) | 36 | (8,1) | 25 | (5,6) | 29 | (6,5) | 447 | (0,6) |
| 10 a 14 | 717 | (79,6) | 5 | (0,6) | 8 | (0,9) | 64 | (7,1) | 50 | (5,5) | 57 | (6,3) | 901 | (1,2) |
| 15 a 19 | 3476 | (76,7) | 33 | (0,7) | 37 | (0,8) | 196 | (4,3) | 576 | (12,7) | 212 | (4,7) | 4530 | (6,3) |
| ≤ 19 | 5195 | (76,8) | 56 | (0,8) | 73 | (1,1) | 367 | (5,4) | 704 | (10,4) | 372 | (5,5) | 6767 | (9,4) |
| ≥ 20 | 46361 | (70,7) | 2545 | (3,9) | 2997 | (4,6) | 3376 | (5,2) | 6867 | (10,5) | 3406 | (5,2) | 65552 | (90,6) |
| Total | 51556 | (71,3) | 2601 | (3,6) | 3070 | (4,2) | 3743 | (5,2) | 7571 | (10,5) | 3778 | (5,2) | 72319 | (100) |
Fonte: Sistema de Informação de Agravos de Notificação/Secretaria de Vigilância em Saúde/Ministério da Saúde, Brasil.
A prevenção da tuberculose ativa por meio do tratamento da infecção latente de tuberculose (ILTB) é uma das principais estratégias para a redução da incidência da doença e o alcance das metas da Estratégia pelo Fim da Tuberculose.3
A carga global da ILTB não é conhecida e é estimada em até um quarto da população mundial. No entanto, há grande variação por país e faixa etária.5,6 No Brasil, seu tratamento não é de notificação compulsória em todas as unidades federadas, porém é recomendado notificar em ficha específica nacional.7 Recentemente, implantou‐se no país o Sistema da Notificação de Tratamento da ILTB, para monitoramento, avaliação e vigilância desses casos, o que permitirá conhecer a magnitude desse agravo.
A OMS estima que em 2014, 25.000 crianças e adolescentes até 15 anos adoeceram por TB drogarresistente (TBDR) e que menos de 10% tiveram acesso ao tratamento. Outra questão preocupante é que não há dados de TBDR, desagregados por idade na faixa etária pediátrica e adolescência reportados a OMS, o que dificulta o conhecimento da real extensão dessa doença.2
No Brasil existe o Sistema de Informação de Tratamentos Especiais da Tuberculose (Sitetb) desde 2013. A avaliação dos casos notificados, em menores de 19 anos, de 2011 a 2016, informou 181 casos de TBDR, o que corresponde uma prevalência de 0,5% do total de casos notificados de TB na mesma faixa etária e no mesmo período. Ressalta‐se que os casos de TBDR foram responsáveis por 67% das notificações no Sitetb entre os menores de 19 anos e entre os casos de resistência a maioria era multirresistente (88%).8
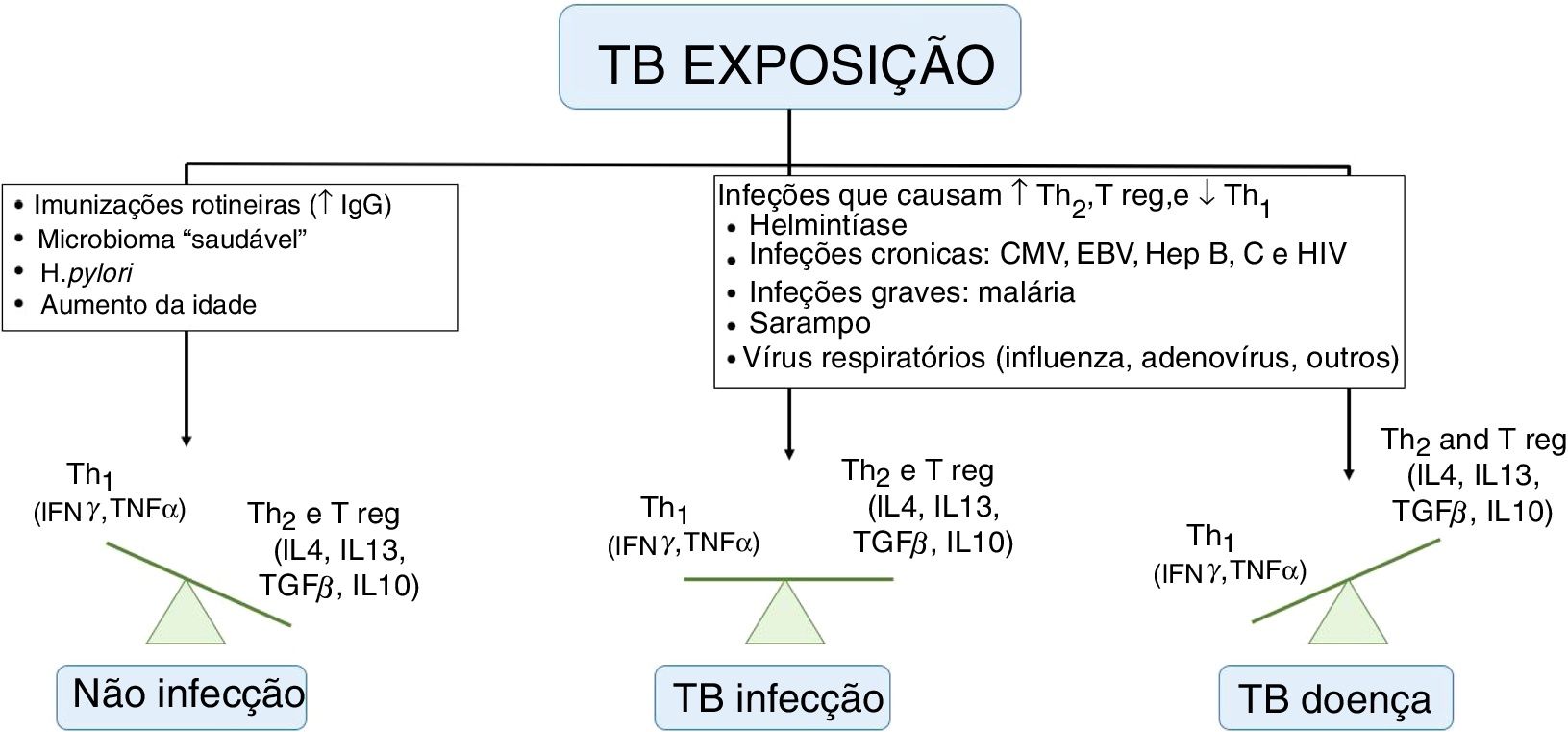
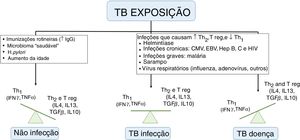
Risco de adoecimentoSabe‐se que nem toda criança com infecção latente desenvolverá TB ativa. Os menores de cinco anos ou portadores de imunodeficiência apresentam um risco aumentado de progressão para doença, porém a compreensão dos fatores de risco para que isso ocorra é limitada. Whittaker et al. descreveram que a infecção por outro patógeno (vírus, bactérias, fungos e parasitas) é o processo mais implicado, para essa progressão, ao desequilibrar a resposta imunológica tipo Th1, Th2 e T reguladores (fig. 2). Muitas dessas doenças têm distribuições geográficas sobrepostas à TB, o que dificulta estabelecer a correlação de causalidade. As vacinas, principalmente de vírus vivo atenuado, por estimular a produção de imunoglobulinas e interferon gama, podem colaborar e diminuir o risco de adoecimento.9
Fatores que influenciam a resposta imune da tuberculose.
TB, tuberculose; IgG, imunoglublinas G; Th, Linfócito T helper; Treg, T regulador; IL, interleucina; IFN, Interferon; TNF, fator de necrose tumoral; CMV, citomegalovírus; EBV, Epstein‐Barr; Hep, hepatite.
Adaptado de Whittaker et al.9
O tempo de evolução para doença é descrito como de 5% a 10% durante toda a vida, 50% dos casos se concentram nos primeiros 2 a 5 anos após a infecção, são mais incidentes nos menores de 5 anos.10 Trauer et al. propõem que o risco de TB ativa após a infecção é maior do que as estimativas tradicionalmente aceitas, principalmente entre os menores de cinco anos, pode chegar em algumas projeções a até 56%.11
Estudos que avaliaram risco de doença dentre os contatos de países de diferentes rendas mostraram variadas taxas de TB ativa. Nos países de baixa/média renda o percentual foi 3,1%, enquanto nos de alta renda foi de 1,4%. Porém, em ambos, nos menores de cinco anos, os percentuais foram superiores (10,0% e 4,7% respectivamente).12
Outro ponto questionado em relação ao adoecimento está relacionado com o risco de infeção. Quanto tempo de contato seria necessário para um indivíduo se infectar? Normalmente os guidelines não tem essa resposta. Deve‐se analisar cada caso, observarem‐se carga bacilar do caso fonte e o ambiente: a ventilação, o tamanho do espaço, a proximidade do caso e a duração do contato. Esse último item é um dos mais difíceis de se estabelecer, pois depende diretamente dos anteriores. O guideline australiano (2015) atribuiu 8 horas como o tempo mínimo para um indivíduo se infectar, deve ser considerado um período menor quando pessoas mais suscetíveis estão envolvidas ou participam de procedimentos de alta exposição (indução de tosse ou intubação).13 As recomendações da WHO (2013) consideram o período de risco em voos, aqueles com duração acima de 8 horas.14 Porém, em 2017, Luzzati et al. descreveram a investigação de um surto ocorrido em Trieste, na Itália, com identificação de casos secundários em crianças, nos quais o contato com o caso fonte foi ocasional, num período menor de 30 minutos.15 Isso nos leva a questionar a necessidade de contatos duradouros para que o indivíduo se infecte.
Outro tema de estudo é a correlação da deficiência de vitamina D e TB.16,17 Essa associação já está estabelecida, porém estudos são necessários para definir se a deficiência seria causa ou consequência, como também se a suplementação da vitamina D influenciaria em evitar a progressão para doença ou melhoraria a resposta ao tratamento dos doentes.
Diagnóstico da TB pulmonarA TB é classificada em forma pulmonar, extrapulmonar e/ou mista,7 assim as ferramentas diagnósticas variam de acordo com sua localização. A TB pulmonar é a mais prevalente e, portanto, será o foco desta revisão.
A fisiopatologia e a apresentação clínica da TB diferem de acordo com a idade. A OMS classifica como crianças até 14 anos, enquanto, no Brasil, por se basear nessas diferenças, considera‐se até 10 anos. Esse corte de idade define os fluxos de investigação e as condutas terapêuticas. As crianças apresentam quadro clínico inespecífico, semelhante a infecções habituais da infância, e são paucibacilares. Já os adolescentes (maiores de 10 anos) desenvolvem doença similar aos adultos, podem ter quadros bacilíferos. Dessa forma, de acordo com a diretriz do MS, o diagnóstico da TB pulmonar, no Brasil, varia conforme a idade.7
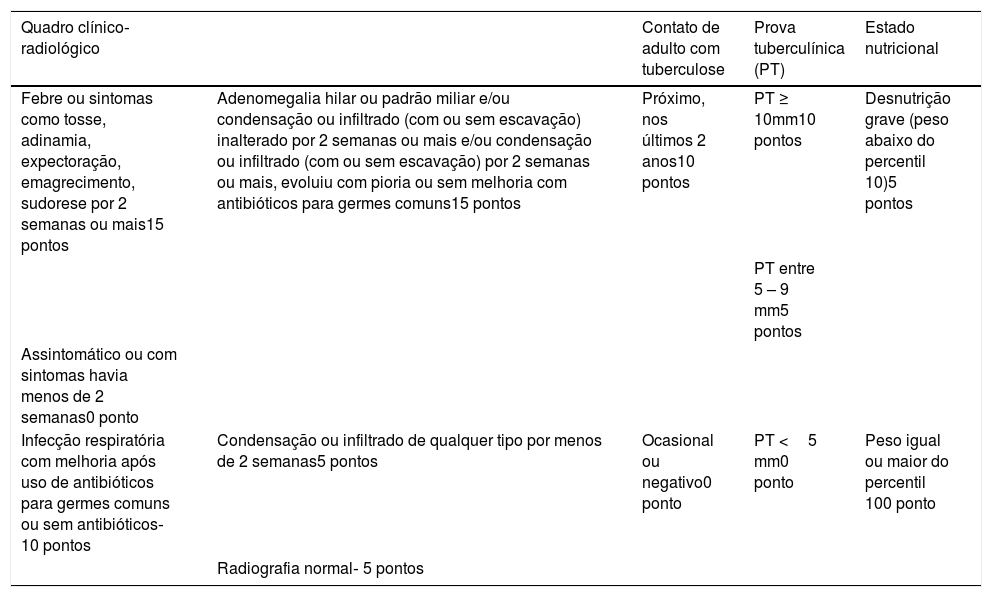
Nos menores de 10 anos, pelas paucibacilaridade e dificuldade de coleta de escarro, o diagnóstico é baseado num sistema de escore, que avalia a história clínica‐epidemiológica, resposta a prova tuberculínica (PT), radiografia de tórax e estado nutricional do paciente (tabela 4). Esse escore é dinâmico e avalia evolutivamente o caso, com pontuações diferentes de acordo com tempo de evolução e a resposta às terapêuticas para infecções habituais, adotado no Brasil desde 2002. É o esquema mais bem estudado, validado e com consistentes sensibilidades e especificidades dentre os diversos existentes no mundo.18 Porém, com a mudança da pontuação da PT, novos estudos devem ser desenvolvidos para avaliar suas atuais sensibilidade e especificidade.
Diagnóstico da tuberculose pulmonar em crianças e adolescentes com baciloscopia negativa ou TRM‐TB não detectado
| Quadro clínico‐radiológico | Contato de adulto com tuberculose | Prova tuberculínica (PT) | Estado nutricional | |
|---|---|---|---|---|
| Febre ou sintomas como tosse, adinamia, expectoração, emagrecimento, sudorese por 2 semanas ou mais15 pontos | Adenomegalia hilar ou padrão miliar e/ou condensação ou infiltrado (com ou sem escavação) inalterado por 2 semanas ou mais e/ou condensação ou infiltrado (com ou sem escavação) por 2 semanas ou mais, evoluiu com pioria ou sem melhoria com antibióticos para germes comuns15 pontos | Próximo, nos últimos 2 anos10 pontos | PT ≥ 10mm10 pontos | Desnutrição grave (peso abaixo do percentil 10)5 pontos |
| PT entre 5 – 9 mm5 pontos | ||||
| Assintomático ou com sintomas havia menos de 2 semanas0 ponto | ||||
| Infecção respiratória com melhoria após uso de antibióticos para germes comuns ou sem antibióticos‐ 10 pontos | Condensação ou infiltrado de qualquer tipo por menos de 2 semanas5 pontos | Ocasional ou negativo0 ponto | PT <5 mm0 ponto | Peso igual ou maior do percentil 100 ponto |
| Radiografia normal‐ 5 pontos |
Interpretação:
≥ 40 pontos (diagnóstico muito provável): recomenda‐se iniciar o tratamento.
30 a 35 pontos (diagnóstico possível): indicativo de tuberculose; orienta‐se iniciar o tratamento a critério médico.
<25 pontos (diagnóstico pouco provável): deve‐se prosseguir com a investigação na criança. Deverá ser feito diagnóstico diferencial com outras doenças pulmonares e podem ser empregados métodos complementares de diagnóstico, como baciloscopias e cultura de escarro induzido ou de lavado gástrico, broncoscopia, histopatológico de punções e outros exames de métodos rápidos.7
Os maiores de 10 anos, com quadros clínicos radiológicos similares aos adultos, têm seu diagnóstico estabelecido por exames microbiológicos. Porém, na ausência da confirmação bacteriológica, a recomendação do MS é que o diagnóstico deva ser baseado no sistema de escore.
A OMS orienta, sempre que possível, buscar a confirmação bacteriológica através da baciloscopia, cultura ou teste rápido molecular e não recomenda o “teste terapêutico”, que seria tentar estabelecer o diagnóstico da TB com a implantação do tratamento e o aguardo da melhoria clínica do paciente.19 Para o MS, o uso do escore propicia diagnóstico e intervenção terapêutica precoces, mesmo em unidades básicas de saúde, sem a necessidade de exames complementares mais sofisticados e/ou profissionais especializados.7 A confirmação bacteriológica deve sempre ser tentada, embora isso não deva retardar o início do tratamento.
Apesar da relevância do tema, pouco se publicou no último ano em relação a esse ponto específico. Outras opções de coletas clínicas, como o escarro induzido, string test o swab oral, são avaliadas, porém ainda existem muitos desafios e controvérsias, como discutidos recentemente por Reuter et al.20
A técnica da coleta de escarro induzido consiste na inalação hipertônica, como irritante das vias aéreas, previamente à coleta do material. Em indivíduos que conseguem expectorar espontaneamente, faz‐se a coleta do escarro, porém em crianças o material é coletado por aspirado nasal. A acurácia dessas amostras é similar à do lavado gástrico,20 porém apresenta a dificuldade de gerar aerossóis e por isso necessita de local com biossegurança adequada para sua coleta.
O string test ou Corda Dulce ainda apresenta sua eficácia não estabelecida. Nessa metodologia as crianças engolem uma cápsula com uma “corda” que permanece por uma hora no estômago e depois é retirada. Essa corda absorve as micobactérias e é enviada ao laboratório para os exames rotineiros, como baciloscopia, cultura e teste rápido molecular. Essa técnica apresenta algumas vantagens por não precisar de internação hospitalar, nem de condições de biossegurança para coleta. Seu inconveniente é que nem todas as crianças conseguem engolir as cápsulas. Porém novos estudos precisam ser feitos a esse respeito para demonstrar a tolerabilidade e acurácia do método.21 O swab oral tem sido estudado como uma opção promissora, porém com estudos apenas em adultos.22–24
Microbiologicamente o teste rápido molecular ainda não conseguiu superar a cultura para diagnóstico da tuberculose pulmonar na infância, porém, pela rapidez do resultado em relação à cultura, quando disponível, sempre deve ser feito. Essa técnica foi atualmente modificada com a produção do novo cartucho, o GeneXpert Ultra, que se demonstrou mais sensível e melhorou o diagnóstico principalmente em populações com HIV, crianças menores de 10 anos e na tuberculose extrapulmonar.25
A PT apresenta várias limitações, como técnica de aplicação, resultado leitor dependente, necessidade de duas visitas para o teste, valores de referência diferentes na literatura para considerar o exame positivo, possibilidade de interferência com outras micobactérias, principalmente o M. bovis vacinal, e nos últimos anos, a falta do insumo (PPD‐RT 23). Diante disso, testes mais sensíveis e específicos estão em estudo. Atualmente, os ensaios de liberação de interferon gama (IGRA) são os mais promissores, porém com limitações de uso nos menores de 2 a 5 anos pela baixa taxa de concordância com a PT e altos índices de indeterminados. Além disso, apresenta alto custo, necessidade de maior infraestrutura laboratorial e não mostrou superioridade em qualquer na comparação com a PT. Velasco‐Arnaiz et al. confrontaram os testes em menores de 5 anos e concluíram que em populações não vacinadas não há necessidade de se fazer ambos, pela alta concordância entre eles. Entre as crianças vacinadas, a discordância foi maior (κ=0,190), não se conseguiu estabelecer se os casos eram infectados por outras micobactérias ou pelo M. tuberculosis. Dessa forma, na presença de discordância, os autores sugerem considerar a criança como infectada. Nesse estudo não se evidenciou diferença nos resultados entre pacientes infectados e doentes, nem houve sensibilidade maior do IGRA, em relação a PT, nos doentes.26
Aggerbeck et al., em 2018 publicaram um estudo de fase 3 com um novo teste tuberculínico, o C‐Tb (Statens Serum Institut, Copenhagem, Dinamarca). É um teste de pele proposto para diagnóstico da ILTB, para superar algumas dificuldades da PT habitual com o PPD RT 23 e os IGRAs. É aplicado e lido da mesma forma que a PT, composto pelos antígenos mais específicos, ESAT‐6 e CFP‐10, os mesmos do IGRAs. O corte de positividade é universal, de 5mm de enduração. Os resultados mostraram um teste seguro e com taxas de positividade similares a PT e ao IGRA (concordância de 83%), mesmo em menores de 5 anos e pacientes HIV positivos. Porém nos HIV positivos com CD4 <100 células/μL a positividades foi diminuída em todos os três testes.27
Provas de atividade inflamatória são classicamente investigadas em associação com a TB. Velasco‐Arnaiz et al. avaliaram a associação da procalcitonina e proteína C reativa com a TB em menores de seis anos e descreveram uma normalidade desse marcador nos casos de TB pulmonar e um aumento, tanto da procalcitonina como da proteína C reativa, nos quadros de pneumonia pneumocócica. Dessa forma, sugerem que crianças contatos de TB, com nível de procalcitonina e proteína C reativa aumentados, avalia‐se a possibilidade de tratamento para pneumonia bacteriana e posterior reavaliação para TB em duas a três semanas.28
Tratamento da doença ativaOs esquemas de tratamento da TB recomendados, no Brasil, da mesma forma que no diagnóstico, seguem os mesmos cortes de idade. Na última diretriz houve mudança nas faixas de doses para as crianças, de acordo com recomendações da OMS, para que se atingissem as concentrações séricas indicadas desses fármacos. A rifampicina deve ser prescrita na dose de 15mg/kg (10‐20mg/kg) e a isoniazida 10mg/kg (7‐15mg/kg), enquanto a pirazinamida foi mantida na dose de 35mg/kg (30‐40mg/kg).7
O tempo de tratamento preconizado é de 2 meses para a pirazinamida e 6 para as demais drogas.7 Especificamente em relação à forma meníngea, se estende para 12 meses, segue esquema padronizado pela OMS. Reitera‐se a importância da isoniazida e da pirazinamida, pela excelente penetração e elevada concentração com potente atividade bactericida no líquor, enquanto que a rifampicina tem penetração e concentração menores nesse local.29 Enquanto para as formas com acometimento ósseo o tempo de tratamento recomendado é de 6 a 12 meses, a critério clínico.7
Revisão feita por Donald et al. mostrou que o uso do etambutol na dose de 20mg/kg (15‐25mg/kg) é seguro em crianças e pode ser aplicado na faixa etária pediátrica. Nesta revisão, com 3.811 crianças, a neurite óptica foi atribuída ao etambutol, em apenas 0,05% das crianças que usaram essa droga na dose de 15‐30mg/kg/dia.30 No Brasil, o seu uso ainda é recomendado apenas nos maiores de 10 anos, mas, quando necessário, pode ser usada com segurança nos menores.7
Outro avanço importante para as crianças foi o desenvolvimento da dose fixa combinada desde 2015, na forma de comprimidos dispersíveis: formulações amigáveis (child‐friendly formulations), com sabor de fruta, o que torna o tratamento muito mais palatável e agradável às crianças, além de estarem adequadas às novas recomendações da OMS. Cada comprimido contém 75mg de rifampicina, 50mg de isoniazida e 150mg de pirazinamida para a fase intensiva e comprimidos com 75mg de rifampicina e 50mg de isoniazida para a fase de manutenção do tratamento (tabela 5). Encontram‐se em elaboração comprimidos dispersíveis com doses isoladas de pirazinamida, etambutol, isoniazida e outros medicamentos usados para TBMR.31
Esquema terapêutico para tuberculose, com formulações amigáveis, conforme diferente faixa de peso
| Faixa de peso | Fase intensiva (RHZ 75/50/150) | Fase de manutenção (RH 75/50) |
|---|---|---|
| 4‐7kg | 1 | 1 |
| 8‐11 kg | 2 | 2 |
| 12‐15 kg | 3 | 3 |
| 16‐24 kg | 4 | 4 |
| ≥ 25 kg | Dose recomendada para adulto | Dose recomendada para adulto |
H, isoniazida; R, rifampicina; Z, pirazinamida.
Adaptado da Organização Mundial de Saúde.31
Destaca‐se que o Brasil se encontra em fase de aquisição das formulações dispersíveis infantis, o que mostra seu compromisso de priorizar o controle da TB nessa faixa etária.
As crianças encontram‐se em crescimento e desenvolvimento e, devido a isso, as drogas apresentam ampla variabilidade farmacocinética, podem apresentar concentrações séricas abaixo do nível terapêutico. Observou‐se em estudo feito na África que a rifampicina e a pirazinamida, nas novas doses preconizadas pela OMS, não atingem a concentração sérica adequada nos menores de 12kg. Notadamente, o nível sérico da rifampicina nas crianças, independentemente do peso, foi inferior ao dos adultos. Novos estudos estão em condução para avaliar a biodisponibilidade das drogas em diferentes regiões geográficas, se levarmos em consideração possíveis fatores genéticos, peso, idade e formulação usada.32
Estudo conduzido na Índia avaliou as concentrações séricas atingidas pela isoniazida (10mg/kg) e pirazinamida (35mg/kg) e as comparou em menores e maiores de 3 anos, bem como com o estado nutricional. Observou‐se que a concentração da pirazinamida foi mais baixa nos menores de três anos e em crianças com baixo índice de massa corporal, enquanto que para isoniazida não houve diferença significativa ao se avaliarem essas variáveis.33
No Brasil, os esquemas usados e oferecidos no tratamento da TBDR nas crianças são os mesmos dos adultos, estendem‐se de 18 a 24 meses.7 A OMS orienta a possibilidade do esquema encurtado de 9 a 12 meses, porém com pouca evidência na população pediátrica.34
Kumar et al. avaliaram a farmacocinética das medicações de segunda linha usadas no tratamento de TBMR, em crianças e adolescentes indianas, com mediana de 16 anos, e mostraram que a levofloxacino atingiu concentrações séricas maiores no gênero feminino,35 valor semelhante a estudo conduzido por Denti et al. com crianças sul‐africanas.36 Essa última pesquisa usou comprimidos de levofloxacino macerado nas crianças e mostrou concentração sérica inferior à dos adultos, apesar das doses equivalentes, sugeriu a necessidade de novos estudos para avaliar o efeitos das diferentes formulações e manipulações.36
Kumar et al. ainda demonstraram que a etionamida apresentou concentração sérica mais baixa nos menores de 12 anos e para a pirazinamida, em crianças e adolescentes com peso baixo, a concentração sérica desse fármaco encontrou‐se diminuída.35
Essas diferenças na farmacocinética das drogas conforme gênero, idade e peso devem ser consideradas quando nos deparamos com evoluções desfavoráveis, mesmo em uso de doses adequadas e boa adesão ao tratamento.
Novas drogas estão sendo testadas e liberadas para uso na pediatria, como bedaquilina e delamanid nos esquemas longos. A bedaquilina pode ser usada para pacientes entre 6 a 17 anos e o delamanid a partir dos 3 anos.34 O pretomanid, uma nova droga aprovada recentemente pelo FDA, ainda necessita de estudos para seu uso nas crianças.37
Seguimento do tratamento das crianças e adolescentesAs crianças e adolescentes devem ser seguidos conforme descrito na tabela 6.
Consultas clínicas e exames de seguimento do tratamento da tuberculose em crianças e adolescentes
| Procedimentos | 1° mês | 2° mês | 3°mês | 4° mês | 5° mês | 6° mês | Observações |
|---|---|---|---|---|---|---|---|
| Consulta mensala | X | X | X | X | X | X | Fazer com maior frequência a critério clínico. |
| Oferta de teste para diagnóstico do HIV | X | Caso não seja possível no primeiro mês, fazer durante o tratamento. | |||||
| Avaliação da adesão e eventos adversos | X | X | X | X | X | X | |
| Baciloscopias de controle (escarro) | Apenas para casos pulmonares bacilíferos, quando houver facilidade na coleta. | ||||||
| Radiografia de tórax | X | X | Repetir a critério clínico, se primeiro controle normal, não há necessidade de repetir. |
As crianças, geralmente paucibacilares e sem confirmação bacteriológica, não farão baciloscopia de controle e serão acompanhadas periodicamente (pelo menos uma vez por mês) conforme sua evolução clínica e radiológica. O acompanhamento em ambulatórios de referência com pediatras especialistas seria o recomendado em casos de maior complexidade, vistos os melhores desfechos de tratamento, como a redução da letalidade, observados no acompanhamento com profissionais desses serviços.38
Estudo feito com crianças paraguaias mostra que a dosagem de rifampicina e pirazinamida por meio de gota sanguínea seca em papel de filtro poderia ser uma forma de monitoramento das concentrações plasmáticas desses fármacos,39 principalmente quando há certeza de boa adesão ao tratamento e a evolução está desfavorável.
As crianças raramente apresentam eventos adversos, portanto exames bioquímicos são recomendados apenas a partir de critérios clínicos individuais, no início ou durante a terapia.
Reitera‐se a importância do TDO em todas as idades, orientação à família e ao paciente, conforme seu entendimento, sobre as consequências da adesão irregular e do abandono de tratamento.7
Tratamento da infecção latenteA ILTB é definida como um estado de resposta imune persistente sem a doença ativa. Devem‐se definir os grupos que seriam beneficiados com a identificação desse status e a necessidade do tratamento. A forma de diagnóstico com PT ou IGRA, valor da PT considerado positivo, populações prioritárias para o tratamento, podem variar nos diversos países, de acordo com a prevalência de TB na região e as diretrizes locais.5
O tratamento farmacológico da ILTB é a principal intervenção capaz de prevenir a progressão para tuberculose ativa. A sua indicação depende do resultado da PT ou do IGRA, da idade, da probabilidade de infecção e do risco de adoecimento.
No Brasil, a PT é considerada positiva com enduração ≥ 5mm, independentemente de idade, situação imunológica e vacinal ou tempo decorrido da vacinação com BCG.7 Estudos recentes apontaram que a influência da BCG na PT depende mais da idade em que o BCG foi aplicado, do que o intervalo entre essas aplicações. Esse efeito reduz com o passar do tempo, principalmente se a vacina foi feita antes de dois anos, período no qual é feita na população brasileira.40 Seddon et al. confirmaram esse achado, mostraram que nesse cenário (menores de 2 anos vacinados) na maioria dos casos a PT foi negativa.41
Os pacientes com história de contato ou conversão tuberculínica no último ano, imunossuprimidos por medicamentos ou doença de base seriam os grupos prioritários a se investigar ILTB e avaliar necessidade do tratamento.
Grupos de risco, como crianças com infecção pelo HIV, pré‐transplante de órgãos ou que iniciarão terapia imunossupressora devem ser avaliadas com PT, independentemente do contato com TB. Em caso PT positiva, fazer o tratamento da ILTB. Por outro lado, se história de contato com bacilífero, tratar, mesmo que PT negativa.7
Caso seja necessário, o tratamento da ILTB deve afastar, previamente, o diagnóstico de doença ativa com avaliação clínica e radiografia de tórax.7
Atualmente, vários esquemas terapêuticos estão disponíveis (tabela 7).42
Esquema terapêutico para tratamento da infecção latente tuberculosa
| Esquema | Tempo de tratamento | Posologia | Dose máxima |
|---|---|---|---|
| Isoniazida, diária | 6 a 9 meses(180 a 270 doses) | Adulto: 5 mg/kgCriança: 10 (7–15) mg/kg | 300 mg |
| Rifampicina, diária | 3 a 4 meses(90 a 120 doses) | Adulto: 10 mg/kgCriança: 15 (10–20) mg/kg | 600 mg |
| Isoniazida + Rifampicina, diárias | 3 a 4 meses(90 a 120 doses) | Mesma posologia das drogas separadas | |
| Rifapentina + Isoniazida, semanal | 3 meses (12 doses) | Isoniazida:≥ 12 anos: 15 mg/kg2–11 anos: 25 mg/kgRifapentina:10,0–14,0kg = 300 mg14,1–25,0kg = 450 mg25,1–32,0kg = 600 mg32,1–50,0kg = 750 mg> 50kg = 900 mg | Isoniazida: 900 mgRifapentina: 900 mg |
| Rifapentina + Isoniazida, diáriasaEstudo apenas em ≥ 18 anos | 1 mês (30 doses) | Isoniazida:300 mgRifapentina:<35kg = 300 mg35,0–45,0kg = 450 mg> 45kg = 600 mg | Isoniazida: 300 mgRifapentina: 600 mg |
Adaptado da Organização Mundial de Saúde.34
A isoniazida reduz em 60% a 90% o risco de adoecimento. Essa variação se deve à duração e à adesão ao tratamento. Destaca‐se que o número de doses, e não o tempo de tratamento, é o mais importante para a efetividade terapêutica. Recomendam‐se 270 doses a serem tomadas de 9 a 12 meses ou 180 doses, entre 6 e 9 meses.7
Estudos em crianças mostraram as vantagens de adesão, eficácia e segurança de 4 meses de rifampicina comparados com 9 meses de isoniazida.43,44
O Brasil, diante dessas evidências, recomenda a rifampicina nos menores de 10 e maiores de 50 anos, hepatopatas e intolerantes à isoniazida, com 120 doses tomadas entre 4 e 6 meses.7
O esquema de tratamento mais promissor é com a rifapentina associada à isoniazida, cujos estudos mostraram não inferioridade a nove meses de isoniazida isolada. As vantagens desse esquema são maior adesão, toxicidade menor ou similar e facilidade posológica. Há duas formas de prescrição: doses semanais por 3 semanas (12 doses)45 ou diárias por 4 semanas (30 doses).46
No Brasil, o tratamento da ILTB não é de notificação compulsória, porém recomenda‐se a notificação em ficha específica nacional.7
Para os contatos com TBDR, não há evidência suficiente para o tratamento. Recomenda‐se a avaliação desses para a identificação de possíveis casos de TB ativa ou latente. Quando ILTB for identificada, recomenda‐se o acompanhamento periódico por pelo menos dois anos, a fim de se identificarem precocemente sinais de progressão para doença. A levofloxacina tem sido estudada como uma opção profilática para esses casos.47
Quimioprofilaxia primáriaRecém‐nascidos (RN) expostos a casos de TB pulmonar bacilífera ou laríngea podem desenvolver formas graves da doença, devem ser acompanhados e investigados. No fluxo de prevenção dessa população, no Brasil recentemente foi incorporado o uso da rifampicina como opção ao uso da isoniazida.7
A orientação se mantém, de não vacinar com a BCG ao nascimento e iniciar a quimioprofilaxia por três meses. Após esse período, faz‐se a PT. Se o resultado da PT for positiva, completar o esquema terapêutico escolhido (isoniazida 180 doses ou rifampicina 120 doses) e o RN não deverá ser vacinado com BCG. Caso a PT seja negativa, interromper o tratamento e vacinar. Se o RN exposto for inadvertidamente vacinado, recomenda‐se completar a terapêutica, sem necessidade da PT.7
Quando o caso fonte for a mãe, avaliar a possibilidade de TB congênita. Não há contraindicações à amamentação, desde que a mãe não seja portadora de mastite tuberculosa. É recomendável o uso de máscara cirúrgica ao amamentar e ao cuidar da criança enquanto a baciloscopia do escarro se mantiver positiva.7
Imunização ativaNas últimas duas décadas, houve um grande progresso na busca por uma vacina mais eficaz contra a tuberculose, mas ainda não há substituto para a vacina BCG licenciada. Existem em torno de 14 vacinas contra a tuberculose em estudo e estão em diferentes fases de ensaios clínicos, são testadas em pré e pós‐exposição. São compostas por subunidades vacinais (associadas a vetores virais atenuados ou proteínas adjuvantes), vacinas de células inteiras (geneticamente atenuadas com o M. tuberculosis, recombinantes de BCG ou M. vaccae ou M. tuberculosis mortos).48,49
Duas vacinas encontram‐se em fase 3, ou seja, a que demonstra a eficácia da vacina e reforça a segurança, antes de se obter o registro sanitário para liberar seu uso na população. A maioria dos estudos encontra‐se em fase 2, que tem por objetivo avaliar a imunogenicidade. E duas vacinas estão em fase 1, que é a da segurança vacinal. Um resumo das vacinas e dos estudos encontra‐se na tabela 8.
Fases clínica dos estudos em andamento para vacinas em tuberculose
| Vacina em estudo | Classificação quanto ao tipo de vacina | Fase clínica |
|---|---|---|
| Vaccae | Mycobacterium vaccae. Vacina inativada de células inteiras | 3 |
| MIP | Mycobacterium indicus pranii. Vacina inativada de células inteiras | 3 |
| VPM1002 | Recombinante da BCG | 2b |
| M72 + AS01E | Vacina de subunidade | 2b |
| H56 + IC31b | Vacina de subunidade | 2b |
| DAR-901 | Mycobacterium não tuberculose. Vacina inativada de células inteiras | 2b |
| MTBVAC | Mycobacterium tuberculosis atenuado | 2a |
| H4 + IC31b | Vacina de subunidade | 2a |
| ID93 + GLASEc | Vacina de subunidade | 2a |
| TB-FLU-04L | Vacina de subunidade | 2a |
| H1 + IC31b | Vacina de subunidade | 2a |
| RUTI | Mycobacterium tuberculosis. Vacina inativada de células inteiras | 2a |
| Ad5Ag85A | Vacina de subunidade | 1 |
| ChAdOX/85A/MVA85A | Vacina de subunidade | 1 |
Adaptado de Méndez‐Samperio.48
Apesar do uso consagrado da BCG, essa vacina ainda é motivo de muitos estudos. Em fevereiro de 2018, a OMS questionou os benefícios de se repetir a BCG, por ausência de evidencias científicas, em crianças vacinadas e que não tenham desenvolvido a cicatriz vacinal, mesmo com PT ou IGRA negativos.50 Por orientação da OMS, o MS do Brasil passou a não recomendar a revacinação de crianças que não desenvolveram a cicatriz vacinal após seis meses da aplicação e sem necessidade de testes complementares (Nota Informativa n° 10/2019‐CGPNI/DEVIT/SVS/MS).
Considerações finaisBuscou‐se dar um novo olhar à TB na infância e adolescência. Um olhar que se deparou com maior relevância dada a essa doença e, assim, fazer com que crianças, adolescentes, parentes, profissionais e sociedade fossem mais ouvidos, propiciar que essa epidemia deixe de ser tão silenciosa. Observaram‐se avanços no seu manejo. Entretanto há muito a trilhar... Associar ao olhar um ouvir mais aguçado, dar ainda maior voz às crianças e aos adolescentes; paladar e olfato para que desenvolvam novas fórmulas amigas da criança e um tato que mobilize e resulte em ações mais efetivas. Somente com a união dos cinco sentidos as crianças e os adolescentes conseguirão substituir o sofrimento, outrora imposto pela TB, por um futuro de maior acolhimento, assertividade no diagnóstico, tratamento, bem como prevenção e quiçá sua eliminação num futuro próximo.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Tahan TT, Gabardo BM, Rossoni AM. Tuberculosis in childhood and adolescence: a view from different perspectives. J Pediatr (Rio J). 2020;96(S1):99–110.
Instituição ou serviço com a/o qual o trabalho está associado para indexação no Index Medicus/Medline: Departamento de Pediatria, Universidade Federal do Paraná; Rede Brasileira de Pesquisas em Tuberculose (REDE TB).