Review the main aspects of the definition, diagnosis, and management of pediatric patients with sepsis and septic shock.
Source of dataA search was carried out in the MEDLINE and Embase databases. The articles were chosen according to the authors’ interest, prioritizing those published in the last five years.
Synthesis of dataSepsis remains a major cause of mortality in pediatric patients. The variability of clinical presentations makes it difficult to attain a precise definition in pediatrics. Airway stabilization with adequate oxygenation and ventilation if necessary, initial volume resuscitation, antibiotic administration, and cardiovascular support are the basis of sepsis treatment. In resource‐poor settings, attention should be paid to the risks of fluid overload when administrating fluids. Administration of vasoactive drugs such as epinephrine or norepinephrine is necessary in the absence of volume response within the first hour. Follow‐up of shock treatment should adhere to targets such as restoring vital and clinical signs of shock and controlling the focus of infection. A multimodal evaluation with bedside ultrasound for management after the first hours is recommended. In refractory shock, attention should be given to situations such as cardiac tamponade, hypothyroidism, adrenal insufficiency, abdominal catastrophe, and focus of uncontrolled infection.
ConclusionsThe implementation of protocols and advanced technologies have reduced sepsis mortality. In resource‐poor settings, good practices such as early sepsis identification, antibiotic administration, and careful fluid infusion are the cornerstones of sepsis management.
Revisar os principais aspectos da definição, diagnóstico e manejo do paciente pediátrico com sepse e choque séptico.
Fontes de dadosUma pesquisa nas plataformas de dados Medline e Embase foi feita. Os artigos foram escolhidos segundo interesse dos autores, priorizaram‐se as publicações dos últimos 5 anos.
Síntese dos dadosA sepse continua a ser uma causa importante de mortalidade em pacientes pediátricos. A variabilidade de apresentação clínica dificulta uma definição precisa em pediatria. A estabilização da via aérea com adequada oxigenação, e ventilação se necessário, ressuscitação volêmica inicial, administração de antibióticos e suporte cardiovascular são a base do tratamento da sepse. Em cenários de poucos recursos, deve‐se atentar para os riscos de sobrecarga hídrica na administração de fluidos. A administração de drogas vasoativas, como adrenalina ou noradrenalina, se faz necessária na ausência da resposta ao volume na primeira hora. O seguimento do tratamento do choque deve seguir alvos como restauração dos sinais vitais e clínicos de choque e controle do foco de infecção. Recomenda‐se a avaliação multimodal, com auxílio da ecografia à beira‐leito para manejo após as primeiras horas. No choque refratário, deve‐se atentar para situações como tamponamento cardíaco, hipotireoidismo, insuficiência adrenal, catástrofe abdominal e foco de infecção não controlado.
ConclusõesImplantação de protocolos e avançadas tecnologias propiciou uma redução da mortalidade da sepse. Em cenários de poucos recursos, as boas práticas, como reconhecimento precoce da sepse, administração de antibióticos e cuidadosa infusão de fluidos, são os pilares do manejo da sepse.
Desde os primórdios do homo sapiens até os dias de hoje, as doenças infectocontagiosas constituem um enorme desafio para a humanidade. A Organização Mundial de Saúde estima que mais de 60% das mortes de crianças com idade inferior a 5 anos no planeta se devem a doenças infecciosas.1
Sepse é conceituada como falência multiorgânica potencialmente fatal consequente à resposta desregulada do organismo a um processo infeccioso. Essa resposta desregulada pode oscilar desde uma manifestação exagerada e incontrolada de atividade pró‐inflamatória (p.ex.: meningococcemia), com apresentação clínica florida e intensa, até uma manifestação frustra secundária a ausência de resposta inflamatória, como no caso de pacientes imunossuprimidos ou com “imunoparalisia”, onde a apresentação clínica pode ser silenciosa ou insidiosa (p.ex.: Candidemia relacionada a cateter central em crianças imunosuprimida por quimioterapia).2–7
Nas últimas décadas, várias campanhas e recomendações para combate a sepse têm sido divulgadas no sentido de facilitar o diagnóstico, promover a intervenção precoce e reduzir a mortalidade em crianças. Consequentemente, houve um acentuado declínio da mortalidade de sepse grave e choque séptico ao redor do mundo, obtiveram‐se menores índices nos países desenvolvidos do que em nações mais pobres (19% versus 32%, respectivamente).8–13
Aumento na sobrevida da sepse tem sido atribuído ao reconhecimento precoce associado a um tratamento agressivo em ambiente hospitalar, em que se seguem protocolos previamente estabelecidos.2–6 Entretanto, sepse envolve complexos mecanismos fisiopatológicos com apresentações clínicas variadas e inespecíficas, afetam um grupo heterogêneo de pessoas (recém‐nascidos, pacientes hígidos, portadores de comorbidades, entre outros); de forma que uma definição única, simples e objetiva que inclua toda essa abrangência torna‐se um desafio gigantesco. As atuais definições de sepse e seus estágios em pediatria são imprecisas, não levam em consideração toda essa diversidade de apresentações, por isso mesmo, com baixa especificidade e sensibilidade.5,12,14 Consequentemente, o retardo no diagnóstico não é raro, há atraso na instituição do tratamento adequado que contempla alvos bem definidos já na primeira hora de atendimento (The golden hour).5,6,15 O objetivo deste trabalho é revisar os aspectos mais importantes na definição, diagnóstico e manejo da sepse em pediatria; discutir com base nas mais recentes evidências científicas os pontos controversos da literatura e expor criticamente a opinião dos autores.
Definição de sepse em pediatriaEm 2005 a International Pediatric Consensus Conference – IPSCC5 propôs definições ajustadas à idade para sepse e seus estágios em pediatria, teve como conceito central a Síndrome da Resposta Inflamatória Sistêmica (SIRS). Nessa perspectiva a IPSCC propõe como definições:
Sepse:
Infecção suspeita ou comprovada causada por qualquer patógeno ou síndrome clínica com alta probabilidade de infeção, associada a:
Presença de pelo menos duas das manifestações clínicas abaixo (é obrigatória a presença de anormalidade na temperatura ou na contagem de leucócitos):
- ‐
Temperatura > 38,5 oC ou < 36 oC
- ‐
Taquicardia ou bradicardia (valores ajustados à idade)
- ‐
Taquipneia (de acordo com a faixa etária) não relacionada a doença neuromuscular ou anestesia.
- ‐
Contagem leucocitária elevada ou suprimida, de acordo com os valores para cada faixa etária.
Sepse grave: Paciente definido com sepse pelos critérios acima que apresente disfunção orgânica (respiratória ou cardiocirculatória) ou duas outras disfunções.
Choque séptico: paciente com sepse com falha circulatória aguda caracterizada por hipotensão persistente (< 2 desvios‐padrão do padrão para a faixa etária) apesar de ressuscitação volumétrica adequada e inexplicada por outras causas.
A força tarefa da IPSCC, ao criar essas definições, ressaltava que se tratava de instrumento ainda em fase de construção que requeria um refinamento, mesmo assim foram incorporadas à prática diária das UTIPs ao redor do mundo2–4,7,14–16 e formaram a base dos conceitos para as recomendações de diagnóstico e tratamento na sepse pediátrica.5,6,15
Apesar da rápida aceitação no cenário clínico, vários estudos feitos na última década demonstraram as limitações das definições propostas pela ISPCC. No estudo SPROUT que envolveu 7.000 crianças admitidas a 128 UTIP em 26 países, observou‐se uma concordância fraca (46%) entre o diagnóstico presuntivo de sepse grave feito pelo médico assistente e o diagnóstico segundo as recomendações da IPSCC.17 O diagnóstico clínico foi feito de forma mais liberal, houve menores alterações laboratoriais, menor mortalidade e menor falências de órgãos do que o observado no grupo definido estritamente pelos critérios do consenso.
A principal razão para justificar a baixa especificidade e sensibilidade dos critérios da IPSCC no diagnóstico da sepse em pediatria está relacionado à SIRS: pacientes com sepse podem não apresentar SIRS, assim como SIRS pode estar presente em pacientes sem infecção. Nesse sentido, vários outros marcadores clínicos e biológicos têm sido avaliados em sepse (p.ex.: lactato sérico, saturação venosa central, pressão arterial, enchimento capilar, entre outros), sem que nenhum deles apresente a uma acurácia segura para definir e guiar o tratamento da sepse em crianças.6,15,18,19
Como consequência da resposta desregulada à infeção e do tratamento oferecido, podem ocorrer duas formas de morte na sepse: a) Choque refratário e b) Síndrome da Disfunção de Múltiplos Órgãos (MODS). Estima‐se que um terço das mortes em crianças com sepse e choque séptico ocorra nas primeiras 72 horas, nas quais o choque refratário é a principal causa. Por outro lado, após o terceiro dia, MODS, falência respiratória e neurológica predominam como as causas principais de óbito.20
Recentemente novas definições para sepse e choque séptico foram propostas para a população adulta – The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis‐3), onde alguns conceitos de disfunção de órgãos (Sequential Organ Failure Assesment – SOFA Score) foram incorporados.3,4 Essas novas definições têm sido adaptadas para ser adotadas também na população pediátrica. O SOFA score para pediatria (pSOFA) é baseado na avaliação de seis sistemas (respiratório, hepático, coagulação, cardiovascular, neurológico e renal) com valores de 0 a 4 pontos.21 O escore do pSOFA pode oscilar de 0 (entendido como uma condição normal de saúde e sem chance de sepse) até o máximo de 24 (interpretado como choque séptico grave). Portanto, se adotarmos o Sepsis‐3 adaptado para crianças, as definições seriam as que seguem:
- I.
Sepse: infecção suspeita ou confirmada associada com aumento agudo no escore pSOFA > 2 pontos (nas 48 horas prévias até 24 horas de infecção).
- II.
Choque séptico: Os mesmos critérios citados acima em criança que recebe drogas vasoativas associadas com lactato sérico superior a 2mg/dL.
Essas definições foram avaliadas de forma retrospectiva, analisaram‐se mais de 8.500 crianças admitidas em sete anos em uma UTIP americana. A mortalidade no grupo em estudo foi de 2,4% e considerada muito baixa mesmo para países desenvolvidos. Nesse cenário foi demonstrado que o Sepsis‐3 pediátrico tem ótimo poder para predizer mortalidade (AUC = 0,94), com poucas (se alguma) vantagens em relação a outros escores pediátricos, tais como: PRISM III, P‐MODS e PELOD 1 e 2. Um escore pSOFA superior a 8 foi o melhor ponto de corte para predizer mortalidade na sepse.21
Quando o Sepsis‐3 pediátrico foi avaliado em um UTIP da Índia, envolveu uma população menor, mas com uma mortalidade por sepse muito maior (40%), observou‐se uma especificidade grande (identifica os casos mais graves de sepse) mas com uma baixa sensibilidade, pois deixaram de identificar 18% dos episódios de sepse diagnosticados pelo IPSCC.22
Em nossa perspectiva, o Sepsis‐3 adaptado para pediatria não atende aos principais requisitos que garantam acurácia e segurança na identificação de sepse e choque séptico na população pediátrica. Obviamente, a disfunção orgânica é um achado relevante no contexto da sepse pediátrica. A progressão ou o aparecimento de uma nova falência orgânica, especialmente no segundo dia, tem sido associada com aumento na mortalidade.23 Nesse contexto, tanto o pSOFA como o PELOD‐2 poderiam ser usados para identificar os casos mais severos de sepse (maior risco de morte), os quais demandam o atendimento em centros de referência e com maiores recursos. Entretanto, considerando sua baixa sensibilidade, a sua inclusão na definição (identificação) de sepse e choque séptico não tem suporte e tampouco justificativa.
Embora alguns estudos pediátricos tenham demonstrado que o aumento do lactato sérico pode ser um marcador de gravidade e que seu decréscimo pode ser associado a uma boa resposta terapêutica, é sabido que vários fatores afetam essa oscilação. Até este momento, não há suficiente solidez científica que suporte o uso do lactato na caracterização de choque séptico em pediatria. Pois, se adotarmos os critérios propostos pelo Sepsis‐3 na população pediátrica, corremos o risco de deixar de identificar uma razoável porção de pacientes com choque séptico clinicamente estabelecido, mas ainda com níveis baixos de lactato. Entendemos que as variáveis fisiológicas e biológicas fazer parte dessa complexa equação, mas para definir Sepse com segurança e acurácia outros elementos devem ser computados.
ManejoA sepse pediátrica é uma condição de alto risco que requer vigilância para um diagnóstico precoce e oportuno. O seu reconhecimento tardio, ou atraso no início do tratamento, com persistência de disfunção hemodinâmica, está associado a piores desfechos clínicos e ao aumento da mortalidade.24 Uma ressuscitação rápida e agressiva com volume nos primeiros cinco minutos, administração de antibiótico e agentes vasoativos precoces podem ser cruciais para o sucesso no tratamento. Veremos que esse padrão de tratamento, que muitas vezes pode se modificar rapidamente, também torna o manejo da sepse crítico para o pediatra.6
O manejo inicial do choque séptico é o mesmo de outras condições que ameaçam a vida. Inicia‐se pela estabilização da via aérea e da respiração adequada com oferta extra de oxigênio. O apoio ventilatório deve ser suficiente para aumentar a oferta e a captação de oxigênio pela célula. Como a circulação é a parte mais evidentemente comprometida, inicia‐se com uma reposição volumétrica agressiva para restaurar o volume circulante, seguida da correção de fatores inotrópicos negativos, aumentam‐se a contratilidade cardíaca e a eventual diminuição da resistência vascular periférica.
O objetivo é manter a oxigenação, a ventilação, a circulação e a frequência cardíaca nos limites da normalidade e restaurar as condições clínicas do paciente, melhorar a perfusão (enchimento capilar menor do que 2 segundos), com pulsos cheios e extremidades quentes, débito urinário maior do que 1mL/kg/h, estado mental adequado e pressão arterial normal para a idade. A monitoração mínima desejada é uma oximetria de pulso, traçado de ECG, medida da pressão arterial, temperatura, diurese horária, glicose e cálcio.15
As decisões de intubar e ventilar são clínicas: falência respiratória, hipoventilação, alteração do estado de consciência ou morte iminente. Para a ressuscitação volumétrica e início da terapia, o acesso vascular deve ser obtido imediatamente e a inserção de um cateter central é preferível para infusão de drogas vasoativas. Acessos periféricos também podem ser usados para a ressuscitação volumétrica inicial e para administração de algumas dessas aminas simpaticomiméticas. Um acesso intraósseo pode ser necessário na impossibilidade de acesso periférico.25
Ressuscitação volumétrica e drogas na primeira horaPara ressuscitação volumétrica, usamos uma solução cristaloide, geralmente a solução salina normal (solução fisiológica). Eventualmente podemos usar soluções balanceadas de cristaloides (como solução de ringer lactato e outras) com os mesmos resultados. Essas soluções balanceadas t∼Em sido preconizadas por reduzir a acidose, mortalidade e lesão renal pós‐ressuscitação no choque da criança.26 Mas esses resultados são ainda controversos. Usamos coloides, como a albumina, em casos excepcionais e selecionados, como quando infundimos grandes quantidades de solução e queremos restringir volume. A solução de albumina, além de não ter seu benefício confirmado, tem maior custo do que as demais soluções. Não se demonstrou diferença entre as soluções de albumina e cristaloides mesmo em crianças com síndrome do choque da dengue.27
O choque séptico evoluiu com perda volêmica para o terceiro espaço e síndrome de extravasamento capilar. Esse é um ponto importante na reavaliação e manutenção da necessidade de reposição volumétrica. Recomenda‐se a infusão 20ml/kg de soro fisiológico entre 10 e 20 minutos. Repetir a infusão de 20mL/kg até que a perfusão tecidual, o fornecimento de oxigênio e a pressão sanguínea sejam adequados. Uma boa prática inclui a observação clínica de sobrecarga circulatória após as infusões. Ausência de estertores bolhosos, taquicardia e taquipneia ou desenvolvimento de ritmo em três tempos e hepatomegalia nos autoriza a repetir os líquidos. Pacientes com choque séptico geralmente requerem volumes de até 60ml/kg ou mais na primeira hora.28
Em ambientes com recursos limitados que não podem fornecer suporte avançado de vias aéreas e circulatório, crianças com sinais de choque compensado e doença febril grave devem ser manejadas ainda com maior cautela.29 Nessas condições temos sugerido repetidas infusões de solução salina 10mL/kg a cada 20min (30mL/kg na 1a hora) e vigília de sinais de sobrecarga circulatória a cada infusão.
Em algumas situações será necessário o uso de drogas vasoativas no choque grave durante a reanimação com líquidos. Na maioria das vezes agentes vasoativos são administrados quando já não existe resposta ao uso de líquidos em bolus, mas podem ser usados concomitantemente. Pacientes com fraca resposta adrenérgica, com bradicardia ou na iminência de parada cardiorrespiratória devem ser tratados com infusão de adrenalina em doses médias ou altas (0,2‐0,5μg/kg/min) e os com hipotensão com noradrenalina (0,05‐0,1μg/kg/min) concomitantemente e independentemente da ressuscitação volumétrica.
Suporte farmacológico na primeira horaO manejo hemodinâmico no choque objetiva uma oferta de oxigênio supranormal (acima do limite crítico) e um aumento da pressão arterial média para um nível que permita ao débito cardíaco alcançar a perfusão orgânica adequada. Drogas vasoativas devem ser usadas criteriosamente, com uma abordagem guiada por objetivos. Choque frio (presumivelmente devido ao baixo débito cardíaco) deve ser tratado com a adrenalina e choque quente (presumivelmente por elevado débito cardíaco com baixa resistência vascular sistêmica [SVR]) deve ser tratado com noradrenalina. Pacientes egressos da comunidade com sepse, via de regra evoluem com choque frio (titular adrenalina entre 0,1‐0,2μg/kg/min), enquanto aqueles com infecção intra‐hospitalar (p.ex.: relacionada a cateter, infecções fungicas, entre outras) tendem a evoluir com choque quente, de instalação mais lenta, é recomendada nesses casos a noradrenalina (0,05 – 0,2μg/kg/min). Considerar transfusões de concentrado de hemácias para manter a hemoglobina acima de 7 e uma saturação venosa central de oxigênio de > 70%.15
Choque resistente ao manejo inicialCaso o paciente não apresente sinais de reversão do choque com adrenalina até 0,3μg/kg/min, o que deve ser reconhecido rapidamente, iniciamos noradrenalina principalmente se o paciente estiver hipotenso, hiperdinâmico ou dilatado com choque quente, a fim de normalizar a perfusão e a pressão sanguínea. Se a paciente apresentar choque frio, hipotensão com bradicardia ou o quadro de disfunção cardíaca for o mais preponderante, titula‐se adrenalina em doses maiores.
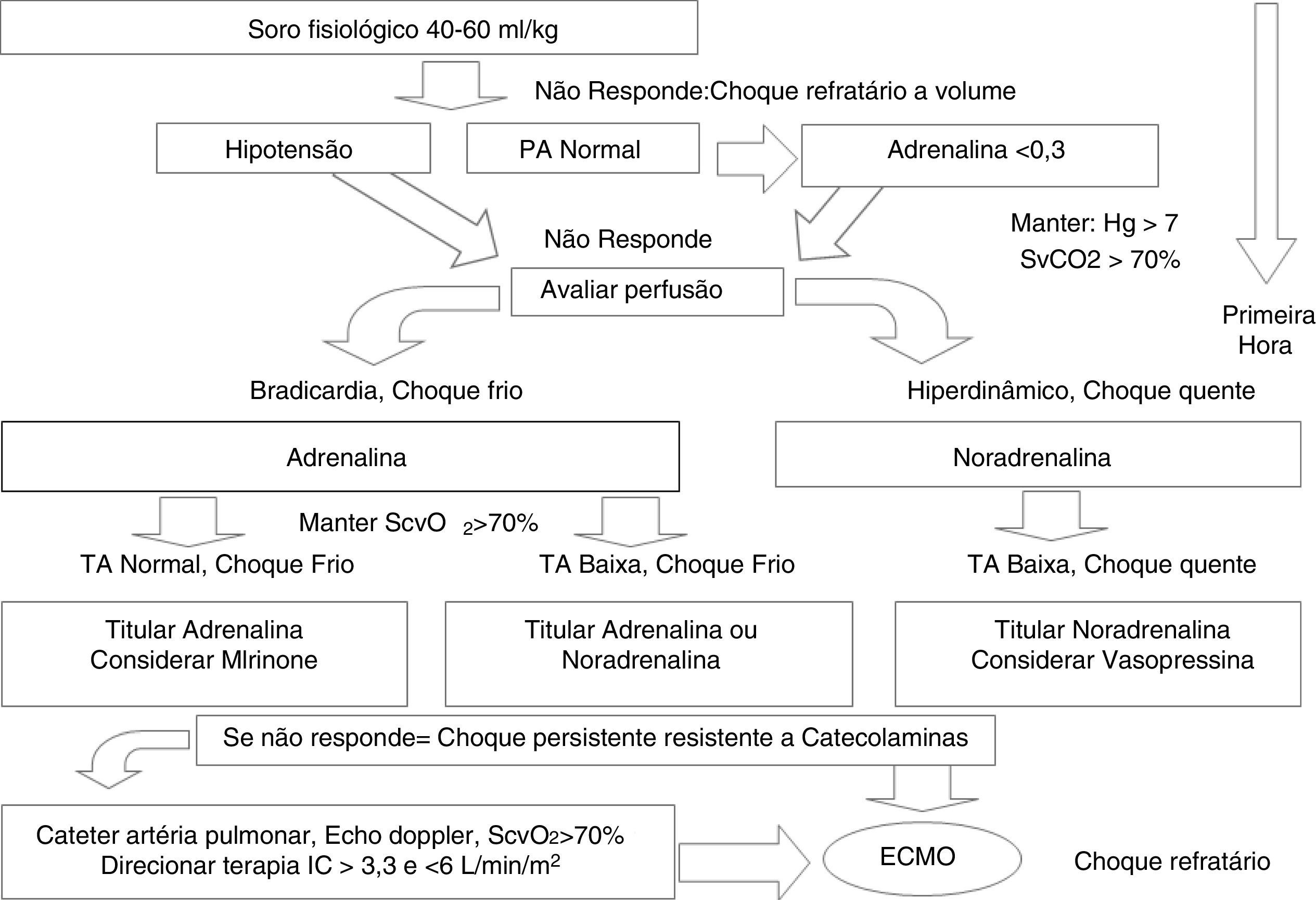
Choque frio é reconhecido pelas extremidades frias e monteadas, má perfusão periférica com enchimento capilar lento (maior do que dois segundos), pulsos periféricos fracos e débito urinário diminuído (menor do que 1mL/kg/h). Choque quente é reconhecido pelo rubor de extremidades, enchimento capilar rápido (menor do que dois segundos), pulsos cheios ou oscilantes, mas também débito urinário diminuído (menor do que 1mL/kg/h). A noradrenalina tem importante papel na manutenção da pressão sanguínea na loja renal, onde a pressão de perfusão deve ser adequada. Nesse fim de primeira hora, nos pacientes com choque quente refratário ao volume e resistentes ao manejo inicial, iniciamos a infusão com 0,05g/kg/min e aumentamos progressivamente a dose de 0,2g/kg/min. A figura 1 resume as condutas para o suporte farmacológico no choque séptico.6
Esquema simplificado do suporte farmacológico a criança com choque séptico. Ver detalhes no texto.
PA, pressão arterial; IC, índice cardíaco; ECMO, oxigenação por membrana extracorpórea.
Modificado de Davis et al.6.
Apesar de tentarmos classificar estados de choque séptico de forma prática, essa é uma condição clínica evolutiva. Assim, muitas vezes a droga escolhida para início de terapia pode tornar‐se inadequada e necessitar nova droga ou associação. A resposta de cada paciente a terapia vasoativa também pode ser diferente e a reavaliação clínica e de parâmetros hemodinâmicos frequente deve ser feita.30
Depois da primeira hora, pacientes com choque refratário ao volume que persistem em choque apesar do uso de catecolaminas como adrenalina ou noradrenalina são considerados como em choque resistente às catecolaminas. Nesse período esperamos que estivessem internados na UTIP, monitorado, com medida contínua de traçado eletrocardiográfico, frequência cardíaca, temperatura, um vaso de grosso calibre já deve ter sido obtido e, caso já tenha sido conseguido um acesso venoso central, por ele já medidos a pressão venosa central. Medida da pressão arterial deve ser feita de preferência por método invasivo, medimos a saturação de oxigênio com oxímetro de pulso e medida de débito urinário através de uma sonda vesical. Uma ecografia funcional à beira‐leito permite uma avaliação do estado volêmico e da função miocárdica. Passamos a calcular a pressão de perfusão [PP = PAM – PVC (mmHg)]. São limites da pressão de perfusão: Recém‐nascido 55, Lactentes 58, Pré‐escolares e escolares 65.6,31
Choques frio, resistente a catecolaminas, PA baixa, DC baixo e RVS altaNesse cenário o paciente com choque frio, resistente a catecolaminas com pressão arterial ainda baixa, baixo débito cardíaco e alta resistência vascular sistêmica, se beneficia da ação inotrópica da adrenalina e de sua ação vasopressora. Uma boa resposta é esperada nas doses entre 0,2‐0,5μg/kg/min. Se a frequência cardíaca não está muito alta o paciente pode se beneficiar do estímulo adrenérgico extra da adrenalina que pode ser usada até 1μg/kg/min e excepcionalmente até 2μg/kg/min. Essas doses mais altas geralmente comprometem a circulação esplâncnica e só devem ser usadas associadas a vasodilatadores.
Choques frio, resistente a catecolaminas, PA normal, DC baixo e RVS altaNesse caso o paciente tem choque frio, resistente a catecolaminas (não respondeu a infusão inicial de fluidos, nem da adrenalina até 0,2μg/kg/min) mas a pressão arterial normalizou, o débito ainda é baixo (ou normal) e resistência vascular sistêmica ainda é alta. Esses pacientes que apresentam alta resistência vascular sistêmica se beneficiam do uso de vasodilatadores. Nesse momento estamos autorizados a associar drogas que atuem diretamente em nível vascular, a fim de tentar contrapor tal vasoconstrição e melhorar o débito cardíaco. Nesses pacientes em que foram introduzidas as aminas simpaticomiméticas e nos quais ainda não se observou melhoria clínica (principalmente naqueles pacientes com hipoxemia grave com aumento da resistência vascular pulmonar e/ou sistêmica), usamos milrinona (0,25–0,75μg/kg/min) associada com noradrenalina e abandonamos a adrenalina. Quando é contraindicado o uso de milrinona e/ou nos casos de aumento rebelde da RVS, a outra opção é usar o nitroprussiato de sódio em infusão contínua com 0,5μg/kg/min até um máximo de 10μg/kg/min.
Choques quente, resistente a catecolaminas, PA baixa, DC alto e RVS baixaSe o choque ainda é quente e o paciente continua hipotenso, hiperdinâmico e com baixa resistência, o melhor é continuar a se beneficiar da ação vasopressora da noradrenalina. Com doses acima de 0,2μg/kg/min a noradrenalina começa a perder seu efeito inotrópico, mas seu efeito vasopressor pode ser sentido com doses de até 5μg/kg/min. Aumentamos gradativamente a noradrenalina e, enquanto o paciente estiver hipotenso mantemos a adrenalina 0,2‐0,5μg /kg/min ou introduzimos dobutamina em doses de até 20μg/kg/min para nos beneficiar de sua ação inotrópica. Se ocorrer, por conta das altas doses de noradrenalina, uma normalização da pressão arterial, podemos retirar gradualmente a adrenalina ou dobutamina e associar a milrinona.
Choque refratárioQuando o choque persiste, apesar do uso direcionado de agentes inotrópicos, vasopressores, vasodilatadores e da manutenção dos fatores inotrópicos negativos, é definido como choque refratário. Nesse caso, deve‐se suspeitar de algum problema desconhecido, como derrame pericárdico, pneumotórax, hipoadrenalismo, hipotireoidismo, perda contínua de sangue, catástrofe intra‐abdominal ou presença de tecido necrótico.
A ecografia à beria de leito tem papel fundamental nesse estágio de avaliação. A responsividade a fluidos pode ser estimada pela medida da distensibilidade da cava inferior, o débito cardíaco medido através da função do ventrículo esquerdo e o diagnóstico de derrame pericárdico através da visualização direta na posição paraesternal eixo longo ou subcostal.31 Um cateter arterial pulmonar também pode ser usado para medida do débito cardíaco, resistência vascular e pressão de oclusão da artéria pulmonar e análise da saturação de oxigênio da veia cava superior e arterial pode ser benéfica para orientar a terapia em pacientes com choque refratário. As terapias devem ser ajustadas a fim de manter a saturação de oxigênio venosa mista (SvO2) acima de 70%, índice cardíaco (IC) > 3,3 < 6,0 L/min/m2 e pressão de perfusão usual para a idade, com o principal objetivo de restabelecimento da perfusão normal.
Nos pacientes com choque refratário que não responderam a doses entre 0,6 a 1μg/kg/min de noradrenalina, que não estão hipovolêmicos, temos usado a vasopressina. Usamos dose inicial de 0,0005 U/kg/min, aumenta‐se gradativamente até 0,002 U/Kg/min (dose ideal) e, se necessário até a dose máxima: 0,008 U/Kg/min.32
Síndrome hipotireoideia pode complicar casos de choque séptico refratário. A terapia com T3 em choque séptico é reservada para as crianças com disfunção tireoidiana conhecida, para as crianças com alto risco de hipotireoidismo (crianças com trissomia do 21 e crianças com doença do sistema nervoso central) ou como terapia de resgate em choque séptico refratário. Recomenda‐se usar T3 em infusão intravenosa a uma dose de 0,05 a 0,15μg/kg/hora ou T4 (levotiroxina, 0,8 a 1μg/kg/hora).33 Como essas drogas são pouco disponíveis, como opção usamos levotiroxina por sonda nasogástrica, cuja dose varia conforme a idade e é reajustável conforme as variações laboratoriais: de 0 a 3 meses: 10 a 15μg/kg/dia; 3 a 12 meses: 6 a 10μg/kg/dia; 1 a 10 anos: 3 a 6μg/kg/dia; e de 10 a 16 anos: 2 a 4μg/kg/dia.34
A oxigenação por membrana extracorpórea (ECMO) é uma opção a ser considerada. Nessa situação o ECMO veno‐arterial, além de prover a adequada oxigenação sanguínea, pode, através da regulação do fluxo liberado na porção arterial, determinar a pressão arterial sistêmica. À medida que o débito cardíaco próprio do paciente melhora, promove‐se uma redução gradual do fluxo do ECMO. A expectativa de sobrevida com ECMO em crianças com choque séptico refratário a drogas vasoativas tem suplantado os 50%, com mortalidade menor do que 20%, passa a ser uma opção considerável.35
Alvos no choque sépticoO choque séptico pode ser caracterizado como uma alteração de sinais clínicos e hemodinâmicos, que incluem hipo ou hipertermia, taqui ou bradicardia, alteração do estado mental e da circulação periférica (vasodilatação – choque quente; vasoconstrição – choque frio) que precedem a hipotensão. O tratamento do choque deve objetivar a manutenção da perfusão orgânica e a observação desses sinais deve ser a prioridade no manejo desses pacientes. Segundo Carcillo et al., a hipotensão associada ao tempo de enchimento capilar maior do que 3 segundos está associada a uma mortalidade de 33% em pacientes atendidos em emergências pediátricas. A reversão desses parâmetros, de acordo com os protocolos estabelecidos, como o Pediatric Advanced Life Support (PALS), pode reduzir a chance de óbito em 40%, independentemente das condições hemodinâmicas iniciais.36 Dessa forma, a despeito do avanço tecnólogico atual, o exame físico e a monitoração básica à beira de leito ainda têm papel fundamental no atendimento dos pacientes em fase inicial de sepse e choque séptico, principalmente em cenários de poucos recursos.
A saturação venosa central de oxigênio (SCVO2) pode ser aferida através de um cateter posicionado na entrada na junção da veia cava superior ou inferior com o átrio direito e seu valor considerado normal é 70% em pacientes sem doença que produza shunt intracardíaco. Ela indica o quanto de oxigênio permanece disponível após o consumo celular, ou seja, representa um balanço entre a oferta de oxigênio e o consumo pela célula. É um exame prático, barato e acessível em países de poucos recursos e que já demonstrou benefícios, como redução de disfunções orgânicas e mortalidade, serve como marcador no tratamento de choque séptico em crianças.37,38 Alguns pontos devem ser levados em consideração para o seu uso, pois há discordância se em adultos ela é útil como alvo no tratamento da sepse.39 Primeiro, comparado com os adultos, o choque séptico em crianças costuma cursar com baixo débito cardíaco, enchimento capilar prolongado e vasoconstrição periférica. Nesses casos, a SCVO2 inicialmente é mais baixa e provavelmente indica um desbalanço entre o consumo e oferta oxigênio, além de ser um marcador de mau prognóstico.38 Segundo, não há benefício em instituir terapias segundo os protocolos para elevar a SCVO2 naqueles pacientes que têm valor próximo ou acima de 70%.40 Ou seja, em pacientes com alto débito cardíaco e choque vasodilatado, que cursa normalmente com hiperlactatemia, a SCVO2 pode não ser uma boa escolha como alvo terapêutico.
A pressão venosa central (PVC) também pode ser aferida no mesmo cateter que mede a SCVO2. De forma isolada, ela tem valor limitado, pois não reflete com precisão o volume intravascular devido à influência da pressão positiva da ventilação mecânica e da disfunção do ventrículo direito. Entretanto, ela serve para medir e monitorar Pressão de Perfusão (PP = PAM ‐ PVC), objetiva‐se com isso melhorar a perfusão renal, periférica e oxigenação tecidual como um todo.41 Dois estudos demonstraram melhoria da sobrevida com a combinação de adequada PP e SCVO2 > 70%.37,38
O lactato sérico é o produto da respiração anaeróbica em condições nas quais não há perfusão adequada nos tecidos. A sua diminuição ou clearance após a instituição da terapia (10% em relação ao valor inicial) tem sido associada a aumento da sobrevida em adultos.42,43 Como explicado anteriormente, um perfil de pacientes apresentará choque vasodilatado com alto débito cardíaco e hiperlactatemia. Neles, o clearance de lactato poderá ser usado como marcador de resposta terapêutica e marcador prognóstico. Porém, para a grande maioria dos pacientes pediátricos, esse exame apresentará valores normais na chegada, não pode ser usado para esse fim.37 Acreditamos que para a grande maioria dos casos de sepse em pediatria o lactato tenha seu valor como marcador prognóstico, e não como monitoração ou alvo terapêutico.
A descompensação hemodinâmica na sepse envolve uma complexa interação entre tônus vascular, disfunção miocárdica e hipovolemia que muitas vezes torna difícil o raciocínio clínico guiado apenas pelo exame físico à beira de leito. Nos pacientes com choque refratário a volume (> 40mL/kg) a decisão de fornecer mais fluidos, inotrópicos ou vasopressores tradicionalmente era direcionada pelo exame clínico, classificava‐se o choque em “quente” ou “frio”.31 Porém, nem sempre a observação clínica é precisa em definir o tipo de choque ou estimar o índice cardíaco. Além disso, eles podem mudar de característica no decorrer do tratamento da doença.31,44 A monitoração multimodal surgiu para aumentar a precisão nessa tomada de decisão. Ela usa parâmetros clínicos, monitoração da pressão invasiva e exame de ecografia à beira de leito para isso.31 O estudo de Ranjit et al., as ecografias cardíaca e de veia cava inferior, feitas por intensivista à beira de leito, associada a monitoração invasiva da pressão arterial, foram responsáveis por mudança em conduta em 87,5% dos pacientes do estudo. Nesse estudo, o exame físico sozinho não foi confiável para definir o tipo de choque (alto x baixo índice cardíaco; vasoconstrito x vasodilatado).31 Acreditamos que essa abordagem individualizada, guiada por exames confiáveis de fácil execução à beira‐leito e metas pré‐estabelecidas, seja a melhor estratégia na tomada de decisão deste perfil mais complexo de paciente. A figura 2 apresenta um resumo de boas práticas e alvos no choque séptico.
Resumo das boas práticas e alvos no choque séptico. Adaptado de Ames et al.41
SIRS, síndrome da resposta inflamatória sistêmica; PA, pressão arterial; TEC, tempo de enchimento capilar; PAM, pressão arterial média; PVC, pressão venosa central; IC, índice cardíaco; SVCO2, saturação venosa de veia cava superior.
Os marcadores inflamatórios são exames que podem ser usados na prática clínica para diagnóstico, estratificação de risco (prognóstico) e monitoração da resposta à terapia antibiótica (e seu uso racional determinando o tempo de tratamento) da sepse. A aplicação desses biomarcadores deve ser criteriosa e sempre interpretada num contexto clínico. Abaixo descreveremos os principais biomarcadores usados na sepse pediátrica.
A proteína C‐reativa (CRP) é um dos biomarcadores mais usados em pediatria. Sua utilidade no diagnóstico é limitada, principalmente pela baixa sensibilidade em diferenciar casos de sepse grave e infecções bacterianas comuns em uma medida isolada.45 A maior aplicação da CRP está no seguimento de pacientes com sepse. A queda de 60% no quarto dia de doença está associada a um prognóstico favorável, assim como a sua manutenção em valores próximos aos iniciais à má resposta terapêutica.46
A ferritina sérica, além de representar as reservas de ferro do organismo, é uma proteína de fase aguda que se eleva na presença de citocinas inflamatórias. Desde 2007 ela é usada como marcador prognóstico na sepse pediátrica, estima mortalidade ou desfechos desfavoráveis, de forma isolada ou em associação com o CRP.18,47 Além disso, o seu acompanhamento durante o episódio de choque séptico de má evolução pode indicar a presença de sepse hiperferritinêmica, muitas vezes indica terapia específica como corticoides, imunoglobulina, plasmaferese ou mesmo imunossupressão.48 Seu valor de ponto de corte para mortalidade ainda é motivo de estudo, mas acredita‐se que seja menor do que o encontrado no passado no estudo pioneiro de Garcia et al. (500 ng/mL).18 Há evidência que isso aconteça em cenários de poucos recursos com alta prevalência de anemia ferropriva.49
A procalcitonina, em comparação com a RCP e a ferritina, tem maior poder diagnóstico de sepse bacteriana em pediatria. Valores abaixo de 0,5 ng/mL são sugestivos de inflamação sem etiologia infecciosa e acima de 2 ng/mL de sepse de origem bacteriana. Assim como a RCP, ela também pode ser usada para acompanhar a evolução da doença, é útil na decisão de suspender a antibioticoterapia sem evidenciar aumento de falha terapêutica.50 Seu alto custo em alguns centros ainda é o principal fator que limita a disseminação do seu uso em pediatria.
Escolha da terapia antibióticaO protocolo da American College of Critical Care Medicine/Pediatric Advanced Life Support (ACCM/PALS) orienta a administração de antibioticoterapia dentro da primeira hora de tratamento da sepse.6 A adesão a esse protocolo, que contém medidas como reconhecimento da sepse, obtenção de acesso venoso, ressuscitação volêmica, administração de antibióticos e, quando necessário, início de droga vasoativa, tem sido associada a melhoria da qualidade do atendimento dos pacientes e redução de mortalidade.51–53 Entretanto, alguns autores questionam se a administração de antibióticos até a primeira hora do início do tratamento, em cenários com adequados recursos, realmente faria alguma diferença. Em estudo observacional, esse atraso não esteve associado com aumento do tempo de ventilação mecânica, de internação e mortalidade. Por outro lado, nesse mesmo estudo não houve aumento dos parefeitos com a administração precoce.54 Acreditamos que, de forma geral, eles devam ser administrados o mais cedo possível num quadro de sepse em pediatria, idealmente na primeira hora. Outro ponto fundamental é que exames de culturas devem ser coletados de todos os focos suspeitos de infecção, de preferência antes do início da antibioticoterapia. Essas coletas não devem atrasar, de forma significativa, o início da terapia antimicrobiana.
A escolha do antibiótico na sepse deve ser direcionada de acordo a epidemiologia local, o foco de infecção e o resultado das culturas. Entretanto, essas informações nem sempre estão definidas no atendimento inicial. Empiricamente, para infecções comunitárias, optamos por usar um esquema de monoterapia com cefalosporina de terceira geração (ceftriaxone 100mg/kg/dia por via endovenosa). A associação de antibióticos não parece ter benefício na melhoria dos desfechos em pacientes previamente hígidos e sem fatores de risco.55 Além disso, os efeitos adversos são menos frequentes quando usada a monoterapia.56 Esse esquema pode não ser o ideal se o paciente estiver sob risco de infecção por estafiloco meticilina resistente da comunidade, por gram negativos multirresistentes ou apresentar histórico de imunossupressão ou neutropenia.55,57 Para pacientes com infecção adquirida no ambiente hospitalar ou internados em UTIP em choque refratário, pelo alto risco infecção por estafilococo resistente a meticilina e Pseudomonas sp, optamos pela combinação de vancomicina associada a um betalactâmico (piperacilina + tazobactam) ou cefalosporina de quarta geração (cefepime) com ação antipseudomonas. Nesses pacientes, o local de internação e a alta gravidade influenciam na decisão do esquema de antibióticos.
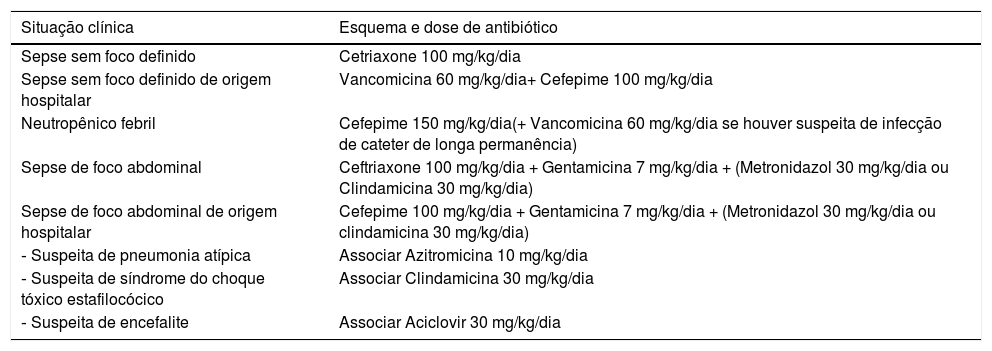
De forma geral, usamos um tempo máximo de tratamento de 7 dias para pacientes com boa evolução e sem agente etiológico definido pelos exames de culturas. Em pacientes com imunossupressão, neutropenia ou dificuldade de resolução do foco de infecção (por exemplo: empiema, necrose ou abscesso), o tratamento pode se estender por mais tempo, em geral 10‐14 dias. Uma proposta de antibióticos empíricos nas diversas condições clínicas está apresentada na tabela 1.
Proposta de esquema de antibioticoterapia para pacientes pediátricos com sepse
| Situação clínica | Esquema e dose de antibiótico |
|---|---|
| Sepse sem foco definido | Cetriaxone 100 mg/kg/dia |
| Sepse sem foco definido de origem hospitalar | Vancomicina 60 mg/kg/dia+ Cefepime 100 mg/kg/dia |
| Neutropênico febril | Cefepime 150 mg/kg/dia(+ Vancomicina 60 mg/kg/dia se houver suspeita de infecção de cateter de longa permanência) |
| Sepse de foco abdominal | Ceftriaxone 100 mg/kg/dia + Gentamicina 7 mg/kg/dia + (Metronidazol 30 mg/kg/dia ou Clindamicina 30 mg/kg/dia) |
| Sepse de foco abdominal de origem hospitalar | Cefepime 100 mg/kg/dia + Gentamicina 7 mg/kg/dia + (Metronidazol 30 mg/kg/dia ou clindamicina 30 mg/kg/dia) |
| ‐ Suspeita de pneumonia atípica | Associar Azitromicina 10 mg/kg/dia |
| ‐ Suspeita de síndrome do choque tóxico estafilocócico | Associar Clindamicina 30 mg/kg/dia |
| ‐ Suspeita de encefalite | Associar Aciclovir 30 mg/kg/dia |
Essa tabela refere‐se a uma sugestão de esquema de antibióticos dos próprios autores. Dose e esquema podem variar de acordo com a condição clínica, idade do paciente e microbiologia local.
Não recomendamos o uso rotineiro de corticoides em pacientes com choque séptico refratário a catecolaminas, apesar dos seus potenciais benefícios teóricos, como melhorias no sistema cardiovascular e ações anti‐inflamatórias.58 Os dados atuais na literatura são inconsistentes para justificar o seu uso.59 O valor do cortisol basal e o teste de resposta ao hormônio adrenocorticotrófico (ACTH) não são exames seguros o suficiente para fazer o diagnóstico de insuficiência adrenal. Sabe‐se que valores altos ou baixos de cortisol basal estão associados com aumento da mortalidade na sepse e que a falha da resposta do eixo do ACTH após estímulo hormonal também é preditora de má resposta ao uso de corticoides exógeno.60,61 Porém, muitos pacientes podem apresentar alterações nestes testes sem a correspondente repercussão clínica.62 Além disso, parefeitos importantes, como hiperglicemia, sangramentos, hipernatremia e supressão da resposta imunológica adaptativa cellular, já foram relatados após o uso de corticoides e isso não pode ser ignorado.59,63 Sugerimos que apenas pacientes com choque refratário a catecolaminas e que estejam em risco de insuficiência adrenal ou falha do eixo adrenal por púrpura fulminante, síndrome de Waterhouse‐Friderichsen, uso crônico de corticoides, hiperplasia adrenal congênita, doenças do eixo hipotálamo/hipófise e intubação com uso de etomidato, possam se beneficiar da infusão de hidrocortisona, que deve iniciar idealmente após a coleta basal do nível de cortisol.6 A dose que usamos é 4mg/kg de hidrocortisona como ataque e, posteriormente, 2mg/kg/dose de 8/8h por no máximo 7 dias ou até que cesse a infusão de drogas vasoativas.
Ventilação mecânicaA ventilação mecânica (VM) provê adequada oxigenação e melhoria da perfusão tecidual, principalmente pela diminuição do trabalho respiratório em pacientes com choque séptico. Alguns aspectos devem ser levados em consideração quando pacientes com sepse ou choque séptico desenvolvem insuficiência ventilatória:
Como regra geral, optamos pela ventilação mecânica invasiva. A possibilidade de broncoaspiração e a instabilidade hemodinâmica gerada pelo choque aumentam a chance de complicações se o paciente não estiver com via aérea garantida. Além disso, na VM invasiva é possível determinar o volume corrente adequado, evita‐se a hiperventilação e a consequente diminuição do retorno venoso. Em casos muito selecionados, como em cenários de poucos recursos, podem‐se usar com sucesso modos de ventilação não invasiva ou cânula de alto fluxo.64
Embora alguns pacientes necessitem de intubação imediata, como em casos de coma ou apneia, na maioria dos casos há tempo e recomenda‐se que seja iniciada ressuscitação volêmica e, se houver indicação, o início da infusão de drogas vasoativas por via periférica antes do procedimento de intubação.6 Esses pacientes estão em elevado risco de deterioração pela hipoxemia, pela ação das drogas usadas na sequência rápida de intubação (SRI) e pela diminuição da pré‐carga, que gera instabilidade hemodinâmica durante o procedimento de intubação e o início da ventilação mecânica.
O uso de atropina como pré‐medicação, nos casos de bradicardia, e de cetamina para sedação na SRI é recomendado em pacientes com choque séptico. Desde que não haja contraindicações ao seu uso, esse esquema parece promover a uma manutenção mais adequada do estado cardiovascular.65
Em cenários de poucos recursos, onde há grande prevalência de doenças como dengue ou malária, a ressuscitação volêmica deve ser cuidadosa e devemos atentar para sinais de insuficiência ventilatória precoce causada por edema pulmonar.66
Oxigenação por membrana extracorpórea (ECMO)O suporte com oxigenação por membrana extracorpórea tem cada vez mais sido
usado com sucesso em pediatria. Em pacientes com sepse, as indicações costumam ser insuficiência ventilatória e/ou choque refratário.6 A taxa de sobrevida em pacientes submetidos a ECMO por instabilidade circulatória em episódio de choque séptico pode chegar a 75%.35 Historicamente, estas taxas só eram alcançadas na faixa etária neonatal.67 O aumento crescente do número de centros e da experiência dos já existentes na América Latina tem contribuído para atingir esses índices na pediatria.68 A ECMO demonstrou nos últimos anos ser um tratamento custo‐efetivo, desde que feito por centros com adequado treinamento e seguidores de protocolos internacionais. A justificativa para dispor recursos nesse tipo de tratamento é que ele contempla uma população de elevada mortalidade, acima de 80% quando sem uso de suporte extracorpóreo, e possibilita, em muitos casos, uma sobrevida com poucas sequelas.
ConclusãoApesar do grande avanço no tratamento da sepse nos últimos anos, com implantação de protocolos na maioria dos centros e tecnologias avançadas, além de melhorias no manejo nas Unidades de Terapia Intensiva Pediátricas, ela continua a ser uma condição de elevada morbimortalidade. Carecemos de uma definição mais precisa e adaptada para a população pediátrica. Isso auxiliaria no reconhecimento precoce, definição de estágios de doença e identificação de terapias específicas para cada etapa evolutiva. Enquanto não obtemos tais marcadores, devem‐se incentivar as boas práticas em todos os cenários, com implantação de protocolos baseados na melhor evidência e ajustados pelos recursos de cada local, que se mostraram como fatores decisivos no controle e diminuição da mortalidade por sepse.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Garcia PC, Tonial CT, Piva JP. Septic shock in pediatrics: the state‐of‐the‐art. J Pediatr (Rio J). 2020;96(S1):87–98.