Acute lymphoblastic leukemia is the most common childhood cancer, yet surprisingly, very few studies have reported the treatment outcomes and the relapse rate of patients from low/middle‐income countries.
MethodThis study was a 5‐year retrospective cohort study. It was conducted at Oncology Center of Mansoura University in Egypt and aimed to estimate the treatment outcomes and the relapse rates of newly diagnosed acute lymphoblastic leukemia in children.
ResultsTwo hundred children suffering from acute lymphoblastic leukemia were studied; forty‐six patients (23%) died during induction and most of those deaths were related to infection. Forty‐one patients (27%) relapsed out of the 152 patients who achieved complete remission. The most common site of relapse was the bone marrow, followed by the isolated central nervous system, 53.7% and 31.7%, respectively. Seventy‐eight percent of relapses occurred very early/early rather than later. The majority of relapse patients’ deaths were related to infection and disease progression. The 5‐year overall survival rate for patients was 63.1% (82.1% for non‐relapsed compared to 36.6% for relapsed patients).
ConclusionThere was a high incidence of induction deaths related to infection and high percentages of very early/early relapses, with high mortalities and low 5‐year overall survival rates. These findings suggest the urgent need for modification of chemotherapy regimens to be suitable for the local conditions, including implementation of supportive care and infection control policies. There is also a requirement for antimicrobial prophylaxis during induction period combined with the necessary increase in government healthcare spending to improve the survival of acute lymphoblastic leukemia in Egyptian children.
Estimar os desfechos do tratamento e as taxas de recidiva de crianças recém‐diagnosticadas com leucemia linfoblástica aguda. É o câncer infantil mais comum, mas surpreendentemente poucos estudos relataram os desfechos do tratamento e a taxa de recidiva em pacientes de países de renda baixa/média.
MétodoEstudo de coorte retrospectivo de cinco anos. Foi feito no Centro de Oncologia da Universidade de Mansoura, no Egito.
ResultadosForam estudadas 200 crianças com leucemia linfoblástica aguda, das quais 46 (23%) morreram durante a indução e a maioria dessas mortes estava relacionada à infecção. Dos 152 pacientes que alcançaram a remissão completa, 41 (27%) apresentaram recidiva. O local mais comum de recidiva foi a medula óssea, seguido pelo sistema nervoso central isolado, com 53,7% e 31,7% dos casos, respectivamente. Das recidivas, 78% ocorreram muito precocemente ou precocemente, em vez de tardiamente. A maioria das mortes de pacientes com recidiva estava relacionada à infecção e progressão da doença. A taxa de sobrevida global em cinco anos para os pacientes foi de 63,1% (82,1% para não recidivados em comparação com 36,6% para os recidivados).
ConclusãoHouve uma alta incidência de mortes na indução relacionadas à infecção e altos percentuais de recidivas muito precoces ou precoces, com altas taxas de mortalidade e baixas taxas de sobrevida global em cinco anos. Nossos achados sugerem a necessidade urgente de modificação dos esquemas quimioterápicos para adequação às nossas condições locais, implantação de políticas de cuidados de suporte e controle de infecções. Há também a necessidade de profilaxia antimicrobiana durante o período de indução, junto com um aumento necessário nos gastos governamentais com a saúde, para melhorar a capacidade de sobrevivência das crianças egípcias com leucemia linfoblástica aguda.
A leucemia linfoblástica aguda (LLA), o câncer infantil mais comum em todo o mundo, caracteriza‐se por apresentar altas taxas de cura e bons desfechos de tratamento em mais de 80% dos casos nos países de alta renda (HIC, do inglês High‐Income Countries);1 entretanto, pouco se sabe sobre os desfechos do tratamento e taxas de recidiva de LLA nas crianças de países de renda baixa/média (LIC/MIC, do inglês: Low Income Countries/Middle‐Income Countries), pouquíssimos estudos foram feitos nesses países.2–6 O Egito, como um país em desenvolvimento de renda média (MIC), sofre com dificuldades econômicas e recursos limitados, o que o impede de alcançar e fornecer melhores taxas de cura em comparação com países desenvolvidos HIC. Este estudo relata os desfechos do tratamento e as taxas de recidiva de LLA nas crianças tratadas na Unidade de Oncologia Pediátrica do Centro de Oncologia da Mansoura University, na região nordeste do delta do Rio Nilo, no Egito.
Pacientes e métodosO Comitê de Pesquisa Institucional e o Comitê de Ética da Mansoura University aprovaram este estudo retrospectivo de revisão de prontuários do período de cinco anos (junho de 2011 a junho de 2016). Esta pesquisa analisou dados de crianças com diagnóstico recente de LLA tratadas gratuitamente em nossa Unidade de Oncologia Pediátrica com uma abrangência populacional de mais de 10 milhões de pessoas. Nossa unidade tem 32 leitos de internação (três leitos por quarto), com um adicional de quatro leitos de cuidados intermediários (dois leitos por quarto, com monitoramento de pacientes e fornecimento de oxigênio). Temos acesso a dois leitos na unidade de terapia intensiva pediátrica, com ventiladores mecânicos que são compartilhados com a unidade de terapia intensiva para adultos (UTI). Não há nas proximidades instalações para hospedagem de pacientes vindo de áreas distantes.
Foram incluídas consecutivamente todas as crianças recém‐diagnosticadas com LLA (entre um e 18 anos). Pacientes com dados faltantes ou incompletos e aqueles que abandonaram o tratamento foram excluídos. As seguintes informações foram coletadas dos prontuários médicos do paciente: sexo, idade no diagnóstico, residência (se em áreas urbanas da cidade de Mansoura e cidades próximas ou em áreas rurais em aldeias próximas ou áreas agrícolas distantes), contagem de glóbulos brancos (WBC, do inglês White Blood Cells), perfis imunofenotípicos da leucemia, comprometimento do sistema nervoso central (SNC), resposta à quimioterapia baseada no exame da medula óssea (MO) no 29° dia, estado clínico (remissão completa, recidiva, último seguimento, óbito ou perdido no seguimento, causa da morte).
Diagnóstico de LLAO exame de MO foi a base do diagnóstico de LLA, toda vez que a MO mostrou blastos ≥ 25%, com confirmações adicionais de diagnósticos positivos de LLA feitos por meio de citometria de fluxo. Pacientes com linfoblastos < 5% no aspirado de MO (29 dias após o tratamento de indução), enquanto apresentavam hematopoiese normal, foram considerados como em remissão completa (RC). O acometimento do SNC foi avaliado através do exame do líquido cefalorraquidiano (LCR) em lâminas preparadas por citocentrifugação, classificado da seguinte forma: SNC1: < 5 WBC/mm3, sem blastos. SNC2: < 5 WBC/mm3 com blastos. SNC3: > 5 WBC/mm3 com blastos.7 Restrições financeiras e de recursos impediram estudos citogenéticos e de doença residual mínima (DRM) na maioria dos pacientes.
Estratificação de risco e protocolos de tratamentoOs pacientes com < 1 ano ou > 10 anos, com a contagem inicial de WBC maior do que 50x109/L, que mostravam infiltração de células blásticas do sistema nervoso central na hospitalização, com imunofenótipo CD10 negativo ou células T precursoras e sem sinais de remissão, confirmado através do exame de MO no 29° dia da terapia de indução, foram classificados como indivíduos com LLA de alto risco; caso contrário, foram considerados pacientes com LLA de risco padrão. Todos os protocolos de tratamento da LLA foram baseados na versão modificada do protocolo Berlin‐Frankfurt‐Münster 90 (ALL‐BFM 90)8 (ver material suplementar para mais detalhes). As informações sobre radioterapia (RT) profilática e terapêutica estão detalhadas nas tabelas suplementares de tratamento (tabelas S1 e S2 de materiais suplementares).
Definição e classificação da recidivaA identificação da recidiva se baseou na reinfiltração ≥ 25% de blastos na MO ou blastos em locais extramedulares. A classificação das recidivas foi baseada no tempo decorrido após o diagnóstico inicial: recidiva “muito precoce” foi definida como a que ocorreu em menos de 18 meses após o diagnóstico, recidiva “precoce” entre 18 e 36 meses após o diagnóstico e recidiva “tardia” após 36 meses do diagnóstico.7
O abandono do tratamento foi definido como o término dos cuidados de saúde pelos pais/responsáveis e/ou se mais de quatro semanas se passaram sem que o paciente comparecesse para o tratamento programado.9
A avaliação de não adesão foi estabelecida durante a fase de manutenção, mais apropriadamente descrita como o fato de o paciente interromper a ingestão de medicamentos sem orientação médica, através de revisão de prontuários, revisão de registros de entrega de medicamentos na farmácia ou durante visitas clínicas e discussões com famílias e/ou através dos próprios pacientes. Não foi possível medir o metabolito da 6‐mercaptopurina (6‐MP) devido a restrições financeiras e indisponibilidade de instalações para o teste.
Análise estatísticaPara a análise dos dados usamos o software estatístico SPSS (Statistical Package for the Social Sciences para Windows, versão 18.0. Chicago, EUA). O teste t de Student foi usado para comparar dados numéricos e o teste de qui‐quadrado para comparar dados não numéricos, enquanto a sobrevida global (SG) foi medida com base no tempo do diagnóstico até a morte do paciente ou seu último registro de seguimento documentado. Os cálculos de sobrevida livre de eventos (SLE) foram baseados no tempo do diagnóstico até a data do primeiro evento, seja na falha de indução, recidiva em qualquer local ou morte dos pacientes. Os cálculos de sobrevida livre de recidiva (SLR) foram baseados no fim do tempo de indução até a recidiva dos pacientes que atingiram a RC. As curvas de sobrevida de Kaplan‐Meier foram usadas para estimar a SLR e a SG e a comparação foi feita através do teste de log‐rank. O modelo de regressão de riscos proporcionais de Cox foi usado para a análise univariada e multivariada de fatores prognósticos, com intervalos de confiança de 95% (IC). Valores de p < 0,05 foram considerados significativos.
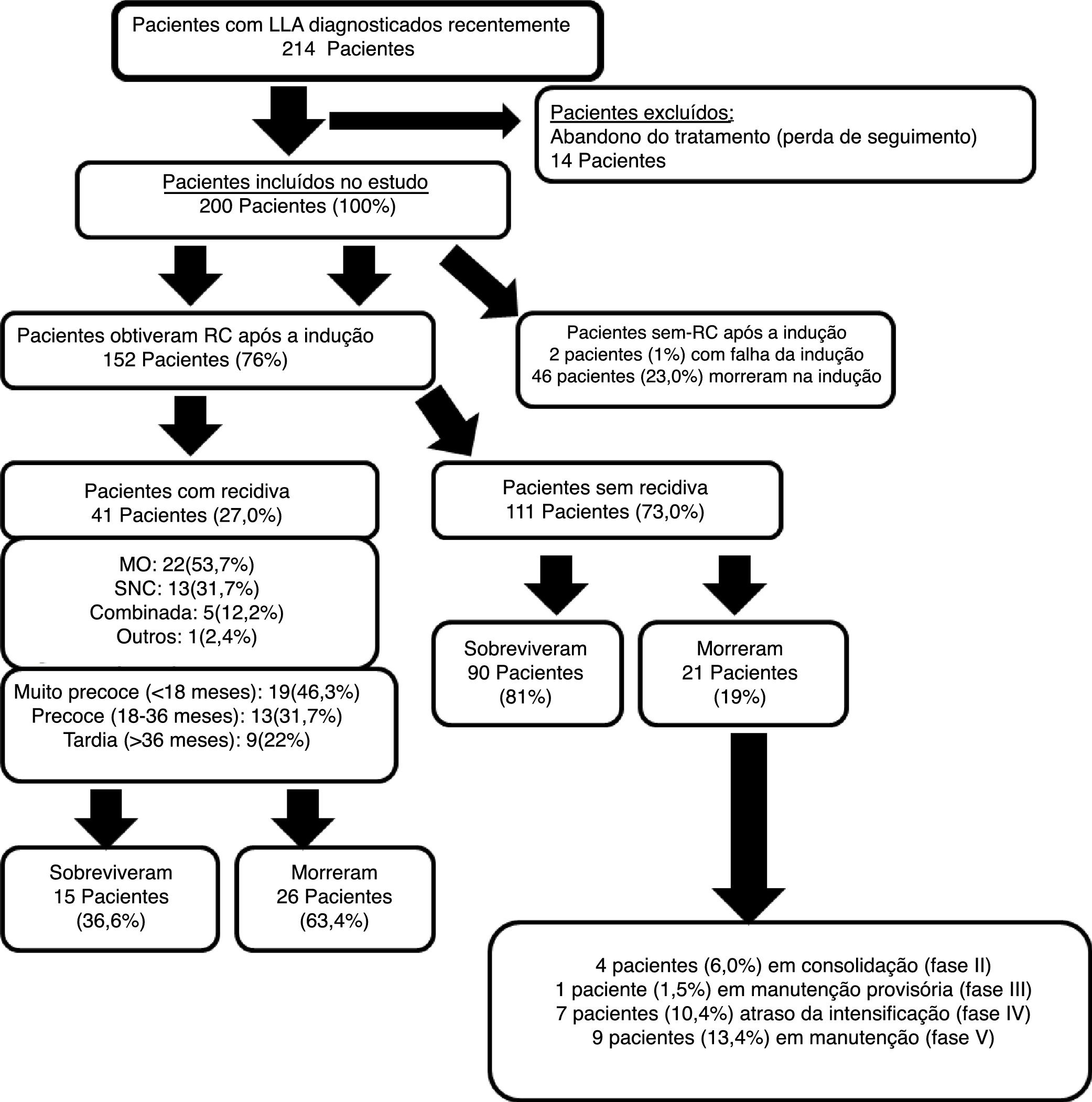
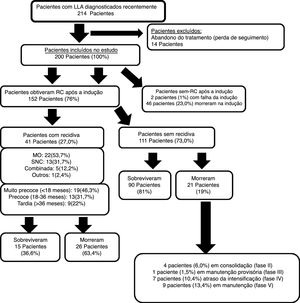
ResultadosForam estudados 200 pacientes recém‐diagnosticados com LLA entre os 214 inicialmente avaliados, já que 14 (6,5%) abandonaram o tratamento, com perda do seguimento. Dos 200 pacientes estudados, 152 (76%) obtiveram RC após a fase de indução A falha da indução ocorreu em apenas dois pacientes (1%), enquanto morte por indução ocorreu em 46 (23%).
Dos 152 pacientes que atingiram a RC, 41 (27%) apresentaram recidiva. A figura 1 ilustra o fluxograma clínico do estudo. A mediana do tempo de acompanhamento deste estudo foi de 2,4 anos (entre 0,25 e 5,9 anos).
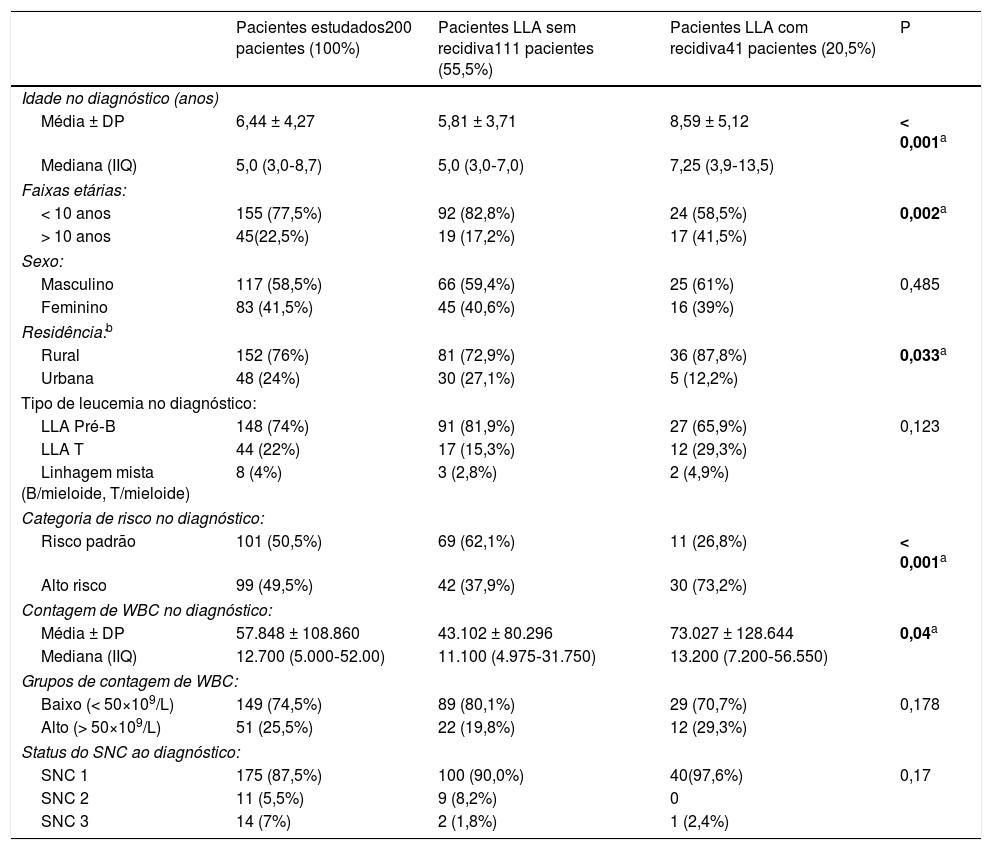
As diferentes características clínicas dos pacientes estudados e a comparação entre pacientes com recidiva e sem recidiva são mostradas na tabela 1. Dos pacientes estudados, 23% (46/200) morreram durante a fase de indução.
Diferentes características dos indivíduos e comparação entre pacientes com LLA com recidiva versus sem recidiva (teste t de Student e teste de qui‐quadrado)
| Pacientes estudados200 pacientes (100%) | Pacientes LLA sem recidiva111 pacientes (55,5%) | Pacientes LLA com recidiva41 pacientes (20,5%) | P | |
|---|---|---|---|---|
| Idade no diagnóstico (anos) | ||||
| Média ± DP | 6,44 ± 4,27 | 5,81 ± 3,71 | 8,59 ± 5,12 | < 0,001a |
| Mediana (IIQ) | 5,0 (3,0‐8,7) | 5,0 (3,0‐7,0) | 7,25 (3,9‐13,5) | |
| Faixas etárias: | ||||
| < 10 anos | 155 (77,5%) | 92 (82,8%) | 24 (58,5%) | 0,002a |
| > 10 anos | 45(22,5%) | 19 (17,2%) | 17 (41,5%) | |
| Sexo: | ||||
| Masculino | 117 (58,5%) | 66 (59,4%) | 25 (61%) | 0,485 |
| Feminino | 83 (41,5%) | 45 (40,6%) | 16 (39%) | |
| Residência:b | ||||
| Rural | 152 (76%) | 81 (72,9%) | 36 (87,8%) | 0,033a |
| Urbana | 48 (24%) | 30 (27,1%) | 5 (12,2%) | |
| Tipo de leucemia no diagnóstico: | ||||
| LLA Pré‐B | 148 (74%) | 91 (81,9%) | 27 (65,9%) | 0,123 |
| LLA T | 44 (22%) | 17 (15,3%) | 12 (29,3%) | |
| Linhagem mista (B/mieloide, T/mieloide) | 8 (4%) | 3 (2,8%) | 2 (4,9%) | |
| Categoria de risco no diagnóstico: | ||||
| Risco padrão | 101 (50,5%) | 69 (62,1%) | 11 (26,8%) | < 0,001a |
| Alto risco | 99 (49,5%) | 42 (37,9%) | 30 (73,2%) | |
| Contagem de WBC no diagnóstico: | ||||
| Média ± DP | 57.848 ± 108.860 | 43.102 ± 80.296 | 73.027 ± 128.644 | 0,04a |
| Mediana (IIQ) | 12.700 (5.000‐52.00) | 11.100 (4.975‐31.750) | 13.200 (7.200‐56.550) | |
| Grupos de contagem de WBC: | ||||
| Baixo (< 50×109/L) | 149 (74,5%) | 89 (80,1%) | 29 (70,7%) | 0,178 |
| Alto (> 50×109/L) | 51 (25,5%) | 22 (19,8%) | 12 (29,3%) | |
| Status do SNC ao diagnóstico: | ||||
| SNC 1 | 175 (87,5%) | 100 (90,0%) | 40(97,6%) | 0,17 |
| SNC 2 | 11 (5,5%) | 9 (8,2%) | 0 | |
| SNC 3 | 14 (7%) | 2 (1,8%) | 1 (2,4%) | |
DP, desvio padrão; IIQ, intervalo interquartil: 25%‐75%; SNC, sistema nervoso central; WBC, glóbulos brancos.
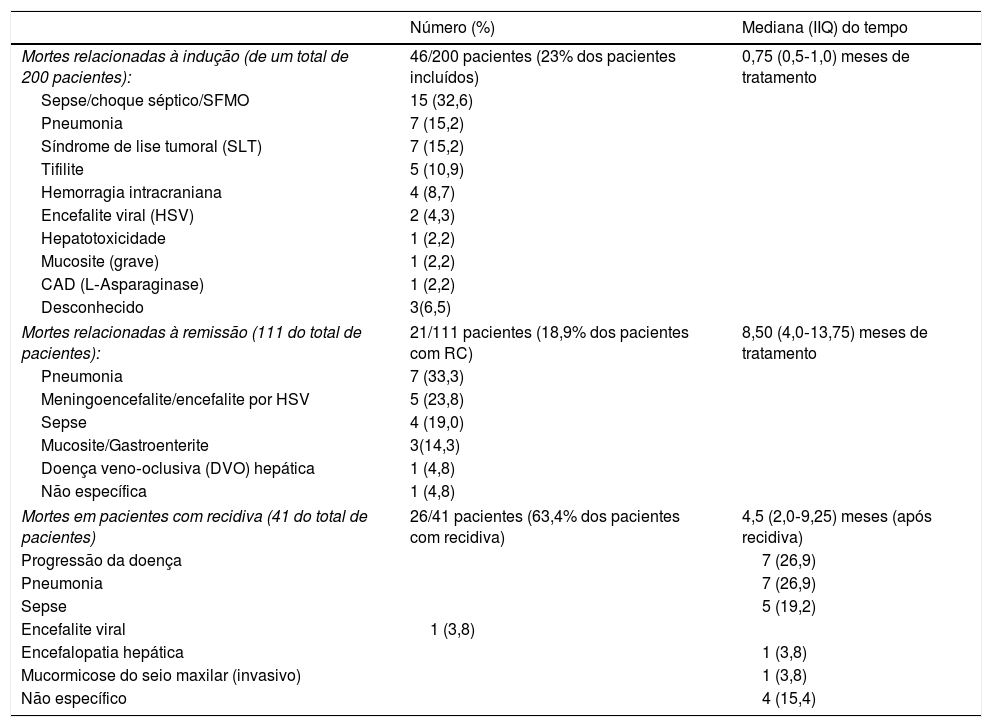
A tabela 2 mostra as principais causas de morte em pacientes submetidos à indução e que, infelizmente, morreram devido a doenças infecciosas. As taxas de mortalidade permaneceram inalteradas ao longo do período observado.
Dados comparativos das diferentes causas e tempo de ocorrência dos óbitos em pacientes com recidiva e sem recidiva
| Número (%) | Mediana (IIQ) do tempo | |
|---|---|---|
| Mortes relacionadas à indução (de um total de 200 pacientes): | 46/200 pacientes (23% dos pacientes incluídos) | 0,75 (0,5‐1,0) meses de tratamento |
| Sepse/choque séptico/SFMO | 15 (32,6) | |
| Pneumonia | 7 (15,2) | |
| Síndrome de lise tumoral (SLT) | 7 (15,2) | |
| Tifilite | 5 (10,9) | |
| Hemorragia intracraniana | 4 (8,7) | |
| Encefalite viral (HSV) | 2 (4,3) | |
| Hepatotoxicidade | 1 (2,2) | |
| Mucosite (grave) | 1 (2,2) | |
| CAD (L‐Asparaginase) | 1 (2,2) | |
| Desconhecido | 3(6,5) | |
| Mortes relacionadas à remissão (111 do total de pacientes): | 21/111 pacientes (18,9% dos pacientes com RC) | 8,50 (4,0‐13,75) meses de tratamento |
| Pneumonia | 7 (33,3) | |
| Meningoencefalite/encefalite por HSV | 5 (23,8) | |
| Sepse | 4 (19,0) | |
| Mucosite/Gastroenterite | 3(14,3) | |
| Doença veno‐oclusiva (DVO) hepática | 1 (4,8) | |
| Não específica | 1 (4,8) | |
| Mortes em pacientes com recidiva (41 do total de pacientes) | 26/41 pacientes (63,4% dos pacientes com recidiva) | 4,5 (2,0‐9,25) meses (após recidiva) |
| Progressão da doença | 7 (26,9) | |
| Pneumonia | 7 (26,9) | |
| Sepse | 5 (19,2) | |
| Encefalite viral | 1 (3,8) | |
| Encefalopatia hepática | 1 (3,8) | |
| Mucormicose do seio maxilar (invasivo) | 1 (3,8) | |
| Não específico | 4 (15,4) | |
CAD, cetoacidose diabética; DVO, doença veno‐oclusiva; HSV, herpes‐vírus simplex; IIQ, intervalo interquartil 25%‐75%; RC, remissão completa; SFMO, síndrome de falência de múltiplos órgãos; SLT, síndrome de lise tumoral.
A SG e a SLE em cinco anos para todos os pacientes foram de 63,1% e 46%, respectivamente. A SG em cinco anos para pacientes que alcançaram a remissão, após a exclusão de óbitos relacionados à indução e/ou pacientes com falha de indução, foi de 82,2% para aqueles que não apresentaram recidiva e de 36,6% para os com recidiva (p < 0,001), como mostrado na figura S1 do material suplementar para comparação. Os pacientes recidivados apresentaram maior risco, com probabilidade quatro vezes maior de chegar a óbito do que os sem recidiva (p < 0,001).
Desfecho de pacientes sem recidivaDos 111 pacientes que obtiveram RC sem apresentar recidiva, 90 (81%) sobreviveram, enquanto os 21 restantes (19%) morreram principalmente devido a complicações relacionadas a infecções, como mostrado na tabela 2.
Desfecho de pacientes com recidivaDos 41 pacientes com recidiva, 15 (36,6%) sobreviveram e foram tratados da seguinte forma: nove receberam quimioterapia de reindução, quatro receberam quimioterapia e irradiação craniana e dois foram submetidos a transplante alogênico de células‐tronco periféricas (PSCT, do inglês Peripheral Stem Cell Transplantation). Infelizmente, 26 (63,4%) dos pacientes com recidiva morreram. A grande maioria dessas mortes ocorreu nos estágios iniciais da segunda reindução e os pacientes tiveram uma sobrevida média de 4,5 meses. Mais uma vez, essas mortes aconteceram principalmente devido a eventos relacionados às infecções, como pneumonia, sepse ou progressão da doença (tabela 2). Os pacientes que apresentaram recidiva eram significativamente mais velhos e vinham principalmente de áreas rurais, com critérios de alto risco e maior contagem de WBC no diagnóstico.
Dos pacientes recidivados (46,3%), 19 apresentaram recidiva “muito precoce”, que foi o tipo mais comum, seguido por recidivas “precoces” e “tardias”. A MO foi o local de recidiva mais frequente, seguido pelo SNC isolado (figura 1).
Uma diferença significativa foi encontrada em relação à SG em cinco anos e tipo de recidiva (p = 0,005), com SG em cinco anos de 61,5% para pacientes com recidiva no SNC e 27,3% para pacientes com recidiva na MO, nenhum paciente sobreviveu a essas recidivas combinadas. A figura S2 do material suplementar mostra a capacidade de sobrevivência em relação ao tempo de recidiva. Os pacientes com recidiva “muito precoce” apresentaram SG em cinco anos significativamente menor (15,8%) (p < 0,001) em comparação com pacientes com recidiva “precoce” e “tardia”, cujas SG foram 46,2% e 66,7%, respectivamente.
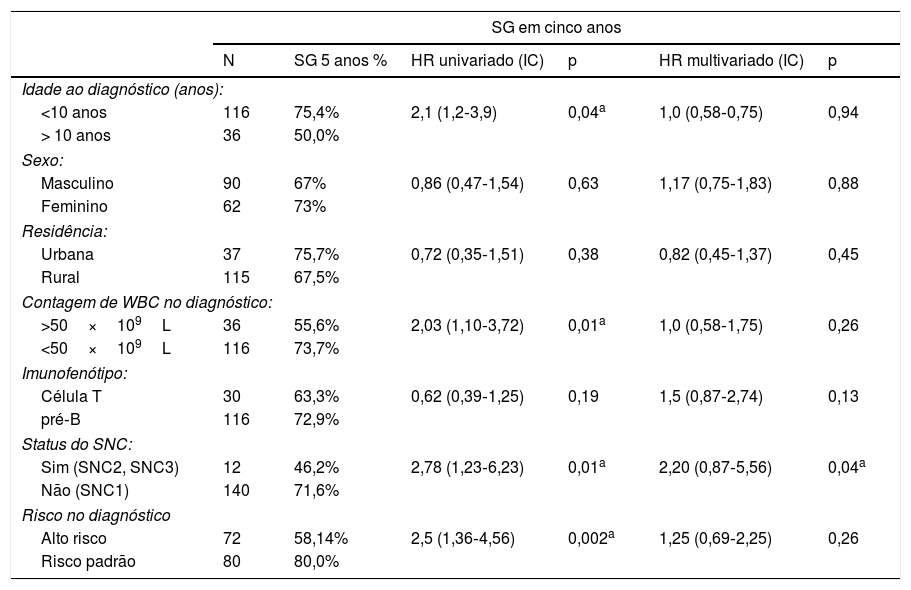
Preditores de morteA avaliação do risco de morte foi feita com o Modelo de Riscos Proporcionais de Cox (tabela 3). A análise univariada mostrou que pacientes maiores de 10 anos com uma contagem inicial alta de WBC, maior do que 50x109/L, juntamente com status positivo do SNC (SNC2 ou SNC3), de uma categoria de alto risco no diagnóstico, foram preditores significativos para redução da SG em cinco anos. A análise de regressão de Cox multivariada destacou que o apenas o status do SNC (SNC2 ou SNC3) já foi considerado um fator prognóstico independente desfavorável para a SG em cinco anos, pois apresentou correlação significativa com o aumento do risco de morte.
Hazard ratio (HR) para óbito pela análise de regressão univariada e multivariada de Cox das características clínicas e laboratoriais, durante a SG em cinco anos
| SG em cinco anos | ||||||
|---|---|---|---|---|---|---|
| N | SG 5 anos % | HR univariado (IC) | p | HR multivariado (IC) | p | |
| Idade ao diagnóstico (anos): | ||||||
| <10 anos | 116 | 75,4% | 2,1 (1,2‐3,9) | 0,04a | 1,0 (0,58‐0,75) | 0,94 |
| > 10 anos | 36 | 50,0% | ||||
| Sexo: | ||||||
| Masculino | 90 | 67% | 0,86 (0,47‐1,54) | 0,63 | 1,17 (0,75‐1,83) | 0,88 |
| Feminino | 62 | 73% | ||||
| Residência: | ||||||
| Urbana | 37 | 75,7% | 0,72 (0,35‐1,51) | 0,38 | 0,82 (0,45‐1,37) | 0,45 |
| Rural | 115 | 67,5% | ||||
| Contagem de WBC no diagnóstico: | ||||||
| >50×109L | 36 | 55,6% | 2,03 (1,10‐3,72) | 0,01a | 1,0 (0,58‐1,75) | 0,26 |
| <50×109L | 116 | 73,7% | ||||
| Imunofenótipo: | ||||||
| Célula T | 30 | 63,3% | 0,62 (0,39‐1,25) | 0,19 | 1,5 (0,87‐2,74) | 0,13 |
| pré‐B | 116 | 72,9% | ||||
| Status do SNC: | ||||||
| Sim (SNC2, SNC3) | 12 | 46,2% | 2,78 (1,23‐6,23) | 0,01a | 2,20 (0,87‐5,56) | 0,04a |
| Não (SNC1) | 140 | 71,6% | ||||
| Risco no diagnóstico | ||||||
| Alto risco | 72 | 58,14% | 2,5 (1,36‐4,56) | 0,002a | 1,25 (0,69‐2,25) | 0,26 |
| Risco padrão | 80 | 80,0% | ||||
HR, Hazard ratio; IC, intervalo de confiança de 95%; SG, sobrevida global.
Abandonaram o tratamento imediatamente após o início do tratamento da leucemia 14 pacientes e o contato para o seguimento foi perdido sem motivo ou razão justificável. Nenhum desses pacientes retornou ou fez contato com nosso hospital. Existe a possibilidade de que tenham procurado tratamento em outro lugar, em outro hospital, ou possam ter falecido em casa. O abandono do tratamento ocorreu durante a fase de manutenção para sete pacientes (13‐26 meses), após a indução para cinco (1‐1,5 meses), e para outros dois pacientes após intensificação tardia (quatro meses).
A baixa adesão e/ou a interrupção do tratamento foram registradas em 28,9% dos pacientes estudados. As causas mais comuns da não adesão foram: o hospital não adquiriu medicação suficiente devido à escassez econômica e orçamento inadequado; incapacidade dos pacientes de comprar medicamentos de fontes externas, o que agravou a indisponibilidade de medicamentos. Poucos pacientes relataram a omissão de doses, seja por esquecimento, por recusa do paciente em tomar medicamentos ou porque os pais interromperam os medicamentos devido a doenças sem gravidade (resfriado comum) ou medo de complicações.
DiscussãoEste estudo relatou os desfechos do tratamento de crianças com LLA e tentou explorar as áreas que precisam de melhorias na implantação de políticas de tratamento do câncer. Regimes de tratamento de alta intensidade sem os cuidados adequados de suporte geralmente levam a uma taxa de SLE paradoxalmente mais baixa, aumentam a morte tóxica.10 Ao usar protocolos de HIC para tratamento da LLA infantil, o protocolo Total XI resultou em 72% de SLE nos EUA, enquanto o Brasil relatou 32% de SLE.11 Curiosamente, quando esse mesmo protocolo foi usado em El Salvador com algumas modificações/adaptações (sem indução com antraciclinas), a SLE aumentou de 10% para 48%.12
Em nossos protocolos de tratamento, tentamos nos manter em conformidade com os padrões e protocolos internacionais, mesmo de difícil adesão; e esses padrões se tornam cada vez mais complicados com a constante introdução de extensas necessidades e altos gastos com medicamentos e cuidados de suporte. Infelizmente, em nosso estudo, a maioria das mortes foi relacionada à indução, a infecção/sepse é a principal causa de morte. Estudos de desfecho de tratamento de crianças egípcias com LLA e de países em desenvolvimento vizinhos são mostrados na tabela S3 do material suplementar.6,13–17 De maneira similar, estudos do México2 e da Índia5 relataram mortes em 24% a 63,9% dos pacientes, sepse foi a principal causa de morte, em 53,3% e 71,4% dos casos nesses países, respectivamente. Em contraste, Jastaniah et al.,6 de um país em desenvolvimento (Arábia Saudita), com cuidados de suporte e recursos financeiros adequados, relataram apenas 2,7% de mortes por indução em seus pacientes.
A redução da quimioterapia de indução pode ser benéfica, mas nem sempre é necessariamente melhor. Os esquemas de tratamento com pequenas modificações/adaptações, como omissão de indução de duas doses de doxorrubicina ou o uso de antibióticos profiláticos, podem resultar em grandes benefícios para os LIC e MIC.18 O uso de antimicrobianos profiláticos é uma abordagem para diminuir a mortalidade por indução relacionada à infecção, especialmente com poucos recursos e instalações de cuidado de suporte inadequadas. Os oncologistas são, eventualmente, obrigados a modificar os esquemas de tratamento devido a graves infecções bacterianas/virais ou fúngicas disseminadas, mau estado nutricional, mucosite grave e acesso deficiente a instalações de cuidados de suporte. A modificação da quimioterapia geralmente pode ser feita através de reduções de dosagens, remoção de componente do esquema de tratamento, encurtamento do ciclo ou administração de menos ciclos.18–20 Messinger et al.21 relataram não haver qualquer melhoria adicional da SLE para pacientes de risco padrão com o uso de antraciclinas com uma terapia de indução com três fármacos (prednisona, vincristina e L‐asparaginase). Além disso, no protocolo BFM‐90, a redução de 25% da dose de indução de antraciclina não teve efeitos adversos na sobrevivência.22 Curiosamente, estudos sobre a LLA com o protocolo BFM 95, em comparação com ensaios anteriores, relataram que uma redução de 50% da dose de indução com daunorrubicina em pacientes de risco padrão foi segura, com a excelente SLE de 89,5%.23 Hunger et al.,19 em estudo na República Dominicana, relataram que o uso de quimioterapia de indução reduzida em pacientes com risco padrão, com o uso da indução com três fármacos sem antraciclinas, juntamente com quatro semanas de consolidação oral com 6‐MP, resultou em uma melhoria na SG em 12 e 24 meses, de 50% para 80% e de 40% para 70%, respectivamente, e reduziu a taxa de mortalidade.
Diminuir a dosagem ou omitir as antraciclinas administradas a todas as crianças com LLA com critérios de baixo risco pode ser considerado uma boa prática, ou seja, para aqueles pacientes com < 10 anos, contagem de WBC < 50x109/L e com envolvimento negativo do SNC, ou até mesmo adiar a administração das antraciclinas durante a fase de indução, aguardar os resultados dos exames da MO no 15° dia de indução e somente então considerar a administração apropriada de antraciclinas. Pode ser válida a tentativa de administrar apenas duas das quatro doses de antraciclinas durante a fase de indução, reavaliar a MO no 29° dia de indução e, se necessário, compensar o menor número de doses posteriormente, durante a fase de reindução/intensificação, caso a resposta do paciente não seja satisfatória ou haja atrasos em seu tratamento.
O uso de medicamentos antimicrobianos profiláticos é altamente encorajado para reduzir a mortalidade por indução relacionada à infecção e sepse. Yeh et al.24 relataram que as crianças com LLA submetidas à quimioterapia de indução que receberam um esquema profilático com ciprofloxacina oral e voriconazol oral ou micafungina intravenosa, durante os períodos de neutropenia, apresentaram menor número de episódios de infecções da corrente sanguínea, não apresentaram infecções fúngicas invasivas e não houve mortes por infecções graves. Mais significativamente, isso reduziu episódios de febre e neutropenia e diminuiu o tempo de permanência na UTI. Eles também relataram custos de terapia significativamente menores com o uso de tratamento antibiótico/antifúngico profilático em comparação com os custos de tratamento da infecção; entretanto, esses custos ainda são considerados muito altos e fora do alcance dos LIC. Além disso, esses esquemas de tratamento ainda são considerados de risco devido ao aumento da toxicidade (hepatotoxicidade), com situações emergentes de maior resistência bacteriana aos antibióticos, assim como o receio de interações medicamentosas.
Em nosso estudo, durante a fase de indução da LLA, usamos apenas a profilaxia contra Pneumocystis jirovecii com sulfametoxazol + trimetoprima, mantidas durante todo o tratamento. Atualmente, avaliamos a possibilidade de implantar esquemas de terapia profilática antimicrobiana; no entanto, essa implantação está suspensa devido à falta de recursos financeiros e suporte insuficiente e/ou pendente de empresas farmacêuticas.
A recidiva é considerada um grande problema, porque reduz a capacidade de sobrevivência das crianças com LLA. Um estudo significativo da LLA infantil relatou que as taxas de recidiva tendiam a variar entre 12% e 20%.25 No entanto, em nosso estudo, a recidiva ocorreu em 27% dos pacientes que alcançaram a remissão, com altas taxas de mortalidade e baixa sobrevida em cinco anos. A maioria dos pacientes recidivados experimentou recidiva “muito precoce”. Esses resultados, até certo ponto, estão de acordo com outros estudos em países LIC/MIC em desenvolvimento (México e Paquistão).2–4 Esses estudos relataram taxas de recidiva de 21,5%, 26,2%, chegam a até 58,5%. Os pacientes com LLA com recidiva “precoce” foram os mais frequentemente documentados, com 45,83% dos casos, enquanto a recidiva “muito precoce/precoce” foi registrada em 33,9% e 50,4% dos pacientes e a SG em cinco anos foi de 48,9% e 65%. Por outro lado, outro estudo feito em um país em desenvolvimento e com bons recursos (Arábia Saudita)6 relatou uma SG muito boa em cinco anos, de 84,7%, e taxas de recidiva de 15,1%.
Dados de 20 centros de tratamento oncológico em todo o Egito relataram uma taxa de SG em cinco anos de 40% com diretrizes de tratamento baseadas em protocolos internacionais e sem planos de tratamento nacionais uniformes.26 Os gastos governamentais anuais com saúde per capita constituem um fator importante, os quais estão altamente correlacionados à SG em cinco anos. Há uma forte necessidade de aumentar esses gastos do governo, já que a escassez de serviços e o apoio inadequado para melhorar a infraestrutura de saúde são evidentes.27 Estruturas adequadas de apoio de cuidados têm um impacto direto nas taxas de sobrevivência de crianças com LLA e há a necessidade de melhorá‐las significativamente nos países de baixa e média renda.15 As dificuldades de fornecer cuidados de saúde e de suporte adequados no Egito ficaram mais evidentes após o período da revolução egípcia (2011‐2016), que impactou negativamente todo o aprovisionamento de saúde.
Melhorias em curto prazo podem ser alcançadas com o aumento dos orçamentos da saúde para, no mínimo, manter os estoques de medicamentos essenciais devidamente abastecidos, e também melhorar o treinamento médico, o que requer esforços de colaboração internacional. Essas melhorias também incentivarão a liberdade para troca de dados e informações, promoverão uma avaliação colaborativa das necessidades da criança e o estabelecimento de um registro de câncer para o adequado rastreamento e avaliação das necessidades dessas crianças, para o benefício delas.
O tratamento de crianças com câncer no Egito é feita principalmente em hospitais universitários, sem custos, mas com orçamento, redes de suporte e cuidados inadequados. O paciente muitas vezes experimenta e sofre com a falta de quimioterapia e medicamentos de suporte, que só estão disponíveis através de organizações sem fins lucrativos ou doações pessoais. Há também a falta de políticas de controle de infecção ou a adesão adequada a práticas de higiene pelos funcionários do hospital e/ou das famílias dos pacientes.14 A redução das infecções é possível através de correções cuidadosas nos padrões inadequados adotados para a sua contenção, o que inclui necessariamente aumentar o conhecimento do paciente e de sua família sobre as práticas de higiene doméstica, especialmente para aqueles que vivem nas áreas rurais. As áreas rurais são frequentemente afetadas por ambientes contaminados e pela falta de abastecimento de água.28
O tratamento efetivo da LLA em um país de baixa renda requer que a terapia, inclusive os custos dos medicamentos, seja feita de maneira gratuita ou, no mínimo, seja altamente subsidiada, de forma que a família do paciente consiga pagar o mínimo necessário para um tratamento adequado. Deve haver uma infraestrutura para minimizar o abandono da terapia, como, por exemplo, fundos para o sustento do paciente e de sua família, bem como a provisão de alojamento próximo ao hospital de tratamento, para os pacientes vindos de lugares distantes. É necessário desenvolver fundações locais de captação de recursos ou aceitar o financiamento de agências externas eficientemente organizadas.18
Em conclusão, nosso estudo encontrou um alto número de mortes por indução, principalmente relacionadas à infecção/sepse, com altos percentuais de recidivas muito precoces/precoces e altas taxas de mortalidade, com baixa SG em cinco anos. Esses achados sugerem a necessidade urgente de modificar o regime de tratamento quimioterápico para adequação às condições locais e fornecer o necessário para os cuidados de suporte adequados e a implantação de políticas de controle de infecção. Existe também a necessidade de uso de profilaxia antimicrobiana na fase de indução. Finalmente, há uma necessidade urgente de o governo egípcio de aumentar os gastos com saúde, estabelecer agências de arrecadação de fundos para ajudar a melhorar a capacidade de sobrevivência das crianças com LLA e diminuir as complicações encontradas durante o tratamento.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Abdelmabood S, Fouda AE, Boujettif F, Mansour A. Treatment outcomes of children with acute lymphoblastic leukemia in a middle‐income developing country: high mortalities, early relapses, and poor survival. J Pediatr (Rio J). 2020;96:108–16.