To analyze toll‐like receptor (TLR)‐2 and TLR‐4 expression in monocytes of newborns with late‐onset sepsis.
MethodsThis prospective study included 27 full‐term newborns aged 8 to 29 days, with clinical and laboratory diagnosis of late‐onset sepsis. Ten newborns (37%) had positive cultures. Cytokines were measured by cytometric bead array in peripheral blood, while TLR‐2, TLR‐4 expression, and median fluorescence intensity (MFI) were determined by immunophenotyping peripheral whole blood monocytes, and were analyzed with a BD FACSDiva flow cytometer (Becton, Dickinson and Company, USA). A comparison was performed with healthy adults.
ResultsMicroorganisms were identified in 37% of these septic newborns, and all of them had high levels of pro‐inflammatory cytokines (IL‐8, IL‐6, IL‐1β) and anti‐inflammatory cytokine (IL‐10) corroborating the inflammatory/septic process. In monocytes, the frequency of TLR‐4 expression was higher in infected newborns (p = 0.01).
ConclusionThis study investigated the innate immune response in septic newborns. Septic newborns that relied almost exclusively on the innate immune system showed little in vivo response at monocyte activation, suggesting impaired immune response and increased susceptibility to infection.
Analisar a expressão dos TLR‐2 e TLR‐4 em monócitos de recém‐nascidos com sepse tardia.
MétodosTrata‐se de um estudo prospectivo com 27 recém‐nascidos a termo entre 8 e 29 dias de vida com diagnóstico clínico e laboratorial de sepse tardia dos quais dez (37%) apresentaram cultura positiva. As citocinas foram determinadas por teste de CBA em sangue periférico enquanto que a expressão e MFI (mediana de intensidade de fluorescência) dos TLR‐2 e TLR‐4 foi determinado por imunofenotipagem em monócitos de sangue periférico total através de análise pelo citômetro de fluxo BD FACSDiva. O grupo usado para comparação foi de adultos saudáveis.
ResultadosMicrorganismos foram identificados em 37% dos pacientes e estes juntamente com os pacientes com sepse clínica tiveram níveis elevados de citocinas pró‐inflamatórias (IL‐8, IL‐6, IL‐1β) e de citocina anti‐inflamatória (IL‐10) corroborando o processo inflamatório/infeccioso. No monócito, a frequência de expressão do TLR‐4 foi mais elevada (p = 0,01).
ConclusõesEste estudo analisou a resposta imune inata no recém‐nascido com sepse. Recém‐nascidos sépticos que dependem quase exclusivamente do sistema imune inato apresentaram pouca resposta in vivo na ativação de monócitos o que sugere uma resposta imune deficiente e maior susceptibilidade à infecção.
A sepse corresponde a uma das principais causas de morbidade e mortalidade no recém‐nascido (RN),1,2 com gravidade proporcional à interação existente entre o hospedeiro e seu agente agressor, desencadeando a ativação de uma cascata de eventos responsáveis pela expressão da resposta imune.
A sepse neonatal tardia ocorre após 72h de vida com sinais e sintomas clínicos que podem ser sutis e inespecíficos no começo da infecção, e muitas vezes mal interpretados ou confundidos com outras condições clínicas não infecciosas. Apesar disso, sua evolução pode ser fulminante e levar a choque séptico, coagulação intravascular disseminada e óbito em poucas horas.3–5
Diferentemente do adulto, foram descritos no RN muitos graus de deficiência na resposta imune inata e adaptativa.6 Ao nascimento, a resposta imune adaptativa está prejudicada tanto pela mínima exposição antigênica intraútero quanto pela disfunção das células B e T efetora.1 Por conta disso, o RN conta com a efetividade da resposta imune inata e com a proteção passiva dos anticorpos maternos adquiridos via transplacentária.7
Parte primordial do desencadear da resposta imune inata corresponde à ativação dos receptores Toll‐like (TLR) expressos na superfície de monócitos, macrófagos, células dendríticas, linfócitos, células epiteliais ou no citoplasma de células de diferentes tecidos. Dos dez tipos de receptores descritos em seres humanos, o TLR‐2 e o TLR‐4 reconhecem principalmente componentes de bactérias Gram‐positivas e Gram‐negativas, respectivamente. A ativação de sinais de transdução recruta várias proteínas intracelulares (MyD88, IRAK e TRAF‐6), que vão desencadear a ativação das vias JNK e ERK da cascata das MAPKs (proteínas quinases ativadas por mitógeno). Isso induz a ativação dos fatores de transcrição AP‐1 (ativador proteico‐1) e NF‐kB (fator nuclear kappa B) que expressam vários genes diretamente envolvidos na produção de citocinas inflamatórias em resposta à infecção, exercendo influência fundamental na amplificação da resposta imune celular.8–11
Os monócitos são células possuidoras de antígenos que agem sobre o processo inflamatório e como fontes de macrófagos e células dendríticas. Após a ativação via TLR ocorre aumento na expressão de moléculas coestimuladoras (CD80 e CD86), que são importantes no início da resposta imune adaptativa e na produção de citocinas.12
A regulação do sistema imunológico ao nascimento se traduz numa resposta neonatal do TLR tendenciosa por estimular uma menor produção de citocinas pró‐inflamatórias e mostrar menor polifuncionalidade.13,14 Somente com o decorrer da vida os níveis de citocinas se equiparam aos do indivíduo adulto.15 Ainda no período neonatal têm‐se descrito alterações quantitativas e qualitativas dos receptores Toll‐like e das células participantes da resposta imune inata quando comparadas ao indivíduo adulto, proporcionais à idade gestacional ao nascer.16 Estas diferenças poderiam elucidar a maior susceptibilidade à infecção observada na faixa etária neonatal.1,17
Portanto, apesar da crescente conscientização sobre a importância do sistema do TLR na defesa do RN contra as infecções,18 muito ainda precisa ser esclarecido sobre os mecanismos de regulação das respostas TLR no período neonatal. Assim, este estudo teve como objetivo caracterizar a expressão dos TLR‐2 e TLR‐4 em monócitos de recém‐nascidos a termo com sepse tardia.
MétodosTrata‐se de um estudo prospectivo cuja amostra de conveniência incluiu 27 recém‐nascidos a termo transferidos para a Unidade de Cuidados Intensivos Neonatal do Hospital Instituto da Criança do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo – HCFMUSP, no período entre fevereiro de 2011 a janeiro de 2013. Foram incluídos pacientes cuja idade gestacional esteve entre 37 e 42 semanas, que apresentaram manifestações clínicas e/ou laboratoriais (hemograma completo e PCR) de sepse neonatal entre 72h até 30 dias de vida no momento da internação ou durante a mesma que levou ao início de antibioticoterapia. Os critérios de exclusão foram fatores que por si só alterariam a resposta imune, como: diagnóstico de infecções congênitas, erros inatos do metabolismo, uso de anti‐inflamatórios (indometacina, ibuprofeno e corticóides), diagnóstico de hemorragia intracraniana comprovada por ultrassonografia ou tomografia computadorizada de crânio e procedimento cirúrgico na última semana além daqueles em que a data da coleta da amostra não seria favorável à análise do material.
Os critérios utilizados para definir o diagnóstico e classificar quanto à gravidade clínica (sepse, sepse grave e choque séptico) foram os citados no Surviving Sepsis Campaign (2012), ajustados para a faixa etária com base nos critérios de Goldstein (2005) conforme contemplado pelo consenso.19,20 A análise do hemograma completo foi baseada no escore hematológico de Rodwell (SHR), enquanto que um PCR (proteína C reativa) > 10mg/L foi considerado sugestivo de infecção. O estudo foi aprovado pela Comissão de Ética para Análise de Projetos de Pesquisa do HCFMUSP (CAPPesq).
AmostrasApós consentimento livre e esclarecido dos responsáveis legais foram coletadas amostras de sangue dos RN por punção venosa de veia periférica para a avaliação do quadro infeccioso (HMG, PCR e hemocultura) e análise das citocinas e monócitos. O momento da coleta foi padronizado para ocorrer nas primeiras 24h a partir da suspeita diagnóstica de infecção e início da antibioticoterapia. Distribuiu‐se 0,5mL do sangue em tubo com gel separador para dosagem de citocinas e 1,5mL em tubo com EDTA para realização de imunofenotipagem, que foram realizados no Laboratório de Investigação Médica do Instituto da Criança do HC‐FMUSP (LIM 36).
Análise das citocinasAs citocinas TNF‐ α, IL‐1 β, IL‐2, IL‐4, IL‐6, IL‐8, IL‐10 foram dosadas nas amostras de soro através do teste de CBA (Cytometricbeadarray BD OptEIA™ Set Human), de acordo com as instruções do fabricante.
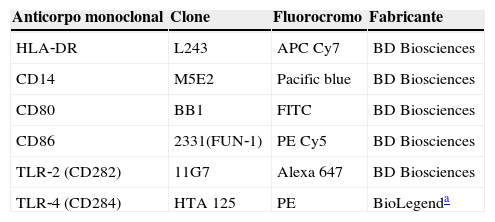
Análise de receptores Toll‐likePara a realização da imunofenotipagem, as hemácias das amostras de sangue colhidas em tubo contendo EDTA foram preparadas para adição de anticorpos pré‐estabelecidos (tabela 1) e processamento até serem transferidas para leitura no citômetro de fluxo FACS LRS II Fortessa. A população de monócitos foi definida pelo gate de células CD14+HLA‐DR+ utilizando como parâmetro o tamanho (forward scatter, FSC) e a granulosidade celular (side scatter, SSC), como descrito na literatura.20
Marcadores de superfície celular de monócitos
| Anticorpo monoclonal | Clone | Fluorocromo | Fabricante |
|---|---|---|---|
| HLA‐DR | L243 | APC Cy7 | BD Biosciences |
| CD14 | M5E2 | Pacific blue | BD Biosciences |
| CD80 | BB1 | FITC | BD Biosciences |
| CD86 | 2331(FUN‐1) | PE Cy5 | BD Biosciences |
| TLR‐2 (CD282) | 11G7 | Alexa 647 | BD Biosciences |
| TLR‐4 (CD284) | HTA 125 | PE | BioLegenda |
HLA‐DR, antígeno leucocitário humano classe II, locus‐DR; CD, cluster of differentiation; TLR, receptor Toll‐like; APC Cy7, aloficocianina combinado ao corante de cianina; Pacific blue, fluoróforo 6, 8‐difluoro‐ 7‐ hidroxicumarina; FITC, isotiocianato de fluoresceína; PE Cy5, conjugado com ficoeritrina e corante de cianina; Alexa 647, fluorocromo para leitura entre 594 e 633nm; PE, R‐ficoeritrina. Clone, refere‐se aos marcadores dos anticorpos monoclonais especificados.
A análise foi feita no software FlowJo (Tree Star, Ashland, OR, USA), onde cada população celular foi analisada separadamente através de gates utilizando como parâmetro o tamanho e a granulosidade celular. Pelo mesmo software foram obtidos os dados apresentados que representam a Mediana da Intensidade de Fluorescência (MFI, median fluorescence intensity) dos respectivos marcadores.
Os números absolutos das populações foram calculados pela multiplicação da porcentagem indicada de cada população na citometria de fluxo e o número absoluto de leucócitos determinados pelo contador automático de células.
Amostras controle de sangue de adultos saudáveisForam obtidas amostras de sangue periférico de 27 adultos saudáveis, que foram utilizadas para a padronização e o controle dos testes realizados. Os critérios de seleção foram: adultos voluntários saudáveis de 18 a 35 anos, dos sexos masculino e feminino, com reações sorológicas negativas para HIV, HTLV I/II, hepatites B e C, doença de Chagas e sífilis, e ausência de sintomas de infecção no período da coleta.
Análise estatísticaOs dados dos RN foram registrados em formulário de coleta e armazenados em planilha eletrônica do pacote estatístico GraphPad‐Prism versão 6.0c para Mac OS X (GraphPad Software, La Jolla, Califórnia, Estados Unidos). Para as variáveis qualitativas foi calculada a frequência absoluta e relativa (número de casos e porcentagem), enquanto que para as variáveis quantitativas foi calculada a mediana, os valores mínimo e máximo e intervalo interquartil (p25‐p75), para cada um dos receptores avaliados em cada análise. O teste de Mann‐Whitney foi usado para comparar a mediana de marcadores entre os grupos, enquanto que a análise comparativa das medianas de mais de dois grupos utilizou‐se o Teste de Kruskal‐Wallis com pós‐teste de Dunn. Os testes foram realizados com limites de intervalo de confiança de 95%, e um valor de p<0,05 foi considerado significativo.
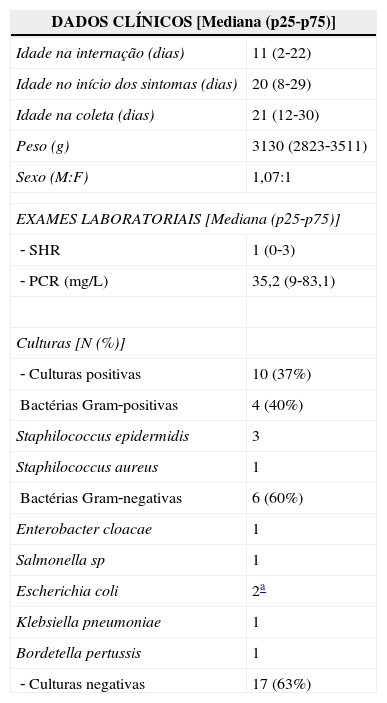
ResultadosAs características clínicas e laboratoriais dos 27 RN incluídos no estudo encontram‐se na tabela 2. Observa‐se que a maioria dos pacientes (62,9%) apresentou quadro compatível com sepse grave (44,4%) e choque séptico (18,5%) ocorrido com mediana de idade de 20 dias de vida, sendo que foi constatado óbito em apenas dois pacientes (7,4%). Dentre os 17 pacientes que apresentaram cultura negativa, todos apresentaram sinais e sintomas clínicos claros de infecção e alterações laboratoriais compatíveis em hemograma e PCR no momento do diagnóstico e na análise clínica sequencial, sendo assim considerados pacientes com sepse clínica.
Distribuição dos 27 RN conforme os dados clínicos e laboratoriais
| DADOS CLÍNICOS [Mediana (p25‐p75)] | |
|---|---|
| Idade na internação (dias) | 11 (2‐22) |
| Idade no início dos sintomas (dias) | 20 (8‐29) |
| Idade na coleta (dias) | 21 (12‐30) |
| Peso (g) | 3130 (2823‐3511) |
| Sexo (M:F) | 1,07:1 |
| EXAMES LABORATORIAIS [Mediana (p25‐p75)] | |
| ‐ SHR | 1 (0‐3) |
| ‐ PCR (mg/L) | 35,2 (9‐83,1) |
| Culturas [N (%)] | |
| ‐ Culturas positivas | 10 (37%) |
| Bactérias Gram‐positivas | 4 (40%) |
| Staphilococcus epidermidis | 3 |
| Staphilococcus aureus | 1 |
| Bactérias Gram‐negativas | 6 (60%) |
| Enterobacter cloacae | 1 |
| Salmonella sp | 1 |
| Escherichia coli | 2a |
| Klebsiella pneumoniae | 1 |
| Bordetella pertussis | 1 |
| ‐ Culturas negativas | 17 (63%) |
| CITOCINAS pg/mL [Mediana (p25‐p75)] | Cultura positiva | Cultura negativa | p |
|---|---|---|---|
| ‐ IL‐6 | 147,7 (72,2‐385,1) | 132,3 (6,3‐332) | 0,6066 |
| ‐ IL‐8 | 137,9 (61,1‐411,8) | 58,1 (16,3‐55,4) | 0,5414 |
| ‐ IL‐1β | 3,0 (1,07‐15,8) | 2,55 (1,15‐5,62) | 0,5349 |
| ‐ IL‐10 | 8,05 (4,12‐19,9) | 3,5 (1,8‐76,15) | 0,4516 |
| ‐ TNF‐ α | 1,2 (0,45‐1,7) | 1,75 (1,0‐2,47) | 0,1188 |
| ‐ IL‐2 | 1,7 (1,4‐1,9) | 2,4 (1,6‐4,55) | 0,1014 |
| ‐ IL‐4 | 2,2 (0,85‐2,8) | 0,4 (0,3‐1,1) | 0,0714 |
N, número absoluto; %, porcentagem; SHR, escore hematológico de Rodwell; PCR, proteína C reativa; IL, interleucina; TNF‐α, fator de necrose tumoral alfa.
Desses pacientes com sepse clínica, oito (47%) apresentaram quadro clínico compatível com sepse, cinco (29,5%) com sepse grave e quatro (23,5%) com choque séptico. Além do mais, a dosagem das citocinas pró‐inflamatórias foi semelhante entre os pacientes infectados, independentemente da positividade da cultura, conforme mostrado na tabela 2. A positividade de cultura coletada de líquido estéril (sangue, urina e líquor) ocorreu em dez pacientes (37%) com distribuição conforme o agente isolado, como apresentado na mesma tabela.
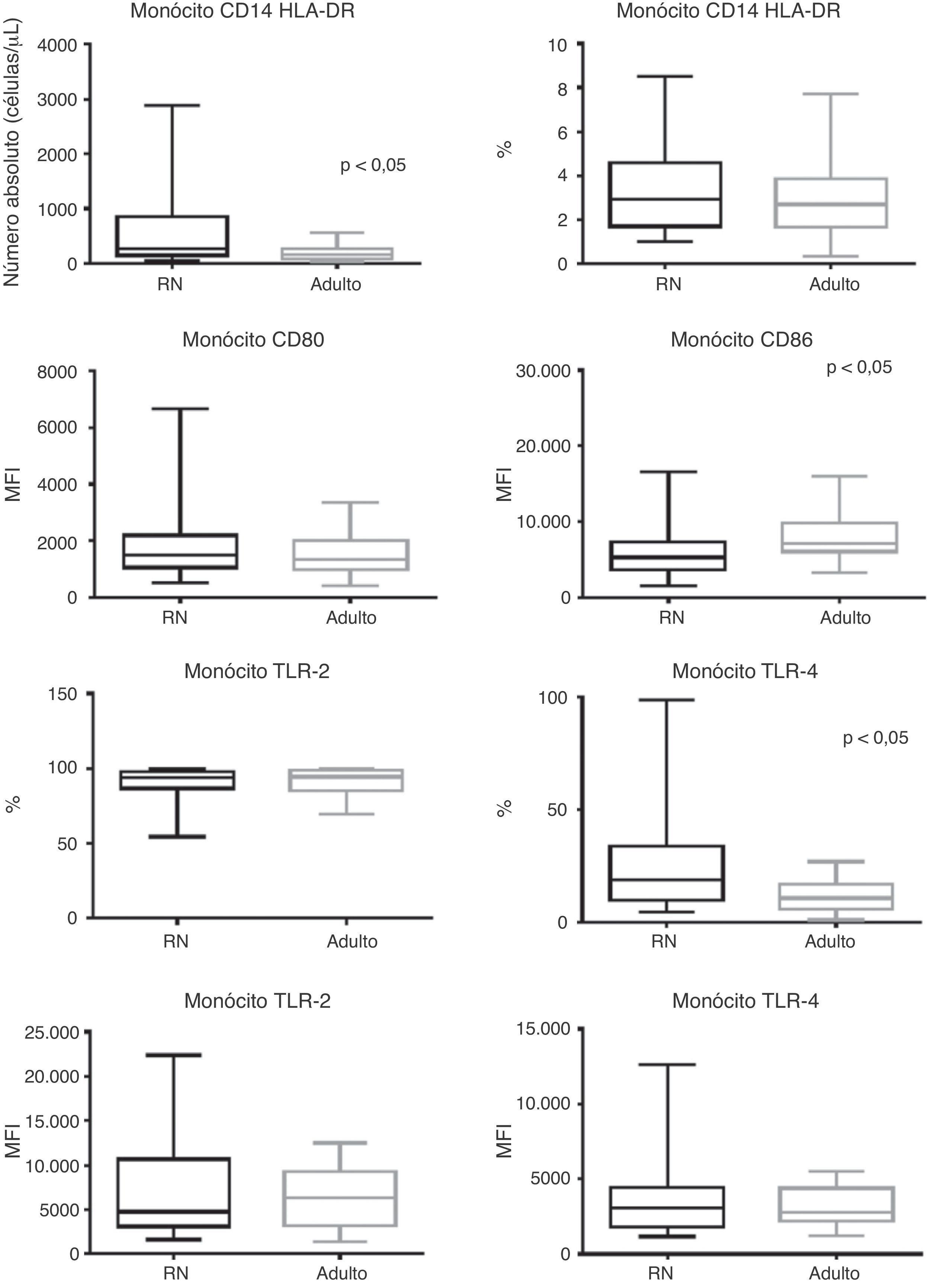
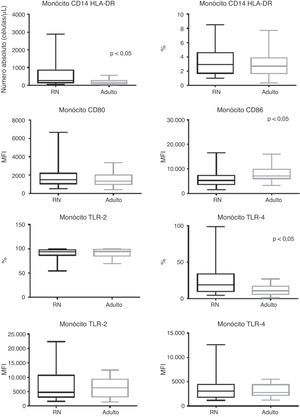
Com relação aos monócitos observa‐se que, apesar do seu número absoluto total ser maior nos RN comparado aos adultos (p < 0,0001), houve frequência semelhante dos monócitos entre os grupos (fig. 1).
Apresentação do gráfico de caixa do número absoluto (células/μL), frequência (%) e mediana da intensidade de fluorescência (MFI) para moléculas de ativação CD80, CD86, TLR‐2 e TLR‐4. Valores expressos em mediana ± intervalo interquartil (p25‐p75); p referente à significância estatística. Número da amostra dos grupos “RN” e “adulto” = 27.
RN, recém‐nascido; HLA‐DR, antígeno leucocitário humano classe II, locus‐DR; CD, cluster of differentiation; TLR, receptor Toll‐like.
O MFI para moléculas de ativação CD80, CD86 e a frequência e MFI para TLR‐2 e TLR‐4 encontra‐se exposta na figura 1. Além do menor MFI para CD86 nos RN com infecção, esses pacientes apresentaram manutenção da expressão no CD80 e TLR‐2 (p = 0,822 e p = 0,825, respectivamente), enquanto houve maior frequência para TLR‐4 no RN séptico em relação ao adulto (p = 0,0043).
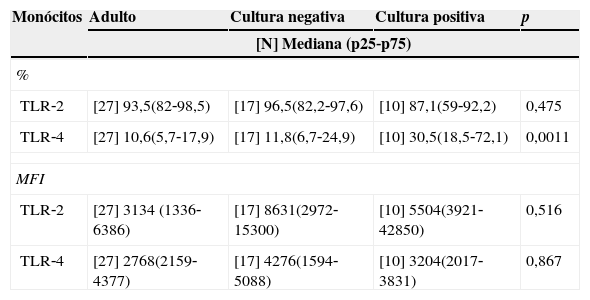
A positividade da cultura esteve relacionada à maior frequência do TLR‐4 comparativamente aos adultos e aos pacientes com cultura negativa (tabela 3), enquanto houve frequência semelhante entre os grupos na avaliação do TLR‐2.
Mediana da frequência (%) e MFI dos receptores Toll‐like 2 e 4 em monócitos de sangue periférico de recém‐nascidos com infecção (cultura positiva ou negativa) e de sangue periférico de adultos
| Monócitos | Adulto | Cultura negativa | Cultura positiva | p |
|---|---|---|---|---|
| [N] Mediana (p25‐p75) | ||||
| % | ||||
| TLR‐2 | [27] 93,5(82‐98,5) | [17] 96,5(82,2‐97,6) | [10] 87,1(59‐92,2) | 0,475 |
| TLR‐4 | [27] 10,6(5,7‐17,9) | [17] 11,8(6,7‐24,9) | [10] 30,5(18,5‐72,1) | 0,0011 |
| MFI | ||||
| TLR‐2 | [27] 3134 (1336‐6386) | [17] 8631(2972‐15300) | [10] 5504(3921‐42850) | 0,516 |
| TLR‐4 | [27] 2768(2159‐4377) | [17] 4276(1594‐5088) | [10] 3204(2017‐3831) | 0,867 |
N, número da amostra; Mediana da intensidade de fluorescência (MFI) p referente à significância estatística pelo teste de Kruskal‐Wallis; TLR, receptor Toll‐like.
Apesar da identificação de algumas bactérias, a análise entre a positividade da cultura conforme o tipo de bactéria identificada e os tipos de receptor Toll‐like não foi realizada devido ao número da amostra estudada.
DiscussãoDescrevemos a resposta in vivo de monócitos neonatais de sangue periférico frente a um quadro infeccioso que evidenciou expressão semelhante ou menor de moléculas de ativação, além de maior expressão dos TLR‐4 em RN com infecção por bactérias gram‐positivas e gram‐negativas e do TLR‐2 em pacientes com sepse clínica.
Os monócitos são células do sistema fagocitário e exercem importante papel na imunidade inata e adquirida através da sua ação sobre o processo inflamatório ou como fonte dos macrófagos e células dendríticas. O comportamento dos TLR no RN, seja ele saudável ou com infecção, é controverso. Segundo Levy et al., embora a expressão basal dos receptores Toll‐like em monócitos de RN a termo seja similar ao de adultos, as consequências funcionais da ativação são bem diferentes, já que se observa menor produção de citocinas nos RN e menor expressão das moléculas coestimuladoras.18
Pôde‐se observar que, frente a um estímulo infeccioso, a população de recém‐nascidos analisada apresentou menor quantidade de células ativadas (MFI para CD86 menor que no indivíduo adulto e MFI para CD80 semelhante ao indivíduo adulto sem infecção) em sangue periférico, sugerindo um menor potencial de atividade deste tipo celular no RN, dado esse de acordo com a literatura.18–21
Com relação ao TLR‐2, observou‐se que o mesmo foi amplamente expresso nos monócitos neonatais (93,9%) e nos monócitos de indivíduos adultos sem infecção (94,6%). A mesma semelhança foi observada com relação ao MFI para esse receptor (MFI = 4748 e 6386, respectivamente), independentemente da positividade ou não da cultura, contrariando achados da literatura que demonstram um up‐regulation na expressão de TLR‐2 em monócitos isolados de pacientes com sepse bem como mudanças significantes na expressão de TLR‐2.22,23 Assim, na nossa casuística, onde todos os recém‐nascidos apresentavam sinais clínicos e laboratoriais de infecção, observamos que, apesar de apresentarem as ferramentas necessárias para reconhecer o antígeno invasor (receptor Toll‐like e moléculas coestimuladoras), estas não sofreram o up‐regulation esperado na análise global.
Enquanto isso, de forma contrária ao relatado por Viemann et al.,1 a presença de cultura positiva esteve associada a uma maior frequência na expressão do TLR‐4 com relação ao indivíduo adulto e com cultura negativa provavelmente secundária ao fato de a maior parte dos pacientes com cultura positiva ter isolado bactérias gram‐negativas (60%) na cultura. Já a expressão semelhante do mesmo receptor nos RN com cultura negativa e nos pacientes adultos pode sugerir uma tendência a imunoparalisia que teria desviado a mediana para níveis mais baixos e semelhantes ao do indivíduo adulto saudável, já que quatro RN deste grupo evoluíram com quadro de choque séptico.
Nosso estudo apresenta limitações que merecem ser ressaltadas, como o tamanho da amostra e seu caráter pontual quanto à avaliação do quadro infeccioso. Ainda assim, os resultados sugerem que no momento da hipótese diagnóstica de infecção no RN os receptores TLR‐2 e o TLR‐4 apresentaram uma expressão maior em RN com infecção, mas com manutenção da expressão das moléculas coestimuladoras indicando uma possível deficiência no processo de ativação celular in vivo.
Assim, embora maiores extrapolações não possam ser feitas, acreditamos que seria interessante verificar na evolução de um quadro clínico de infecção a resposta dos TLR, bem como da ativação celular em RN com infecção.
FinanciamentoFundação de Amparo à Pesquisa do Estado São Paulo ‐ FAPESP.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Os autores agradecem à Fundação de Amparo à Pesquisa do Estado São Paulo pelo financiamento do projeto.
Como citar este artigo: Redondo AC, Ceccon ME, Silveira‐Lessa AL, Quinello C, Palmeira P, Carvalho WB, et al. TLR‐2 and TLR‐4 expression in monocytes of newborns with late‐onset sepsis. J Pediatr (Rio J). 2014;90:472–8.
Estudo realizado no Instituto da Criança, Hospital das Clínicas, Faculdade de Medicina, Universidade de São Paulo, São Paulo, SP, Brasil.