To study bone mineral density (BMD) in adolescent females according to five groups of chronological age (CA), bone age (BA), and breast development stage (B), and to correlate these parameters with plasma bone biomarkers (BB).
MethodsThis was a cross‐sectional study performed in 101 healthy adolescent females between 10 and 20 years old. The study variables were: weight, height, body mass index (BMI), CA, B, BA, calcium intake, BMD, and BB. Osteocalcin (OC), bone alkaline phosphatase (BAP), and C‐terminal telopeptide (S‐CTx) were evaluated for BB. BMD was measured using dual energy X‐ray absorptiometry (DXA).
ResultsBMD in lumbar spine, proximal femur, and total body increased with age, and the respective observed averages were: in CA1 (10 years old), 0.631, 0.692, 0.798g/cm2; in CA2 (11 to 12 years old), 0.698, 0.763, 0.840g/cm2; in CA3 (13 to 14 years old), 0.865, 0.889, 0.972g/cm2; in CA4 (15 to 16 years old), 0.902, 0.922, 1.013g/cm2; and in CA5 (17 to 19 years old), 0.944, 0.929, 1.35g/cm2. These results showed significant differences between 13 and 14 years of age (CA3) or when girls reached the B3 stage (0.709, 0.832, 0.867g/cm2). The highest median concentrations of BB were between 10 and 12 years of age when adolescents were in the B2–B3 (p<0.001). Median BB concentrations decreased in advanced BA and B.
ConclusionsBB concentrations were positively correlated with the peak height velocity and negatively correlated with BMD in the study sites. Increased BMD and BB concentrations were observed in B3.
Avaliar a densidade mineral óssea (DMO) em adolescentes do sexo feminino de acordo com a idade cronológica (IC), idade óssea (IO) e desenvolvimento das mamas (M) e suas correlações com biomarcadores de remodelação óssea em plasma (BO).
MétodosEste foi um estudo transversal prospectivo feito em 101 adolescentes saudáveis do sexo feminino com idade entre 10 e 20 anos. As variáveis estudadas foram: peso, altura, índice de massa corpórea (IMC), IC, IO, M, ingestão de cálcio, DMO e BO. A osteocalcina (OC), fosfatase alcalina óssea (BAP) e o telopeptídeo C terminal (S‐CTx) foram os biomarcadores de remodelação óssea avaliados. A DMO foi obtida por absorciometria de raios‐X de dupla energia (DXA).
ResultadosA DMO de coluna lombar, fêmur proximal e corpo total aumentou com a idade, e as respectivas médias observadas foram: IC1=0,631, 0.692, 0,798g/cm2; IC2, 0,698, 0,763, 0,840g/cm2; IC3, 0,865, 0,889, 0,972g/cm2; IC4, 0,902, 0,922, 1,013g/cm2; e IC5, 0,944, 0,929, 1,35g/cm2. Observou‐se diferença significativa entre 13 e 14 anos (IC3) ou quando as meninas estavam em M3 (0,709, 0,832, 0,867g/cm2). Os valores dos BO apresentaram elevação entre 10 e 12 anos e quando as adolescentes estavam em M2–M3 (p<0,001). Os valores das medianas dos BO diminuíram com o avançar da IO e M.
ConclusõesOs BOs mostraram paralelismo com o pico de velocidade de crescimento e demonstraram correlação negativa com a DMO no sítios avaliados. O aumento da DMO e dos BOs foi observado em M3.
O esqueleto era tradicionalmente conhecido como um órgão passivo, com a função principal de sustentar o corpo humano. Contudo, é atualmente considerado um órgão mutável que participa de interações entre mecanismos reguladores e energéticos, agindo em conjunto com o tecido adiposo.1,2
A puberdade é considerada um momento importante de crescimento ósseo substancial e, para tanto, é sensível às influências externas que possuem fortes efeitos, como dietas, exercícios físicos, estilo de vida e medicações.3
O metabolismo ósseo é caracterizado por ciclos de formação e reabsorção, e o equilíbrio entre esses dois processos altera ao longo da vida. Durante a infância e a adolescência, a formação óssea predomina sobre a absorção; na vida adulta, ambos os processos se estabilizam.4 A remodelação óssea também está fortemente relacionada a variações de peso,5,6 incluindo mudanças na massa muscular e na taxa de gordura corporal. Assim, a carga mecânica imposta ao sistema esquelético interfere com a formação óssea.
Segundo Haeney et al.,7 o pico de massa óssea representa o valor mais alto de massa óssea ou a quantidade óssea máxima que um indivíduo atinge quando seu esqueleto está totalmente mineralizado ou consolidado. Atualmente, a idade em que o pico de massa óssea biológico ou cronológico ocorre não é estabelecida com precisão. Há indicações de que o pico ocorre no final da adolescência.8
A deposição de massa óssea começa durante a vida fetal e continua durante a infância e a adolescência, estabilizando‐se no início da vida adulta. Entender e avaliar a aquisição de massa óssea em uma população de adolescentes poderia ser um fator determinante na prevenção de osteopenia/osteoporose, doenças consideradas como questões de saúde pública de grande impacto econômico.9
A densidade mineral óssea (DMO) é considerada uma medição importante, precisa e estatisticamente válida; contudo, essas medições não refletem as mudanças dinâmicas que o tecido ósseo sofreu, representando apenas um momento em uma doença em evolução. Para superar essa limitação e melhorar a sensibilidade e especificidade da avaliação da situação da massa óssea, foi sugerido o uso de biomarcadores ósseos (BOs) para melhorar nossa compreensão do processo de remodelação óssea.10–12
Os biomarcadores séricos importantes de formação óssea incluem: a) osteocalcina (OC), proteína não colágena abundante nos ossos, sintetizada predominantemente por osteoblastos diferenciados e considerada um biomarcador sensível da atividade de síntese óssea; e b) fosfatase alcalina óssea (BAP), ectoenzima ou glicoproteína específica encontrada na superfície dos osteoblastos, com uma função importante na mineralização óssea e considerada um indicador altamente sensível e específico de formação óssea.13 Além disso, estudos sugeriram que o fragmento telopeptídeo C‐terminal (S‐CTx), indicador de reabsorção óssea, é um bom indicador para avaliar os processos de formação óssea, pois é formado quando ocorre a degradação do colágeno tipo I.
Os biomarcadores de remodelação óssea são ferramentas importantes para a compreensão da dinâmica do metabolismo ósseo e acrescentam informações adquiridas da densitometria óssea.
Portanto, este é o primeiro estudo que avalia a densidade mineral óssea (DMO) em adolescentes brasileiras do sexo feminino de acordo com a idade cronológica (IC), idade óssea (IO) e estágio de desenvolvimento das mamas (M), e que correlacionou esse parâmetro com biomarcadores ósseos (BOs).
MétodosAdolescentes do sexo feminino brancas e saudáveis (não descendentes de africanos ou asiáticos) entre os 10 e 20 anos incompletos de idade foram convidadas a participar deste estudo. As voluntárias eram estudantes do Colégio La Salle, em Botucatu, estado de São Paulo, Brasil, e do Colégio Santa Marcelina, em Botucatu. No total, 101 das 497 estudantes adolescentes que estavam na faixa etária estudada foram incluídas no estudo e participaram de todas as avaliações.
O estudo foi aprovado pelo Comitê de Ética em Pesquisa da Faculdade de Medicina de Botucatu – UNESP. Um consentimento informado por escrito foi coassinado por cada participante (101) e seus pais ou responsáveis.
Os critérios de inclusão exigiram que as adolescentes tivessem peso entre o 10° e o 90° percentis, apresentassem altura entre o 10° e o 97,5° percentis para cada faixa etária,14 apresentassem índice de massa corporal (IMC) adequado para sua idade15 e relatassem o consumo diário de laticínios.
Os critérios de exclusão foram: histórico de prematuridade ou baixo peso ao nascer; presença de diabetes mellitus; subnutrição aguda ou crônica; doenças ósseas congênitas ou adquiridas, doenças gastrointestinais acompanhadas de má absorção; histórico de nefropatia com ou sem insuficiência renal crônica; endocrinopatias; puberdade precoce ou tardia; consumo crônico de medicamentos; fibrose cística; doença celíaca; uso de medicamentos que tenham afetado negativamente o metabolismo ósseo (como anticonvulsivantes e antiácidos com alumínio); exercícios físicos por mais de 2h/semana, já que o exercício físico interfere na mineralização óssea; uso de contraceptivos 24 meses antes da coleta de dados, gravidez em qualquer momento; e ausência nas datas marcadas para coleta de dados do estudo. Os critérios de exclusão alimentar foram: práticas alimentares exclusivamente vegetarianas e ricas em fibras; consumo de cafeína e consumo de mais de 300mL/dia de refrigerante; e ausência de consumo de laticínios. Esses rigorosos critérios de seleção foram aplicados para minimizar a interferência de fatores que pudessem afetar o metabolismo ósseo normal durante a puberdade.
As adolescentes elegíveis como possíveis participantes no estudo, com base nos critérios de inclusão, foram convidadas a aferir seu peso e sua altura. As participantes que se encaixavam nos critérios de parâmetros foram questionadas sobre fumo e consumo de álcool. As adolescentes selecionadas foram convidadas a participar do estudo como voluntárias, e uma explicação completa dos métodos e procedimentos foi fornecida às participantes e a seus pais ou responsáveis, incluindo informações sobre a opção de retirar‐se do estudo a qualquer momento.
Os pais e responsáveis foram entrevistados e as participantes foram submetidas a exames físicos gerais e específicos para detecção de qualquer anormalidade física (adolescentes com infecção congênita crônica e grandes anomalias congênitas) que poderia interferir nos resultados esperados do estudo. As características sexuais secundárias foram avaliadas e os resultados comparados com os critérios de Tanner para desenvolvimento das mamas (M). A idade média de menarca no grupo das participantes era semelhante à média da população brasileira (12,2 anos de idade).16 A maturação óssea foi avaliada por determinação da idade óssea (IO) de acordo com o método GP descrito por Greulich e Pyle.17 Os parâmetros de idade cronológica (IC), idade óssea e estágio puberal das mamas (M) foram divididos em cinco grupos. O grupo IC1 era composto por garotas de 10 anos de idade; o IC2 por garotas de 11 a 12 anos; o IC3 por garotas de 13 a 14 anos; o IC4 por garotas de 15 a 16 anos; e o IC5 por garotas de 17 a 19 anos. Os grupos IO foram divididos em: IO1, adolescentes com idade óssea (IO) de 10 a 11 anos; IO2, IO de 12 a 13 anos; IO3, IO de 14 a 15 anos; IO4, IO de 16 a 17 anos; e IO5, IO de 18 a 19 anos. A caracterização alimentar foi mensurada posteriormente com a utilização de um registro alimentar não consecutivo de três dias.18 Questionários para quantificação centesimal dos alimentos foram aplicados e analisados por meio de um sistema de computador desenvolvido pelo Departamento de Nutrição da Faculdade de Saúde Pública da Universidade de São Paulo.19
As participantes que concluíram todos os passos iniciais foram submetidas a uma avaliação de massa óssea com uma unidade de densitometria óssea com atenuação de raios‐X de dupla energia (DXA) usando uma Hologic QDR 2000‐Plus (Hologic Inc., Waltham, MA, EUA), de acordo com as recomendações da Sociedade Internacional de Densitometria Clínica.20 Os resultados da DMO foram expressos em g/cm2. Foram tomadas medições das vértebras L1–L4da região da coluna lombar, do fêmur proximal total (incluindo o colo do fêmur e as regiões trocantéricas e intertrocantéricas), do triângulo de Ward e da densitometria de corpo inteiro. A quantidade de radiação à qual as participantes foram expostas foi considerada segura e não prejudicial às suas vidas atuais e futuras.20
Coleta de sangueAs amostras de sangue foram coletadas por punção venosa e centrifugadas por 15 minutos a 1.500g para a separação do soro; amostras de soro foram armazenadas a –70°C até a análise dos biomarcadores BAP, OC e telopeptídeo c‐terminal (S‐CTx). A BAP e a OC foram aferidas usando o ensaio (Metra™ Biosystems, San Diego, CA, EUA), com os coeficientes de variação intraensaio e interensaio de 8% e 7,6%, respectivamente. O S‐CTx foi quantificado por um exame de eletroquimioluminescência usando um kit comercial ß‐Cross Laps sérico (Roche Diagnostic Corporation, Indianápolis, IN, EUA) e Elecsys 1010 (Roche Diagnostic Corporation, Indianápolis, IN, EUA); o coeficiente de variação interensaio foi de 5%.
Análise estatísticaOs dados estatísticos descritivos foram expressos como média ±, desvio‐padrão usando a análise de variância (ANOVA) e o teste de Student‐Newman‐Keuls. Foram realizados a análise de variância de Kruskal Wallis e o teste de Dunn para comparar biomarcadores ósseos e IC, IO e M quando o teste de Shapiro‐Wilk demonstrou distribuição anormal desses dados. Os coeficientes de correlação de Spearman foram calculados entre os biomarcadores ósseos e os resultados da DMO nos locais avaliados e a IC, IO e M. Foi considerada uma diferença estatística mínima de 5% A representação gráfica incluiu valores médios de DXA e concentrações médias de biomarcadores ósseos em relação à IC, IO e M.
ResultadosO peso, a altura, o IMC e a DMO auferidos nos três locais analisados aumentaram de acordo com a idade, estágio puberal das mamas e idade óssea (tabela 1 e fig. 1 A‐C). As concentrações de todos os biomarcadores de formação e reabsorção óssea (BAP, OC e S‐CTx) reduziram com a idade; as maiores concentrações foram vistas no IC1 e as mais baixas no IC5, última fase da puberdade (fig. 1 D‐F).
Média e desvio‐padrão (DP) de indicadores nutricionais e ingestão de cálcio de acordo com os grupos de idade cronológica (IC), estágio de desenvolvimento das mamas (M) e idade óssea (IO)
| Variáveis | GruposMédia±DP (n total=101) | ||||
|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | |
| IC (anos) | (n=10) | (n=19) | (n=26) | (n=27) | (n=19) |
| Peso (kg) | 35,3±7,2 | 42,90±7,36 | 49,39±7,02 | 52,33±5,39 | 53,46±7,62 |
| Altura (m) | 1,39±0,07 | 1,50±0,08 | 1,59±0,05 | 1,60±0,05 | 1,61±0,04 |
| IMC (Kg/m2) | 17,64±2,27 | 18,92±±2,59 | 19,26±2,10 | 20,39±1,77 | 20,44±2,32 |
| Cálcio (mg/dia) | 652±176 | 624±271 | 533±150 | 490±153 | 532±267 |
| M | (n=5) | (n=7) | (n=11) | (n=37) | (n=41) |
| Peso (kg) | 31,92±4,7 | 39,18±5,56 | 45,75±7,98 | 50,31±7,46 | 51,69±6,04 |
| Altura (m) | 1,38±0,05 | 1,43±0,08 | 1,54±0,09 | 1,60±0,06 | 1,59±0,05 |
| IMC (Kg/m2) | 16,24±1,62 | 19,02±2,84 | 18,81±2,18 | 19,59±2,18 | 20,31±1,91 |
| IO | (n=9) | (n=14) | (n=21) | (n=31) | (n=26) |
| Peso (kg) | 33,02±4,4 | 45,20±5,73 | 48,92±6,68 | 53,46±5,46 | 49,31±12,6 |
| Altura (m) | 1,38±0,05 | 1,52±0,06 | 1,59±0,05 | 1,60±0,05 | 1,52±0,37 |
| IMC (Kg/m2) | 16,99±1,57 | 19,26±2,58 | 19,24±2,17 | 20,78±1,73 | 18,88±4,62 |
Nota: ANOVA seguida de Student‐Newman Keuls.
IMC, índice de massa corpórea.
Grupos de idade cronológica (anos de idade): IC1 – 10; IC2 – 11‐12; IC3 – 13‐14; IC4 – 15; IC5 – 17‐19.
Peso: IC1 < IC4 e IC5; IC2 < IC4 e IC5; p < 0,001
Altura: IC1 < IC2, IC3, IC4 e IC5; IC2 < IC3, IC4 e IC5; p < 0,001
IMC: IC1<IC4 e IC5; p<0,001
Cálcio: p=0,407
Grupos de estágio de desenvolvimento das mamas (critérios de Tanner)
Peso: M1<M3, M4 e M5; p<0,001
Altura: M1<M4 e M5; M2<M4 e M5; p<0,001
IMC: M1<M5; M1<M4; p<0,001
Grupos de idade óssea (Greulich&Pyle): IO1 – 10‐11 anos, IO2 – 12‐13 anos, IO3 – 14‐15 anos, IO4 – 16‐17 anos, IO5 – 18‐19 anos
Peso: IO1<IO2, IO3, IO4 e IO5; IO2<IO4 e IO5; p<0,001
Altura: IO1<IO3, IO4 e IO5; IO2<IO3, IO4 e IO5; p<0,001
IMC: IO1<IO4 e IO5; p<0,001
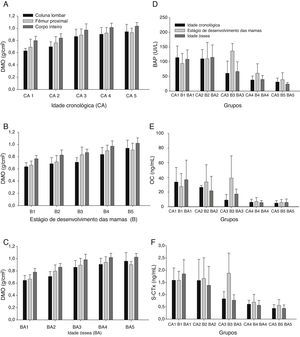
Representação gráfica das médias e desvios‐padrão de densidade mineral óssea (DMO) da coluna lombar, do fêmur proximal e do corpo inteiro; valores em g/cm2 de acordo com as faixas etárias (A), o estágio de desenvolvimento das mamas (B) e a idade óssea (C). Medianas de fosfatase alcalina óssea (BAP) (D), osteocalcina (OC) (E) e telopeptídeo C‐terminal (S‐CTx) (F) de acordo com os grupos de faixa etária, estágio de desenvolvimento das mamas e idade óssea.
Foram observadas diferenças significativas no peso entre as faixas etárias (IC4 e IC5 diferiram dos grupos IC1 e IC2, com p<0,01).
A ingestão de cálcio variou de 489±153mg/dia para 652±176mg/dia; a média±DP em toda a amostra foi de 566±210mg/dia (tabela 1).
As análises de DMO (coluna lombar, fêmur proximal e total do corpo) mostraram diferenças nos grupos IC3, IC4 e IC5, que diferiram dos grupos IC1 e IC2 com p<0,01 em todos os locais de estudo; os valores no grupo IC3 foram intermediários (fig. 1 A‐C).
Os valores de DMO (coluna lombar, fêmur proximal e total do corpo) diferiram de forma significativa entre os estágios de desenvolvimento das mamas (p<0,01). Os grupos M4 e M5 mostraram os maiores valores médios de DMO em todos os locais, e o grupo M3 apresentou um valor médio intermediário (fig. 1B).
Os biomarcadores de remodelação óssea BAP, OC e S‐CTx apresentaram concentrações significativamente diferentes no início da puberdade. As concentrações médias em IC1 e IC2 foram significativamente maiores que as encontradas em IC3, IC4 e IC5 (p<0,01). As concentrações médias de BAP no IC3 foram maiores que as encontradas em IC5; além disso, não foi observada diferença significativa entre as concentrações médias em IC4 e IC5. As alterações nas concentrações de OC de acordo com a idade seguiram uma tendência semelhante à observada para BAP. A mesma tendência foi observada para S‐CTx (p<0,001; fig. 1). As médias mais altas de S‐CTx foram observadas em IC1 e IC2, que diferiram de IC5 (fig. 1 D‐F).
Foram constatadas diferenças significativas no peso e na altura em participantes com idade óssea entre 12 e 13 anos (IO2) e entre 10 e 11 anos (IO1). Essas diferenças também foram observadas nos grupos com idades ósseas entre 14 e 15 anos (IO3), 16 e 17 anos (IO4) e 18 e 19 anos (IO5), que apresentaram médias de peso e altura maiores que as encontradas no grupo com idade óssea de 10 a 11 anos (IO1) (tabela 1).
As diferenças nos valores de DMO foram observadas inicialmente no grupo IO3, que diferiu dos grupos IO1 e IO2 com p<0,01 em todos os valores de DMO e em todos os locais estudados. As médias de DMO aumentaram dos grupos de menor IO com relação aos grupos de maior IO (fig. 1C).
Foram registradas diferenças significativas nos biomarcadores de remodelação óssea em todas as variáveis estudadas (BAP, OC e S‐CTx) quando apresentadas de acordo com a IO; as medianas do IO1 e IO2 foram maiores que as medianas do IO4 e IO5 (fig. 1 D‐F).
Foi observada uma correlação positiva significativa entre os valores de DMO para IC e IO e o nível de maturação (tabela 2); os biomarcadores de remodelação óssea (BAP, OC e S‐CTx) apresentaram uma correlação negativa significativa com a IC, IO e o desenvolvimento das mamas (tabela 2). Esse achado mostrou que quanto mais maduras eram as participantes, mais altos eram seus valores de DMO. A correlação era significativa, porém negativa, entre a idade das participantes e as concentrações de biomarcadores de remodelação óssea; quanto mais maduras eram as participantes, mais baixas eram suas concentrações de biomarcadores ósseos (tabela 2).
Coeficiente de correlação de Spearman entre as medições de densidade mineral óssea (DMO) (g/cm2), as concentrações de biomarcadores ósseos (fosfatase alcalina óssea, osteocalcina e telopeptídeo C‐terminal), a idade cronológica (IC), o estágio de desenvolvimento das mamas (M) e a idade óssea (IO)
| Variável | Idade e estágio de desenvolvimento das mamas | Biomarcador ósseo | ||||
|---|---|---|---|---|---|---|
| IC | M | IO | BAP | OC | S‐CTx | |
| DMO (g/cm2)Coluna, L1‐L4 | 0,754a | 0,649a | 0,760a | −0,696a | −0,367b | −0,627a |
| Fêmur | 0,605a | 0,516a | 0,652a | −0,519a | −0,334c | −0,644a |
| Corpo inteiro | 0,766a | 0,665a | 0,789a | −0,655a | −0,425a | −0,695a |
| BAP (IU/L) | −0,822a | −0,638a | −0,831a | ‐ | ‐ | ‐ |
| OC (ng/mL) | −0,552a | −0,602a | −0,482a | ‐ | ‐ | ‐ |
| S‐CTx(ng/mL) | −0,769a | −0,653a | −0,812a | ‐ | ‐ | ‐ |
BAP, fosfatase alcalina óssea; OC, osteocalcina; S‐CTx, telopeptídeo C‐terminal; L1‐L4, regiões 1 e 4da coluna lombar.
Relevância do coeficiente de correlação de Spearman.
A tabela 2 mostra os dados do coeficiente da análise de correlação entre os biomarcadores de remodelação óssea e os valores de DMO. Esses resultados mostraram que uma correlação negativa significativa foi encontrada entre os valores de DMO e as concentrações de biomarcadores ósseos.
DiscussãoNosso estudo mostra correlações negativas significativas entre as concentrações de biomarcadores de remodelação óssea e a idade cronológica, idade óssea, desenvolvimento das mamas e valores de DMO. Essa evidência revela resultados inversamente proporcionais de biomarcadores de remodelação e variáveis que representam o tempo e a maturação da massa óssea. Assim, apesar de os valores de DMO terem aumentado com o adiantamento de eventos de maturação, as concentrações dos três biomarcadores reduziram com a idade no final da adolescência, com início dos 15 aos 16 anos de idade (fig. 1).
Outros autores também observaram as mais baixas concentrações de biomarcadores ósseos no final da puberdade, e relataram essas mesmas concentrações em jovens de 18 anos do sexo feminino semelhantes àquelas encontradas em adultos.13,21,22
Boot et al.8 observaram que o pico de massa óssea, tanto na região lombar como em todo o corpo, ocorreu entre os 18 e 20 anos de idade em um grupo de 360 mulheres. Silva et al.23,24 e Moretto et al.25 mostraram que os valores médios de DMO em todos os locais avaliados aumentaram com a idade, maturação esquelética e idade óssea em adolescentes brasileiros. Nesses estudos, os menores valores de DMO foram observados em meninas de 10 anos e os maiores em meninas de 17 anos ou mais. Foi relatado que os principais períodos para o crescimento de massa óssea estão entre os 13 e 14 anos, em meninas no estágio de desenvolvimento das mamas M3 e, entre 13 e 15 anos, em meninos no estágio G4. Esses resultados corroboram nossas constatações, sugerindo a existência de uma janela de oportunidade para o ganho de massa óssea entre os 13 e 14 anos de idade e no estágio M3 nos períodos de maturação citados. Nossas análises lineares de regressão mostraram ganhos de DMO de 0,0574, 0,0592 e 0,0654g/cm2 na coluna lombar, no fêmur proximal e em todo o corpo, respectivamente, em cada ano de crescimento na idade cronológica.
A literatura é clara e concorda que atingir o pico de massa óssea mais alto possível durante a adolescência é um fator importante e, possivelmente, o principal preventivo para ocorrência de osteoporose senil.26
O fato de que os biomarcadores produzem leituras sensíveis e precisas das mudanças no metabolismo ósseo deve contribuir com seu uso mais amplo na prática clínica. As medições de biomarcadores sanguíneos podem ser repetidas com mais frequência que os métodos radiológicos quantitativos usados comumente porque as amostras de sangue são relativamente fáceis de obter. Apesar das dificuldades na análise e interpretação dos resultados de biomarcadores devido à sua variabilidade biológica durante a vida de um indivíduo,3 há vantagens no uso desses marcadores.
Portanto, é possível prever que, quando os indivíduos apresentam uma evolução de desenvolvimento saudável na infância e na puberdade, livres de doenças que interferem no metabolismo ósseo, seriam encontrados marcadores de formação óssea proporcionalmente mais ativos nas primeiras duas décadas de vida que os marcadores de reabsorção. Alguns outros fatores podem afetar as concentrações de biomarcadores de remodelação óssea, como fatores genéticos, idade, sinais sexuais secundários que representam uma evolução visível à puberdade, estilo de vida, nutrição e exercício físico.27
Tuchman et al.22 observaram uma correlação entre os biomarcadores ósseos e o pico de velocidade de crescimento (PVC), mostrando um paralelismo entre as maiores concentrações de marcadores e a velocidade de crescimento. Apesar disso, Harel et al.11 enfatizaram que os valores de DMO ainda continuaram aumentando com o avanço da idade, com um aumento máximo próximo da menarca, que é quando as meninas já estão diminuindo a velocidade de crescimento. Essa evolução também foi observada em nossos dados. Em termos sequenciais, o pico de massa óssea será finalmente atingido no momento em que a taxa de crescimento em altura diminuir. A altura final nessas adolescentes foi obtida quando atingiram os estágios de desenvolvimento das mamas M4‐M5. Conforme afirmado anteriormente, o pico de velocidade de crescimento (PVC) ocorre simultaneamente ao estágio de desenvolvimento das mamas M3 ou um pouco depois. Esse comportamento é semelhante ao observado nos marcadores ósseos, que mostram as maiores concentrações nesse estágio de desenvolvimento, reforçando a relação entre esses eventos e os fatores hormonais envolvidos nesses processos. Dessa perspectiva, van Coeverden et al.13 e Yilmazet et al.6 avaliaram a magnitude dessa relação entre a remodelação óssea e o pico de velocidade de crescimento (PVC), analisada por meio dos níveis de alguns marcadores ósseos e da avaliação dos níveis de esteroide sexual, do fator de crescimento semelhante à insulina (IGF‐1) e da proteína 3 de ligação ao fator de crescimento semelhante à insulina (IGF‐BP‐3).
Assim, essas considerações permitiram a compreensão dos níveis elevados de correlação entre biomarcadores ósseos e densidades minerais ósseas observados em nossa análise estatística.
Yilmaz et al.6 avaliaram 91 meninas e 83 meninos turcos na puberdade, de 11 a 15 anos de idade. Seus critérios de inclusão, apesar de muito precisos, não eram tão rígidos e restritivos quanto os nossos. Esses autores avaliaram a DMO na coluna lombar e em todo o corpo, os níveis de estradiol e testosterona e aferiram os marcadores de formação óssea (OC e BAP) em ambos os sexos. Os resultados de aumento máximo de DMO no terceiro estágio da puberdade corroboram nossos resultados. Esses autores observaram que as concentrações médias de OC foram mais altas em meninas no estágio 3 de Tanner que em M4 ou M5, e apresentaram redução de forma constante no final da puberdade. Esse comportamento não foi tão expressivo na BAP, porém demonstrou que as concentrações na metade da puberdade eram mais altas que as do final da puberdade, com diferença significativa em meninas (p<0,001). Além disso, Yilmaz et al.6 demonstraram correlação negativa significativa entre a DMO e os marcadores ósseos avaliados, o que corrobora os resultados observados em nosso estudo.
Estudos longitudinais realizados para avaliar a curva de velocidade de crescimento e as concentrações máximas de marcadores de formação óssea poderiam contribuir para confirmar o paralelismo observado indiretamente entre essas variáveis.
Por meio de análises de biomarcadores, nosso estudo demonstrou as alterações na remodelação óssea que ocorre na segunda década de vida, revelando altas concentrações de marcadores nos primeiros anos da adolescência e concentrações significativamente reduzidas no final da adolescência. Essas análises estão relacionadas aos valores de DMO, que representam a incorporação da massa óssea e indicam um comportamento inversamente proporcional entre os maiores valores de DMO e as menores concentrações de biomarcadores de formação e reabsorção.
Idealmente, nosso estudo teria tido um modelo longitudinal, incluindo maior quantidade de participantes para obter uma amostragem mais abrangente em coortes semelhantes (escolas). Apesar dessa limitação, nossos critérios restritos de inclusão favoreceram uma interpretação precisa dos resultados de ganho e metabolismo ósseo durante a adolescência.
Os resultados de nosso estudo complementam o trabalho publicado sobre o assunto e melhoram o entendimento das alterações da massa óssea durante a adolescência.
FinanciamentoFinanciado pela FAPESP (Fundação de Amparo à Pesquisa do Estado de São Paulo) – Processo n° 2007/07731‐0 e 2011/05991.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Este estudo tem bolsa FAPESP (2007/07731‐0 e 2011/05991) e Prope‐UNESP (Pró‐Reitoria de Pesquisa da UNESP). Agradecemos muito aos pediatras, técnicos da sala geral de coleta de amostras do Laboratório Clínico Botucatu, Hospital Geral da Faculdade de Medicina de Botucatu – UNESP e aos técnicos do Laboratório Pediátrico de Pesquisa do Departamento Pediátrico.
Como citar este artigo: Fortes CM, Goldberg TB, Kurokawa CS, Silva CC, Moretto MR, Biason TP, et al. Relationship between chronological and bone ages and pubertal stage of breasts with bone biomarkers and bone mineral density in adolescents. J Pediatr (Rio J). 2014;90:624–31.